一种多病原羊支原体肺炎核酸疫苗的构建方法
1.本发明涉及生物技术领域,具体涉及一种多病原羊支原体肺炎核酸疫苗的构建方法。
背景技术:
2.羊支原体肺炎是由丝状支原体山羊亚种(mycoplasma mycoides subsp. capri,mmc)、绵羊肺炎支原体(mycoplasma ovipneumoniae,mo)和山羊支原体山羊亚种(mycoplasma capricolum subsp.capricolum,mcc)等支原体引起的在羊群中普遍流行的接触性传染病,纤维素性肺炎和胸膜炎是其主要特征,被世界动物卫生组织(oie)列为b类传染病。近年来,我国多个养羊业发达的省区均有羊支原体肺炎的发生和流行的报道,疫病的流行严重影响着养羊业的健康发展,危害日趋加重,给全国养羊业造成巨大经济损失,且我国该病病原以绵羊肺炎支原体和丝状支原体山羊亚种两种病原为主。
3.免疫接种依然是防治该类传染病的重要措施之一,目前使用的疫苗为灭活疫苗,还存在一些不足:
①
灭活疫苗的免疫保护效力十分有限,且不能激发保护性细胞免疫应答;
②
羊支原体肺炎病原种类多样,目前的疫苗主要以mmc 生产,但mo和mmc之间无交叉免疫保护,灭活疫苗存在生产周期长,生产成本高等因素。因此,新型疫苗的开发显得十分迫切和必要。
技术实现要素:
4.本发明的目的是克服现有羊支原体肺炎灭活疫苗免疫保护效力低下、生产周期长、成本高、mo和mmc之间无交叉免疫保护等问题。
5.为了实现上述目的,本发明提供如下技术方案:一种多病原羊支原体肺炎核酸疫苗的构建方法,包括以下步骤:
6.步骤一:mo/mmc基因组的提取;
7.步骤二:mo p113/mmc lppa基因获取;
8.步骤三:pvax1
‑
p113
‑
lppa共表达载体的构建及在哺乳动物细胞中的表达。
9.优选的,在步骤一中mo/mmc基因组的提取具体步骤为:
10.s1:mo y98/mmc pg3标准株的复苏与培养:
11.在超净工作台中使用酒精棉球擦拭保存mo y98菌株和mmc pg3标准株的单管式冷冻管表面,用剪刀打开管口,加入改良hayflick's培养基溶解冻干菌种,将溶液接种于5mlhayflick's培养基,37℃恒温震荡培养箱培养3~5d,当培养基颜色变为黄色时取200μl进行传代,连续传3代,并把每代培养物4℃保存备用;
12.s2:mo y98/mmcpg3标准株dna的提取:
13.取第3代培养产物参照支原体基因组dna提取试剂盒提取获得mo、 mmc的总dna,并运用核酸蛋白测定仪测定核酸浓度。
14.优选的,在步骤二中mo p113/mmc lppa基因获取步骤如下:
15.s1:引物的设计与合成:
16.参考genbank中登录的mo y98株p113基因和mmc pg3株lppa基因信息,使用primer 5.0软件分别设计1对特异性引物,将引物稀释至 10pmol/μl,
‑
20℃保存备用;
17.s2:mo p113/mmc lppa的扩增:
18.以提取的dna为模板,分别使用mo p113和mmc lppa特异性引物构建25μlpcr反应体系:2
×
taq pcr mastermix 12.5μl,上下游引物各 1μl,dna模板2μl,dd h2o 8.5μl;反应条件:94℃3min,94℃45s, 58℃40s,72℃10s,共35个循环;72℃延伸10min;取pcr产物8μl 于含核酸染料的1.2%琼脂糖凝胶上电泳,于凝胶成像系统观察结果;
19.s3:mo p113/mmc lppa基因回收纯化:
20.mo p113/mmc lppa基因经pcr扩增,凝胶成像系统观察结果后,使用胶回收试剂盒回收得到目的基因。
21.优选的,在步骤三中pvax1
‑
p113
‑
lppa共表达的构建及表达具体为:利用基因重组技术、双酶切技术、测序技术手段构建出pvax1
‑
p113
‑
lppa 共表达质粒,转入大肠杆菌感受态细胞dh5α中,运用无内毒素质粒提取试剂盒得到大量无内毒素质粒,并在细胞培养、间接免疫荧光技术的基础上测定重组质粒在哺乳动物细胞中的表达情况,通过研究发现重组质粒能在mdbk中大量表达,再通过一系列处理得到mo p113、mmc lppa核酸疫苗。
22.在上述技术方案中,本发明提供的技术效果和优点:
23.本发明在前期筛选出的羊肺炎支原体多表位抗原基因mo p113和mmclppa基础上,通过基因工程方法构建出pvax1
‑
p113
‑
lppa重组共表达表达载体,应用间接免疫荧光技术验证重组质粒在mdbk中的表达情况;本发明选择两个不同抗原基因研制出核酸疫苗,可有效针对mo和mmc感染引起的羊支原体肺炎提供免疫保护作用,解决目前疫苗研发所面临的诸多问题。
附图说明
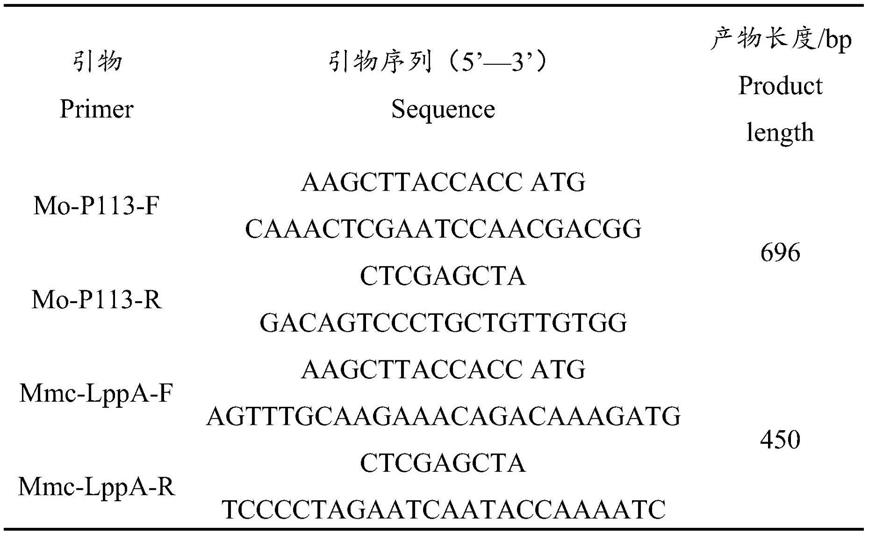
24.为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明中记载的一些实施例,对于本领域普通技术人员来讲,还可以根据这些附图获得其他的附图。
25.图1为本发明的mo p113/mmc lppa基因的扩增图;
26.图2为本发明的pvax1
‑
p113重组质粒pcr及双酶切验证图;
27.图3为本发明的pvax1
‑
lppa重组质粒pcr及双酶切验证图;
28.图4为本发明的pvax1
‑
p113
‑
lppa重组质粒pcr及双酶切验证图;
29.图5为本发明的重组质粒转染mdbk细胞表达情况图。
具体实施方式
30.为了使本领域的技术人员更好地理解本发明的技术方案,下面将结合附图对本发明作进一步的详细介绍。
31.实施例1
32.本发明提供了一种多病原羊支原体肺炎核酸疫苗的构建方法,包括以下步骤:
33.步骤一:mo/mmc基因组的提取:
34.s1:mo y98/mmc pg3标准株的复苏与培养:
35.在超净工作台中使用酒精棉球擦拭保存mo y98菌株和mmc pg3标准株的单管式冷冻管表面,用剪刀打开管口,加入改良hayflick's培养基溶解冻干菌种,将溶液接种于5mlhayflick's培养基,37℃恒温震荡培养箱培养3~5d,当培养基颜色变为黄色时取200μl进行传代,连续传3代,并把每代培养物4℃保存备用;
36.s2:mo y98/mmc pg3标准株dna的提取:
37.取第3代培养产物参照天根生化科技(北京)有限公司支原体基因组 dna提取试剂盒提取获得mo、mmc的总dna,并运用赛默飞世尔科技公司核酸蛋白测定仪测定核酸浓度;
38.步骤二:mo p113/mmc lppa基因获取:
39.s1:引物的设计与合成:
40.参考genbank中登录的moy98株p113基因和mmc pg3株lppa基因信息,使用primer 5.0软件分别设计1对特异性引物,引物由生工生物工程(上海)有限公司合成,将引物稀释至10pmol/μl,
‑
20℃保存备用;
41.s2:mo p113/mmc lppa的扩增:
42.以提取的dna为模板,分别使用mo p113和mmc lppa特异性引物构建25μlpcr反应体系:2
×
taq pcr mastermix 12.5μl,上下游引物各 1μl,dna模板2μl,dd h2o 8.5μl;反应条件:94℃3min,94℃45s, 58℃40s,72℃10s,共35个循环;72℃延伸10min;取pcr产物8μl 于含核酸染料的1.2%琼脂糖凝胶上电泳,于凝胶成像系统观察结果;
43.s3:mo p113/mmc lppa基因回收纯化:
44.mo p113/mmc lppa基因经pcr扩增,凝胶成像系统观察结果后,使用omega公司e.z.n.a.tm gel extraction kit胶回收试剂盒回收得到目的基因;
45.步骤三:pvax1
‑
p113
‑
lppa共表达的构建及在哺乳动物细胞(mdbk) 中的表达:
46.利用基因重组技术、双酶切技术、测序等技术手段构建出 pvax1
‑
p113
‑
lppa共表达质粒,转染如大肠杆菌感受态细胞dh5α中,运用无内毒素质粒提取试剂盒得到大量无内毒素质粒,并在细胞培养、间接免疫荧光等技术的基础上测定重组质粒在哺乳动物细胞(mdbk)中的表达情况,通过研究发现重组质粒能在mdbk中大量表达,再通过一系列处理得到mo p113、mmc lppa核酸疫苗。
47.实施例2
48.申请人研究小组从贵州省内某些养羊场发病的山羊肺脏组织中成功分离得到几株绵羊肺炎支原体(mo)和1株丝状支原体山羊亚种(mmc),
49.1目的基因的获取
50.引物设计与合成
51.基于该分离株的基因组的核苷酸序列设计mo p113和mmc lppa的上下游引物,引物核苷酸序列以及扩增片段大小见表1,由上海生工生物工程有限公司合成。
52.表1引物序列
53.tab.1 primersequence
54.1.2目的基因的扩增
55.通过pcr方法得到mo p113基因具有抗原优势的c末端和mmc lppa基因具有抗原优势的n末端,建立50μl反应体系:
[0056][0057]
混合均匀后,按下列反应条件进行目的基因pcr扩增:94℃预变性3min; 94℃变性45s,58℃退火40s,72℃延伸1min,共34个循环;72℃延伸10min。取7μl pcr产物应用含gold view核酸染料的1.2%琼脂糖凝胶电泳,凝胶成像系统观察结果。
[0058]
2 mo p113/mmc lppa基因双酶切
[0059]
应用限制性内切酶hindⅲ和xhoⅰ对目的基因mo p113/mmc lppapcr 产物进行双酶切,50μl双酶切体系:
[0060][0061]
37℃水浴酶切5h,应用胶回收试剂盒对双酶切产物进行目的基因的纯化回收,
‑
20℃冰箱保存备用。
[0062]
pvax1载体双酶切
[0063]
应用限制性内切酶hindⅲ和xhoⅰ对表达载体pvax1进行双酶切,建立50μl 双酶切体系:
[0064][0065][0066]
37℃水浴酶切5h,应用胶回收试剂盒对双酶切产物进行目的基因的纯化回收,
‑
20℃冰箱保存备用。
[0067]
连接
[0068]
将纯化目的基因p113/lppa与pvax1载体运用快速连接试剂盒连接,建立20μl连接体系:
[0069][0070]
混合均匀,22℃连接1h获得连接产物。
[0071]
mo p113/mmc lppa基因阳性重组质粒筛选
[0072]
将连接产物转化大肠杆菌感受态细胞dh5α,进行重组质粒pcr、双酶切鉴定和测序确认。
[0073]
应用双酶切技术构建50μl双酶切体系,将目的基因与载体分别37℃水浴过夜酶切,运用e.z.n.a.tm gel extraction kit胶回收试剂盒回收酶切产物;用solution i连接酶构建10μl16℃过夜连接体系,将10μl连接产物转化入大肠杆菌感受态dh5α中,并运用pcr、双酶切、测序等技术验证重组质粒是否构建成功,并将重组质粒转染mdbk细胞运用间接免疫荧光技术检测目的蛋白表达水平,通过研究重组蛋白能够在细胞中良好表达,进而对重组质粒研制成核酸疫苗。
[0074]
由附图1
‑
5可知本发明成功研制出一种羊支原体肺炎多病原基因mop113、mmclppa核酸疫苗。
[0075]
以上只通过说明的方式描述了本发明的某些示范性实施例,毋庸置疑,对于本领域的普通技术人员,在不偏离本发明的精神和范围的情况下,可以用各种不同的方式对所描述的实施例进行修正。因此,上述附图和描述在本质上是说明性的,不应理解为对本发明权利要求保护范围的限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1