m6A修饰相关联合基因组在预测肾透明细胞癌患者免疫治疗疗效中的应用
m6a修饰相关联合基因组在预测肾透明细胞癌患者免疫治疗疗效中的应用
技术领域
1.本发明属于医学生物检测技术领域,涉及由hnrnpa2b1和alkbh5的m6a修饰相关联合基因组作为标志物的用途,具体为该联合基因组在制备肾透明细胞癌免疫治疗疗效预测试剂盒及预测系统中的应用。
背景技术:
2.肾细胞癌是泌尿生殖系统最常见的恶性肿瘤肿瘤之一,约占所有成人男性新发病例5%,占女性新发病例的3%。据统计,2019年全美约有73,820例肾癌新发例和14,770例死亡病例,我国每年新发肾癌患者约6.68万例,居泌尿系统肿瘤发病率的第二位。透明细胞肾癌(clear cell renal cell carcinoma,ccrcc)是最常见的、恶性程度较高的肾癌病理类型,约占全部肾癌患者的70
‑
85%,约25
‑
30%的ccrcc患者初诊即出现转移,而转移性ccrcc的5年生存率仅为32%。对于临床局限期的肿瘤而言,治疗手段仍以保留肾单位手术或根治性肾切除干预为主,术后进一步的细胞因子或个体化精准辅助治疗可减少肿瘤复发转移率,提高患者远期生存率。目前晚期肾癌的一线治疗药物以靶向血管内皮生长因子受体(vascular endothelial growth factor receptor,vegfr)的酪氨酸激酶抑制剂(tyrosine kinase inhibitor,tki)为主,如培唑帕尼、舒尼替尼、卡博替尼、阿西替尼等。尽管抗血管生成药物在一定程度上可以抑制肿瘤增殖,可以显著延长低危ccrcc患者生存,但药物副反应明显,总体疗效欠佳,治疗的客观反应率仅不到30%,延长的中位总生存时间也不到12个月。此外,即使是最初治疗有效的患者,也会在一段时间后出现疾病进展,此时多数患者将缺乏后续的有效治疗手段。
3.近年来,以pd
‑
1/pd
‑
l1、ctla4抑制剂为代表的新型免疫治疗在肾癌治疗领域迅速崛起,对晚期难治性患者显示出令人鼓舞的疗效。自2015年fda基于checkmate025研究批准了纳武利尤单抗应用于既往接受过抗血管生成药物治疗的晚期肾细胞癌患者,2020年asco gu公布了checkmate025研究的5年随访结果,结果显示纳武利尤单抗二线治疗的5年生存率高达26%,彰显了免疫治疗的生存获益优势。随后,免疫检查点抑制剂逐渐从二线走向了一线,目前pd
‑
1单抗联合ctla
‑
4单抗及pd
‑
1/pd
‑
l1单抗联合抗血管生成药物一线治疗晚期肾癌在fda相继获批,晚期肾癌的治疗引来了新的篇章。免疫检查点抑制剂联合tki从诱导抗肿瘤免疫正常化、抑制晚期肾癌发生发展的主要信号通路及调节肿瘤微环境(tumor microenvironment,tme)多种角度发挥作用,其成功有赖于对肿瘤细胞及tme相互作用的深刻理解。随着研究的深入,更多证据表明,不仅免疫治疗的疗效依赖于肿瘤免疫微环境的激活,靶向治疗等传统治疗手段的疗效同样取决于机体抗肿瘤免疫反应的强弱。tme中的细胞和分子处于动态变化的过程,反映了癌症的进化本质,并共同促进肿瘤的免疫逃逸、生长和转移。探索tme驱动的肿瘤发生和发展的潜在机制对于开发癌症治疗的潜在方法、提高各种已有治疗手段有效率、发现新的肾癌治疗精确靶点具有重要意义。
4.rna最常见的化学修饰包括n6
‑
腺苷酸甲基化(m6a)、n1
‑
腺苷酸甲基化(m1a)、胞嘧
啶羟基化(m5c)等。m6a是真核细胞中mrnas丰度最高的甲基化修饰,在mrnas、mirnas和lncrna化学修饰中扮演着重要的作用。最近,一些研究揭示了tme浸润的免疫细胞与m6a修饰之间的特殊相关性,这不能通过rna降解机制来解释。dali等报道ythdf1与编码被m6a甲基化修饰的溶酶体蛋白酶的转录本结合,提高了树突状细胞(dcs)中溶酶体组织蛋白酶的翻译效率,而抑制dc中的组织蛋白酶显着增强了其交叉表达肿瘤抗原的能力,进而增强了肿瘤浸润的cd8+t细胞的抗肿瘤反应。ythdf1的抑制作用还提高了抗pd
‑
l1阻滞的疗效。huamin等人的研究揭示了mettl3介导的m6a修饰促进了dc的活化和成熟。mettl3特异性耗竭导致的共刺激分子cd80和cd40的表达下降,降低了刺激t细胞活化的能力。m6a与肿瘤免疫存在着密切的关联,探索m6a修饰模式差异有可能为肾癌的精准免疫治疗提供强大帮助。
5.在最近十年中,高通量技术与生物信息学分析相结合被广泛用于检测全面的mrna表达水平,这有助于鉴定差异表达基因(deg)并探索与ccrcc免疫微环境成分密切相关的标志物。
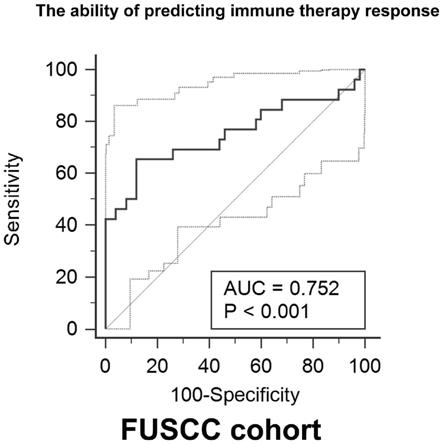
技术实现要素:
6.本发明在上述研究的基础上进一步进行,目的在于提供一种预测肾透明细胞癌患者免疫治疗疗效的生物标志物,本发明的目的也在于hnrnpa2b1和alkbh5的m6a修饰相关联合基因组的新用途,即在肾透明细胞癌免疫治疗疗效预测试剂盒及预测系统中的应用。
7.发明人前期通过复杂的生物信息学筛选,从tcga下载了肾透明细胞癌患者的基因表达以及生存数据,然后发明人根据肾透明细胞癌的表达矩阵提取21个m6a调节因子的表达,并使用共识聚类的方式识别了潜在的3种m6a修饰模式(cluster1、2、3),并发现cluster3中m6a修饰模式与患者不良预后以及肿瘤标本中较高的免疫检查点表达存在显著相关性,提示该类m6a修饰模式可能可以用于免疫治疗响应的预测。
8.进一步发明人依此构建了转录组分类器,由于目前缺乏可以使用的肾癌免疫治疗队列数据,发明人将该分类器在已经公开发表的膀胱癌imvigor210队列中使用,发现该分类器可以有力地预测患者对于免疫治疗的响应。应用二元logistics回归,发明人将分类器简化为公式:预测评分=1.889*hnrnpa2b1表达水平
‑
0.451*alkbh5表达水平。hnrnpa2b1和alkbh5作为预测肾透明细胞癌患者免疫治疗疗效的生物标志物属首次发现。
9.本发明的第一方面,提供了hnrnpa2b1和alkbh5的联合基因组作为预测肾透明细胞癌患者免疫治疗疗效的生物标志物的应用。
10.本发明的第二方面,提供了上述联合基因组在制备肾透明细胞癌免疫治疗疗效预测试剂或试剂盒中的应用,其中预测试剂为检测生物样品中hnrnpa2b1和alkbh5相对表达水平的试剂组合;预测试剂盒包含了检测生物样品中hnrnpa2b1和alkbh5相对表达水平的试剂组合。
11.优选的,试剂组合为检测上述基因mrna表达水平的试剂组合,该试剂组合中包含对上述基因具有检测特异性的pcr引物,引物序列如下表seq id no.1~4所示。
12.优选的,所述生物样品为肾透明细胞癌患者手术切除的肿瘤标本切片。
13.本发明第三方面,提供了肾透明细胞癌免疫治疗疗效预测试剂盒,由反转录系统、引物系统和扩增系统组成,引物系统包括如seq id no.1~4所示的pcr引物。
14.本发明第四方面,提供了一种肾透明细胞癌免疫治疗疗效预测系统,包括预测试
剂盒以及安装在终端载体上的免疫亚群分类模型。预测试剂盒如上所述,对标志物基因的相对表达水平进行检测,免疫亚群分类模型根据下述公式进行预测评分,并根据据分值确定当前样本的免疫分型属于免疫排斥型还是免疫荒漠型,预测评分=1.889*hnrnpa2b1表达水平
‑
0.451*alkbh5表达水平。
15.优选的,免疫亚群分类模型根据二元logistic回归构建,并采用二元logistic分析对预测评分与患者对免疫治疗的显著相关性进行预测。
16.本发明的第五方面,提供了一种利用上述免疫治疗疗效预测系统进行肾透明细胞癌免疫治疗疗效预测方法,具体包括以下步骤:
17.(a)利用试剂盒中的试剂对肿瘤样本进行反转录和扩增,获取每种基因的mrna表达水平;
18.(b)肾透明细胞癌免疫治疗预测评分根据下述公式计算:预测评分=1.889*hnrnpa2b1表达水平
‑
0.451*alkbh5表达水平,并根据分值确定当前样本的免疫分型属于免疫排斥型还是免疫荒漠型。
19.免疫排斥型的cluster3调节亚型与较差的生存显著相关,同时也与较高的t分期显著相关。与cluster1/2相比,cluster3的基因表达谱显著富集于类固醇代谢过程、突触膜、神经活性配体
‑
受体相互作用等生物学过程,但该类患者可从免疫治疗中获益良多。
20.本发明的有益保障及效果如下:
21.本发明的基因组合来源于参与肾透明细胞癌m6a修饰转录亚型形成的基因组合,在imvigor210队列以及fuscc的真实世界队列验证的结果均显著,均能有效的预测患者对免疫治疗的响应。说明hnrnpa2b1和alkbh5的表达水平具有较高的预测免疫治疗疗效价值,可能有助于更加精准地在肾癌患者应用免疫检查点抑制剂治疗。
22.因此,该基因组合模型的发现为预测肾透明细胞癌患者免疫治疗疗效提供了一条全新的策略,能够评估患者对免疫治疗响应的可能性,有助于指导临床医生实施个体化精准治疗策略,提高患者术后的生存率,对于肾透明细胞癌患者术后随访监控及序贯治疗管理也具有重要的指导意义。
23.就技术而言,两种基因表达水平检测本质上是组织样本的定量pcr检测,具有操作简便、检测灵敏、特异性好、重复性高等特点,现今已越来越多地被应用于临床检验技术中。这一技术在现代实验诊断学中已被证实是高灵敏度、高准确度的检测方法,试验技术已经十分成熟。并且我们采用的是这一技术中的标准曲线定量法,可以准确地对各种样品中特点核酸分子做精确定量。
附图说明
24.图1为区分肿瘤组织和正常组织m6a调节因子表达并识别肾透明细胞癌m6a转录亚型的过程:(a)肿瘤组织和癌旁正常组织中21个m6a调节因子表达差异分布箱图,绝大多数m6a调节因子在肿瘤组织和癌旁正常组织中存在着显著差异的分布;(b)肿瘤组织内21个m6a调节因子表达水平的相关性热图,可以发现多种m6a调节因子之间表达互为正相关,如cbll1与ythdf3相关性系数为0.58,mettl14与ythdc1相关性系数为0.66,mettl14与lrpprc相关性系数0.6;(c)共识聚类显示,将tcga
‑
ccrcc分为3类m6a调节亚类效果最佳;(d)主成分分析显示三类m6a调节亚类基因表达模式显著不同。
25.图2为探索m6a调节亚类之间潜在的临床表型差异:(a)整合了临床信息的m6a调节亚类基因表达热图,该图显示cluster3中存在显著较多的死亡结局;(b)生存分析显示相比于cluste1与cluster2中患者的总体生存类似,而cluster3中的患者总体生存显著差于cluster1和cluster2中的患者(p=0.002);(c)单因素回归分析显示,hnrnpa2b1、zc3h13、lrpprc、metll14以及ythdc1等m6a调节因子与患者总体生存存在显著的相关性。
26.图3为探索m6a调节亚类之间(cluster3相比于cluster1&2)潜在的生物学功能差异、免疫检查点表达差异以及免疫细胞浸润成分的差异:(a)相比于cluster1和cluster2,cluster3调节亚型的肾癌在类固醇代谢过程、突触膜功能、受体配体活性等生物学过程中存在显著富集;(b)差异分析显示,相比于cluster1和cluster2,cluster3中,ctla4、pdcd1、tnfsf14以及lag3等均显示出显著的高表达(log2foldchange>1,p<0.05),提示cluster3可能与免疫抑制性微环境存在关联;(c)使用cibersort算法预测了肾癌微环境中免疫细胞的丰度,结果显示,相比于cluster1和cluster2,cluster3类肾癌存在显著增高的cd8阳性t细胞(p<0.001)以及tfh细胞浸润(p<0.001),而m2型巨噬细胞的浸润则在cluster3中显著下降。
27.图4采用kaplan
‑
meier法对cluster1&2与cluster3进行生存分析结果,显示cluster3类患者的总体生存显著差于非cluster3类患者。
28.图5预测评分与患者对免疫治疗响应的相关性列线图。将pdl1、pd1、ctla4、lag3四个免疫检查点分子纳入列线图构建,结果显示预测评分可以有效地用于患者对免疫治疗响应的预测。
29.图6为使用预测评分在imvigor210队列中预测患者免疫治疗响应的接受者操作特性曲线(roc),结果显示曲线下面积(auc)为0.65,p<0.001,说明本项目所构建的预测评分可以较好地预测患者对于免疫治疗的响应。
30.图7为接受过免疫治疗患者中高预测评分的肾透明细胞癌原发灶标本的免疫微环境;
31.图8为接受过免疫治疗患者中低预测评分的肾透明细胞癌原发灶标本的免疫微环境;
32.图9为使用预测评分评估fuscc队列中98名患者免疫治疗响应的roc曲线。
具体实施方式
33.下面结合本发明的附图和实施例对本发明的实施作详细说明,以下实施例是在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体操作过程,但本发明的保护范围不限于下述的实施例。
34.本发明所用试剂和原料均市售可得或可按文献方法制备。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
35.在以下实施例中,肾透明细胞癌患者的肿瘤组织样本均来自于复旦大学附属肿瘤医院,由病理科医生明确诊断为肾透明细胞癌。
36.本发明旨在探索和调查基于多队列的免疫治疗疗效预测基因表达谱。从the cancer genome atlas(tcga)下载了602例肾透明细胞癌肿瘤以及癌旁正常组织的rna
‑
seq数据(72例癌旁正常组织以及530例肿瘤组织)。然后从rna
‑
seq中提取出21个m6a调节因子
的表达数据,进一步探索了癌和癌旁中m6a调节因子的表达差异以及它们之间的相互作用关系。使用共识聚类的方法识别出了三类m6a转录调节亚型cluster1\2\3。
37.使用单因素回归方法评估了21个m6a调节因子的预后价值,单因素回归分析显示,igf2bp1、hnrnpa2b1等与不良的预后显著相关,而cbll1、fmr1等表达则与良好的预后显著相关。分析发现cluster3的生存远远差于cluster1\2。将所有免疫检查点相关基因表达提取,发现pdcd1、ctla4、lag3等在cluster 3中显著高表达。提示我们肾癌m6a调节亚型可能与免疫微环境有关。进一步使用cibersort算法评估肿瘤浸润淋巴细胞组成,发现cluster 3与cluster 1/2的肿瘤浸润cd8阳性t细胞等免疫细胞含量差异显著。
38.接下来,报告人使用二元logistic回归构建m6a调节亚型分类器,得到公式:m6ascore=1.889*hnrnpa2b1
‑
0.451*alkbh5。使用公式计算得到imvigor210队列每名患者的预测评分,二元logistic分析发现预测评分与患者对免疫治疗的相应显著相关(p<0.0001),模型roc曲线下面积(auc)为0.65。并利用rt
‑
qpcr技术在fuscc队列中验证了预测评分与患者免疫治疗响应的关系。
39.本发明研究包括三个阶段:首先,我们使用共识聚类在tcga肾癌队列中识别了可能的肾细胞癌m6a修饰亚型;在第二阶段,探索了肾细胞癌m6a修饰亚型之间的临床表型差异与可能的生物学差异,并探索了免疫检查点表达和免疫细胞浸润的差异;在第三阶段,基于m6a修饰亚型构建了分类器,然后利用imvigor210队列和真实世界数据探索、验证了预测评分对于患者免疫治疗响应的预测作用。下面结合附图实施作进一步详细描述。
40.实施例1:免疫治疗预测评分的构建
41.一、m6a转录调节亚型的识别
42.从the cancer genome atlas(tcga)下载了602例肾透明细胞癌肿瘤以及癌旁正常组织的rna
‑
seq数据(72例癌旁正常组织以及530例肿瘤组织)。然后申请人从rna
‑
seq中提取出21个m6a调节因子的表达数据,包括8个writer(mettl3、rbm15、mettl14、rbm15b、kiaa1429、wtap、cbll1、zc3h13)、2个eraser(fto、alkbh5)和11个reader(ythdf1、ythdf2、ythdf3、ythdc1、ythdc2、hnrnpc、igf2bp1、hnrnpa2b1、lrpprc、fmr1、elavl1)。
43.进一步探索了癌和癌旁中m6a调节因子的表达差异,肿瘤组织和癌旁正常组织中21个m6a调节因子表达存在差异,绝大多数m6a调节因子在肿瘤组织和癌旁正常组织中存在着显著差异的分布(图1a);同时探索了它们之间的相互作用关系,肿瘤组织内21个m6a调节因子表达水平的相关性热图,可以发现多种m6a调节因子之间表达互为正相关,如cbll1与ythdf3相关性系数为0.58,mettl14与ythdc1相关性系数为0.66,mettl14与lrpprc相关性系数0.6(图1b)。
44.共识聚类是一种为确定数据集中可能的聚类的数量和成员提供定量证据的方法。这种方法在癌症基因组学中得到了广泛应用,先前有多项权威组学研究通过这种聚类方法识别了多种新的疾病分子亚类。本发明中,使用共识聚类的方法识别出了三类m6a转录调节亚型cluster1\2\3,显示将tcga
‑
ccrcc分为该3类m6a调节亚类效果最佳(图1c);主成分分析显示三类m6a调节亚类基因表达模式显著不同(图1d)。
45.二、m6a转录调节亚型的临床表型差异探索
46.将患者的性别、年龄、肿瘤分期和分级等一并纳入,探索m6a调节亚型之间的临床差异,显示cluster3中存在显著较多的死亡结局(图2a)。进一步分析显示,cluster3调节亚
型与较差的生存显著相关,同时也与较高的t分期显著相关。并使用kaplan
‑
meier方法对三类m6a调节亚型的总体生存率进行比较,发现cluster3的生存远远差于cluster1\2;相比于cluste1与cluster2中患者的总体生存类似,cluster3中的患者总体生存显著差于cluster1和cluster2中的患者(p=0.002)(图2b)。使用单因素回归方法评估了21个m6a调节因子的预后价值,分析显示,igf2bp1、hnrnpa2b1等与不良的预后显著相关,而cbll1、fmr1等表达则与良好的预后显著相关(图2c)。
47.三、m6a转录调节亚型的潜在生物学差异探索
48.使用limma算法对cluster3和cluster1/2进行差异基因分析(差异倍数大于2,p小于0.05认为有意义)。然后对差异基因做功能富集分析,与cluster1/2相比,cluster3的基因表达谱显著富集于类固醇代谢过程、突触膜、神经活性配体
‑
受体相互作用等生物学过程(图3a);为了探索m6a修饰模式与肿瘤免疫微环境的关系,将所有免疫检查点相关基因表达提取,发现相比于cluster1和cluster2,cluster3中,ctla4、pdcd1、tnfsf14以及lag3等均显示出显著的高表达(log2foldchange>1,p<0.05),提示cluster3可能与免疫抑制性微环境存在关联,提示肾癌m6a调节亚型可能与免疫微环境有关(图3b);进一步使用cibersort算法预测了肾癌微环境中免疫细胞的丰度,结果显示,相比于cluster1和cluster2,cluster3类肾癌存在显著增高的cd8阳性t细胞(p<0.001)以及tfh细胞浸润(p<0.001),而m2型巨噬细胞的浸润则在cluster3中显著下降(图3c)。
49.四、m6a调节亚型分类器的构建
50.我们将cluster1/2归为一类,kaplan
‑
meier分析显示cluster3预后显著较差(图4)。使用二元logistic回归构建m6a调节亚型分类器,得到公式:预测评分=1.889*hnrnpa2b1
‑
0.451*alkbh5。分类器成功的将矩阵分为cluster1/2和cluster3,与原有分类契合度高,匹配原有分类的auc值达到0.985。
51.五、预测评分与免疫治疗疗效的相关性探索
52.cluster3与cluster1\2在免疫检查点表达上差异显著,使用已公开发表的免疫治疗队列(imvigor210)数据来进行免疫治疗疗效的预测。使用公式计算得到imvigor210队列每名患者的预测评分,然后绘制了列线图(图5),探索了预测评分的运用价值,二元logistic分析发现预测评分与患者对免疫治疗的相应显著相关(p<0.0001),模型roc曲线下面积(auc)为0.65(图6)。
53.实施例2外部验证
54.20018年6月至2020年9月,选取98例来自复旦大学附属上海肿瘤中心泌尿外科的接受过免疫检查点抑制剂治疗的ccrcc患者手术标本。手术期间收集了包括ccrcc和正常组织在内的组织样本,这些样本可从fuscc组织库获得。
55.1、实时定量pcr(rt
‑
qpcr)分析
56.通过trizol(invitrogen,carlsbad,ca)从收获的细胞中分离总rna。使用primescript rt试剂盒(termo fisher,美国)将其逆转录为cdna。稀释引物,并用sybr green qpcr方法(takarabiotechnology co.)在不含rnase的dh2o中混合,所用引物序列如表1所示。测量gapdh rna表达以进行标准化。根据green qpcr预混液(applied biosystems)制造商规程,对mrna和gapdh的特定操作循环条件进行了测定,并通过2
‑
δδct
计算靶mrna的相对表达水平。
57.表1 qrt
‑
pcr中三种基因的引物序列汇总
[0058][0059]
2、多标记免疫组化染色鉴定高低预测评分组免疫微环境差异
[0060]
从复旦大学附属肿瘤医院(fuscc)收集了98例接受过免疫治疗患者的肾透明细胞癌原发灶标本,并使用rt
‑
qpcr技术评估了样本中hnrnpa2b1以及alkbh5的相对含量。并利用公式对评估了每例标本的预测评分,然后根据预测评分将标本分为高低评分两组,并使用多标记染色技术对高低评分组样本中的cd3、cd4、cd8、ck、foxp3、pd
‑
l1进行染色用以评估高低评分组的免疫微环境变化。我们初步发现在高预测评分组中,pd
‑
l1、cd8、foxp3等分子均染色明显,pd
‑
l1分子表达显著升高,与前期工作中tcga的肾透明细胞癌队列的趋势一致(图7)。而在低预测评分组中,pd
‑
l1、cd8、cd4等分子染色均较弱(图8)。提示高预测评分组肾癌可能为一种功能抑制性免疫微环境。
[0061]
3、fuscc队列中的统计分析artificial sequence
[0062]
在ccrcc样本中分析了2个标记物基因的不同mrna表达,并确定了每名患者的预测评分,预测评分被确定为每个重要致癌中心基因重量的总和。评估了预测评分与免疫治疗响应之间的相关性。构建接收器工作特征(roc)曲线以验证诊断的特异性和敏感性,通过进行曲线下面积(auc)分析以确定诊断能力。
[0063]
4、结果分析
[0064]
在整合98名ccrcc患者的rt
‑
qpcr和临床随访数据后,我们验证了fuscc队列中的hnrnpa2b1和alkbh5 mrna表达并得到了预测评分。使用选定的2个m6a修饰相关基因构建了一个整合的基因组,它可以作为预测ccrcc患者免疫治疗响应的独立方法。生成roc曲线以鉴定基因模型预测免疫治疗疗效的能力。对于患者免疫治疗疗效,集成模型的auc指数为0.752(图9),p<0.001,验证了预测评分对于免疫治疗疗效预测的稳定性和有效性。
[0065]
综上所述,本发明利用了特征明确且完整的ccrcc原发性肿瘤系统微阵列数据分析,揭示了肿瘤m6a修饰相关的独特基因表达亚型。并发现其中一类m6a转录亚型预后显著较差,免疫检查点分子表达显著升高,免疫细胞浸润成分显著不同。并以此构建了分类器和预测评分,该预测评分为hnrnpa2b1和alkbh5的联合基因组。
[0066]
本发明联合基因组在imvigor210队列以及fuscc的真实世界队列验证的结果均显著,均能有效的预测患者对免疫治疗的响应。因此,在这项研究中,对ccrcc原发组织的系统分析可以筛查和鉴定有前途的预测免疫治疗疗效的生物标志物表达谱。
[0067]
总之,本研究确定了可能参与ccrcc抑制性免疫微环境形成的m6a修饰亚型。hnrnpa2b1和alkbh5的表达水平具有较高的预测免疫治疗疗效价值,可能有助于更加精准地在肾癌患者应用免疫检查点抑制剂治疗。
[0068]
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述
实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可作出种种的等同的变型或替换,这些等同的变型或替换均包含在本技术权利要求所限定的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1