一种核酸免提取三重荧光RT-LAMP检测FCV、FPV及FHV-1病毒的试剂盒的制作方法
一种核酸免提取三重荧光rt
‑
lamp检测fcv、fpv及fhv
‑
1病毒的试剂盒
技术领域
1.本发明属于生物检测技术领域,涉及一种核酸免提取三重荧光rt
‑
lamp检测fcv、fpv及fhv
‑
1病毒的试剂盒。
背景技术:
2.猫杯状病毒(feline calicivirus,fcv)、猫细小病毒(feline panleukopenia virus,fpv)及猫疱疹病毒i型(feline herpesvirus
‑
1,fhv
‑
1)是临床上危害猫科动物健康的三种主要传染性病毒,其传染性强,致死率高。它们常见的实验室检测方法主要有电镜观察、pcr、荧光定量pcr(real
‑
time quantitative pcr,qpcr)、重组酶聚合酶扩增(recombinase polymerase amplification,rpa)、酶联免疫吸附(enzyme linked immunosorbent assay,elisa)、胶体金免疫层析等。由于这些方法对实验器材及环境的要求较高、耗时长、成本高或易造成假阳性等缺点,难以在临床检测中广泛推广使用。
3.fcv、fpv与fhv
‑
1这三种病原感染引发的疾病临床症状有相似之处,且与其他病毒、真菌、细菌或寄生虫等病原体之间常常发生混合交叉感染。当发生混合感染后根据常规的病原学调查分析及临床症状变化更难得到准确有效的诊断结果,容易导致错判误判,需要实验室技术进行鉴别诊断确诊。因此建立一种方便快捷、敏感性高、特异性强和重复性好的鉴别诊断方法,是临床中快速缉鉴别检测诊断fcv、fpv和fhv
‑
1三种病原尚待解决的问题。
4.多重lamp技术通过在一管反应体系中混合多对不同目的基因的特异性引物,实现了单管内多目的片段的同时扩增,改善了单重lamp技术一次扩增反应中只能检测单种目的片段的缺点
3.。多重lamp技术不仅使扩增效率得到了有效的提高,并且在扩大检测领域范围的同时降低了检测成本。多重lamp技术的发展趋势与运用领域逐渐增大,已成为国内外研究的一大热点。但由于多重lamp反应体系中存在多种靶基因特异性引物,可能会产生引物间相互干扰或配对引起非特异性扩增反应而导致假阳性的发生。同时,不同目的基因引物浓度的高低对扩增反应效率的影响不同,因此在多重lamp反应体系中各目的基因的引物并不是简单的混合,而是要对各引物浓度比例进行优化,以考察不同比例引物浓度对扩增效率的影响。
技术实现要素:
5.本发明的目的是针对现有技术的上述不足,提供一种用于三重荧光rt
‑
lamp检测fcv、fpv、fhv
‑
1的引物和探针组合物。
6.本发明的另一目的是提供一种核酸免提取三重荧光rt
‑
lamp检测fcv、fpv及fhv
‑
1病毒的试剂盒。
7.本发明的又一目的提供一种非疾病诊断目的的核酸免提取三重荧光rt
‑
lamp检测fcv、fpv、fhv
‑
1的方法。
8.本发明的目的可通过以下技术方案实现:
9.一种用于三重荧光rt
‑
lamp检测fcv、fpv、fhv
‑
1的引物和探针组合物,包含:
10.(1)检测fcv
‑
f3的荧光rt
‑
lamp引物和探针组合物fcv
‑
pm:如seq id no.1所示的fcv
‑
f3,如seq id no.2所示的fcv
‑
b3,如seq id no.3所示的fcv
‑
fip,如seq id no.,4所示的fcv
‑
bip,如seq id no.5所示的fcv
‑
lf,如seq id no.6所示的fcv
‑
lb,如seq id no.7所示的fcv
‑
f strand,其中fcv
‑
f strand为同化探针引物荧光链,5
′
末端被fam荧光基团标记;
11.(2)检测fpv
‑
f3的荧光rt
‑
lamp引物和探针组合物fpv
‑
pm:如seq id no.9所示的fpv
‑
f3,如seq id no.10所示的fpv
‑
b3,如seq id no.11所示的fpv
‑
fip,如seq id no.12所示的fpv
‑
bip,如seq id no.13所示的fpv
‑
lf,如seq id no.14所示的fpv
‑
lb,如seq id no.15所示的fpv
‑
f strand,其中fpv
‑
f strand为同化探针引物荧光链,5
′
末端用vic荧光基团标记;
12.(3)检测fhv
‑1‑
f3的荧光rt
‑
lamp引物和探针组合物fhv
‑1‑
pm:如seq id no.16所示的fhv
‑1‑
f3,如seq id no.17所示的fhv
‑1‑
b3,如seq id no.18所示的fhv
‑1‑
fip,如seq id no.19所示的fhv
‑1‑
bip,如seq id no.20所示的fhv
‑1‑
lf,如seq id no.21所示的fhv
‑1‑
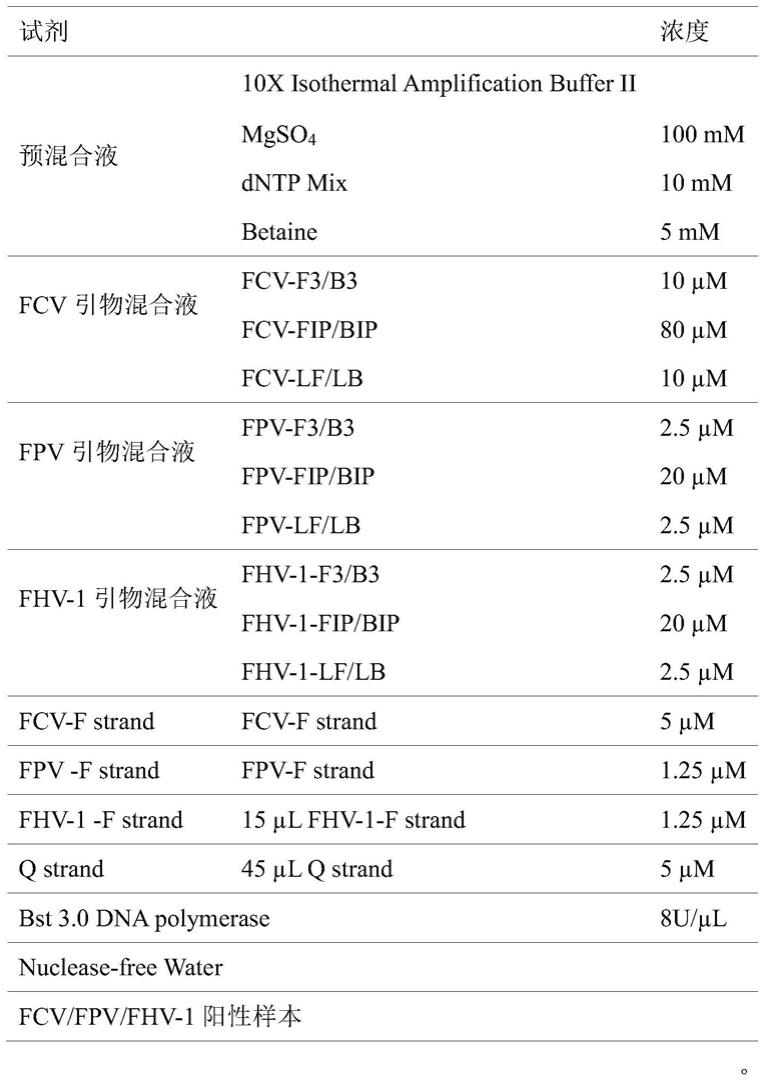
lb,如seq id no.22所示的fhv
‑1‑
f strand,其中fhv
‑1‑
f strand为同化探针引物荧光链,5
′
末端用ned荧光基团标记;
13.(4)三个基因共用的同化探针引物淬灭链q strand如seq id no.8所示,fcv
‑
q strand的3
′
末端用bhq1标记。
14.本发明所述的引物和探针组合物在三重荧光rt
‑
lamp检测fcv、fpv、fhv
‑
1中的应用,所述的检测为非疾病诊断目的的检测。
15.本发明所述的引物和探针组合物在核酸免提取三重荧光rt
‑
lamp检测fcv、fpv、fhv
‑
1中的应用,所述的检测为非疾病诊断目的的检测。
16.本发明所述的引物和探针组合物在制备三重荧光rt
‑
lamp检测fcv、fpv、fhv
‑
1的试剂盒中的应用。
17.一种核酸免提取三重荧光rt
‑
lamp检测fcv、fpv及fhv
‑
1病毒的试剂盒,包含本发明所述的引物和探针组合物。
18.作为本发明的一种优选,试剂盒中所述的检测fcv
‑
f3的荧光rt
‑
lamp引物和探针组合物:所述的检测fcv
‑
f3的荧光rt
‑
lamp引物和探针组合物:所述的检测fhv
‑1‑
f3的荧光rt
‑
lamp引物和探针组合物的摩尔浓度比为:3.5~4.5:0.8~1.1:1,优选4:1:1。
19.作为本发明的一种优选,试剂盒的组成如下表所示:
[0020][0021][0022]
一种非疾病诊断目的的三重荧光rt
‑
lamp检测fcv、fpv、fhv
‑
1的方法,所述的三重荧光rt
‑
lamp反应体系如下所示:
[0023][0024]
其中,fcv
‑
pm、fpv
‑
pm、fhv
‑1‑
pm、q strand的组成和序列如权利要求1所示;
[0025]
按照上述的反应体系配制反应液,反应液避光冰上轻轻混合均匀,以无核酸酶灭菌水设立阴性对照,三重荧光rt
‑
lamp反应条件为:65~67℃50min,80℃5min,期间每间隔1min采集一次荧光值。
[0026]
作为本发明的一种优选,所述的方法,fcv
‑
pm、fpv
‑
pm、fhv
‑1‑
pm中fip/bip引物浓度为1.6μm;f3/b3引物浓度为0.2μm;lf/lb引物浓度为0.2μm;f strand引物浓度为0.1μm。
[0027]
一种非疾病诊断目的的核酸免提取三重荧光rt
‑
lamp检测fcv、fpv、fhv
‑
1的方法,包含:取待检样本原液经90~93℃水浴加热5min后立即置于冰上冷却3min,吸取上清液,按照本发明所述的方法进行三重荧光rt
‑
lamp。
[0028]
有益效果:
[0029]
本发明在对各目的基因引物浓度平衡的同时优化了反应条件,成功建立了能同时检测fcv、fpv、fhv
‑
1三种病原的核酸免提取三重荧光rt
‑
lamp反应体系并研制出相关试剂盒。试验结果表明,当临床样本中至少存在这三种病毒中的一种时该试剂盒均可进行检测鉴别,其敏感性与之前建立的单重荧光(rt)
‑
lamp方法检测结果一致。对临床样本检测结果表明与pcr、胶体金试纸板等临床现有方法检测结果符合率良好,节省了一定的物力、成本及时间。
[0030]
多重lamp反应体系中存在的多套引物之间可能会引起非特异性扩增而导致假阳性结果的产生。本发明采用同化探针的方法,即整个反应种只设计一个淬灭链,其3
′
末端均用bhq1标记;在不同目的基因序列lf引物的5’端含有与淬灭链互补的序列,同时连接不同的荧光基团,在不同的荧光通道下显色。本发明同化探针引物的这种设计则有效减少了体系中的引物数量。
[0031]
多重lamp体系中不同目的基因引物浓度的高低对扩增反应效率的影响不同。在本发明中,考虑到以下几个方面:
①
反应体系中酶等成分含量;
②
rna逆转录过程各种成分的消耗;
③
减少引物交叉反应及非特异性扩增,同时保证一定的扩增效率;
④
检测结果的更好显示及检测成本等情况,根据扩增结果进行矩阵排列择优,最终确定fcv引物浓度保持初始浓度不变,而fpv及fhv
‑
1引物浓度各减为其初始浓度的四分之一。
[0032]
本试验在考察建立的核酸免提取三重荧光rt
‑
lamp方法的特异性时,对三种病毒分别进行扩增反应的同时,也设立了两两相互混合及三种核酸模板同时混合的情况,以模拟临床上单一或多种病原感染的情况
[9]
。结果表明,建立的核酸免提取三重荧光rt
‑
lamp检测方法均可检出单一或混合模板中相应的基因。
[0033]
多重lamp技术可在单管反应中同时针对多个目的基因序列进行扩增,在保证检测结果正确性的同时也提高了扩增效率、节省了检测成本及时间。从研究结果可以看出,建立的核酸免提取三重荧光lamp反应特异性好,灵敏度比常规pcr高。当临床上fcv、fpv、fhv
‑
1三种病原中至少有一种存在时,该检测方法可区分鉴别检测出病原,节省了物力和时间,可用于临床样本的直接检测鉴别与诊断。
附图说明
[0034]
图1同化探针设计原理
[0035]
图2核酸免提取(rt)
‑
lamp裂解温度优化结果
[0036]
fcv(a)、fpv(b)、fhv
‑
1(c)凝胶电泳结果及sybr green i染色结果
[0037]
m:dna marker 2000;1:93℃;2:90℃;3:87℃;4:84℃;5:阴性对照
[0038]
图3三重荧光rt
‑
lamp结果
[0039]
1:fpv;2:fhv
‑
1;3:fcv;4
‑
6:阴性对照
[0040]
图4三重荧光rt
‑
lamp引物浓度优化结果
[0041]
1:fpv 1;2:fhv
‑
1 1;3:fcv 1;4:fpv 1/2;5:fhv
‑
1 1/2;6:fcv 1/2;7:fpv 1/4;8:fhv
‑
1 1/4;9:fcv1/4;10
‑
12:阴性对照
[0042]
图5 fcv三重实时荧光rt
‑
lamp特异性结果
[0043]
1:fcv(fam);2:fcv(vic);3:fcv(ned);4
‑
6:fcov;7
‑
9:支原体;10
‑
12:阴性对照
[0044]
图6 fpv三重荧光rt
‑
lamp特异性结果
[0045]
1:fpv(vic);2:fpv(fam);3:fpv(ned);4
‑
6:fcov;7
‑
9:支原体;10
‑
12:阴性对照
[0046]
图7 fhv
‑
1三重荧光rt
‑
lamp特异性结果
[0047]
1:fhv
‑
1(ned);2:fhv
‑
1(vic);3:fhv
‑
1(fam);4
‑
6:fcov;7
‑
9:支原体;10
‑
12:阴性对照
[0048]
图8 fhv
‑
1+fcv三重荧光rt
‑
lamp特异性结果
[0049]
1:fhv
‑
1+fcv(ned);2:fhv
‑
1+fcv(fam);3:fhv
‑
1+fcv(vic);4
‑
6:fcov;7
‑
9:支原体;10
‑
12:阴性对照
[0050]
图9 fpv+fcv三重荧光rt
‑
lamp特异性结果
[0051]
1:fpv+fcv(vic);2:fpv+fcv(fam);3:fpv+fcv(ned);4
‑
6:fcov;7
‑
9:支原体;10
‑
12:阴性对照
[0052]
图10 fpv+fhv
‑
1三重荧光rt
‑
lamp特异性结果
[0053]
1:fpv+fhv
‑
1(vic);2:fpv+fhv
‑
1(ned);3:fpv+fhv
‑
1(fam);4
‑
6:fcov;7
‑
9:支原体;10
‑
12:阴性对照
[0054]
图11 fpv+fhv
‑
1+fcv三重荧光rt
‑
lamp特异性结果
[0055]
1:fpv+fhv
‑
1+fcv(vic);2:fpv+fhv
‑
1+fcv(ned);3:fpv+fhv
‑
1+fcv(fam);4
‑
6:fcov;7
‑
9:支原体;10
‑
12:阴性对照
[0056]
图12三重荧光rt
‑
lamp敏感性结果
[0057]
1:fpv 55.7ng/μl;2:fhv
‑
1 37.2ng/μl;3:fcv 45.7ng/μl;4:fpv 5.57ng/μl;5:fhv
‑
1 3.72ng/μl;6:fcv 4.57ng/μl;7:fpv 0.557ng/μl;8:fhv
‑
1 0.372ng/μl;9:fcv 0.457ng/μl;10:fpv 55.7pg/μl;11:fhv
‑
1 37.2pg/μl;12:fcv 45.7pg/μl;13:fpv 5.57pg/μl;14:fhv
‑
1 3.72pg/μl;15:fcv 4.57pg/μl;16:fpv 0.557pg/μl;17:fhv
‑
1 0.372pg/μl;18:fcv 0.457pg/μl;19:fpv 55.7fg/μl;20:fhv
‑
1 37.2fg/μl;21:fcv 45.7fg/μl;22:fpv 5.57fg/μl;23:fhv
‑
13.72fg/μl;24:fcv 4.57fg/μl;25:fpv 0.557fg/μl;26:fhv
‑
1 0.372fg/μl;27:fcv 0.457fg/μl;28:fpv阴性对照;29:fhv
‑
1阴性对照;30:fcv阴性对照
[0058]
图13核酸免提取三重荧光rt
‑
lamp结果
[0059]
1:fpv;2:fhv
‑
1;3:fcv;4
‑
6:阴性对照
[0060]
图14核酸免提取三重荧光rt
‑
lamp重复性结果
[0061]1‑
3:fpv;4
‑
6:fpv 30次;7
‑
9:fhv
‑
1;10
‑
12:fhv
‑
1 30次;13
‑
15:fcv;16
‑
18:fcv 30次;
[0062]
19
‑
27:fpv\fhv
‑
1\fcv阴性对照
具体实施方式
[0063]
实施例1引物设计与合成
[0064]
针对fcv orf2基因、fpv vp2基因、fhv
‑
1nk基因的保守序列,使用在线软件primer explorer v5(http://primerexplorer.jp/e/index.html)自动生成多套lamp引物对并经过筛选得到针对fcv orf2基因、fpv vp2基因、fhv
‑
1nk基因的lamp引物对:f3、b3、fip、bip、lf、lb。此外,设计了同化探针引物,包括荧光链(fluorescent strand)f链和淬灭链(quench strand)q链。荧光链3
′
末端为正向环引物(lf)序列,其5
′
末端序列与淬灭链互补。fcv荧光链引物的5
′
末端被fam荧光基团标记,fpv同化探针在f链的5
′
末端用vic荧光基团标记,fhv
‑
1同化探针在f链的5
′
末端用ned荧光基团标记,在q链的3
′
末端均用bhq1(black hole quencher
‑
1)标记,如图1所示。
[0065]
引物与同化探针均由生工生物工程(上海)股份有限公司合成,其序列及引物/探针结合位点如表1所示。
[0066]
表1
[0067][0068]
[0069][0070]
实施例2核酸免提取(rt)
‑
lamp反应体系及热裂解温度优化
[0071]
取100μl疫苗原液(妙三多灭活疫苗购自硕腾(上海)企业管理有限公司,生产批号:d216520a)以3℃为梯度,采用不同的裂解温度(93℃、90℃、87℃、84℃)水浴5min,冰上3min,吸取上清液5μl做扩增模板,同时以无核酸酶灭菌水作为阴性对照。按照以下反应体系和反应程序进行三种病毒基因的常规(rt)
‑
lamp反应。
[0072]
表2(rt)
‑
lamp反应液配制方法
[0073][0074]
将上述反应液于冰上轻轻混合均匀,同时以无核酸酶灭菌水设立阴性对照,pcr仪中65℃反应60min后,小心吸取5μl反应液于2%琼脂糖凝胶电泳;余下反应液中通过加入5μl稀释的100
×
sybr greenⅰ观察自然光及紫外光下的颜色变换。
[0075]
如图2所示:裂解温度在84℃
‑
93℃范围内,fcv、fpv、fhv
‑
1引物均能扩增出典型的梯形条带。当温度为84℃
‑
90℃时可见扩增条带亮度逐渐增高,在90℃时目的基因条带最亮且清晰;当温度达到93℃时扩增条带亮度减弱。加入核酸染料后,在84℃
‑
93℃范围内,自然光及紫外光下阳性产物呈现明显荧光绿色,而阴性对照反应液无明显颜色变化。最终确定核酸免提取(rt)
‑
lamp扩增反应中样本热裂解最适温度均为90℃。
[0076]
实施例3引物浓度与多重荧光rt
‑
lamp体系
[0077]
单重(rt)
‑
lamp引物混合液(primer mix,pm)组成为:fip/bip primers 1.6μm;f3/b3primers 0.2μm;lf/lb primers 0.2μm;f strand 0.1μm,将以上组分混合,25μl反应体系中的单个目的基因一套引物浓度设置为4.1μmol/l。由于引用了同化探针引物,在单重荧光(rt)
‑
lamp反应中的淬灭链(quench strand)q链相同,因此在多重荧光rt
‑
lamp 25μl
反应体系中淬灭引物终浓度只需0.2μm。多重荧光rt
‑
lamp需要对混合引物比例进行优化,因此按照下列方法对不同浓度引物进行组合:
[0078]
(1)fcv、fpv、fhv
‑
1的引物浓度均设置为4.1μmol/l。
[0079]
(2)fcv、fpv、fhv
‑
1的引物浓度均设置为2.05μmol/l。
[0080]
(3)fcv、fpv、fhv
‑
1的引物浓度均设置为1.025μmol/l。
[0081]
本试验将单个病毒引物浓度组合的三重荧光rt
‑
lamp体系分别对fcv、fpv、fhv
‑
1的rna\dna样本进行扩增,考察对扩增效率的影响,按照优化矩阵方法确定三重荧光rt
‑
lamp体系中各引物浓度。其反应体系及反应条件如下:
[0082]
表3三重荧光rt
‑
lamp反应液配制方法
[0083][0084]
将上述反应液避光冰上轻轻混合均匀,以无核酸酶灭菌水设立阴性对照,三重荧光rt
‑
lamp反应条件为:67℃50min,80℃5min,期间每间隔1min采集一次荧光值。
[0085]
通过在单管荧光rt
‑
lamp反应体系中加入三套不同目的基因引物,结果显示分别在fam、vic、ned通道下可分别检测到fcv、fpv、fhv
‑
1扩增曲线,而阴性对照则无。结果表明设计的fcv、fpv、fhv
‑
1引物及同化探针之间无交叉反应的发生,如图3所示。
[0086]
如图4所示:三种不同的引物浓度均可对相应靶基因进行扩增,而阴性对照则无明显扩增曲线出现。当均为其初始浓度4.1μmol/l时,fpv、fhv
‑
1、fvc扩增曲线出现荧光值相对最高;当均为其初始浓度的四分之一1.025μmol/l时,fpv、fhv
‑
1扩增曲线出现时间相对较早,而fvc扩增曲线出现时间及荧光值相对最低。考虑到若反应体系中各目的基因引物浓度均为最高浓度4.1μmol/l时,可能引起引物间出现非特异性扩增而导致假阳性结果,同时考虑到检测结果的显示及检测成本,根据矩阵优化结果,最终确定25μl的多重荧光rt
‑
lamp反应体系中fcv、fpv、fhv
‑
1引物终浓度分别为4.1μmol/l、1.025μmol/l、1.025μmol/l。
[0087]
实施例4.三重荧光rt
‑
lamp反应条件的优化
[0088]
4.1酶终浓度的优化
[0089]
在上述引物优化的结果下,设置bst 3.0dna polymerase(8,000u/ml)终浓度分别为160u/ml、320u/ml、480u/ml、640u/ml,其他条件按照实施例3进行。结果显示,酶浓度在160u/ml时均无明显扩增;在320u/ml、480u/ml、640u/ml条件下,均有扩增曲线出现。当酶浓度为480u/ml时扩增反应出现时间早且荧光信号高,阴性对照无明显扩增曲线出现。因此三重荧光rt
‑
lamp反应最适酶浓度为480u/ml。
[0090]
4.2 dntp终浓度的优化
[0091]
在上述优化条件的结果下,设置dntp mix(10mm)终浓度分别为0.8mm each、1.0mm each、1.2mm each、1.4mm each,其他成分的浓度和反应条件按照实施例3进行。结果显示:三重荧光rt
‑
lamp反应在设立的dntp梯度浓度下,均有扩增曲线出现而阴性对照则无。在1.4mm条件下,fpv扩增曲线出现时间早且荧光强度较高;当dntp浓度为1.2mm时,fhv
‑
1扩增曲线出现时间早且荧光强度较高;当dntp终浓度减少至0.8mm时,fcv扩增曲线出现时间较早且荧光强度较高,如图4
‑
4所示。在高浓度的dntp下可能导致非特异性反应,因此相对考虑,本试验建立的三重荧光rt
‑
lamp反应体系dntp终浓度为0.8mm each。
[0092]
4.3 mg
2+
终浓度的优化
[0093]
在上述优化条件的结果下,设置mgso4(100mm)终浓度分别为4mm、6mm、8mm、10mm,其他成分的浓度和反应条件按照实施例3进行。结果显示:在4mm、6mm、8mm、10mm条件下均有扩增曲线出现,阴性对照无明显扩增曲线。与其他浓度相比,fpv、fhv
‑
1、fcv扩增曲线在mg
2+
浓度为8mm时出现时间早且荧光强度较高。根据扩增曲线出现时间且荧光强度相对考虑,本发明建立的三重荧光rt
‑
lamp反应体系最适mg
2+
终浓度为8mm。
[0094]
4.4 betaine终浓度的优化
[0095]
在上述优化条件的结果下,设置betaine(5mm)终浓度分别为0mm、2mm、4mm、6mm,其他成分的浓度和反应条件按照实施例3进行。结果显示:fpv、fhv
‑
1、fcv的三重荧光rt
‑
lamp反应在betaine浓度为4mm条件下,扩增曲线出现时间较早;在betaine浓度为2mm条件下,fpv、fhv
‑
1荧光强度较高。根据扩增曲线出现时间最早且荧光强度相对较高考虑,本试验建立的三重荧光rt
‑
lamp反应体系最适betaine终浓度为4mm。
[0096]
实施例5三重荧光rt
‑
lamp方法特异性试验
[0097]
以fcv、fpv、fhv
‑
1、fcv+fhv
‑
1、fcv+fpv、fpv+fhv
‑
1、fcv+fpv+fhv
‑
1的rna\dna为阳性样本,fcov、猫支原体核酸为阴性样本,同时设立阴性对照,进行特异性试验。
[0098]
由图5所示:在fam通道下,以fcv核酸作为模板的多重荧光rt
‑
lamp反应中可见明显扩增曲线,在vic(fpv)、ned(fhv
‑
1)通道下无扩增曲线出现,而以fcov、猫支原体核酸、无核酸酶灭菌水作为扩增模板时三个荧光通道下均无扩增曲线。
[0099]
由图6显示:fpv核酸作为模板时在vic通道下,可见明显扩增曲线,而在fam(fcv)、ned(fhv
‑
1)通道下无扩增曲线出现,且以fcov、猫支原体核酸及无核酸酶灭菌水作为扩增模板时三个荧光通道下均无扩增曲线。
[0100]
fhv
‑
1的核酸作为扩增模板时,在ned通道下可见清晰的扩增曲线,在vic(fpv)、fam(fcv)通道下无扩增曲线出现,而以fcov、猫支原体核酸及无核酸酶灭菌水作为扩增模板时三个荧光通道下均无扩增曲线,如图7所示。
[0101]
由图8显示:以fcv及fhv
‑
i混合核酸作为模板的多重荧光rt
‑
lamp反应在fam(fcv)、ned(fhv
‑
1)通道下,可见明显扩增曲线,而vic(fpv)通道下无扩增曲线出现,同时以
fcov、猫支原体核酸及无核酸酶灭菌水作为扩增模板时三个荧光通道下均无扩增曲线。
[0102]
由图9显示:以fcv及fpv混合核酸作为模板的多重荧光rt
‑
lamp反应在fam(fcv)、vic(fpv)通道下,可见明显扩增曲线,而ned(fhv
‑
1)通道下无扩增曲线出现,且以fcov、猫支原体核酸及无核酸酶灭菌水作为扩增模板时三个荧光通道下均无扩增曲线。
[0103]
由图10显示:以fpv及fhv
‑
i混合核酸作为模板的多重荧光rt
‑
lamp反应仅在vic(fpv)、ned(fhv
‑
1)通道下可见明显扩增曲线,而以fcov、猫支原体核酸及无核酸酶灭菌水作为扩增模板时三个荧光通道下均无扩增曲线。
[0104]
由图11显示:以fcv、fpv及fhv
‑
i混合核酸作为模板的多重荧光rt
‑
lamp反应分别在fam(fcv)、vic(fpv)、ned(fhv
‑
1)三个通道下,均可见明显扩增曲线,而其他扩增模板条件下三个荧光通道下均无扩增曲线。
[0105]
结果表明三重荧光rt
‑
lamp反应对fcv、fpv、fhv
‑
1病毒具有高度特异性,在fcov、猫支原体之间无交叉反应的产生。
[0106]
实施例6三重荧光rt
‑
lamp方法敏感性试验
[0107]
将fcv、fpv、fhv
‑
1的rna\dna混合样本以10倍梯度倍比稀释后进行三重荧光rt
‑
lamp反应,同时与普通(rt)
‑
pcr法及建立的单重荧光(rt)
‑
lamp法结果对比,以确定并评价多重荧光rt
‑
lamp检测的灵敏度。
[0108]
以fcv、fpv、fhv
‑
1的rna\dna混合样本10倍梯度稀释液为模板,评价三重荧光rt
‑
lamp检测的灵敏度结果如图4
‑
14所示:在fam通道下随着rna浓度的降低,fcv扩增曲线出现时间逐渐增加,荧光强度逐渐降低,其rna的检测最低限度为45.7fg/μl;在vic通道下随着dna浓度的降低,fpv扩增曲线出现时间逐渐增加,荧光强度逐渐降低,其dna的检测最低限度为5.57fg/μl;在ned通道下随着dna浓度的降低,fhv
‑
1扩增曲线出现时间逐渐增加,荧光强度逐渐降低,其dna的检测最低限度为3.72fg/μl。其检测结果与建立的fcv的荧光rt
‑
lamp反应、fpv的荧光lamp反应、fhv
‑
1的荧光lamp反应检测结果相同,比普通(rt)
‑
pcr检测方法更敏感。
[0109]
实施例7核酸免提取三重荧光rt
‑
lamp反应体系及试剂盒的组装
[0110]
采用已优化确立的三重荧光rt
‑
lamp反应条件,取100μl疫苗原液经90℃水浴5min后立即于冰上放置3min,吸取上清液5μl做模板。其他反应条件按照实施例4得出的最佳条件进行。
[0111]
表4核酸免提取三重荧光rt
‑
lamp成分
[0112]
[0113][0114]
如图13,疫苗原液的核酸免提取三重荧光rt
‑
lamp结果显示,在fam、vic、ned通道下可分别检测到fcv、fpv、fhv
‑
1扩增曲线,且阴性对照无扩增,表明建立的核酸免提取多重荧光rt
‑
lamp反应体系可同时检测三种病原。
[0115]
实施例8核酸免提取三重荧光rt
‑
lamp试剂盒的组装
[0116]
根据优化后的结果建立核酸免提取多重荧光rt
‑
lamp反应体系及研制核酸免提取多重荧光rt
‑
lamp试剂盒,并对试剂盒的包装规格及组成成分进行明确。
[0117]
表5核酸免提取三重荧光rt
‑
lamp试剂盒成分
[0118]
[0119][0120]
试剂盒成分表中用量为25μl反应体系中各成分含量。试剂盒需低温运输,实验室需
‑
20℃避光保存。所有接触过病毒阳性模板的物品,再次使用前需高压灭菌、紫外照射或depc水处理,防止交叉污染。操作过程需避光,应注意避免试剂盒中各成分受到污染。采取的样本应及时检测,配制好的检测混合液低温避光尽快进行检测。定期进行阴性和阳性样本对照,以检测假阳性\假阴性污染。
[0121]
实施例9核酸免提取三重荧光rt
‑
lamp检测试剂盒重复性试验
[0122]
为了验证该试剂盒的重复性,将上述试剂盒于
‑
20℃和室温下反复冻融30次后,进行核酸免提取三重荧光rt
‑
lamp反应以检测其重复性及稳定性。
[0123]
结果如图14所示:经过
‑
20℃与室温之间反复冻融30次后使用试剂盒进行核酸免提取三重荧光rt
‑
lamp反应,每份样品设置3组平行,在fam、vic、ned通道下可分别检测到fcv、fpv、fhv
‑
1扩增曲线,且阴性对照无扩增,表明建立的核酸免提取多重荧光rt
‑
lamp检测试剂盒重复性及稳定性良好。
[0124]
实施例10临床样本检测
[0125]
对采集保存的眼睑、呼吸道鼻液、口腔咽喉唾液拭子液,粪便、粪便拭子液及腹水病料,取100μl样本原液经90℃水浴5min后立即于冰上放置3min,吸取上清液5μl,按照上述1.2.8核酸免提取多重荧光rt
‑
lamp反应试剂盒进行检测。样本由临床诊断试剂盒、普通pcr或胶体金试纸板检测阳性或阴性。
[0126]
以不同样本组合模拟临床上混合感染使用核酸免提取三重荧光rt
‑
lamp试剂盒进行检测反应,对20份fcv阳性样本、3份fcv阴性样本、3份fcov阳性样本、2份支原体阳性样本进行检测发现,含有fcv的临床样本在fam荧光通道下呈现清晰的扩增曲线,在vic及ned通道下未见明显扩增曲线,而其他样本在三个荧光通道下均无扩增曲线。其中20份fcv阳性样本使用核酸免提取多重荧光rt
‑
lamp方法共检出17份阳性,3份阴性样品,与临床方法检测相符率为85%。
[0127]
对20份fpv阳性样本、3份fpv阴性样本、3份fcov阳性样本、2份支原体阳性样本进行检测,含fpv病毒的样本在vic荧光通道下出现明显扩增曲线,在fam及ned通道下未见显著扩增反应,而其他样本在三个荧光通道下均无扩增曲线。其中20份fhv
‑
1阳性样本使用核酸免提取多重荧光rt
‑
lamp方法共检出20份阳性,与临床方法检测结果相符率为100%。
[0128]
对20份fhv
‑
1阳性样本、3份fhv
‑
1阴性样本、3份fcov阳性样本、2份支原体阳性样本进行检测,含fhv
‑
1病毒的样本在ned荧光通道下出现明显扩增曲线,在fam及vic通道下未见明显扩增曲线,而其他样本在三个荧光通道下均无扩增曲线。其中20份fhv
‑
1阳性样本使用核酸免提取多重荧光rt
‑
lamp方法共检出20份阳性,与临床方法检测结果符合率为100%。
[0129]
对临床检测的20份阳性混合样本、3份阴性混合样本、3份fcov阳性样本、2份支原体阳性样本进行检测结果显示,在fam、vic、ned三个通道下,可见fcv、fpv及fhv
‑
i明显扩增曲线,而以fcov、猫支原体及阴性对照均无扩增曲线。其中20份混合阳性样本使用核酸免提取多重荧光rt
‑
lamp方法共检出17份fcv+fhv
‑
1+fpv阳性,1份fhv
‑
1+fpv阳性,1份fpv阳性,与临床检测方法符合率为85%。
[0130]
结果表明,研制的核酸免提取三重荧光rt
‑
lamp试剂盒检测结果与临床诊断试剂盒、普通pcr或胶体金试纸板方法检测结果符合率92.5%,临床效果好。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1