一种紫球藻多糖及其制备方法和应用与流程
本发明涉及植物多糖技术领域,具体涉及一种紫球藻多糖及其制备方法和应用。
背景技术:
紫球藻(porphyridium)是一种隶属于红藻门、红藻纲、红毛菜亚纲、紫球藻目、紫球藻科、紫球藻属的海洋单细胞藻类,它具有极强的环境适应性和快速繁殖能力,同时作为一种比较原始的红藻门单细胞藻类,能够产生许多生物活性物质,如藻胆蛋白、多不饱和脂肪酸及胞外多糖物质。紫球藻细胞可积累20%-50%生物量的多糖,该多糖是由木糖,葡萄糖,半乳糖等单糖构成的多聚体,具有独特的胶体性能,粘度大,其结构与褐藻胶,褐藻淀粉相似。然而,基于藻类细胞良好的吸附能力,且具有吸附速度快、不易造成二次污染的诸多优点,近年来对藻类胞外多糖的研究多以其作为吸附剂为主;例如cn105664862a公开了一种紫球藻胞外多糖吸附剂及其制备方法,cn104591334a公开了一种紫球藻胞外多糖吸附金属离子的方法。基于此,开发紫球藻多糖在其他领域的性能研究显得尤为必要。
技术实现要素:
本发明的目的在于提供一种紫球藻多糖及其制备方法和在抗炎和/或免疫调节药物中的应用。通过对紫球藻中多糖成分进行针对性提取后进行抗炎活性研究,结果显示紫球藻多糖能够发挥抗炎和/或免疫调节作用,在医药以及保健品领域将会有很广的应用。
本发明的技术方案之一,一种紫球藻多糖,包括古洛糖醛酸、甘露糖、核糖、葡萄糖醛酸、氨基葡萄糖、葡萄糖、半乳糖、木糖、阿拉伯糖和l-岩藻糖。
进一步地,紫球藻多糖的平均分子量为4467770da,质量分数计,古洛糖醛酸、甘露糖、核糖、葡萄糖醛酸、氨基葡萄糖、葡萄糖、半乳糖、木糖、阿拉伯糖和l-岩藻糖所占比例为0.26%、2.48%、3.28%、1.82%、1.7%、29.35%、18.21%、40%、1.57%和0.97%。
本发明的技术方案之二,上述紫球藻多糖的制备方法,以紫球藻为原料,经扩大培养后所得藻液进行透析浓缩得到紫球藻多糖。
进一步地,具体包括以下步骤:
紫球藻扩大培养:紫球藻经活化培养后接种于f/2液体培养基中震荡培养7-10d,转移至f/2海水培养基中继续培养7天后扩大培养10-15d,收集藻液,静置离心得上清液a和藻体;
紫球藻多糖的制备:上清液a经一次浓缩后透析然后二次浓缩,收集浓缩液,加入等体积的三氯乙酸溶液得混合液,低温放置后离心,取上清液b,调节ph值至7后三次浓缩后醇沉,离心得沉淀即为粗多糖。
进一步地,所述紫球藻扩大培养过程中:
活化培养具体为:紫球藻在温度25℃,光照3000lux条件下培养24h;
所述震荡培养条件为:温度25±2℃,光照3000±100lux,转速120±10r/min,光暗比12h:12h;
所述扩大培养条件:温度25℃±2℃,光照3000lux±100lux,转速120r/min±10,光暗比12h:12h。
进一步地,所述紫球藻多糖的制备过程中:
透析具体为:流水透析24±2h,单蒸水中透析24±2h;
混合液中三氯乙酸的质量分数为10%;
低温放置具体为:4℃放置12-24h;
离心为:8000rmp离心20min;
醇沉为:加入三倍体积的95%乙醇过夜沉淀。
本发明的技术方案之三,上述紫球藻多糖在抗炎药物和/或免疫调节药物中的应用。
本发明的技术方案之四,一种抗炎药物,成分为上述紫球藻多糖以及辅料。
与现有技术相比,本发明的有益效果:
本发明制备的紫球藻多糖在12.5μg/ml~400μg/ml范围内,对细胞存活率没有影响,还能够促进巨噬细胞的吞噬能力。紫球藻多糖单独作用于巨噬细胞时,能够促进一氧化氮的释放,增加il-6与tnf-α的分泌量。由lps诱导炎症后,不同浓度的紫球藻多糖组均能够减少炎症细胞中no的释放,不同浓度的紫球藻多糖组均能够显著的降低炎症细胞中il-6与tnf-α的释放。小鼠dth结果显示,不同浓度紫球藻多糖能够有效的抑制dnfb引起的耳肿胀;westernblot结果显示,紫球藻多糖能够降低磷酸化p38,磷酸化p65和磷酸化iκbα蛋白的表达;由此证明紫球藻多糖具有良好的抗炎和免疫调节剂作用,在医药以及保健品领域将会有很广的应用。
紫球藻多糖本身可能没有一些活性,或者一些生物活性作用比较差,但是对其结构进行修饰后,则可改变其生物活性。硒是一种人体必需的微量元素,是构成生物体内若干抗氧化物酶的活性中心,具有清除自由基、抗衰老等的功能。含硒的生物大分子,如蛋白、多糖等均具有抗癌、增强免疫、抗氧化等活性。利用微藻作为载体,将无机硒通过微生物转化为有机硒是一条简便而有效的途径。紫球藻可以合成蛋白质,多糖与脂类等大分子物质,在紫球藻硒化的过程中,硒也会结合到蛋白质与脂类,将紫球藻作为载体,制备硒化多糖,形成多糖衍生物,这样既避免了补充无机硒引起的毒性,同时也保留了多糖的原有活性,二者发挥着协同作用,在抗炎方面效果更佳。这为将紫球藻作为中间体,通过生物转化,将无机营养元素转化为经济价值更高的多糖衍生物提供基础。
附图说明
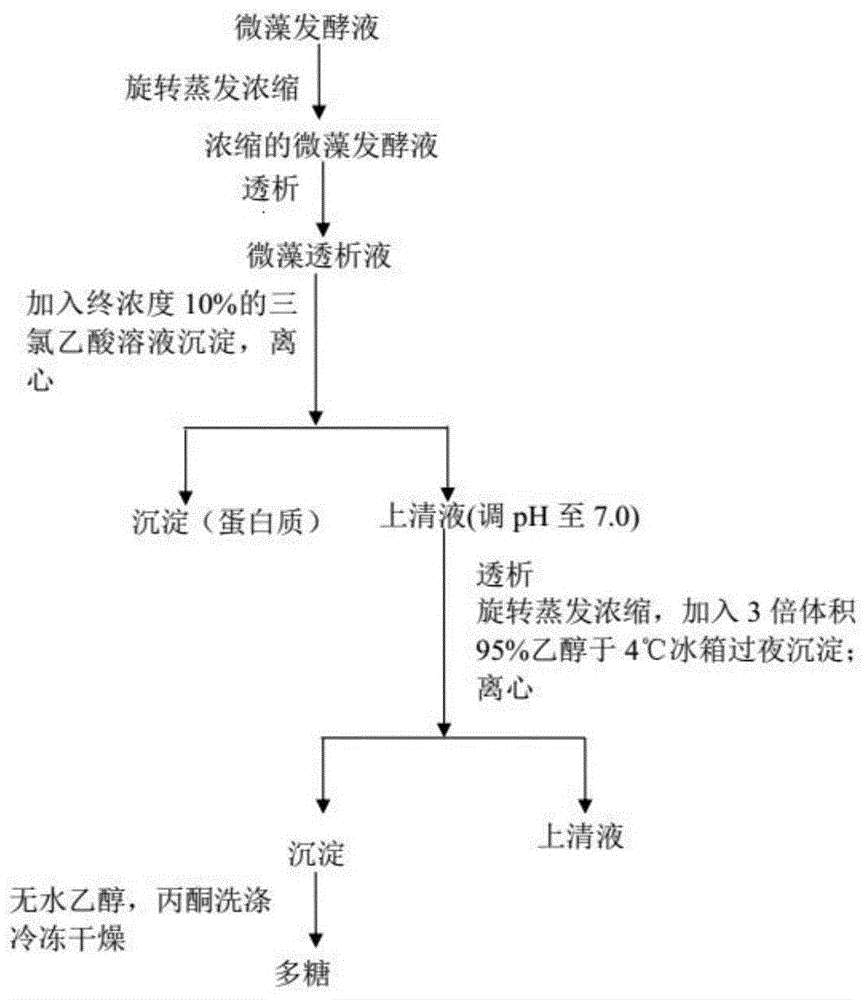
图1为本发明实施例1步骤(2)中紫球藻上清液中多糖的制备工艺路线图;
图2为本发明实施例1步骤(3)中紫球藻多糖的gpc图;
图3为本发明实施例1步骤(4)中紫球藻多糖红外分析光谱图;
图4为本发明效果验证例1步骤(1)中不同浓度紫球藻多糖对细胞活力的影响;
图5为本发明效果验证例1步骤(4)中不同浓度紫球藻多糖刺激巨噬细胞释放no的影响;
图6为本发明效果验证例1步骤(5)中不同浓度紫球藻多糖对巨噬细胞吞噬能力的影响;
图7为本发明效果验证例1步骤(6)中不同浓度紫球藻多糖对巨噬细胞分泌tnf-α的影响;
图8为本发明效果验证例1步骤(6)中不同浓度紫球藻多糖对巨噬细胞分泌il-6的影响;
图9为本发明效果验证例2步骤(3)中lps诱导炎症后,紫球藻多糖对炎症细胞no分泌量的影响;
图10为本发明效果验证例2步骤(4)中lps诱导炎症后,紫球藻多糖对炎症细胞tnf-α分泌量的影响;
图11为本发明效果验证例2步骤(4)中lps诱导炎症后,紫球藻多糖对炎症细胞il-6分泌量的影响;
图12为本发明效果验证例2步骤(5)中紫球藻多糖对小鼠耳肿胀程度的影响;
图13为本发明效果验证例2步骤(5)中紫球藻多糖对小鼠体质量的影响;
图14为本发明效果验证例2步骤(5)中紫球藻多糖对小鼠脾脏的影响;
图15为本发明效果验证例2步骤(5)中紫球藻多糖对小鼠的胸腺的影响。
具体实施方式
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本申请说明书和实施例仅是示例性的。
关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
本发明以下实施例中所用f/2海水培养基的配置:
以下各组分用单蒸水配置成初浓度母液,取相应的量加单蒸水至1l配置成f/2营养液,临用时与海水按照1:1000配置成f/2海水培养基。配置完成后,用灭菌过滤器过滤,加入灭菌海水,f/2海水培养基的配方如表1-3所示。
表1f/2海水培养基
表2微量元素母液
表3维生素母液
实施例1紫球藻多糖制备及表征
(1)紫球藻的扩大培养:先将保存于4℃冰箱的藻种(广东恒兴南方科技有限公司惠赠紫球藻)放于恒温光照培养箱(25℃,光照3000lux)24h,然后接种于60ml的f/2液体培养基中,放于光照震荡摇床培养。培养条件是:温度25℃±2℃,光照3000lux±100lux,转速120r/min±10,光暗比12h:12h。培养一周后,将其转移至200ml的f/2海水培养基,继续培养。待其长好后,再转移至3000mlf/2海水培养基。最后再转移到20l光反应器进行扩大培养(温度25℃±2℃,光照3000lux±100lux,转速120r/min±10,光暗比12h:12h)。培养约10天后,收集藻液,静置沉淀,离心过滤,分别收集上清液与藻体。
(2)上清液放入旋转蒸发仪浓缩,将浓缩后的液体放入透析袋内,放于流水中透析1天,然后再放于单蒸水中透析1天。将透析好的液体放于旋转蒸发仪中浓缩。收集浓缩液,加入等体积的终浓度为10%三氯乙酸,4℃冰箱过夜放置。8000rmp离心,20min,取上清液,上清液调节ph为7.0,于旋转蒸发仪浓缩,然后加入三倍体积的95%乙醇过夜沉淀。沉淀后的溶液离心后,取沉淀。沉淀用无水乙醇与丙酮清洗2遍后,冷冻干燥,得到粗多糖。紫球藻上清液中多糖的制备工艺路线如图1所示。
(3)采用凝胶渗透色谱法(gpc)测定紫球藻多糖的平均分子量:色谱柱为ultrahydrogeltmlinear300mm×7.8mm,流动相为0.1%mol/l硝酸钠水溶液,流速0.8ml/min,柱温30℃,进样量20μl。检测器rid2410。用流动相溶解不同分子量的葡聚糖标准品(2000000,133800,36800,9700,2700,180)与样品,浓度为0.5%,进样检测。根据保留时间与分子量对数做出标准曲线,将多糖的保留时间代入标准曲线,测得样品平均分子量。
gpc的测定结果表明,时间在14~16分钟之间,出现一个比较小的峰,时间在21~24分钟之间,又出现两个相连的峰,在24~26分钟之间,出现一个尖峰;26分钟之后出现的倒峰为溶剂峰。样品总共有4个峰,说明步骤(2)所提取的多糖是一个多聚物,其分子量是平均分子量;在24~26分钟之间出现一个较大的峰,说明该组分含量最多;这为进一步探究该紫球藻多糖的组分组成以及各组分的含量提供一定信息。gpc具体图示如图2所示。根据标准品的保留时间和分子量对数做出标准曲线,得到线性回归方程为:logm=13.5-0.441t,将样品保留时间代入得到样品的平均分子量为4467770da。
(4)红外光谱分析:称取干燥紫球藻多糖1.0mg,用kbr压片,进行红外扫描,测定多糖特征吸收峰。在3397.22cm-1处有一个较强的宽峰,为羟基(-oh)的伸缩振动峰;在2927.74cm-1处出现一个较弱的峰,是c-h的伸缩振动峰;1431.99cm-1是c-h的变角震动峰;这两组c-h峰是多糖的特征吸收峰。1091.91cm-1是c-o伸缩振动峰;1147.23cm-1是硫酸基的非对称伸缩振动峰。紫球藻多糖红外图谱吸收峰如图3所示。
(5)hplc法测定单糖组分以及组分比例:称取10mg多糖样品于20ml的钳口瓶中,加入5ml的2mol/ltfa,充n2封管,110℃烘箱中水解6h;冷却后打开盖,取1ml出来加入1ml甲醇后,70℃水浴下用n2吹干,如此重复加甲醇并用n2吹干2次,以去除tfa;加入1ml0.3mol/lnaoh溶液充分溶解残渣,得到多糖水解液。
分别取400μl的混合单糖标准液和多糖水解液于5ml的具塞试管中,加400μlpmp甲醇溶液,漩涡混匀;于70℃水浴中反应2h;取出放置冷却至室温;加400μl0.3mol/l的hcl中和(ph6~7);加水1200μl,再加等体积的氯仿,涡旋混匀振摇,静置,弃去氯仿相,如此萃取2次。将水相用0.45μm微孔膜(水系)过滤后供hplc进样分析。结果显示:紫球藻多糖由古洛糖醛酸、甘露糖、核糖、葡萄糖醛酸、氨基葡萄糖、葡萄糖、半乳糖、木糖、阿拉伯糖以及l-岩藻糖组成;各组分所占比例为0.26%,2.48%,3.28%,1.82%,1.7%,29.35%,18.21%,40%,1.57%,0.97%,其中木糖的含量最高。
效果验证例1紫球藻多糖免疫调节活性验证
(1)紫球藻多糖对raw264.7细胞活力的测定
将紫球藻多糖制备成12.5μg/ml,25μg/ml,50μg/ml,100μg/ml,200μg/ml,400μg/ml的浓度梯度,分别作用于巨噬细胞raw264.7(购置于上海细胞研究所)24h和48h,具体的:收集细胞,调整细胞浓度为5×103个/ml,接种于96孔板中,100μl/孔,置37℃,5%co2培养箱培养。每孔加入已经稀释好的不同浓度紫球藻多糖溶液100μl,继续培养24h与48h;将板取出,每孔加入终浓度为0.5mg/mlmtt100μl,继续培养4h,弃上清,每孔加入150μldmso,低速震荡10min使结晶完全溶解,测定490nm处的吸光值。
结果见图4,图4显示,与空白对照组相比,加药培养24h与48h后,紫球藻多糖质量浓度在12.5μg/ml~400μg/ml范围内,均无统计学意义,对细胞均无明显毒性。说明该浓度范围的紫球藻多糖对细胞是安全的,无毒性的。
(2)griess法筛选lps作用浓度:收集细胞,调整细胞浓度为5×104个/ml,接种于96孔板中,100μl/孔,置37℃,5%co2培养箱培养。设计空白组,lps组(0.5μg/ml,1μg/ml,2μg/ml,4μg/ml,8μg/ml)每孔加入100μl,继续培养24h后;从每孔上清液吸取50μl到新的96孔板中,用griess法测定no的含量。从而确定lps的作用浓度;
结果显示lps能够有效的诱导细胞no的释放,故选用no的释放量来筛选lps的作用浓度。
(3)mtt法测定lps对raw264.7细胞存活率影响:收集细胞,调整细胞浓度为5×103个/ml,接种于96孔板中,100μl/孔,置37℃,5%co2培养箱培养。设计空白组,lps组(0.5μg/ml,1μg/ml,2μg/ml,4μg/ml,8μg/ml)每孔加入100μl,连续培养24h,培养结束后,将板取出,去除培养液,加入终浓度为0.5mg/mlmtt100μl,继续培养4h,弃上清,每孔加入150μldmso,低速震荡10min使结晶完全溶解,490nm处的吸光值。
结果显示,lps在设定的浓度范围内对细胞活力没有明显影响,与空白对照组相比,均无统计学意义,对细胞没有毒性作用,但是从4μg/ml浓度之后,细胞的存活率有轻微下降趋势。
(4)细胞上清液中no含量测定:制备细胞浓度为1×104个/ml的巨噬细胞悬液,接种于96孔板中,100μl/孔,置于37℃,5%co2培养箱培养。设计空白组,lps组,紫球藻多糖组,每孔加入100μl,继续培养24h后,从每孔上清液吸取50μl到新的96孔板中,用griess法测定no的含量。
结果见图5,lps和不同浓度的紫球藻多糖均能够促进细胞释放no,与空白组相比,其促进程度均具有统计学意义。
(5)巨噬细胞吞噬中性红能力的检测:制备细胞浓度为1×104个/ml的巨噬细胞悬液,接种于96孔板中,100μl/孔,置于37℃,5%co2培养箱培养。如步骤(4)分组与加药,培养24h后,加入0.05%的中性红100μl/孔,继续培养5min,倾掉中性红,用温pbs洗三次,每孔加入细胞裂解液(无水乙醇:冰醋酸=1:1)200μl。4℃冰箱静置2h~3h,待细胞裂解后,540nm处测定吸光值,并计算吞噬指数。
结果显示(图6):lps与不同浓度紫球藻多糖均能够促进巨噬细胞吞噬中性红,与正常对照组相比,紫球藻多糖在12.5μg/ml~400μg/ml质量浓度范围内显示出的吞噬指数具有显著性差异。
(6)elisa试剂盒检测细胞因子释放情况:制备细胞浓度为1×104个/ml的巨噬细胞悬液,接种于96孔板中,200μl/孔,置37℃,5%co2培养箱培养。如步骤(4)分组与加药,培养24h后,收集细胞上清液,3000rmp离心10min。取上清并按照小鼠tnf-α与il-6试剂盒说明书操作。用酶标仪进行双波长检测,450nm处测最大吸收波长,570nm作为参考波长,最后的od用最大波长od值减去参考波长的od值。
结果显示:与空白组相比,不同浓度的紫球藻多糖和lps均能够促进细胞tnf-α的分泌,且均有显著性差异(p<0.05)。tnf-α的分泌呈现先上升后下降的趋势,质量浓度在12.5μg/ml~50μg/ml范围内时,分泌量呈剂量依赖性上升;而在100μg/ml~400μg/ml范围内,其分泌量被一定程度的抑制。分泌量趋势如图7。
紫球藻多糖对il-6分泌的影响情况则有所不同。不同浓度的紫球藻多糖和lps均能够促进细胞il-6的分泌,但是il-6的分泌量随着紫球藻多糖浓度的增加出现降低的趋势,但是差异仍然有统计学意义,如图8。
通过以上内容得出结论:基于小鼠腹腔巨噬细胞raw264.7,初步探究了紫球藻多糖对其存活率,吞噬能力,no释放能力,细胞因子tnf-α和il-6分泌能力的影响。由于lps能够很好的激活巨噬细胞,是探究巨噬细胞免疫调节作用常用的阳性对照药物,因此选择lps作为阳性对照,通过免疫调节的相关指标,共同探究其与紫球藻多糖对巨噬细胞免疫调节作用规律。实验结果表明:紫球藻多糖作用24h时,与空白对照组相比,无统计学意义,对细胞存活力无影响,但是作用48h后,细胞存活率相对于空白组虽没有统计学意义,但是细胞活力相比于24h稍微有点降低。因此为了排除药物本身对实验的干扰,在后续内容中所采取药物作用时间为24h。结果显示,不同浓度的紫球藻多糖与lps均可以刺激细胞释放no,紫球藻多糖组的no释放量均低于lps组,但紫球藻多糖组与lps组的释放量均高于空白组,且相对于空白组都具有统计学意义(p<0.05);说明紫球藻多糖能够激活巨噬细胞。本发明的实验结果表明不同浓度的紫球藻多糖都能够增强巨噬细胞的吞噬能力,且吞噬能力随着紫球藻多糖浓度的增加而增强,相比于空白组都具有显著性差异(p<0.05);紫球藻多糖在12.5μg/ml~50μg/ml浓度范围,吞噬能力增强的比较明显,但是小于lps的增强作用;浓度在100μg/ml~400μg/ml时,虽然吞噬能力随着紫球藻多糖浓度增大而增强,但是增强能力趋于平缓,与lps组的吞噬能力几乎接近。说明低浓度范围的紫球藻多糖能较好的增强巨噬细胞的吞噬能力。有研究表明多糖受体主要是ш型补体受体,属于整合素家族,主要存在于巨噬细胞,自然杀伤细胞和多形核中性粒细胞表面。多糖与受体结合有以下几个特点:可逆性,饱和性,特异性且存在活性中心。基于此,紫球藻多糖与巨噬细胞的作用可能存在一个饱和值,这个饱和值可能与细胞膜表面受体有关,所以导致浓度升高,巨噬细胞的吞噬能力增强的效果不明显。不同浓度的紫球藻多糖均可以刺激巨噬细胞释放tnf-α,与空白对照组相比,都具有显著性差异(p<0.05)。但是tnf-α释放量呈先上升后下降的趋势,最佳释放量对应的紫球藻多糖浓度是50μg/ml。各浓度的紫球藻多糖可以刺激il-6的释放,但是il-6的释放量随着紫球藻浓度的增加反而出现降低的趋势,但是相比于空白对照组,仍具有显著性差异(p<0.05)。紫球藻多糖浓度在12.5μg/ml~100μg/ml区间内,对il-6释放量的促进作用比较明显,且各组间的释放量相差不大,而浓度在200μg/ml~400μg/ml区间促进作用明显低于12.5μg/ml~100μg/ml该区间的促进作用。综上紫球藻多糖浓度为50μg/ml时,是促进tnf-α与il-6释放的最佳浓度。
效果验证2紫球藻多糖抗炎作用的验证
研究对象:spf级雄性balb/c小鼠(18-22g),购置于广东省医学实验动物中心(许可证:scxk(粤)2013000,生产批号:no·44007200044305),raw264.7细胞购置于上海细胞研究所。
(1)mtt法测定地塞米松对raw264.7细胞存活率影响:收集细胞,调整细胞浓度为5×103个/ml,接种于96孔板中,100μl/孔,置于37℃,5%co2培养箱培养。设计空白组,地塞米松组(12.5ng/ml,25ng/ml,50ng/ml,100ng/ml,200ng/ml)连续培养24h,培养结束后,将板取出,去除培养液,加入终浓度为0.5mg/mlmtt100μl,继续培养4h,弃上清,每孔加入150μldmso,低速震荡10min使结晶完全溶解,检测490nm处的吸光值。
结果显示,与空白对照组相比,地塞米松浓度在12.5ng/ml~200ng/ml范围内,对细胞没有毒性,不影响细胞存活率。
(2)griess法筛选地塞米松抗炎浓度:收集细胞,调整细胞浓度为5×104个/ml,接种于96孔板中,100μl/孔,置37℃,5%co2培养箱培养。设计空白组,lps模型组,地塞米松组(12.5ng/ml,25ng/ml,50ng/ml,100ng/ml,200ng/ml)每孔加入100μl。先用地塞米松保护细胞2h,再用lps继续培养24h后;从每孔上清液吸取50μl到新的96孔板中,用griess法测定no的含量。从而确定地塞米松抗炎浓度。
结果显示,lps模型组相对于空白组而言,其细胞no的释放量明显增多;不同浓度的地塞米松与lps组相较,能够不同程度的降低no的释放量,且差异具有统计学意义。
(3)细胞上清液中no含量测定:制备细胞浓度为1×104个/ml的巨噬细胞悬液,接种于96孔板中,100μl/孔,置37℃,5%co2培养箱培养。设计空白对照组,lps+地塞米松组,lps模型组,lps+紫球藻多糖组。试验时,lps+地塞米松组和lps+紫球藻多糖组先加入不同浓度紫球藻多糖(100μg/ml,200μg/ml,400μg/ml)和地塞米松保护细胞2h,之后再加入终浓度为2μg/ml的lps共同培养24h,从每孔上清液吸取50μl到新的96孔板中,用griess法测定no的含量。
结果显示:与空白对照组相比,lps组细胞释放的一氧化氮量具有显著性的升高;而与lps组相比,紫球藻多糖组与地塞米松组均能够显著的抑制no的释放,且差异具有统计学意义(图9)。
(4)elisa试剂盒检测细胞因子释放情况:制备细胞浓度为1×104个/ml的巨噬细胞悬液,接种于96孔板中,100μl/孔,置于37℃,5%co2培养箱培养。设计空白对照组,lps+地塞米松组,lps模型组,lps+紫球藻多糖组。试验时,lps+地塞米松组和lps+紫球藻多糖组先加入地塞米松和不同浓度紫球藻多糖(100μg/ml,200μg/ml,400μg/ml)保护细胞2h,之后再加入终浓度为2μg/ml的lps共同培养24h。收集细胞上清液。3000rmp离心10min,取上清并按照小鼠tnf-α与il-6试剂盒说明书操作。用酶标仪进行双波长检测,450nm处测最大吸收波长,570nm作为参考波长,最后的od用最大波长od值减去参考波长的od值。
结果显示,与空白组相比,lps模型组细胞tnf-α与il-6的分泌量显著上升;而与模型组相比,紫球藻多糖组能够明显的抑制细胞tnf-α与il-6的分泌,差异均具有统计学意义(图10-11).
(5)小鼠迟发型变态反应(dth)试验:取balb/c小鼠60只,随机分为以下6组(每组10只):分为正常对照组(生理盐水组)、阳性对照组(醋酸地塞米松组,30mg/kg)、紫球藻多糖高剂量组(320mg/kg)、中剂量组(80mg/kg)、低剂量组(20mg/kg)以及模型组。实验过程:灌胃给药0.2ml/10g,连续给药7天。给药第一天,腹部去毛,给药第二天1h后,在去毛部位涂5%二硝基甲苯(dnfb),50μl/只,隔日再次在同一部位涂等量的dnfb强化。第6天给药1h后,用1%dnfb,20μl/只,涂于右耳双面,左耳双面涂相应的溶剂作为对照。第8天将小鼠处死,剪下两耳,用直径为8mm的打孔器打耳片,称重。计算耳肿胀程度,即为两边耳重之差。
结果显示:模型组与生理盐水组相比,模型组小鼠的耳肿胀程度明显大于生理盐水组。紫球藻多糖高、中、低剂量组分别与模型组相比,各组小鼠耳肿胀程度均明显降低,且差异均具有统计学意义(p<0.05)。各组比较趋势如图12所示。对小鼠的体质量进行分析可知,各组的小鼠体质量没有明显的差别,没有统计学意义。各组比较趋势如图12所示。将各试验组小鼠脾脏指数与胸腺指数分别相较发现,各试验组小鼠的脾脏指数差别不大;各实验组的胸腺指数也没有明显的区别,没有统计学差异。具体的比较趋势如图14-15所示。
由上述内容可知,经lps诱导炎症后,紫球藻多糖对巨噬细胞释放no的影响。药物作用24h后,与空白组相比,模型组经2μg/ml的lps刺激后,no释放量显著增加。而经过紫球藻多糖预处理组,no释放量相比于模型组,都能够显著的抑制no的释放;紫球藻多糖可以抑制由lps刺激巨噬细胞释放的过量tnf-α与il-6;不同剂量紫球藻多糖组与lps组相比,耳肿胀程度都明显下降;说明不同剂量的紫球藻多糖都能够抑制由dnfb诱导的耳肿胀;同时发明还探究了紫球藻多糖对小鼠的体重以及免疫器官的影响。结果发现给药7天后,模型组小鼠的体重与生理盐水组相比,没有明显的区别;各紫球藻多糖组小鼠体重相对于模型组也没有明显的区别;紫球藻多糖的免疫调节与抗炎作用的研究结果表明紫球藻多糖单独作用时能够促进巨噬细胞的吞噬能力,能够促进no的释放以及肿瘤坏死因子的释放,表现出免疫增强作用。但在体外建立lps诱导炎症模型时,紫球藻多糖能够降低由lps诱导的过度产生的no,tnf-α与il-6,表现出抗炎效果。可见紫球藻多糖具有双向调节作用。
除上述研究内容外,本发明还对紫球多糖的抗炎机理进行了研究,结论如下:
p38mapk信号通路的激活可促进炎症因子的产生,加剧炎症反应。有炎症存在时,p38被磷酸化,进而激活其下游通路,发生一系列的级联反应。磷酸化p38的表达量可以反应炎症的程度。抑制p38的磷酸化可以有效的降低炎症反应。p38磷酸化westernblot实验结果显示,炎症模型lps组相比于空白对照组,磷酸化p38蛋白表达量显著的上升;而经过紫球藻多糖预处理后,与lps组相比,100μg/ml、200μg/ml、400μg/ml紫球藻多糖组的磷酸化p38蛋白的表达量下降明显。
通过westernblot测定了磷酸化p65与磷酸化iκbα蛋白的表达情况。实验结果显示,炎症模型lps组相比于空白对照组,磷酸化p65与磷酸化iκbα蛋白的表达量显著上升;而经过紫球藻多糖预处理后,100μg/ml,200μg/ml,400μg/ml紫球藻多糖组与lps组相比,磷酸化p65与磷酸化iκbα蛋白的表达量明显下降。
因此,球藻多糖能够下调磷酸化p38,磷酸化p65与磷酸化iκbα的蛋白表达量,说明紫球藻多糖可能通过下调nf-κb的与p38mapk通路来发挥抗炎作用。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!