一种针对悬浮细胞的慢病毒载体及其应用的制作方法
1.本发明涉及一种针对悬浮细胞的慢病毒载体及其应用,属于生物技术领域。
背景技术:
2.慢病毒(lentivirus,lv)是目前细胞及模式生物实验中非常有效的工具,在基因转染方面有着许多独特的优势。关于慢病毒载体(lentiviral vector)的研究发展得很快,研究得也非常深入。慢病毒载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达。慢病毒载体较逆转录病毒载体有更广的宿主范围,慢病毒能够有效感染非周期性和有丝分裂后的细胞。
3.慢病毒表达载体,即通常所说的穿梭载体,包含了包装、转染、稳定整合所需要的遗传信息。慢病毒包装质粒可提供所有的转录并包装rna到重组的假病毒载体所需要的所有辅助蛋白。为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
4.与其他逆转录病毒相比,慢病毒有其独特的优点。
5.(1)有更广泛的宿主,对于分裂和非分裂细胞均具有感染能力。对于一些较难转染的细胞,如原代细胞、干细胞、不分化的细胞等,能大大提高目的基因转导效率,使目的基因整合到宿主细胞基因组的几率大大增加。
6.(2)稳定表达。慢病毒可以将外源基因有效的整合到细胞染色体中,且目的基因对转录沉默作用有一定的抵抗能力,可以在靶细胞中得到持续高效稳定的表达。
7.(3)经过构建后的慢病毒载体可以携带大约5kb,甚至更长的目的基因。因此除了外源的short
‑
hairpin rnas(shrnas)等小分子外,很多cdna也能被克隆进入慢病毒载体,当然随着目的基因长度的增加,其病毒滴度也会随之下降。
8.基于慢病毒的优点,可以利用慢病毒载体系统进行转染目的基因或rnai基因的常规实验操作,同时慢病毒在基因编辑、基因治疗、转基因动物、药物研究等领域也发挥着重要作用。
9.常见的血液肿瘤主要包括各类白血病、多发性骨髓瘤以及恶性淋巴瘤,目前发病率都排在恶性肿瘤的前十位。因此血液肿瘤是当前的研究热点之一。但是众所周知,血液来源的悬浮细胞,普遍存在难以慢病毒感染的问题。
10.所以,开发一种悬浮细胞专用的慢病毒载体,有很高的临床和市场价值。
技术实现要素:
11.为了解决上述技术问题,本发明提供了一种针对悬浮细胞的慢病毒载体及其应用,该慢病毒载体适用于悬浮细胞的表达,表达效率高效、稳定,能够极大程度提升悬浮细胞中过表达效果,且表达过程简单易行,易于推广。
12.本发明的技术方案如下。
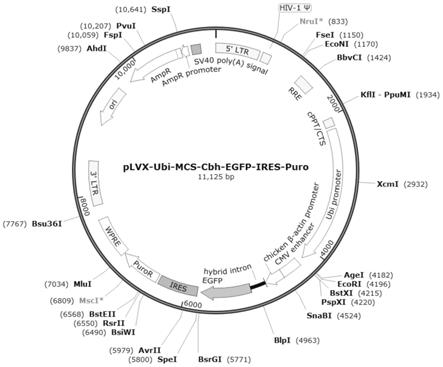
13.本发明提供了一种慢病毒载体,是以plvx
‑
egfp
‑
ires
‑
puro为框架,插入了ubi启动子和cbh启动子。
14.进一步地,所述ubi启动子和cbh启动子替换了plvx
‑
egfp
‑
ires
‑
puro中的cmv启动子。
15.进一步地,所述ubi启动子和cbh启动子的核苷酸序列如seq id no.1所示。
16.本发明还提供了含上述慢病毒载体的重组慢病毒。
17.本发明还提供了一种上述重组慢病毒的制备方法,是将目的基因导入上述慢病毒载体得到目的质粒,将目的质粒与pspax2和pmd2.g共转染宿主细胞得到的重组慢病毒。
18.进一步地,转染时,pspax2、pmd2.g、目的质粒的质量比为pspax2:pmd2.g:目的质粒=2:1:1。
19.本发明还提供了一种重组细胞,所述重组细胞包括上述慢病毒载体和/或重组慢病毒。
20.本发明还提供了一种使用上述重组慢病毒感染细胞的方法,是将上述重组慢病毒与待感染的细胞进行共培养。
21.进一步地,所述细胞为悬浮细胞。
22.本发明还提供了一种药物组合物,所述药物组合物包括上述慢病毒载体、重组慢病毒、重组细胞中的一种或多种。
23.本发明还提供了上述慢病毒载体、重组慢病毒、重组细胞在表达蛋白或制备药物方面的应用。
附图说明
24.图1:本发明提供的慢病毒载体示意图。
25.图2:荧光定量pcr结果。
26.图3:慢病毒感染jurkat细胞的结果。
27.图4:普通载体和悬浮细胞专用载体的病毒感染效果对比。
具体实施方式
28.实施例1构建circrna过表达成环载体
29.1、设计circrna过表达成环载体
30.设计出适用于悬浮细胞的启动子序列;根据商业化载体plvx
‑
egfp
‑
ires
‑
puro的序列信息,设计完整的适用于悬浮细胞过表达的ubi启动子
‑
cbh启动子核苷酸序列(seq id no.1),并利用引物设计软件primer premier 5.0设计引物,所述引物如表1所示,将引物交给核酸合成公司进行引物合成。
31.表1引物设计
[0032][0033]
2、pcr扩增
[0034]
pcr体系如表2所示,通过pcr扩增得到两条dna序列。
[0035]
表2 pcr反应体系
[0036][0037]
pcr反应条件:
[0038]
98℃5min;98℃10s,62℃5s,72℃30s,30cycles;72℃10min,4℃4min。
[0039]
3、通过琼脂糖凝胶电泳回收dna片段
[0040]
取10μl反应产物进行1%琼脂糖凝胶电泳,回收目的基因片段,胶回收试剂盒购自擎科生物。
[0041]
4、酶切plvx
‑
egfp
‑
ires
‑
puro载体
[0042]
质粒plvx
‑
egfp
‑
ires
‑
puro,用clai
‑
ecori进行双酶切,酶切体系如表3所示。
[0043]
表3质粒的双酶切体系
[0044][0045]
双酶切plvx
‑
egfp
‑
ires
‑
puro载体和回收后的目的基因片段。
[0046]
5、胶回收
[0047]
将双酶切后的慢病毒空白载体与进行1%琼脂糖凝胶电泳,胶回收慢病毒空白载体。
[0048]
6、目的基因片段和载体的连接
[0049]
将回收纯化的目的片段与回收纯化的载体连接,连接产物命名为plvx
‑
ubi
‑
mcs
‑
cbh
‑
egfp
‑
ires
‑
puro。连接体系如表4所示。
[0050]
表4连接体系
[0051][0052]
连接反应条件:50℃反应30min。
[0053]
7、连接产物转化感受态细胞
[0054]
取10μl连接产物转化100μl stbl3感受态细胞:将产物与感受态细胞混匀后冰浴30min,42℃热激90s,立即置冰上放置2min,加入预热至室温的500μl lb培养基,180rpm,37℃恒温摇床培养1h,5000rpm离心3min,弃去500μl培养上清,剩余100μl用移液器混匀后均匀涂布于含50μg/ml氨苄抗性的lb平板上,倒置,37℃恒温培养箱培养过夜。
[0055]
8、测序鉴定
[0056]
挑选阳性单菌落送至生工生物工程有限公司测序。
[0057]
9、从测序正确的阳性菌株中提取质粒
[0058]
对测序正确的阳性菌株进行扩大培养,加入含相应抗生素的20ml lb培养基中37℃过夜培养12
‑
16h,提取质粒。
[0059]
对测序正确的阳性菌株进行扩大培养,加入含相应抗生素的20ml lb培养基中37℃过夜培养12
‑
16h,提取质粒,得到含针对悬浮细胞的过表达框架的载体。
[0060]
实施例2目的基因
‑
plvx
‑
ubi
‑
mcs
‑
cbh
‑
egfp
‑
ires
‑
puro载体构建
[0061]
1、目的基因序列pcr扩增,pcr反应体系如表2所示。
[0062]
pcr反应条件:
[0063]
98℃5min;98℃10s,60℃5s,72℃15s,30cycles;72℃10min,4℃4min。
[0064]
2、通过琼脂糖凝胶电泳回收dna片段。
[0065]
取10μl反应产物进行1%琼脂糖凝胶电泳,回收目的基因片段,胶回收试剂盒购自擎科生物。
[0066]
3、酶切plvx
‑
ubi
‑
mcs
‑
cbh
‑
egfp
‑
ires
‑
puro载体
[0067]
质粒plvx
‑
ubi
‑
mcs
‑
cbh
‑
egfp
‑
ires
‑
puro,用agei
‑
ecori进行双酶切,酶切体系如表5所示。
[0068]
表5酶切体系
[0069][0070]
7℃反应5h后1%琼脂糖凝胶回收大片段。
[0071]
4、目的基因片段和载体的连接
[0072]
将回收纯化的目的片段与回收纯化的载体连接,连接产物命名为
[0073]
plvx
‑
ubi
‑
mcs
‑
cbh
‑
egfp
‑
ires
‑
puro。连接体系如表6所示。
[0074]
表6连接体系
[0075][0076]
连接反应条件:50℃反应30min。
[0077]
5、连接产物转化感受态细胞
[0078]
取10μl连接产物转化100μl dh5a感受态细胞:将产物与感受态细胞混匀后冰浴30min,42℃热激90s,立即置冰上放置2min,加入预热至室温的500μl lb培养基,180rpm,37℃恒温摇床培养1h,5000rpm离心3min,弃去500μl培养上清,剩余100μl用移液器混匀后均匀涂布于含50μg/ml氨苄抗性的lb平板上,倒置,37℃恒温培养箱培养过夜。
[0079]
6、测序鉴定
[0080]
挑选阳性单菌落送至生工生物工程有限公司测序。
[0081]
7、从测序正确的阳性菌株中提取质粒
[0082]
对测序正确的阳性菌株进行扩大培养(加入含相应抗生素的20ml lb培养基中37℃培养12h),提取质粒,得到目的基因
‑
plvx
‑
ubi
‑
mcs
‑
cbh
‑
egfp
‑
ires
‑
puro载体。
[0083]
实施例3plvx
‑
ubi
‑
mcs
‑
cbh
‑
egfp
‑
ires
‑
puro慢病毒包装
[0084]
1、细胞准备
[0085]
1)转染前一天,将3
‑
5*106个/皿的293t细胞接种于10mm细胞培养皿中,加入含10%胎牛血清的dmem培养基,37℃、5%co2培养箱内培养。
[0086]
2)转染当天,细胞密度达80%时进行转染。按照pspax2:pmd2.g:目的质粒=2:1:1,加入到无血清dmem培养液中,轻轻混匀,静置5min。
[0087]
3)转染试剂用无血清dmem培养基轻轻混匀,静置5mim
[0088]
将步骤2)和3)的液体混匀,静置20min。
[0089]
4)将混合液均匀滴到细胞培养皿中,37℃,5%co2细胞培养箱中孵育6h。
[0090]
5)继续培养48h后收集细胞上清
[0091]
取10μl反应产物进行1%琼脂糖凝胶电泳,回收目的基因片段,胶回收试剂盒购自擎科生物。
[0092]
2、浓缩
[0093]
1)转染48h后,收集细胞上清液于一个50ml离心管中,并更换dmem培养基,72h后再收集一次细胞上清,并将两次收集的液体混合。
[0094]
2)将收集到的病毒液混合后离心浓缩。
[0095]
3)将病毒上清浓缩液分装至病毒管中,冻存于
‑
80℃。
[0096]
3、浓缩
[0097]
1)将293t细胞接种至96孔板中,每孔1*105个,37℃培养过夜。
[0098]
2)用dmem培养基重悬病毒原液,第一个孔病毒原液量为10μl,然后进行10倍梯度稀释,每孔加入100μl培养基
‑
病毒混合液,每个稀释浓度做3个复孔。放入37℃5%co2培养箱中培养。
[0099]
3)24小时后,将含有病毒dmem的培养基更换为不含病毒液的dmem完全培养基。
[0100]
4)继续培养48h后,在荧光显微镜下观察各孔中含有荧光细胞数量并进行计数,并拍照,计算病毒滴度。
[0101]
计算3个重复孔内的总数之和并计算出平均数,假设为a(倒数第二个能见荧光孔的荧光细胞平均数)和b(倒数第一个能见荧光孔的荧光细胞平均数)。慢病毒滴度计算公式:慢病毒滴度(tu/ml)=(a+b*10)*1000/2/a孔病毒量(μl)。
[0102]
测试例:本发明的慢病毒过表达载体在悬浮细胞中过表达基因测试
[0103]
根据rab40c基因,(ncbi数据库登录号:nm_021168)序列设计pcr扩增引物,扩增此环状rna的线性序列;然后通过ecori和agei酶切位点将目标核苷酸序列连接到本发明的过表达载体中,构建过表达载体,然后将此载体进行慢病毒包装。
[0104]
通过慢病毒转染以及荧光定量pcr检测,构建的慢病毒过表达载体成功地在悬浮细胞中表达。其具体检测步骤如下:
[0105]
1、rab40c(nm_021168)基因pcr扩增引物设计:
[0106]
rab40c(nm_021168)
‑
f:acagcagagatccagtttatcgatctgcagtgcagcgtgaccc(seq id no.4)
[0107]
rab40c(nm_021168)
‑
r:gccacagacctggcccggggaattcctaggagatcttgcagttactccgc(seq id no.5)
[0108]
2、pcr扩增目标环状rna序列
[0109]
pcr体系如表7所示。
[0110]
表7 pcr体系
[0111][0112]
pcr反应条件:
[0113]
98℃5min;98℃10s,60℃5s,72℃15s,30cycles;72℃10min,4℃4min。
[0114]
pcr扩增产物通过割胶回收、酶切后连接到含有本发明的载体中,构建悬浮细胞慢病毒过表达rab40c(nm_021168)基因的载体,命名为rab40c(nm_021168)
‑
plvx
‑
ubi
‑
mcs
‑
cbh
‑
egfp
‑
ires
‑
puro。
[0115]
3、慢病毒包装
[0116]
将上述过表达载体按照pspax2:pmd2.g:目的质粒=2:1:1比例进行慢病毒包装。慢病毒感染悬浮细胞jurkat细胞。
[0117]
4、荧光定量pcr检测mrna的表达
[0118]
1)根据rab40c基因(登录号:nm_021168)序列设计pcr扩增引物,特异性检测rab40c(nm_021168)引物序列为:
[0119]
rab40c
‑
f:cgcctacagtaacgggatcg(seq id no.6)
[0120]
rab40c
‑
r:tttccaaccaagatccgggg(seq id no.7)
[0121]
2)选取β
‑
actin基因,作为荧光定量结果数据的内参基因,序列如下所示:
[0122]
β
‑
actin f:catgggtcagaaggattcct(seq id no.8)
[0123]
β
‑
actin r:tcgtcccagttggtgacgat(seq id no.9)
[0124]
3)具体检测方法如下:
[0125]
将感染过表达慢病毒的细胞严格按照reagent(life technologies公司)试剂操作说明书提取细胞中的总rna。
[0126]
提取详细步骤为:
[0127]
(1)细胞取100万个左右的细胞,加入1ml trizol。
[0128]
(2)加入200μl氯仿,剧烈振荡15s,室温静置15min;
[0129]
(3)4℃下,12000g离心15min,溶液分为三层,rna溶解在水相中,转移水相至另一个新的rnase free ep管;
[0130]
(4)加入1倍体积异丙醇,涡旋充分混匀;
[0131]
(5)4℃下,12000g离心10min,离心后管底出现rna沉淀,弃去上清;
[0132]
(6)加入1ml 75%乙醇,用手轻轻颠倒,12000g离心5min,弃去上清;
[0133]
(7)室温晾干,加入25μl depc h2o,用枪头吹打几次,使rna充分溶解,
‑
80℃保存。
[0134]
(8)rna浓度检测:使用核酸蛋白检测仪检测rna浓度。
[0135]
4)逆转录pcr
[0136]
(1)按表8配制逆转录反应溶液,置于ep管中。
[0137]
表8逆转录反应溶液
[0138][0139]
(2)在pcr仪上进行以下反应:72℃,5min,然后置于冰上急冷。
[0140]
(3)在步骤(1)中的ep管内加入表9中的逆转录体系。
[0141]
表9逆转录反应体系
[0142][0143]
在pcr仪上按以下条件进行反转录反应:25℃,5min;42℃,60min;72℃,10min;4℃,2min。将反应得到的cdna立刻进行实验或者置于4℃保存。
[0144]
5)实时荧光定量pcr反应
[0145]
(1)荧光定量pcr反应体系如表10所示。
[0146]
表10荧光定量pcr反应体系
[0147][0148][0149]
(2)反应条件设置:
[0150]
如表11所示,荧光定量pcr反应条件为:95℃变性3min;95℃ 15s,60℃ 20s(此步骤收集荧光信号);40个循环,然后进行融解曲线分析;熔解程序:95℃ 2min,在温度为59℃
‑
95℃收集荧光信号。
[0151]
表11荧光定量pcr反应条件
[0152][0153]
荧光定量结果如图2所示,从图中可以看出细胞感染过表达慢病毒后,目标rab40c(nm_021168)分子成功检测出来高表达,相对于未转染组表达量增加了4倍,说明本发明构建的悬浮细胞过表达载体可以有效地在悬浮细胞中过表达mrna。
[0154]
rab40c(nm_021168)
‑
plvx
‑
ubi
‑
mcs
‑
cbh
‑
egfp
‑
ires
‑
puro载体,包装慢病毒后,对目的细胞jurkat进行感染后,观察细胞的状态,生长情况以及荧光情况,如图3所示。普通载体(plvx
‑
egfp
‑
ires
‑
puro)进行病毒包装后,用病毒感染悬浮细胞,和悬浮细胞专用载体(plvx
‑
ubi
‑
mcs
‑
cbh
‑
egfp
‑
ires
‑
puro)进行病毒包装后,用病毒感染悬浮细胞,悬浮细胞专用载体包装的病毒感染效果明显好于普通载体包装的病毒(见图4)。
[0155]
综上所述,本发明提供的悬浮细胞过表达慢病毒载体,基于一个优质慢病毒包装质粒设计得到,载体表达mrna后,应用于慢病毒包装中,方便后续试验操作,能够普遍适用于悬浮细胞的表达,表达效率高效、稳定,极大程度提升了悬浮细胞中过表达效果,应用含有该序列的载体表达操作简单易行,易于推广。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1