一种螯合铜离子的自组装多肽纳米水凝胶及其制备方法
1.本发明涉及生物医药技术领域,尤其涉及一种螯合铜离子的自组装多肽纳米水凝胶。
背景技术:
2.铜在人体组织修复、血管形成、伤口愈合和机体抵抗炎症等多种生物反应所必需的酶系统中起着关键作用。
3.随着1973年pickart和thaler首先在人血浆中分离到了铜离子结合的三肽分子(甘氨酸
‑
l
‑
组氨酸
‑
l
‑
赖氨酸,ghk)[l.pickart and m.thaler,nature new biol.243,85(1973)],ghk与铜离子的强亲和力、以及组织损伤修复、抗炎等生物活性逐渐被证实,并于1999年开始应用于人体组织修复、除皱、头发增生等治疗中[f.x.maquart,a.simeon,s.pasco,j.c.monboisse,j.soc.biol.193,423(1999).]。ghk是在组织损伤后细胞外基质蛋白降解过程中产生的小分子肽,通过结合cu
2+
参与到组织修复过程中[e.h.sage and r.b.vernon,j.hypertens.12(suppl.),s145(1994)]。同时,ghk三肽也已被证明能够刺激多种类型的细胞生长并参与伤口愈合和组织修复过程[pickart l,j biomater sci polym ed 19,969(2008).]。
[0004]
asp
‑
ala
‑
his
‑
lys(dahk)是最常见的人血清白蛋白的n端金属结合序列(atcun motif,xxx
‑
xxx
‑
his),在血液和脑脊液中参与铜的转运,与ghk有类似的cu
2+
结合能力,能够参与创伤愈合和组织修复,也是潜在的阿尔茨海默症治疗方法。
[0005]
然而,ghk和dahk的亲水性质使它们不易进入细胞中,且小分子肽在生理环境中易被降解,这些都限制了ghk和dahk生物活性的发挥。研究者开发了多种策略来改善二者尤其是ghk的性质:lee等将四个精氨酸(r4)共价连接到ghk的c端形成ghk
‑
r4,增强了ghk肽的细胞渗透和促进细胞胶原合成的能力[g.h.hur,s.c.han,a.r.ryu,y.eom,j.w.kim,m.y.lee,j pept sci.26,2(2020).];jayakumar等通过生物素修饰形成biotin
‑
ghk,使ghk在组织损伤处螯合铜的能力提高了9倍[v.arul,d.gopinath,k.gomathi,r.jayakumar,j biomed mater res b appl biomater.73,2(2005).];lu等将ghk
‑
cu负载到壳聚糖修饰的介孔硅纳米颗粒中提升了其抗菌能力[https://doi.org/10.1016/j.msec.2019.109746];feng等构建了ghk
‑
脂质体,通过促进细胞增殖和血管生成促进小鼠烫伤创面愈合[x.y.wang,b.q.liu,q.xu,h.y.sun,m.j.shi,d.wang,m.h.guo,j.w.yu,c.h.zhao,b.feng,wound repair regen.25,2(2017).]。
[0006]
然而,精氨酸(r4)以及生物素等共价修饰虽然增强了ghk
‑
cu的细胞渗透性及螯合铜离子的能力,但是不能够改进其生物稳定性,也不能够促进其在损伤部位或者其他靶部位的积累。而将ghk
‑
cu负载到介孔硅纳米颗粒或者脂质体中虽然赋予了其独特的纳米效应,但是涉及到复杂的化学合成操作,且无机材料的引入降低了生物安全性,限制了它的应用范围。公开号为cn110790816a的中国专利申请公开了一种多肽活性化合物及新型铜胜肽,通过烷烃、烯烃、芳烃等的化学修饰提高了ghk
‑
cu的生物活性,但是目标产物不具备自
组装及形成水凝胶的性质,因此没有纳米效应带来的优势,且制备方法及应用范围均不同。ulijn等在其报道中也仅通过ghk与小分子短肽共组装的方式形成了水凝胶[y.m.abul
‑
haija,g.g.scott,j.k.sahoo,t.tuttle,r.v.ulijn,chem.commun.53,9562(2017).],然而共组装体的稳定性和体系的自组装性能均有待于进一步改善。
技术实现要素:
[0007]
为了解决现有技术中存在的问题,本发明的目的是提供一种螯合铜离子的自组装多肽纳米水凝胶及其制备方法。
[0008]
为了实现本发明目的,本发明的技术方案如下:
[0009]
第一方面,本发明提供一种螯合铜离子的自组装多肽纳米水凝胶的制备方法,将通式(i)所示多肽衍生物溶液与cu
2+
溶液混合并调节ph为6.0~7.5,获得螯合铜离子的自组装多肽纳米水凝胶;
[0010][0011]
其中:r1代表β
‑
萘乙酸、笏甲氧羰基等其他常用的氨基酸氮端封端;r2代表gly
‑
his
‑
lys或者asp
‑
ala
‑
his
‑
lys。
[0012]
作为优选,当r2为gly
‑
his
‑
lys时,所述多肽衍生物溶液的浓度为5mg/ml,并调节ph为6.5
±
0.2,可得到成胶更稳定的水凝胶。
[0013]
作为优选,当r2为asp
‑
ala
‑
his
‑
lys时,所述多肽衍生物溶液的浓度为7.5mg/ml,并调节ph为7.4
±
0.2,可得到成胶更稳定的水凝胶。
[0014]
进一步优选,在制备螯合铜离子的自组装多肽纳米水凝胶时,控制多肽衍生物与cu
2+
的物质的量之比为2:1,成胶情况最佳。
[0015]
又进一步地,本发明在考察了(ch3coo)2cu
·
h2o、cuso4·
5h2o及cucl2·
2h2o与多肽的结合效果后优选cucl2·
2h2o作为铜离子来源,故所述制备方法中使用的cu
2+
溶液优选为cucl2·
2h2o溶液。
[0016]
更进一步地,优选所述cucl2·
2h2o溶液的浓度为10mg/ml。
[0017]
第二方面,本发明提供一种利用前述制备方法制备得到的螯合铜离子的自组装多肽纳米水凝胶。
[0018]
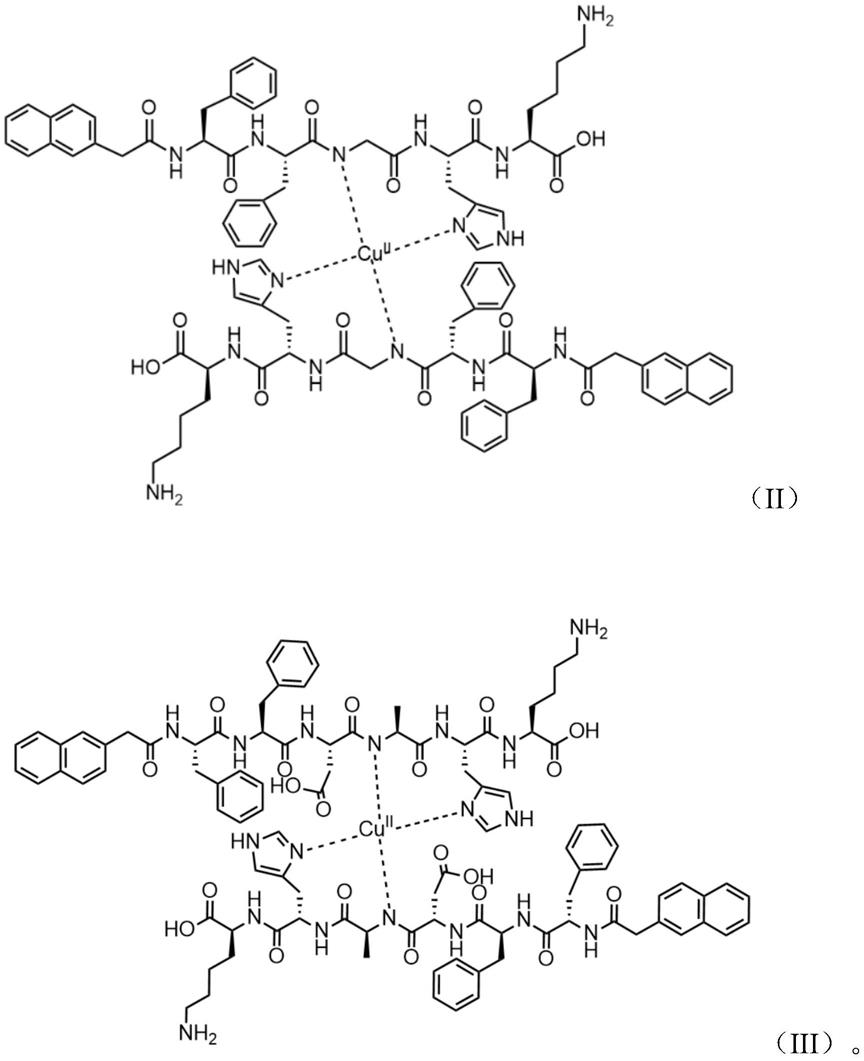
第三方面,本发明提供一种螯合铜离子的自组装多肽纳米化合物,其具体为nap
‑
ffghk
‑
cu或nap
‑
ffdahk
‑
cu,所述nap
‑
ffghk
‑
cu的结构式如式(ⅱ)所示,所述nap
‑
ffdahk
‑
cu的结构式如式(ⅲ)所示;
[0019][0020]
上述螯合铜离子的自组装多肽纳米化合物的制备方法包括:
[0021]
(1)利用固相合成法合成nap
‑
ffghk/nap
‑
ffdahk;
[0022]
(2)将nap
‑
ffghk/nap
‑
ffdahk与cu
2+
以物质的量之比为2:1的比例螯合,即得。
[0023]
所述固相合成法为本领域常规技术手段,本发明在具体实施方式中进行示例性说明,但其具体合成方法并不局限于此,并不排除其他手段合成的nap
‑
ffghk/nap
‑
ffdahk可用于本发明所述水凝胶的制备。
[0024]
本发明涉及到的原料或试剂均为普通市售产品,涉及到的操作如无特殊说明均为本领域常规操作。
[0025]
在符合本领域常识的基础上,上述各优选条件,可以相互组合,得到具体实施方式。
[0026]
本发明的有益效果在于:
[0027]
本发明提供了一种螯合铜离子的自组装多肽纳米水凝胶的制备方法,并提供了可
与铜离子螯合并进行自组装的多肽衍生物。相对于未组装的三肽ghk及四肽dahk,本发明所提供的多肽衍生物形成与螯合铜离子的纳米铜凝胶后具有更强的铜离子螯合能力和更好抵抗蛋白酶降解的能力,具有显著的皮肤细胞吸收能力和细胞辐射损伤修复能力,在组织损伤修复、伤口愈合、抗炎、美容等多个方面具有很好的应用前景。
附图说明
[0028]
此处的附图被并入说明书中并构成本说明书的一部分,示出了符合本发明的实施例,并与说明书一起用于解释本发明的原理。
[0029]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
[0030]
图1为本发明实施例1和实施例2制备的nap
‑
ffghk和nap
‑
ffdahk的质谱图及结构式。
[0031]
图2为ghk
‑
cu、nap
‑
ffghk
‑
cu、dahk
‑
cu及nap
‑
ffdahk
‑
cu在不同ph下的成胶图。
[0032]
图3为ph=7.4时,5mg/ml的nap
‑
ffghk与cu
2+
在不同比例下的成胶情况。
[0033]
图4为ph=6.5时,5mg/ml的nap
‑
ffghk与cu
2+
在不同比例下的成胶情况。
[0034]
图5为ph=7.4时,7.5mg/ml的nap
‑
ffdahk与cu
2+
在不同比例下的成胶情况。
[0035]
图6为ph=6.5时,5mg/ml的nap
‑
ffdahk与cu
2+
在不同比例下的成胶情况。
[0036]
图7为nap
‑
ffghk、nap
‑
ffghk
‑
cu、nap
‑
ffdahk及nap
‑
ffdahk
‑
cu的透射电镜图。
[0037]
图8为nap
‑
ffghk、nap
‑
ffghk
‑
cu、nap
‑
ffdahk及nap
‑
ffdahk
‑
cu的圆二色谱图。
[0038]
图9为利用等温滴定量热法(itc)测定肽与铜离子结合力的测定结果。
[0039]
图10为抵抗蛋白酶k降解实验质谱结果(ghk)。
[0040]
图11为抵抗蛋白酶k降解实验定量结果。
[0041]
图12为细胞毒性检测结果。
[0042]
图13为电感耦合等离子体法(icp)检测hff
‑
1细胞对凝胶的摄取结果。
[0043]
图14为ros清除实验结果。
具体实施方式
[0044]
为了能够更清楚地理解本发明的上述目的、特征和优点,下面将对本发明的方案进行进一步描述。需要说明的是,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
[0045]
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但本发明还可以采用其他不同于在此描述的方式来实施;显然,说明书中的实施例只是本发明的一部分实施例,而不是全部的实施例。
[0046]
下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
[0047]
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
[0048]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0049]
实施例1五肽nap
‑
phe
‑
phe
‑
gly
‑
his
‑
lys的制备
[0050]
称取0.7mg的2
‑
cl
‑
trt树脂,加入固相合成管中,用dcm溶胀5min。用西林瓶称取234mg(0.5mmol)fmoc
‑
lys(boc)
‑
oh,并加入dcm使之溶解,再加200μl diea(1mmol),混合均匀。挤出合成管中的液体,将上述混匀的溶液加入其中,反应1h。反应结束后挤出反应液,用dcm洗5次,加入甲醇封闭液(dcm:ch3oh:diea=8.5:1:0.5),封闭30min。结束后用dcm洗5遍,再用dmf洗5遍,加入20%的哌啶/dmf溶液脱保护15min。结束后用dmf洗5遍,配620mg(1mmol)的fmoc
‑
his(trt)
‑
oh、379mg(1mmol)的hbtu、400μl diea(2mmol)的dmf溶液加入其中反应2h。反应结束用dmf洗5遍,加入20%的哌啶/dmf溶液脱保护15min,再用dmf洗5遍,之后按1:2的投料比,重复上述加
‑
洗
‑
脱
‑
洗的步骤连接剩余的氨基酸,直至最后一个氨基酸,配186mg(1mmol)的2
‑
萘乙酸、379mg(1mmol)的hbtu、400μl diea(2mmol)的dmf溶液加入其中过夜反应。可用茚三酮试剂监测反应程度,若反应完全则树脂呈无色,若反应未完全则树脂呈蓝紫色。用dmf洗净未反应的原料后,用dcm洗净树脂中的dmf,加入95%的tfa(tfa:tis:h2o=9.5:0.25:0.25)反应30min将肽链从树脂上切下来。
[0051]
分离:取切割后的反应液旋蒸,用dcm冲洗3~4次,旋蒸结束加入冰乙醚,析出白色多肽,真空泵抽干至粉末态,称量留存。
[0052]
纯化:以甲醇溶解少量上述粗品,过hplc收集各个峰,打质谱确定目标峰。收集目标峰旋蒸,加少量水将悬浮液转移至培养皿冻存,最后冻干。
[0053]
使用液相色谱
‑
质谱联用仪对所得产物进行检测,质谱图如图1所示,验证了所得产物的结构式。
[0054]
实施例2六肽nap
‑
phe
‑
phe
‑
asp
‑
ala
‑
his
‑
lys的制备
[0055]
制备方法同上,所使用氨基酸除fmoc
‑
lys(boc)
‑
oh、fmoc
‑
his(trt)
‑
oh、fmoc
‑
phe
‑
oh外还有fmoc
‑
asp(otbu)
‑
oh及fmoc
‑
ala
‑
oh,分离纯化的方法与上述相同。
[0056]
使用液相色谱
‑
质谱联用仪对所得产物进行检测,质谱图如图1所示,验证了所得产物的结构式。
[0057]
实施例3 nap
‑
ffghk
‑
cu及nap
‑
ffdahk
‑
cu纳米凝胶的制备
[0058]
分别配制7.5、5mg/ml的上述两种多肽水溶液、10mg/ml的cucl2·
2h2o水溶液,以及50mg/ml的na2co3水溶液,按所需条件(cu
2+
物质的量之比为1:0、1:1、2:1、5:1)向多肽溶液中加入cucl2·
2h2o水溶液,最后用na2co3溶液调节所需ph,观察其成胶情况。
[0059]
通过对比ghk与dahk的cu
2+
螯合物的成胶情况,可以看出ghk与dahk在ph为6.5或7.4,肽与cu
2+
物质的量之比为2:1的条件下,均不能形成外观稳定的胶(图2)。
[0060]
如图3、图4中对不同条件下nap
‑
ffghk的成胶情况进行探究。成胶结果显示对于nap
‑
ffghk,浓度为5mg/ml,ph为6.5左右时成胶情况较好,即称取实施例1中合成的多肽2.5mg于成胶小瓶中,加入500μl的水超声溶解,再按照多肽与cu
2+
的物质的量比为2:1的比例加入浓度为10mg/ml的cucl2·
2h2o水溶液,最后使用50mg/ml的碳酸钠水溶液调节凝胶的ph至6.5左右,即得到成胶更稳定的nap
‑
ffghk
‑
cu凝胶(图2)。
[0061]
如图5、图6中对不同条件下nap
‑
ffdahk的成胶情况进行探究。胶结果显示对于nap
‑
ffdahk,浓度为7.5mg/ml,ph为7.4左右时成胶情况较好,即称取实施例2中合成的肽3.75mg于成胶小瓶中,加入500μl的水超声溶解,再按照多肽与cu
2+
的物质的量比为2:1的比例加入浓度为10mg/ml的cucl2·
2h2o水溶液,最后使用50mg/ml的碳酸钠水溶液调节凝胶的
ph至7.4左右,即得到较稳定的nap
‑
ffdahk
‑
cu凝胶(图2)。
[0062]
实施例4 nap
‑
ffghk
‑
cu及nap
‑
ffdahk
‑
cu凝胶微观结构研究
[0063]
通过透射电镜观察nap
‑
ffghk及nap
‑
ffghk
‑
cu凝胶,可以看出前者在电镜下呈螺旋式的纤维状,直径约40nm,后者发生自组装后纤维变细,直径约18nm,纤维形态更加规则(图7)。通过透射电镜观察nap
‑
ffdahk及nap
‑
ffdahk
‑
cu凝胶,可以看出前者在电镜下呈聚集式的长纤维束,直径约10nm。后者纤维变粗且为螺旋状,直径约25nm,纤维形态更加规则、明显(图7)。
[0064]
通过圆二色谱表征对nap
‑
ffghk及nap
‑
ffghk
‑
cu凝胶的二级结构进行表征(图8),发现前者显示类似于胶原的螺旋结构特征吸收峰。后者显示二级结构向α
‑
螺旋转变。通过圆二色谱表征对nap
‑
ffdahk及nap
‑
ffdahk
‑
cu凝胶的二级结构进行表征,发现前者显示β
‑
折叠结构,后者转变为类似于胶原的螺旋结构特征吸收峰。圆二色谱表征结果均与透射电镜观察结果一致。
[0065]
实施例5等温滴定量热法(itc)测定铜离子结合力
[0066]
用超纯水分别配制浓度为0.1、0.2、0.5、1mm的ghk、dahk、nap
‑
ffghk和nap
‑
ffdahk的水溶液,以及1、2、5、1mm的cucl2·
2h2o水溶液,在测试之前进行超声除气泡处理。实验开始之前,清洗样品池和滴定针,滴定注射器进样管中加入60μl的cucl2·
2h2o溶液,样品池中加入300μl的多肽溶液,同时参照池中加入超纯水。在实验参数界面,设定总滴定数15、样品池反应温度25℃、参比池测量的功率为10μcal/s、搅拌速度750rpm、滴定注射器和样品池中蛋白样品的摩尔浓度以及实验数据文件命名。在滴定参数界面,设定每次滴定的体积2μl,60s的预滴定延迟,两次滴定的间隔时间为120s。最后将滴定注射器放入样品池当中,点击start,实验开始进行。
[0067]
计算结果(图9)表明,nap
‑
ffghk及nap
‑
ffdahk的铜离子螯合的平衡解离常数(kd)分别为1.21
×
10
‑7m和1.8
×
10
‑7m,与未组装对照组相比,纳米铜肽凝胶的螯合铜离子的能力分别提高的1.9倍和1.1倍。且由itc实验结果可知,nap
‑
ffghk及nap
‑
ffdahk与铜离子的结合位点数分别为0.443和0.540,即在铜肽纳米凝胶中约两个组装肽分子螯合一个铜离子,与未组装组相比结合位点显著增多。
[0068]
实施例6 nap
‑
ffghk
‑
cu及nap
‑
ffdahk
‑
cu抵抗蛋白酶降解能力
[0069]
分别制备ghk、ghk
‑
cu、nap
‑
ffghk、nap
‑
ffghk
‑
cu(肽摩尔浓度为6mm)以及dahk、dahk
‑
cu、nap
‑
ffdahk、nap
‑
ffdahk
‑
cu(肽摩尔浓度为8mm)。将以上样品稀释为1mm,与蛋白酶k(10u/ml)37℃孵育0、0.5、1、2、4h,在相应时间点加入400μl甲醇终止反应,混匀,离心(4℃,12000rpm,10min)后取上清,通过hplc和质谱(ms)定量检测样品的抵抗蛋白酶k降解能力。
[0070]
质谱结果(图10)表明,游离短肽在10u/ml蛋白酶k作用下0.5h即被降解。hplc定量结果(图11)表明,nap
‑
ffghk和nap
‑
ffdahk通过组装形成纳米结构后稳定性显著增强,蛋白酶k作用0.5h后的稳定性分别为67.1%和64.3%。通过cu
2+
螯合共组装,铜肽的稳定性得到了进一步的提升,蛋白酶k作用0.5h后的稳定性分别为99.8%和88.0%,尤其是nap
‑
ffghk
‑
cu表现最佳,蛋白酶k作用4h后的稳定性仍为90.7%,这可能与其二级结构有关。
[0071]
实施例7 cck
‑
8检测细胞毒性
[0072]
进一步对nap
‑
ffghk、nap
‑
ffghk
‑
cu、nap
‑
ffdahk及nap
‑
ffdahk
‑
cu进行细胞毒性
检测。采用人皮肤成纤维细胞(hff
‑
1)为模型,所使用培养基为dmem培养基,于96孔板中每孔接种8000
‑
10000个细胞于37℃二氧化碳培养箱培养24h,然后用无血清培养基分别配制0、6.25、12.5、25、50、100、200、400μm浓度梯度的nap
‑
ffghk、nap
‑
ffdahk、nap
‑
ffghk
‑
cu及nap
‑
ffdahk
‑
cu。弃去原培养基加入上述配制的不同浓度的材料,按每孔100μl,于37℃培养24h。培养结束后更换新鲜培养基,并于每孔加入10μl的cck
‑
8试剂,于37℃培养2h,最后使用酶标仪检测吸光度。
[0073]
检测结果如图12所示,上述四种材料在上述浓度范围内均显示出较小的细胞毒性,其中nap
‑
ffghk及nap
‑
ffdahk
‑
cu的促细胞生长的效果较明显。
[0074]
实施例8电感耦合等离子体法(icp)检测细胞对材料的摄取
[0075]
设置两组材料组200μm nap
‑
ffghk
‑
cu及nap
‑
ffdahk
‑
cu,以及不加材料的对照组。接种30~40万hff
‑
1细胞于细胞培养皿中,于37℃二氧化碳培养箱培养24h。弃去旧的培养基,用2ml pbs洗一遍,加1ml的胰酶消化2min左右加入2ml的培养基终止消化,最后将细胞转移至5ml离心管,于900rpm离心3min,弃去上层培养基,用1ml pbs清洗一遍,置于
‑
80℃冷冻,最后检测。
[0076]
检测结果如图13所示,nap
‑
ffghk
‑
cu及nap
‑
ffdahk
‑
cu处理组细胞含铜总量与对照组相比分别提高了1.9倍和3.8倍,表明皮肤成纤维细胞对纳米铜肽凝胶有显著的摄取。
[0077]
实施例9探究ros清除效果
[0078]
取10个共聚焦小皿,每皿接种30~40万hff
‑
1细胞,加入2ml dmem完全培养基培养24h,后用上述培养基分别配制浓度为25μm的ghk、dahk、nap
‑
ffghk、nap
‑
ffdahk以及它们的的cu
2+
螯合物凝胶,弃去旧培养基后每孔分别加入1ml上述配好的材料,以不加材料的细胞作为空白对照,共培养12h,后给予6gy剂量的γ射线照射,其中阳性对照为不加材料的单独照射组,阴性对照组为不加材料的未照射组,清洗后加入dcfh
‑
da活性氧探针孵育30min,以pbs清洗3遍,最后每皿补加1ml pbs,以激光共聚焦显微镜观察。
[0079]
检测结果如图14所示,γ射线照射后细胞内ros水平明显上升,自组装纳米凝胶(nap
‑
ffghk及nap
‑
ffdahk)以及自组装铜肽纳米凝胶(nap
‑
ffghk
‑
cu及nap
‑
ffdahk
‑
c)均显示了显著的ros清除ros能力。
[0080]
以上所述仅是本发明的具体实施方式,使本领域技术人员能够理解或实现本发明。对这些实施例的多种修改对本领域的技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所述的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1