ZmELF3.1蛋白及其功能缺失突变体在调控作物雄穗分支数中的应用
zmelf3.1蛋白及其功能缺失突变体在调控作物雄穗分支数中的应用
技术领域
1.本发明涉及zmelf3.1蛋白及其功能缺失突变体的新用途,尤其涉及zmelf3.1蛋白及其功能缺失突变体在调控作物雄穗分支数中的应用,属于zmelf3.1功能蛋白及其突变体的新用途领域。
背景技术:
2.玉米是全世界种植面积最大的粮食作物、重要的饲料及工业原料,也是我国第一大粮食作物,其产量的提高和稳定直接影响我国的粮食供应安全。玉米是雌雄同株异花授粉作物,雄穗位于植株顶部,雌穗长在植株中部,便于接受花粉。玉米雄穗分支数是雄穗性状的重要组成部分,雄穗分支数与玉米雄穗大小有密切关系,雄穗分支数越多,其对应的雄穗就越大,反之,雄穗则越小。进一步研究表明雄穗大小对雌穗的授粉质量至关重要,雄穗和雌穗间对光合产物有竞争关系,大的雄穗将消耗更多的能量,致使玉米雄穗分支数和籽粒产量间存在显著的负相关关系。
3.现有研究表明玉米雄穗性状属于数量性状,受多基因控制,借助于分子标记技术和qtl作图,不同遗传背景、不同环境条件的大量玉米雄穗分支数相关qtl已被检测和定位。但是具体控制玉米雄穗分支数的具体基因少有报道,更没有关于elf3调控玉米雄穗分支数的报道。
技术实现要素:
4.本发明的目的之一是提供zmelf3.1蛋白在调控作物雄穗分支数中的应用;
5.本发明的上述目的是通过以下技术方案来实现的:
6.本发明利用crispr/cas9基因编辑技术编辑创制了zmelf3.1蛋白缺陷的突变体zmelf3.1,突变体zmelf3.1在短日照和长日照和条件下比野生型c01雄穗分支数增加100%左右,因此,本发明确定zmelf3.1蛋白或其功能缺陷突变体具有调控作物雄穗分支数等方面的应用。
7.本发明所述的zmelf3.1蛋白的氨基酸序列为seq id no.1所示;所述zmelf3.1蛋白的编码基因的多核苷酸序列为seq id no.2所示。
8.更具体的,所述的调控作物雄穗分支数包括使作物雄穗分支数增加,或者是使作物雄穗分支数减少。
9.本发明提供了一种增加作物雄穗分支数的方法,包括:构建zmelf3.1基因的基因编辑载体或zmelf3.1基因的基因敲除载体;将该基因编辑载体或基因敲除载体转入受体植物中得到zmelf3.1蛋白功能缺陷的转基因作物;所得转基因作物的雄穗分支数显著多于野生型植物。
10.本发明还提供了一种雄穗分支数显著多于野生型的玉米新品种的培育方法,包括:构建zmelf3.1基因的基因编辑载体或zmelf3.1基因的基因敲除载体;将该基因编辑载
体或基因敲除载体转入受体作物玉米中得到zmelf3.1蛋白功能缺陷的转基因玉米;将筛选得到的雄穗分支数显著多于野生型植物的转基因玉米与不同玉米材料杂交并回交转育,改良杂交种,获得雄穗分支数显著多于野生型的玉米新品种。
11.其中,zmelf3.1基因的基因编辑载体或zmelf3.1基因的基因敲除载体可以按照本领域的常规构建方法得到。
12.作为一种优选的实施方案,本发明提供了一种zmelf3.1基因的基因编辑载体的构建方法,包括:
13.(1)制备玉米u6
‑
2启动子片段,其中,采用seq id no:3和seq id no:4所述的引物进行pcr扩增得到玉米u6
‑
2启动子片段;
14.(2)sgrna表达盒的制备
15.用overlap pcr的方法将带有接头的zmelf3.1基因的靶点序列和sgrna骨架序列融合在一起,获得的pcr产物命名为zmelf3.1
‑
1片段;其中所述的overlap pcr的引物序列为seq id no:5、seq id no:6和seq id no:7所示;所述sgrna骨架序列为seq id no:8所示;
16.再用overlap pcr的方法将上一步获得的融合pcr片段和u6
‑
2启动子片段融合为一个片段,获得的pcr产物即为sgrna表达盒;其中,所用到的pcr引物序列为seq id no:9、seq id no:10和seq id no:11所示;
17.(3)sgrna表达盒连接cpb
‑
pubi
‑
hspcas9载体:将sgrna表达盒连接到cpb
‑
ubi
‑
hspcas9载体上获得连接产物,即得。
18.本发明还提供了一种使增加作物雄穗分支数的方法,包括:(1)将zmelf3.1蛋白进行功能缺陷突变得到zmelf3.1蛋白功能缺陷突变体;(2)构建含有所述zmelf3.1蛋白功能缺陷突变体的编码基因的重组植物表达载体;(2)将所构建的重组植物表达载体转化到植物组织或植物细胞中;(3)将zmelf3.1蛋白的功能缺陷突变体的编码基因在植物组织或细胞中进行过表达。
19.本发明所述的zmelf3.1蛋白的功能缺陷变体可由遗传多态性或人为操作产生,这些操作方法通常为本领域所了解。例如,可以将seq id no.1所示的氨基酸通过一个或多个氨基酸残基的替换、缺失或/和插入而衍生得到的功能缺陷变体。
20.本发明还提供了一种减少作物雄穗分支数的方法,包括:(1)构建含有所述zmelf3.1蛋白的编码基因的重组植物表达载体;(2)将所构建的重组植物表达载体转化到植物组织或植物细胞中;(3)将zmelf3.1蛋白的编码基因在植物组织或细胞中进行过表达。
21.将所述zmelf3.1蛋白的编码基因可操作的与表达调控元件相连接,得到可以在植物中表达该编码基因的重组植物表达载体;该重组植物表达载体可以由5
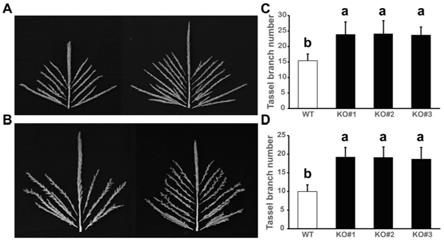
′
端非编码区、seq id no.2所示的多核苷酸序列和3
′
非编码区组成,其中,所述的5
′
端非编码区可以包括启动子序列、增强子序列或/和翻译增强序列;所述的启动子可以是组成性启动子、诱导型启动子、组织或器官特异性启动子;所述的3
′
非编码区可以包含终止子序列、mrna切割序列等。合适的终止子序列可取自根癌农杆菌的ti
‑
质粒,例如章鱼碱合成酶和胭脂碱合成酶终止区。
22.所述重组植物表达载体还可含有用于选择转化细胞的选择性标记基因。选择性标记基因用于选择经转化的细胞或组织。标记基因包括:编码抗生素抗性的基因以及赋予除
草化合物抗性的基因等。此外,所述的标记基因还包括表型标记,例如β
‑
半乳糖苷酶和荧光蛋白等。
23.另外,本领域技术人员可以将seq id no.2所示的多核苷酸进行优化以增强在植物中的表达效率。例如,可采用目标植物的偏爱密码子进行优化来合成多核苷酸以增强在目标植物中的表达效率。
24.本发明中所述的转化方案以及将所述多核苷酸或多肽引入植物的方案可视用于转化的植物(单子叶植物或双子叶植物)或植物细胞的类型而变化。将所述多核苷酸或多肽引入植物细胞的合适方法包括:显微注射、电穿孔、农杆菌介导的转化、直接基因转移以及高速弹道轰击等。在特定的实施方案中,可利用多种瞬时转化法将本发明的基因提供给植物。利用常规方法可使已转化的细胞再生稳定转化植株(mccormick et al.plant cell reports.1986.5:81
‑
84)。
25.本发明中所述的作物种类包括但不限于单子叶植物或双子叶植物,优选是玉米。
26.本发明用拟南芥elf3的蛋白序列为基础,通过在玉米基因组数据库的同源比对获得2个玉米的elf3基因,分别命名为zmelf3.1和zmelf3.2。利用crispr/cas9基因编辑技术,将玉米zmelf3.1基因突变后,其功能缺失突变体在长日照和短日照条件下,均表现雄穗分支数显著增加的表型。表明玉米zmelf3.1基因对调控玉米作物雄穗分支数起着至关重要的作用。本发明不仅对改良玉米作物雄穗分支数具有重要意义,还可将其应用于玉米自交系改良和杂交育种。
27.本发明所涉及到的术语定义
28.除非另外定义,否则本文所用的所有技术及科学术语都具有与本发明所属领域的普通技术人员通常所了解相同的含义。虽然在本发明的实践或测试中可使用与本文所述者类似或等效的任何方法、装置和材料,但现在描述优选方法、装置和材料。
29.术语“多核苷酸”或“核苷酸”意指单股或双股形式的脱氧核糖核苷酸、脱氧核糖核苷、核糖核苷或核糖核苷酸及其聚合物。除非特定限制,否则所述术语涵盖含有天然核苷酸的已知类似物的核酸,所述类似物具有类似于参考核酸的结合特性并以类似于天然产生的核苷酸的方式进行代谢。除非另外特定限制,否则所述术语也意指寡核苷酸类似物,其包括pna(肽核酸)、在反义技术中所用的dna类似物(硫代磷酸酯、磷酰胺酸酯等等)。除非另外指定,否则特定核酸序列也隐含地涵盖其保守修饰的变异体(包括(但不限于)简并密码子取代)和互补序列以及明确指定的序列。特定而言,可通过产生其中一个或一个以上所选(或所有)密码子的第3位经混合碱基和/或脱氧肌苷残基取代的序列来实现简并密码子取代(batzer等人,nucleic acid res.19:5081(1991);ohtsuka等人,j.biol.chem.260:2605
‑
2608(1985);和cassol等人,(1992);rossolini等人,mol cell.probes 8:91
‑
98(1994))。
30.术语“多肽”、“肽”和“蛋白”在本文中互换使用以意指氨基酸残基的聚合物。即,针对多肽的描述同样适用于描述肽和描述蛋白,且反之亦然。所述术语适用于天然产生氨基酸聚合物以及其中一个或一个以上氨基酸残基为非天然编码氨基酸的氨基酸聚合物。如本文中所使用,所述术语涵盖任何长度的氨基酸链,其包括全长蛋白(即抗原),其中氨基酸残基经由共价肽键连接。
31.本发明中所述的“多个”通常意味着2
‑
8个,优选为2
‑
4个;所述的“替换”是指分别用不同的氨基酸残基取代一个或多个氨基酸残基;所述的“缺失”是指氨基酸残基数量的减
少,也即是分别缺少其中的一个或多个氨基酸残基;所述的“插入”是指氨基酸残基序列的改变,相对天然分子而言,所述改变导致添加一个或多个氨基酸残基。
32.术语“重组宿主细胞株”或“宿主细胞”意指包含本发明多核苷酸的细胞,而不管使用何种方法进行插入以产生重组宿主细胞,例如直接摄取、转导、f配对或所属领域中已知的其它方法。外源性多核苷酸可保持为例如质粒的非整合载体或者可整合入宿主基因组中。宿主细胞可为原核细胞或真核细胞,宿主细胞还可为单子叶或双子叶植物细胞。
33.术语“转化”指将编码基因导入到植物细胞内部这样的方式将多核苷酸或多肽遗传转化到植物中。将所述多核苷酸或多肽引入到植物中的方法为本领域所习知,包括但不限于稳定转化法、瞬时转化法和病毒介导法等。
34.术语“稳定转化”指被引入的多核苷酸构建体整合至植物细胞的基因组中并能通过其子代遗传。
35.术语“瞬时转化”指多核苷酸被引入到植物中但只能在植物中暂时性表达或存在。
36.术语“可操作的连接”指两个或更多个元件之间功能性的连接,可操作的连接的元件可为邻接或非邻接的。
37.术语“转化”:将异源性dna序列引入到宿主细胞或有机体的方法。
38.术语“表达”:内源性基因或转基因在植物细胞中的转录和/或翻译。
39.术语“编码序列”:转录成rna的核酸序列。
40.术语“重组植物表达载体”:一种或多种用于实现植物转化的dna载体;本领域中这些载体常被称为二元载体。二元载体连同具有辅助质粒的载体是大多常用于土壤杆菌介导转化的。二元载体通常包括:t
‑
dna转移所需要的顺式作用序列、经工程化处理以便能够在植物细胞中表达的选择标记物,待转录的异源性dna序列等。
附图说明
41.图1为通过crispr/cas9基因编辑方法获得突变体zmelf3.1;测序结果,从图中可以看出:突变体zmelf3.1在编辑的zmelf3.1基因第二个外显子上产生136bp长度的碱基大片段删除或1bp的插入,导致蛋白质移码突变。
42.图2为对t2代植株进行鉴定,挑选纯合体植株(图2
‑
a),对纯合体突变植株进行基因zmelf3.1的qpcr检测,发现zmelf3.1中基因zmelf3.1几乎不转录。
43.图3 zmelf3.1突变体的表型分析;zmelf3.1突变体雄穗分支数显著多于野生型(wt)的雄穗分支数。
具体实施方式
44.以下结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
45.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
46.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
47.下述实施例中的野生型c01为中国种子集团(武汉)的玉米自交系转化材料。
48.实施例1 zmelf3.1基因的获得及突变体zmelf3.1的创制
49.1、zmelf3.1基因的获得
50.本试验用拟南芥elf3的蛋白序列为基础,通过在玉米基因组数据库的同源比对获得2个玉米的elf3基因,分别命名为zmelf3.1和zmelf3.2。
51.2、突变体zmelf3.1的创制
52.首先从玉米gramene数据库中获取zmelf3.1(zm00001d044232)的基因组序列,并在基因组序列中把cds序列标注出来,然后在cds序列中用snap gene viewer软件设计2个靶位点,靶位点找到后要到gramene玉米数据库中进行blast比对,确保这两个靶位点的特异性。靶点序列分别是:
53.zmelf3.1
‑
guide 1:gtcctcacagaccaagaacaagg
54.zmelf3.1
‑
guide 2:gtagactgtcgataaaatctagg
55.然后利用ctab法提取玉米野生型自交系c01的基因组dna。用引物:
56.zmelf3.1
‑
f2:5'tggctgtaatgatatgcttggg 3'
57.zmelf3.1
‑
r2:5'ttctcttagcaccaacttcccg 3'
58.对所提的基因组dna进行pcr扩增,将扩增产物测序。测序结果与b73参考序列进行比对分析,发现c01的zmelf3.1靶位点序列与b73参考序列相同。
59.然后根据测序结果合成引物用于zmelf3.1的crispr
‑
cas9载体构建,引物如下:
60.zmelf3.1
‑
1f:
61.5'gagccgcaagcaccgaattgtcctcacagaccaagaacagttttagagctagaaatagcaagtt 3'
62.zmelf3.1
‑
2f:
63.5'gagccgcaagcaccgaattgtagactgtcgataaaatctgttttagagctagaaatagcaagtt 3'
64.然后构建zmelf3.1的crispr
‑
cas9载体,具体步骤如下:
65.(1)将cpb
‑
pubi
‑
hspcas9载体用hindiii酶切,回收
66.(2)玉米u6
‑
2启动子片段的制备:
67.引物序列:
68.mu62
‑
1f:5'tgcactgcacaagctgctgtttttgttagccccatcg 3'
69.mu62
‑
1r:5'aattcggtgcttgcggctc 3'
70.pcr扩增体系见表1。
71.表1 pcr扩增体系
72.成分体积2
×
pcr buffer for kod fx25μl2mm dntps10μlmu62
‑
1f1.5μlmu62
‑
1r1.5μlkod fx1μlb73dna1μladd ddh2oup to 50μl
73.pcr反应程序如下:
[0074][0075]
将pcr产物进行琼脂糖凝胶电泳,然后切胶回收,即获得玉米u6
‑
2启动子片段。
[0076]
(3)sgrna表达盒的制备
[0077]
首先用overlap pcr的方法将带有接头的靶点序列和sgrna骨架序列融合在一起,获得的pcr产物分别命名为zmelf3.1
‑
1片段,zmelf3.1
‑
2片段。
[0078]
引物序列:
[0079]
zmelf3.1
‑
1f:
[0080]
5'gagccgcaagcaccgaattgtcctcacagaccaagaacagttttagagctagaaatagcaagtt 3'
[0081]
zmelf3.1
‑
2f:
[0082]
5'gagccgcaagcaccgaattgtagactgtcgataaaatctgttttagagctagaaatagcaagtt 3'
[0083]
musgr
‑
2r:5'ggccagtgccaagcttaaaaaaagcaccgactcg3'
[0084]
pcr扩增体系见表2。
[0085]
表2 pcr扩增体系
[0086]
成分体积2
×
pcr buffer for kod fx25μl2mm dntps10μlzmelf3.1
‑
1f/zmelf3.1
‑
2f1.5μlmusgr
‑
2r1.5μlkod fx1μl合成的sgrna骨架序列1μladd ddh2oup to 50μl
[0087]
人工合成sgrna骨架片段序列如下:
[0088]
gttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgcttttttt
[0089]
pcr反应程序如下:
[0090][0091]
然后用overlap pcr的方法将上一步获得的融合pcr片段和u6
‑
2启动子片段融合为一个片段,获得的pcr产物即为sgrna表达盒,分别命名为u62
‑
zmelf3.1
‑
1片段,u62
‑
zmelf3.1
‑
2片段。引物序列为:
[0092]
mu62
‑
1f:5'tgcactgcacaagctgctgtttttgttagccccatcg 3'(u62
‑
zmelf3.1
‑
1)
[0093]
mu62
‑
2f:5'tgctttttttaagctgctgtttttgttagccccatcg 3'(u62
‑
zmelf3.1
‑
2)
[0094]
musgr
‑
2r:5'ggccagtgccaagcttaaaaaaagcaccgactcg 3'
[0095]
pcr扩增体系见表3。
[0096]
表3 pcr扩增体系
[0097]
成分体积2
×
pcr buffer for kod fx25μl2mm dntps10μlmu62
‑
1f/mu62
‑
2f1.5μlmusgr
‑
2r1.5μlkod fx1μlu6
‑
2启动子片段1μlzmelf3.1
‑
1片段/zmelf3.1
‑
2片段1μladd ddh2oup to 50μl
[0098]
pcr反应程序如下:
[0099][0100]
(4)sgrna表达盒连接cpb
‑
pubi
‑
hspcas9载体
[0101]
按以下反应体系和过程,将2个sgrna表达盒依次连接到cpb
‑
ubi
‑
hspcas9载体上,获得连接产物。
[0102]
反应体系及过程见表4。
[0103]
表4反应体系及过程
[0104]
成分体积sgrna表达盒1μlcpb
‑
pubi
‑
hspcas9载体片段1μl重组酶0.5μl
[0105]
重组酶为clontech公司的in
‑
fusion酶,反应条件为50℃,30min。
[0106]
注:连接u62
‑
zmelf3.1
‑
1片段用cpb
‑
pubi
‑
hspcas9载体片段,连接u62
‑
zmelf3.1
‑
2片段用cpb
‑
pubi
‑
hspcas9
‑
u62
‑
zmelf3.1
‑
1载体片段(均为hindiii酶切)。
[0107]
(5)转化大肠杆菌dh5α及验证
[0108]
将连接产物用热激法42℃转化大肠杆菌dh5α,菌液涂布于含有50mg/l卡那霉素的平板上,37℃培养约12
‑
16h。挑取平板上长出的单菌落,摇菌扩繁。以菌液为模板进行pcr验证。
[0109]
pcr扩增体系见表5。
[0110]
表5 pcr扩增体系
[0111]
成分体积
ddh2o5.75μl2xtsingke master mix7.5μlubi
‑
4f0.375μlpsti
‑
r0.375μl菌液1μltotal15μl
[0112]
其中根据载体设计的上游引物为ubi
‑
4f:5’cttagacatgcaatgctcattatctc3’,下游引物为psti
‑
r:5’ctggcgaaagggggatgt3’,用于检测阳性克隆。
[0113]
pcr反应程序如下:
[0114][0115]
将pcr条带大小正确的菌液送公司测序。测序结果正确的质粒经hindiii单酶切后获得第一次的连接产物载体片段,然后再重复步骤(4)和(5),将u62
‑
zmelf3.1
‑
2片段连接到cpb
‑
pubi
‑
hspcas9载体上。
[0116]
(6)将构建好的cpb
‑
pubi
‑
hspcas9
‑
zmelf3.1基因编辑载体用电击法导入农杆菌eha105中。
[0117]
(7)利用农杆菌介导玉米未成熟胚遗传转化方法将cpb
‑
pubi
‑
hspcas9
‑
zmelf3.1 t
‑
dna导入玉米自交系c01受体(委托中国种子集团有限公司生命科学技术中心完成,地址:湖北省武汉市高新技术开发区高新大道888号生物园路3号)。获得转基因t0代种子。
[0118]
(8)将t0代种子播于大田中,在玉米长至4个展开叶时,用basta试剂(200克/升草胺磷,购自淘宝的圣春秋农资店铺)稀释1000倍涂抹叶尖,筛选没有插入t
‑
dna的(basta涂抹部位枯死)t1代植株。然后取样提取t1代植株的基因组dna,pcr扩增并测序鉴定靶位点是否发生突变。
[0119]
pcr扩增体系见表6。
[0120]
表6 pcr扩增体系
[0121]
成分体积ddh2o5.75μl2xtsingke master mix7.5μlzmelf3.1
‑
f30.375μlzmelf3.1
‑
r30.375μl基因组dna1μltotal15μl
[0122]
zmelf3.1
‑
f3:5'gacagagtttcttcatccaggttt 3'
[0123]
zmelf3.1
‑
r3:5'ccacagcttttgatccttgc 3'
[0124]
pcr反应程序如下:
[0125][0126]
由于zmelf3.1基因设计了两个靶点,理论上如果cas9同时在两个靶点切割,则zmelf3.1纯合突变体经pcr扩增后应该获得单一的小带片段。野生型植株则pcr扩增后应该获得没有切割的单一的大带片段,而杂合植株应该扩增出2条带(大片段和小片段)(见图2
‑
a),如下表7所示:
[0127]
表7扩增条带
[0128]
大带bp小带bp516382
[0129]
经初步pcr筛选鉴定后,选取单一的小带片段送公司测序。测序结果见(图1
‑
c),鉴定出了3个独立事件来源的zmelf3.1纯合突变体,2个删除了136bp,一个插入了一个碱基t,它们都发生了移码突变,从而使zmelf3.1蛋白丧失功能。
[0130]
试验例1 zmelf3.1突变体的表型分析
[0131]
将取实施例1中鉴定到的阴性的纯合zmelf3.1玉米突变体(ko#1,ko#2,ko#3)以及野生型玉米种植于河北省廊坊市广阳区万庄镇伊指挥营村国际高新技术产业园基地和海南省三亚市乐东黎族自治县尖峰镇翁毛村万钟公司产学研示范园基地,野生型与每个突变体种植3行,每行15株。对大田中野生型玉米和突变体玉米植株的雄穗分支数目进行调查发现,在长日照和短日照条件下,zmelf3.1突变体雄穗分支数显著多于野生型(wt)的雄穗分支数(p<10
‑
10
)(图3),这一结果表明,玉米zmelf3.1基因抑制雄穗分支数。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1