NK细胞的滋养细胞、其制备方法和应用
nk细胞的滋养细胞、其制备方法和应用
技术领域
1.本发明涉及细胞技术领域,特别涉及nk细胞的滋养细胞、其制备方法和 应用。
背景技术:
2.自然杀伤(nk)细胞为机体一类重要的固有免疫细胞,表型以cd56
+
cd3-为主,具有较强的杀伤功能与免疫调节功能。nk细胞对于异常细胞的识别不受 主要组织相容性受体的限制,可在细胞因子或人工抗原提呈细胞作用下,分泌 穿孔素、颗粒酶,或分泌肿瘤坏死因子α(tnf-α)、干扰素γ(ifn-γ)等,达 到直接杀伤异常细胞的目的;且nk细胞可通过膜表面cd16的表达,经由抗体 介导的细胞杀伤作用,间接清除异常细胞。另一方面,供者nk细胞在杀伤细 胞免疫球蛋白样受体(kir)与受者不相合的情况下,可抑制受者体内淋巴细胞 及树突样细胞的功能,避免移植物抗宿主病(gvhd)的发生。nk细胞在机体 抗感染、抗肿瘤、抗gvhd等多方面发挥着重要作用。基于上述nk的功能, 临床治疗中通过向感染或肿瘤患者回输nk细胞,以达到缓解严重感染或降低 肿瘤负荷的治疗目的。同时,基因修饰nk细胞,如嵌合抗原受体nk细胞 (car-nk)、tcr样nk等,亦被广泛研究与应用,以期增强nk细胞的靶向 性及杀伤能力。
3.nk细胞为极具治疗潜力的免疫细胞,但其在外周血或脐带血中比例有限— —外周血nk细胞比例在1%~32.6%不等;脐带血nk细胞比例报道高者可达 30%,然而占比在不同供体中差异较大。此外,nk细胞体外扩增困难、体内生 存期短,常规细胞培养方式难以满足临床使用需求,亦难以在体外诱导nk细 胞功能活化。既往采用高剂量il-2扩增nk的方式成本高昂,效果有限。为实 现nk细胞体外高效扩增,多种细胞因子组合、细胞因子联合蛋白刺激、细胞 因子联合okt3、其它化合物(如甲基-β-环糊精等)等多种方式均被应用。而 在细胞因子刺激的同时,辅助人工抗原提呈细胞(aapcs),即滋养细胞与nk 细胞共培养,被证实可达到nk细胞的有效扩增与功能活化,且已在临床开展 应用。
4.aapcs通常为ebv感染的淋巴细胞系(如,lcl细胞)或k562细胞,其 通过过表达nk细胞活化受体相关配体,促进nk细胞增殖与活化,同时减少外 周血或脐血单个核体系中t细胞的比例。目前,相关过表达配体包括膜结合型 il15(mil15)、膜结合型il21(mil21)、cd86、cd64、ox40l等。而于nk 细胞而言,其细胞膜表面表达多种类型活化受体,包括nkg2d、2b4/cd244、 dnam-1/cd226、自然细胞毒性受体(ncr,包括nkp30、nkp44、nkp46) 等。
5.在现有技术中,并非所有相关过表达配体都能有效促进nk细胞的增殖, 并且对于外周血或脐带血中nk细胞的定向增殖与功能活化也没有有效的方法。 因此,如何通过不同配体的表达与组合,达到外周血、脐带血以及单一nk细 胞的定向增殖与功能活化,同时延长细胞生存、避免细胞过度活化与耗竭,为 目前nk细胞滋养细胞研究面临的问题,急需寻找一种解决该问题的办法。
技术实现要素:
6.本发明的一个方面,是针对现有技术中,外周血、脐带血以及单一nk细 胞体外扩
增有限、活化程度低的问题,提供了一种nk细胞的滋养细胞、其制 备方法和应用。
7.本发明提供的技术方案为:
8.一种nk细胞的滋养细胞,所述滋养细胞表达nk细胞活化相关配体,所述 nk细胞活化相关配体包括膜结合型cd48。
9.作为优选,在本发明的某些实施方式中,上述膜结合型cd48中的cd48氨 基酸序列过与cd8α中的前导序列、铰链区和跨膜区融合形成前导序列-铰链区
ꢀ‑
cd48-跨膜区顺序的序列表达在上述滋养细胞的表面。
10.作为优选,在本发明的某些实施方式中,上述铰链区为cd8α中的铰链区; 上述跨膜区为选自以下蛋白质的跨膜结构域或与所述蛋白质具有90-99%同源性 的氨基酸序列:t细胞受体的α或β、cd45、cd4、cd5、cd8α、cd9、cd16、 cd22、cd33、cd37、cd64、cd80、cd86、cd134、4-1bb或cd154;
11.进一步地,在本发明的一个实施方式中,上述跨膜区为cd8α中的跨膜区。
12.作为优选,在本发明的一个实施方式中,上述膜结合型cd48的氨基酸序列 如seq id no.3所示,或与其具有90-99%同源性的氨基酸序列。
13.在本发明的某些实施方式中,上述cd48的氨基酸序列以合适的方式进行随 机或者工程化的点突变,其目的可以为,例如,获得更好的亲和力或表达能力, 而这些突变后的氨基酸序列均包含在本发明的保护范围之内。
14.由于cd48蛋白含糖磷脂酰肌醇锚定位点(gpianchor)结构,以膜结合型 或游离型两种形式存在,为构建单纯膜结合型cd48,cd48蛋白不表达第220 位氨基酸(系gpi结构域关键蛋白)。
15.为了实现本发明的目的,在本发明的某些实施方式中,上述cd48可以单独 表达在nk细胞的滋养细胞的表面,也可以与其他nk细胞活化相关配体共同表 达在nk细胞的滋养细胞的表面。
16.在本发明的某些实施方式中,上述nk细胞活化相关配体还包括选自膜结 合型il21、cd137l或ox40l中的一种或几种,优选为还包括ox40l。
17.作为优选,在本发明的某些实施方式中,上述nk细胞活化相关配体至少 包含两种、三种或四种外源性多肽。
18.作为优选,在本发明的某些实施方式中,上述膜结合型il21中的il21序列 通过与cd8α中的前导序列、铰链区和跨膜区融合形成前导序列-铰链区-il21
‑ꢀ
跨膜区顺序的序列表达在所述滋养细胞的表面。
19.更优选地,在本发明的一个实施方式中,上述铰链区为cd8α中的铰链区; 上述跨膜区为选自以下蛋白质的跨膜结构域或与所述蛋白质具有90-99%同源性 的氨基酸序列:t细胞受体的α或β、cd45、cd4、cd5、cd8α、cd9、cd16、 cd22、cd33、cd37、cd64、cd80、cd86、cd134、4-1bb或cd154;优选 为cd8α中的跨膜区。
20.作为优选,在本发明的一个实施方式中,上述膜结合型il21的氨基酸序列 如seqidno.1所示,或与其具有90-99%同源性的氨基酸序列。
21.作为优选,在本发明的一个实施方式中,上述cd137l的氨基酸序列如 seqidno.2所示,或与其具有90-99%同源性的氨基酸序列;
22.作为优选,在本发明的一个实施方式中,上述ox40l的氨基酸序列如 seqidno.4所
示,或与其具有90-99%同源性的氨基酸序列。
23.在本发明的某些实施方式中,上述膜结合型il21、cd137l和ox40l的氨 基酸序列以合适的方式进行随机或者工程化的点突变,其目的可以为,例如, 获得更好的亲和力或表达能力,而这些突变后的氨基酸序列均包含在本发明的 保护范围之内。
24.在本发明中,上述与其具有90-99%同源性的氨基酸序列指与所述氨基酸序 列具有90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的氨 基酸序列。本领域技术人员可根据现有技术中的方法进行随机或者工程化的点 突变来获得,其目的可以为,例如,获得更好的亲和力或表达能力。
25.进一步地,在本发明的一个实施方式中,上述nk细胞活化相关配体包括 膜结合型cd48和ox40l,或者上述nk细胞活化相关配体包括膜结合型il21、 cd137l和cd48,或者所述nk细胞活化相关配体包括膜结合型il21、cd137l 和ox40l,或者上述nk细胞活化相关配体包括膜结合型il21、cd137l、cd48 和ox40l。
26.在本发明中,上述nk细胞的滋养细胞是由表达nk细胞活化相关配体的基 础细胞组成。在本发明的某些实施方式中,该基础细胞可以为ebv感染的淋巴 细胞系或k562细胞系;
27.作为优选,在本发明的某些实施方式中,上述ebv感染的淋巴细胞系为lcl 细胞系。
28.更优选地,在本发明的一个实施方式中,上述滋养细胞为k562细胞系。
29.作为优选,在本发明的一个实施方式中,上述滋养细胞的生物保藏编号为 cgmccno.22306或cgmccno.22307。
30.本发明的另一个方面,是提供了一种上述滋养细胞的制备方法,将上述nk 细胞活化相关配体的核苷酸序列转入所述滋养细胞的基础细胞,经培养、分选 后得到所述滋养细胞;
31.作为优选,在本发明的某些实施方式中,上述转入为通过病毒转导、通过 电穿孔转入或通过脂质体介导的转入。
32.作为优选,在本发明的某些实施方式中,上述转入为通过病毒转导。
33.更优选地,在本发明的某些实施方式中,上述制备方法包括以下步骤:
34.步骤a)构建包含编码上述nk细胞活化相关配体的核苷酸序列的重组载体, 所述重组载体包含一种或几种所述nk细胞活化相关配体的编码序列;
35.所述几种优选为两种;
36.所述重组载体为慢病毒载体、腺病毒载体、腺相关病毒载体、疱疹病毒载 体或基于逆转录病毒的载体;优选为慢病毒载体;
37.步骤b)将步骤a)中得到的重组载体转染进入包装细胞,经扩增、收集后 得到重组病毒颗粒;
38.所述包装细胞优选为293t细胞;
39.步骤c)用步骤b)得到的重组病毒颗粒感染所述滋养细胞的基础细胞,经 培养、分选后得到所述滋养细胞。
40.在本发明的一个实施方式中,上述编码mil21的核苷酸序列如seqidno.5 所示;上述编码cd137l的核苷酸序列如seqidno.6所示;上述编码膜结合型 cd48的核苷酸序列如
seqidno.7所示;上述编码ox40l的核苷酸序列如 seqidno.8所示。
41.作为优选,在本发明的一个实施方式中,上述步骤a)中的重组载体为包含 编码mil21和编码cd137l核苷酸序列的重组载体与包含编码cd48核苷酸序 列的重组载体、包含编码ox40l核苷酸序列的重组载体的组合。
42.作为优选,在本发明的某些实施方式中,上述重组载体为pcdh载体。
43.更具体地,在本发明的一个实施方式中,通过构建重组慢病毒,再将慢病 毒颗粒转导进入k562细胞系,使得重组载体上编码序列整合至k562细胞系基 因组,实现编码序列对应蛋白的膜表面表达,进而与nk细胞的激活性受体结 合,持续激活nk细胞并促进细胞增殖。
44.本发明的另一个方面,是提供了一种上述滋养细胞在培养、扩增或制备nk 细胞中的用途。
45.作为优选,在本发明的某些实施方式中,上述nk细胞的来源为分离的nk 细胞、分离的外周血单个核细胞或分离的脐带血单个核细胞;
46.作为优选,在本发明的某些实施方式中,上述nk细胞为天然的nk细胞, 例如,从动物体内分离出的nk细胞,或经改造的nk细胞,例如,car-nk 细胞。
47.本发明的另一个方面,是提供了一种nk细胞培养基,上述nk细胞培养基 包含上述滋养细胞。
48.作为优选,在本发明的某些实施方式中,上述nk细胞培养基还包含血清 和细胞因子;
49.更优选地,在本发明的一个实施方式中,上述细胞因子为il2和/或il15。
50.除此以外,根据本领域常识,上述培养基中还应包含供给nk细胞生长的 基础培养基。
51.本发明的另一个方面,是提供了一种nk细胞的制备方法,将nk细胞与上 述滋养细胞按照比例共培养。
52.作为优选,在本发明的某些实施方式中,上述共培养为在上述nk细胞培 养基中共培养。
53.作为优选,在本发明的某些实施方式中,上述nk细胞的来源为分离的nk 细胞、分离的外周血单个核细胞或分离的脐带血单个核细胞;
54.作为优选,在本发明的某些实施方式中,上述nk细胞为天然的nk细胞或 经改造的nk细胞。
55.作为优选,在本发明的某些实施方式中,上述比例为nk细胞数:滋养细 胞数=1:1~3。
56.作为优选,在本发明的一个实施方式中,在所述共培养前还包括将所述滋 养细胞进行x射线照射处理的步骤,所述x射线照射处理照射剂量为120gy。
57.本发明的另一个方面,是提供了一种nk细胞,上述nk细胞由上述制备方 法制得。
58.本发明的另一个方面,是提供了一种上述nk细胞的滋养细胞或上述nk细 胞在治疗肿瘤中的用途,上述肿瘤优选为白血病或淋巴瘤。
59.本发明的另一个方面,是提供了一种治疗患者肿瘤的方法,将上述nk细 胞的滋养细胞与从患者体内分离后经治疗性改造的nk细胞共培养,在nk细胞 达到有效剂量时回输
入该患者。
60.上述肿瘤优选为白血病或淋巴瘤。
61.本发明的有益效果为:
62.利用本发明进行外周血nk细胞培养、外周血或脐带血单个核体系中nk细 胞的定向扩增,可实现nk细胞的大量扩增与分化成熟。传代培养后14天,外 周血nk可实现百倍扩增,脐带血nk可扩增至初始数量的千倍。制备所得的 nk细胞活化性受体表达高,未出现抑制性受体的表达增加,具备对于白血病或 淋巴瘤细胞系的杀伤功能。本发明制备方法简单有效,生产成本较低,可批量 生产,并实现nk细胞批量扩增,临床应用前景广阔。
63.生物保藏信息:
64.保藏编号:cgmcc no.22306
65.保藏日期:2021年4月14日
66.保藏单位:中国微生物菌种保藏管理委员会普通微生物中心,简称cgmcc, 地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所
67.分类命名:人骨髓来源慢性髓系白血病细胞系
68.保藏编号:cgmcc no.22307
69.保藏日期:2021年4月14日
70.保藏单位:中国微生物菌种保藏管理委员会普通微生物中心,简称cgmcc, 地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所
71.分类命名:人骨髓来源慢性髓系白血病细胞系
附图说明
72.图1为本发明实施例1中过表达nk细胞活化相关配体的流式检测结果图, 其中,a为过表达mil21、cd137l重组k562细胞中mil21膜受体表达的流式 检测的结果图,b为过表达mil21、cd137l重组k562细胞中cd137l膜受体 表达的流式检测的结果图,c为过表达mil21、cd137l重组k562细胞中mil21 与cd137l共表达的流式检测的结果图;
73.图2为本发明实施例1中过表达mil21、cd137l、cd48重组k562细胞中 cd48膜受体表达的流式检测的结果图;
74.图3为本发明实施例1中过表达nk细胞活化相关配体的流式检测结果图, 其中,a为过表达mil21、cd137l、cd48、ox40l重组k562细胞中cd48膜 受体表达的流式检测的结果图,b为过表达mil21、cd137l、cd48、ox40l 重组k562细胞中ox40l膜受体表达的流式检测的结果图,c为过表达mil21、 cd137l、cd48、ox40l重组k562细胞中cd48与ox40l共表达的流式检测 的结果图;
75.图4为不同滋养细胞与外周血单个核细胞共培养体系下,所得nk细胞绝 对数结果图,其中,横轴坐标分别代表:basic:过表达mil21、cd137l的滋 养细胞;ox40l:过表达mil21、cd137l、ox40l的滋养细胞;48:过表达 mil21、cd137l、cd48的滋养细胞;ox+48:过表达mil21、cd137l、ox40l、 cd48的滋养细胞;
76.图5为不同滋养细胞与外周血单个核细胞共培养体系下,nk细胞在单个核 细胞体系中的比例情况结果图,其中,横轴坐标分别代表:basic:过表达mil21、 cd137l的滋养细胞;ox40l:过表达mil21、cd137l、ox40l的滋养细胞; 48:过表达mil21、cd137l、cd48的滋养
细胞;ox+48:过表达mil21、cd137l、 ox40l、cd48的滋养细胞;单个核细胞来自供者1及供者2两位供者,分别标 记为donor 1、donor 2;
77.图6为不同滋养细胞与外周血单个核细胞共培养体系下,day4、day8 nk细 胞cd16的表达情况及其变化结果图,单个核细胞来自与图5相同的两位供者, 分别标记为donor 1、donor 2;
78.图7为不同滋养细胞与外周血nk细胞共培养下nk细胞扩增情况结果图, nk细胞来自供者3及供者4两位供者,分别标记为donor3、donor4;
79.图8为不同滋养细胞与外周血nk细胞共培养,nk细胞在第14天的表型 情况结果图,涵盖cd16、ox40、2b4、nkg2d、nkp30/nkp44/nkp46;
80.图9为不同滋养细胞与脐带血单个核细胞共培养体系下,所得nk细胞绝 对数及其对应扩增倍数结果图,其中,横轴坐标分别代表:basic:过表达mil21、 cd137l的滋养细胞;ox40l:过表达mil21、cd137l、ox40l的滋养细胞; 48:过表达mil21、cd137l、cd48的滋养细胞;ox+48:过表达mil21、cd137l、 ox40l、cd48的滋养细胞;
81.图10为不同滋养细胞与脐带血单个核细胞共培养体系下所得nk细胞分别 与raji、daudi、namalwa、molt4以5:1的效靶比共培养,在0h、12h、24h、48h 残余细胞比例的变化情况结果图,脐带血来源于供者5;
82.图11为不同滋养细胞与脐带血单个核细胞共培养体系下,nk细胞分别在 第8、12、16天检测所得活化性受体的结果图,其中,a为检测所得活化性受 体cd16、nkg2d、2b4表达情况结果图,b为检测所得ncr——nkp30、nkp44、 nkp46表达情况结果图,c为检测所得抑制性受体pd-1、tigit、tim-3表达情 况结果图。
83.序列说明
84.seqidno.1为本发明实施例中膜结合型il21的氨基酸序列;
85.seqidno.2为本发明实施例中cd137l的氨基酸序列;
86.seqidno.3为本发明实施例中膜结合型cd48的氨基酸序列;
87.seqidno.4为本发明实施例中ox40l的氨基酸序列;
88.seqidno.5为本发明实施例中编码膜结合型il21的核苷酸序列;
89.seqidno.6为本发明实施例中编码cd137l的核苷酸序列;
90.seqidno.7为本发明实施例中编码膜结合型cd48的核苷酸序列;
91.seqidno.8为本发明实施例中编码ox40l的核苷酸序列。
具体实施方式
92.本发明公开了nk细胞的滋养细胞、其制备方法和应用,本领域技术人员 可以借鉴本文内容,适当改进工艺参数实现。需要特别指出的是,所有类似的 替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明, 并且相关人员明显能在不脱离本发明内容、精神和范围的基础上对本文所述内 容进行改动或适当变更与组合,来实现和应用本发明技术。
93.在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领 域技术人员所通常理解的含义。除非另有其它明确表示,否则在整个说明书和 权利要求书中,术语“包括”或其变换如“包含”或“包括有”等等将被理解 为包括所陈述的元件或组成部分,
而并未排除其它元件或其它组成部分。术语
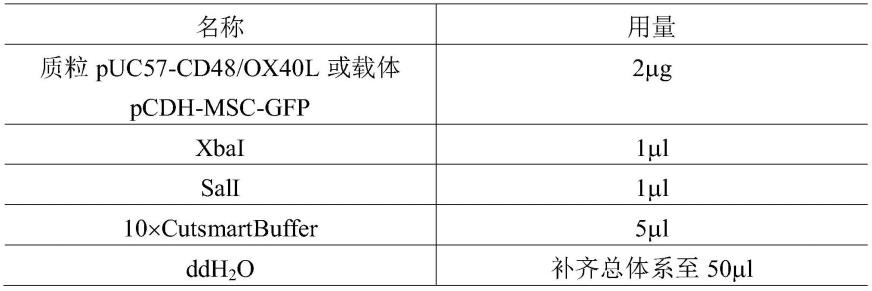
ꢀ“
如”、“例如”等旨在指示例性实施方案,而不意图限制本公开的范围。
94.下面就本发明中出现的部分术语作以解释。
95.术语“载体”,是可将多核苷酸插入其中的一种核酸运载工具。当载体能使 插入的多核苷酸编码的蛋白质获得表达时,载体称为表达载体。载体可以通过 转化,转导或者转染导入宿主细胞,使其携带的遗传物质元件在宿主细胞中获 得表达。载体是本领域技术人员公知的,包括但不限于:质粒;噬菌粒;柯斯 质粒;人工染色体,例如酵母人工染色体(yac)、细菌人工染色体(bac)或p1 来源的人工染色体(pac);噬菌体如λ噬菌体或m13噬菌体及动物病毒等。可用 作载体的动物病毒包括但不限于,逆转录酶病毒(包括慢病毒)、腺病毒、腺相关 病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤 空泡病毒(如sv40)。一种载体可以含有多种控制表达的元件,包括但不限于, 启动子序列、转录起始序列、增强子序列、选择元件及报告基因。另外,载体 还可含有复制起始位点。
96.术语“治疗”,是指减少疾病病理的可能性,减少疾病症状的发生,例如在 一定程度上受试者具有更长的存活期或减少的不适。治疗可以是指当向受试者 给予疗法时该疗法减少疾病症状、体征或病因的能力。治疗还指缓和或减少至 少一种临床症状和/或抑制或延迟病症的进展和/或预防或延迟疾病或疾患的发 作。
97.术语“外源多肽”是指不由该类型的野生型细胞产生的多肽,或者以比含 有该外源多肽的细胞中更低的水平存在于野生型细胞中的多肽。在一些实施方 案中,外源多肽是指被引入到细胞中或细胞上,或者通过将编码外源多肽的外 源核酸引入到细胞或细胞的祖细胞中而导致由细胞表达的多肽。在一些实施方 案中,外源多肽是由被引入到细胞或细胞的祖细胞中的外源核酸编码的多肽, 该核酸任选地不被细胞保留。在一些实施方案中,外源多肽是通过化学或酶促 手段缀合至细胞表面的多肽。
98.为了使本领域的技术人员更好地理解本发明的技术方案,下面结合具体实 施例对本发明作进一步的详细说明。
99.实施例1:nk细胞滋养细胞的制备
100.1、过表达序列的构建
101.1)膜结合型il21(mil21)的构建
102.mil21序列参考ncbi nm_001207006cds区作为il21抗原表达序列,通 过cd8α前导序列诱导膜表达,同时与cd8 hinge区与跨膜区连接构建膜结合型 il21。上述膜结合型il21(mil21)的核苷酸序列如seqidno.5所示。
103.2)膜结合型cd48的构建
104.cd48序列参考ncbi nm_001256030.2cds区,由于cd48蛋白含糖磷脂 酰肌醇锚定位点(gpianchor)结构,以膜结合型或游离型两种形式存在,为构 建单纯膜结合型cd48,cd48蛋白不表达第220位氨基酸(系gpi结构域关键 蛋白)。上述膜结合型cd48的核苷酸序列如seqidno.7所示。
105.3)ox40l的构建
106.ox40l序列参考ncbi nm_001297562.2cds区。上述ox40l的核苷酸序 列如seqidno.8所示。
107.上述mil21、mcd48、ox40l序列载体均为puc57。
108.4)cd137l的构建
109.cd137序列参考ncbinm_009404.3cds区,上述cd137l的核苷酸序列如 seqidno.6所示。
110.cd137l序列载体为pcdh慢病毒载体。
111.2、构建含过表达序列的载体
112.a)酶切及回收
113.将上述质粒puc57-cd48、质粒puc57-ox40l、载体pcdh-mcs-gfp质 粒进行酶切,体系如下:
[0114][0115]
将上述puc57-mil21、pcdh-t2a-41bbl质粒进行酶切,体系如下:
[0116][0117][0118]
反应条件:37℃金属浴,4h或过夜酶切。
[0119]
酶切完成后,每个反应管中加入10μl 6
×
dnaloadingbuffer,配置1%琼脂 糖凝胶,以2k、2kplusii作为dnamarker,进行琼脂糖凝胶电泳,对于 puc57-cd48、puc57-ox40l、pcdh-mcs-gfp,分别切取723bp、408bp、6389bp 对应胶条,对于puc57-mil21、pcdh-t2a-cd137l,分别切取约760bp、7240bp 对应胶条,置于干净的2mlep管中,使用 takaraminibestagarosegeldnaextractionkit进行胶回收,测量回收产物od值,
ꢀ‑
20℃储存备用。
[0120]
b)酶切产物连接、转化与筛选
[0121]
(i)酶切产物连接,配置反应体系如下:
[0122]
体系1:
[0123][0124]
体系2:
[0125][0126]
目的片段质量(ng)/目的片段碱基数(bp):载体片段质量(ng)/载体片 段碱基数(bp)=5~8。
[0127]
反应条件为室温下静置30min或置于16℃金属浴连接过夜。
[0128]
(ii)非成熟质粒转化与筛选
[0129]
取感受态jm109置于冰上融化,取30-50μl jm109加入连接体系,混匀, 冰上孵育30min,孵育完成后置于42℃金属浴热激90s,立即转移至冰上静置 2-3min,向ep管中加入500μl无氨苄青霉素(amp)的lb培养基,置于37℃ 恒温振荡器中,160rpm,1h;1h后离心,3000rpm,3min,部分弃上清,剩余 100μl液体以重悬细菌,将菌液均匀滴加至含amp抗性的lb平板上,无菌涂布 器均匀涂布菌液,待干燥后,倒置于37℃恒温孵箱中培养12-16h。
[0130]
(iii)挑取单个散在菌落,置于含1ml amp抗性的lb培养液中,摇菌并送 菌液测序。
[0131]
3、碱裂解法中量提取质粒
[0132]
1)取以上测序正确的菌液以1:100的比例加入新鲜的含有氨苄青霉素的lb 液体培养基(20-30ml),在37℃恒温摇床中以200rpm/min的速度震荡培养12-16 小时,利用tiangen公司的质粒提取试剂盒提取质粒;
[0133]
2)柱平衡步骤:向吸附柱cp4中(吸附柱放入收集管中)加入500μl的平 衡液bl,12,000rpm(~13,400g)离心1min,倒掉收集管中的废液,将吸附柱重 新放回收集管中。
[0134]
3)取菌液加入离心管中,12,000rpm(~13,400g)离心1min,尽量吸除上 清。
[0135]
4)向留有菌体沉淀的离心管中加入500μl溶液p1(已加入rnasea),使 用移液器或涡旋振荡器彻底悬浮细菌细胞沉淀。
[0136]
5)向离心管中加入500μl溶液p2,温和地上下翻转6-8次使菌体充分裂解。
[0137]
6)向离心管中加入500μl溶液p4,立即温和地上下翻转6-8次,充分混匀, 可见出现白色絮状沉淀,后室温放置10min左右,12,000rpm(~13,400g)离心 10min。
[0138]
7)将上一步收集的上清液分次加入过滤柱cs(过滤柱放入收集管中), 12,000rpm(~13,400g)离心2min,滤液收集在干净的2ml离心管中。
[0139]
8)向滤液中加入0.3倍滤液体积的异丙醇,上下颠倒混匀后转移到吸附柱 cp4中(吸附柱放入收集管中)。吸附柱cp4的最大容积为700μl,根据需要分 次过柱。
[0140]
9)室温12,000rpm(~13,400g)离心1min,倒掉收集管中的废液,将吸附柱 重新放回收集管中。
[0141]
10)向吸附柱cp4中加入500μl去蛋白液pd,12,000rpm(~13,400g)离心 1min,倒掉收集管中的废液,将吸附柱cp4放入收集管中。
[0142]
11)向吸附柱cp4中加入600μl漂洗液pw(已加入无水乙醇),室温静置2-5min,12,000rpm(~13,400g)离心1min,倒掉收集管中的废液,将吸附柱cp4 放入收集管中。
[0143]
13)向吸附柱cp4中加入600μl漂洗液pw,12,000rpm(~13,400g)离心1 min,倒掉收集管中的废液。
[0144]
14)将吸附柱cp4重新放回收集管中,12,000rpm(~13,400g)离心2min, 将吸附柱cp4开盖,置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗 液。
[0145]
15)将吸附柱cp4置于一个干净的离心管中,向吸附膜的中间部位悬空滴 加100-300μl洗脱缓冲液tb或无菌双蒸水,室温放置2min,12,000rpm (~13,400g)离心1min将质粒溶液收集到离心管中。
[0146]
16)提取的质粒溶液利用nanodrop2000测定浓度、a260/a280、a260/a230。
[0147]
17)质粒溶液于-20℃储存,以备后续转染使用。
[0148]
4、慢病毒制备与浓缩
[0149]
1)胰酶消化处于对数生长期的293t细胞,将5
×
106个hek293t细胞接种 于10cm细胞培养皿(培养基为dmem+15%fbs),总体系为10ml。晃匀细胞 后将细胞培养皿置于37℃、5%co2的孵箱中培养24-36h。在细胞汇合度达到 80-90%时,进行转染操作。
[0150]
2)在15ml离心管中,用无血清dmem培养基稀释dna,转染体系如下:
[0151][0152]
上述混合体系配置后静置15min。吸取10cm细胞培养皿中的旧培养基,加 入7ml新鲜的含15%fbs的dmem培养基,将上述转染体系缓慢逐滴加入培养 皿中,培养皿置于37℃、5%co2孵箱培养,12h后更换完全新鲜的含15%fbs 的dmem培养基。
[0153]
3)收集换液后48h的病毒原液,于4℃离心,3000rpm,15min,收集上清。
[0154]
4)利用0.45μm滤器过滤病毒上清,收集于超速离心管中,精密天平严格 配平后,超速离心机离心,4℃,50000g,2h30min。
[0155]
5)离心结束后,弃上清,加入100μl无血清培养基(rpm1640)重悬病毒, 分装于1.5mlep管,-80℃储存备用。
[0156]
5、细胞转导与流式分选
[0157]
1)取处于对数生长期的k562细胞,以5
×
105细胞数接种于24孔板,加入 mil21-t2a-cd137l的病毒浓缩液100μl,调整总体系至1ml,加入polybrene (终浓度8μg/ml),离心:1800rpm,1h30min,32℃。将细胞置于37℃、5%co2恒温孵箱中培养4-6h,更换新鲜培养基。
[0158]
2)在感染后第5天,收集k562细胞,标记抗人il21、抗人cd137l抗体 及相应同型对照抗体,分选il21+cd137l+双阳细胞群,至37℃、5%co2恒温 孵箱中培养。
[0159]
3)取5
×
105细胞数接种于24孔板,加入含cd48的病毒浓缩液100μl,感 染步骤如上诉。在感染后第5天,收集k562细胞,标记抗人il21、抗人cd137l、 抗人cd48抗体及相应同型对照抗体,流式分选il21+cd137+cd48+细胞群, 至37℃、5%co2恒温孵箱中培养。
[0160]
4)取5
×
105细胞数接种于24孔板,加入含ox40l的病毒浓缩液100μl, 感染步骤如上诉。在感染后第5天,收集k562细胞,标记抗人il21、抗人cd137l、 抗人cd48、抗人ox40l抗体及相应同型对照抗体,流式分选 il21+cd137+cd48+ox40l+细胞群,至37℃、5%co2恒温孵箱中培养。
[0161]
6、滋养细胞预处理
[0162]
将分选后不同表型滋养细胞进行x射线照射处理,设置照射剂量为120gy, 将照射后的细胞以适宜比例进行冻存,以备后续共培养使用。
[0163]
实验例1:流式细胞仪检测nk细胞滋养细胞膜表面受体表达
[0164]
1)取1
×
10
5-5
×
105nk细胞滋养细胞至1.5ml ep管,离心,3000rpm,3min;
[0165]
2)100μlpbs重悬细胞,对应滋养细胞分别标记抗人il21、抗人cd137l 及其同型对照,抗人cd48、抗人ox40l及其同型对照,避光,室温孵育15min 或4℃孵育30min;
[0166]
3)加入1mlpbs洗涤,离心,3000rpm,3min;
[0167]
4)充分弃上清,100-200μlpbs重悬细胞,将细胞悬液转移至流式管;
[0168]
5)上机进行流式检测,nk滋养细胞表型如图1-3所示。
[0169]
结果表明,本实施例1所制备的nk细胞滋养细胞表面均过表达上述蛋白 质分子。
[0170]
实验例2:功能验证实验用细胞的分离
[0171]
1、外周血单个核细胞分离
[0172]
a)取无菌50ml离心管,加入适量淋巴细胞分离液
[0173]
b)取无菌50ml离心管,加入全血及等量或过量无菌pbs,充分混匀,将 混合液缓慢滴加至淋巴细胞分离液上方;
[0174]
c)离心,500g,20min,升速设为“9”,降速设为“6”;
[0175]
d)离心后细胞分为三层,利用吸管,充分吸取中间白膜层至新的50ml离 心管,加入等量pbs溶液,充分混匀;
[0176]
e)离心,500g,10min;
[0177]
f)充分弃上清,以5
×
10
6-1
×
107细胞数每管进行冻存,冻存液配置为dmso: fbs体积比2:8。
[0178]
2、外周血nk细胞分离
[0179]
利用easysep
tm
humannkcellenrichmentkit分离人外周血nk细胞,所有操 作及试剂均在常温(~26℃)下进行。
[0180]
a)取无菌50ml离心管,以每毫升全血50μl试剂的比例,充分混匀试剂 cocktail及
全血;
[0181]
b)上述混合物室温静置20min;
[0182]
c)准备2%fbs的无菌pbs溶液,等体积加入上述混合物,充分混匀;
[0183]
d)准备新的无菌50ml离心管,加入适量提及淋巴细胞分离液,将上一步 混合液小心缓慢滴加至淋巴分离液上方,体积如下:
[0184][0185]
e)离心机升降速均设置为“3”,将上述混合液室温离心,1200g,20min;
[0186]
f)离心完成后,混合液分为三层,用吸管小心吸除最上层血浆层,收集临 界面细胞于新的50ml离心管中;
[0187]
g)加入等量或过量含2%fbs的pbs溶液,离心,1500rpm,10min,去除 上清;
[0188]
h)重复步骤g);
[0189]
i)培养基重悬获得的nk细胞(scgm+10%fbs+200u/ml il-2),计数;
[0190]
j)取适量获得nk细胞鉴定细胞纯度:
[0191]
取2管(1-5)
×
105细胞于流式管中,加入1mlpbs离心清洗,3000rpm,3min, 弃上清,100μlpbs重悬细胞,管1加入抗人cd56、抗人cd3抗体各1μl,管2 加入对应同型对照抗体各1μl,避光,室温孵育15min或4℃孵育30min,加入 1mlpbs离心洗涤,弃上清,加入100-300μlpbs重悬细胞,流式上机检测。
[0192]
k)按dmso:fbs体积比2:8配置冻存液,将冻存液与细胞悬液1:1混合, 进行细胞冻存。
[0193]
3、脐带血单个核细胞分离
[0194]
a)取新鲜脐血分装于无菌血浆瓶中,按照体积比5:1加入羟乙基淀粉,充 分混匀,室温静置至少40min以充分沉降红细胞;
[0195]
b)将沉降后的上清转移至新的50ml离心管,离心,1500rpm,10min;
[0196]
c)弃部分上清,每管留约5ml液体,将全部细胞重悬合并至单个50ml离 心管,加入等量pbs溶液,充分混匀;
[0197]
d)取新的50ml离心管,加入适量淋巴细胞分离液,将上述混合液缓慢加 入淋巴细胞分离液上方;
[0198]
e)离心:20℃,2000rpm,20min,升降速均设置为“3”;
[0199]
f)离心结束后,用吸管小心收集中间白膜层,转移至新的含pbe的离心管 中(pbe体积大于白膜层体积),充分混匀;
[0200]
g)离心:20℃,1600rpm,20min;
[0201]
h)弃上清,每管用40mlpbe重悬,充分混匀后计数;
[0202]
i)离心:20℃,1600rpm,10min;
[0203]
j)充分弃上清,按照dmso:fbs体积比2:8配置冻存液,利用冻存液重 悬细胞团块,按5
×
106细胞/管进行细胞冻存。
[0204]
实验例3:nk细胞滋养细胞与外周血单个核细胞共培养,检测nk细胞增 殖与活化情况
[0205]
复苏实验例2中分离的外周血单个核细胞,流式标记抗人cd3、抗人cd56 抗体以确定初始nk细胞比例,取2
×
105nk细胞,按照nk细胞数:滋养细胞 数=1:1,于48孔板进行共培养。培养基为rpmi1640基础培养基 +10%fbs+200u/ml il-2,以5
×
105~1
×
106/ml密度进行细胞培养。分别于第4、8 天进行总细胞数计数,复测nk细胞比例,以nk细胞数:滋养细胞数=1:1补 充滋养细胞,同时通过标记抗人cd16抗体,流式检测nk细胞表型。
[0206]
实验结果如图4-6所示。实验表明,过表达mil21、cd137l、cd48、ox40l 或mil21、cd137l、cd48的重组k562细胞可有效刺激外周血单个核体系中 nk细胞的扩增(nk细胞扩增情况见图4),nk细胞所占比例(即nk细胞纯 度)均高于表达mil21、cd137l重组k562细胞(单个核体系细胞群比例变化 见图5),且对应nk细胞cd16的表达升高(nk细胞cd16表达见图6)。
[0207]
实验例4:nk细胞滋养细胞与外周血nk细胞共培养,检测nk细胞增殖 与活化情况
[0208]
复苏外周血nk细胞,以nk细胞数:滋养细胞数=1:1进行共培养,培养 基为scgm基础培养基+10%fbs+200u/ml il-2+50u/ml il-15,细胞密度为 5
×
10
5-1
×
106/ml。分别于第7、14天标记抗人cd3、抗人cd56、抗人cd16、 抗人ox40、抗人2b4、抗人nkp30/nkp44/nkp46及抗人nkg2d等流式抗体, 以检测nk细胞活化水平。
[0209]
实验结果如图7、8所示。实验表明,过表达mil21、cd137l、cd48、ox40l 或mil21、cd137l、cd48的重组k562细胞可有效刺激外周血nk细胞的扩增 (nk细胞扩增情况见图7),nk扩增倍数可达500倍及以上。nk表面活化性 受体表达,显示nk细胞活化良好,其表型不劣于表达mil21及cd137l滋养 细胞所扩增的nk细胞表型(第14天nk表面受体表达情况见图8)
[0210]
实验例5:nk细胞滋养细胞与脐血单个核细胞共培养,检测nk细胞增殖、 活化情况与杀伤功能
[0211]
复苏脐血单个核细胞,标记抗人cd3、抗人cd56流式抗体以确定初始nk 细胞比例,取2
×
105nk细胞,按照nk细胞数:滋养细胞数=1:2,于48孔板进 行共培养。培养基为scgm基础培养基+10%fbs+200u/ml il-2+50u/ml il-15, 以5
×
105~1
×
106/ml密度进行细胞培养。分别于第4、8天进行总细胞数计数,复 测nk细胞比例,按nk细胞数:滋养细胞数=1:2补充滋养细胞。第12天复测 nk细胞比例,此时细胞群以nk细胞为主,cd3
+
细胞污染低于10%,此情形 下不再单独分选nk细胞(若cd3
+
细胞污染高于10%,则采用miltenyicd56 microbeads进行磁珠分选)。day14,设置1
×
105靶细胞数,按照5:1效靶比将 nk细胞与raji(burkitt’s淋巴瘤细胞系)、daudi(burkitt’s淋巴瘤细胞系)、 namalwa(burkitt’s淋巴瘤细胞系)、molt-4(急性t淋巴细胞白血病细胞系) 进行共培养,分别于12h、24h、48h通过流式抗体标记靶细胞,检测靶细胞残 留比例,以验证nk细胞杀伤功能。nk细胞表型分别于第8、12、16天进行检 测,包括nk细胞表面活化性受体:cd16、nkg2d、2b4,nk细胞杀伤功能 相关受体:nkp30、nkp44、nkp46,nk细胞抑制性受体:pd-1、tim-3、tigit (图11)。
[0212]
实验结果如图9-11所示。实验表明,所构建的滋养细胞 (k562-mil21-cd137l,k562-mil21-cd137l-cd48、 k562-mil21-cd137l-ox40l、k562-mil21-cd137l-cd48&ox40l)均可有效 在脐血单个核体系中定向扩增nk细胞,nk细胞扩增倍数可达6000倍及以上 (见图9);所述滋养细胞可在5:1效靶比下有效杀伤daudi、namalwa细胞系, 对nk抵抗性的raji
细胞具备一定杀伤能力,对急性t淋巴细胞白血病细胞系 molt4亦具备一定杀伤能力(见图10)。在k562-mil21-cd137l滋养细胞(basic) 基础上,过表达cd48或ox40l构建上述滋养细胞,均可获得不亚于基础表达 mil21、cd137l的滋养细胞所能达到的nk活化效果,且nk抑制性受体(pd-1、 tim-3、tigit)无明显表达升高(见图11)。
[0213]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通 技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰, 这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1