一种人来源诱导多功能干细胞分化成间充质干细胞的诱导培养基及诱导方法与流程
1.本发明属于细胞技术领域,具体涉及一种人来源诱导多功能干细胞分化成间充质干细胞的诱导培养基及诱导方法。
背景技术:
2.间充质干细胞(mscs)是多能干细胞,在再生医学领域受到了广泛关注。被描述为多能性非造血成体干细胞,其表达表面标记cd29,cd105和cd44,但不表达cd14,cd34和cd45,具有多种独特的特征,包括分化潜能,菌落形成和自我更新能力。可以分为间充质谱系,即成骨细胞,软骨细胞,脂肪细胞,内皮细胞和心肌细胞,以及非间质谱系,如肝细胞和神经元细胞类型,除具有分化潜能外,mscs还具有分泌某些营养因子的能力,例如生长因子,细胞因子等。
3.诱导多能干细胞(induced pluripotent stem cell,ips细胞)是通过对体细胞重新编程而产生的多能干细胞,ips细胞可以分化为msc(诱导多能干细胞来源的间充质干细胞,imsc),为msc提供了新的来源,imsc的特性包括非侵入性获得,易于扩增和更好的同质性,这有望克服上述msc的缺点,优化的特性表明,在细胞治疗中使用imsc而非传统msc,为以后再生医学治疗提供更广阔前景,以前的研究已经探索了一些类型的疾病imsc的潜在治疗作用,例如,慢性小鼠哮喘模型、小鼠炎症性肠病模型等。
4.间充质干细胞是结缔组织(成骨细胞,软骨细胞和脂肪细胞)的祖细胞,具有显着的免疫调节和再生功能。尽管有潜在的治疗应用,目前的技术仍面临一些障碍,例如移植细胞的低生存力,先天异质性,与供体衰老有关的不确定因素以及潜在的致瘤性。规模制备msc的当前方法面临若干挑战,因为可从供体获得的msc的量通常不足。此外,体外生长和分化的潜力受多种因素影响,例如培养期,供体年龄和供体健康状况。
5.归因于高增殖和分化潜能,诱导的多能干细胞在组织再生方面具有巨大优势,此外,ips细胞可控,可扩展的方式转换为大多数细胞类型,包括msc(诱导多能干细胞来源的间充质干细胞,imsc),以获得足够数量的细胞,几个临床前实验已经表明imsc在若干组织,包括血管、牙周组织、肝、心脏、软骨细胞、骨骼肌和皮肤伤口再生有助于增强,诱导多能干细胞来源的间充质干细胞提供了一种可以避免道德问题和免疫排斥的理想方法,但现有技术中难以获得诱导多功能干细胞来源的间充质干细胞。
技术实现要素:
6.为了解决以上技术问题,本发明提供了一种人来源诱导多功能干细胞分化成间充质干细胞的诱导培养基及诱导方法。
7.本发明具体技术方案如下:
8.本发明一方面提供了一种人来源诱导多功能干细胞分化成间充质干细胞的诱导培养基,该诱导培养基包括基础培养基与添加于所述基础培养基中的血清和添加剂,所述
血清为含量为10%的小牛血清,所述添加剂包括以下含量的组分:10%的无血清替代物、20ng/ml的碱性成纤维细胞生长因子、50μg/ml抗坏血酸、1%1x胰岛素转铁蛋白硒、4.5mm硫代甘油和1%非必需氨基酸。
9.进一步地,添加剂还包括含量为20ng/ml的表皮生长因子。
10.进一步地,诱导培养基使用前还添加含量为10μmol/l的y
‑
27632。
11.进一步地,非必需氨基酸为mem非必需氨基酸溶液。
12.进一步地,基础培养基为高糖dmem基础培养基,高糖dmem培养基购自thermo scientific公司。
13.本发明另一方面提供了一种利用诱导培养基诱导人来源多功能干细胞分化成间充质干细胞的诱导方法,该方法包括以下步骤:
14.阶段1:培养人来源诱导多功能干细胞;
15.阶段2:将阶段1培养的人来源诱导多功能干细胞接种于6孔超低吸附培养板中,在含有含量为20ng/ml的表皮生长因子的诱导培养基中添加含量为10μmol/l的y
‑
27632,在6孔超低吸附培养板中加入添加含量为10μmol/l的y
‑
27632的所述诱导培养基培养4天,每两天更换一次培养基;
16.阶段3:将细胞转到明胶包被的6孔板中,在含有含量为20ng/ml的表皮生长因子的诱导培养基中添加含量为10μmol/l的y
‑
27632,在6孔板中加入添加含量为10μmol/l的y
‑
27632的所述诱导培养基培养7天,每两天更换一次培养基;
17.阶段4:吸出6孔板中含有10μmol/l的y
‑
27632的诱导培养基,对细胞进行消化、孵育,并上下吹打以获得细胞悬浮液,将细胞悬浮液转移至权利要求1所述的诱导培养基中,转移前在权利要求1所述的诱导培养基中添加含量为10μmol/l的y
‑
27632,离心,再将细胞重悬于含有10μmol/l的y
‑
27632的诱导培养基中,再将细胞铺板到人工基质胶包被的6孔板中,待细胞汇合度到达80%左右时进行传代。
18.进一步地,阶段1培养人来源诱导多功能干细胞的方法如下:
19.在15℃条件下,预热足量的ips细胞培养基,ips细胞培养基中添加y
‑
27632以促进ips细胞贴壁,y
‑
27632的终浓度为10μmol/l,用1ml人工基质胶包被6孔板,解冻ips细胞移入6孔板,每孔加入ips细胞培养基培养ips细胞,每天更换培养基,10天后,用1ml的d
‑
pbs洗涤孔,去除洗涤液,每孔加入1ml胰酶替代物以消化培养好的ips细胞,在37℃孵育3~5分钟,吸走胰酶替代物,加入1ml添加有y
‑
27632的ips细胞培养基,轻轻地上下吹打以获得细胞悬浮液。
20.在15℃条件下,室温预热足量的ips细胞培养基,ips细胞培养基中添加y
‑
27632,y
‑
27632的终浓度为10μmol/l,将人工基质胶包被于6孔板,将细胞铺板到已包被人工基质胶的6孔板上进行传代,在37℃培养24小时,从孔中吸出添加有y
‑
27632的培养基并用新鲜的添加有y
‑
27632的ips细胞培养基替换,在37℃培养24小时。
21.进一步地,阶段2具体方法如下:将权利要求2的诱导培养基在15℃条件下预热半小时,在诱导培养基内添加y
‑
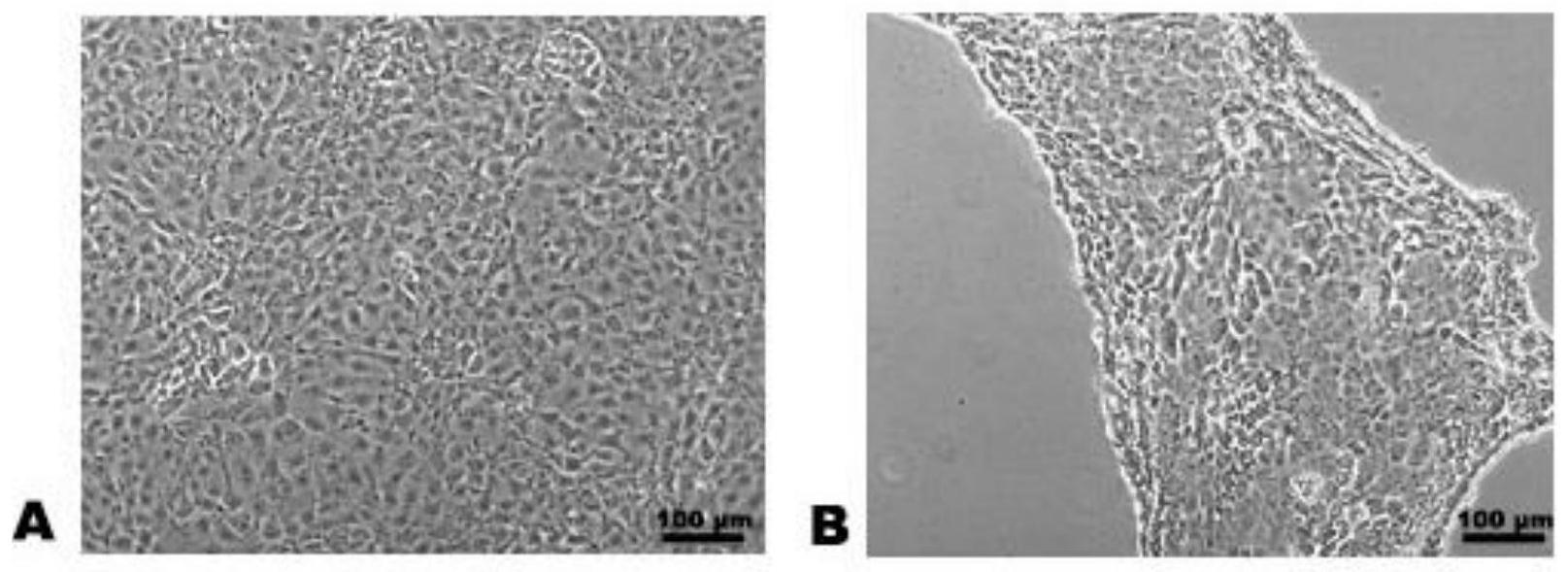
27632,y
‑
27632的终浓度为10μmol/l,从孔中吸出添加有y
‑
27632的ips细胞培养基,用1mld
‑
pbs轻轻洗涤,丢弃,每孔加入胶原酶iv消化ips细胞,在37℃孵育45分钟,轻轻地用刮板刮取ips细胞以获得单层细胞,将单层细胞转移至15ml离心管中,该离心管中含有2ml权利要求2的诱导培养基(含有浓度为10μmol/l的y
‑
27632),用含有
浓度为10μmol/l的y
‑
27632的诱导培养基冲洗孔并将冲洗液加入离心管中,静置3分钟,吸走诱导培养基,吹打单层细胞,使其具有多个大小均一单层形态,将细胞重悬于含有浓度为10μmol/l的y
‑
27632的诱导培养基中,将细胞悬液置于6孔超低吸附培养板中,37℃培养24小时,在第2、4天,用含有浓度为10μmol/l的y
‑
27632的诱导培养基进行培养基更换。
22.进一步地,阶段3具体方法如下:从孔中吸出诱导培养基,15℃预热权利要求2的诱导培养基,加入浓度为10μmol/l的y
‑
27632,将1ml 0.1%明胶包被于6孔板,用含有浓度为10μmol/l的y
‑
27632的诱导培养基进行培养基更换,将细胞按1:3铺板到已包被明胶的6孔板上,37℃培养24小时,每隔两天用含有浓度为10μmol/l的y
‑
27632的诱导培养基进行培养基更换。
23.进一步地,阶段4具体方法如下:吸出诱导培养基,配制并室温预热权利要求1的诱导培养基,在诱导培养基中添加浓度为10μmol/l的y
‑
27632,用1mld
‑
pbs洗涤孔,丢弃洗涤,加入细胞消化液以消化imsc,在37℃孵育4分钟,轻轻地上下吹打以获得细胞悬浮液,将细胞悬浮液转移至含有诱导培养基的15ml离心管,用权利要求1的诱导培养基冲洗孔并将冲洗液加入离心管中,300g离心细胞5分钟,将细胞重悬于含有浓度为10μmol/l的y
‑
27632的诱导培养基中,将细胞按1:10铺板到已包被人工基质胶的6孔板上,细胞汇合度到达80%左右即可进行传代,每次传代细胞铺板密度为1:3传代。
24.本发明提供的诱导培养基和诱导方法具有以下技术效果:本发明提供的诱导培养基能够使诱导多能干细胞先形成拟胚体(eb),再向eb团块外生长,形成间充质干细胞形态,使诱导多能干细胞无限扩展,并在20天之内轻松转换为诱导多能干细胞来源的间充质干细胞。
附图说明
25.图1a为对照例1的细胞接种于人工基质胶包被6孔板中,传代后,用显微镜观察到的细胞形态图,放大倍数为10倍;
26.图1b为对照例1的细胞接种于未铺胶6孔板中,传代后,用显微镜观察到的第1代细胞形态图,放大倍数为10倍;
27.图2a为对照例2的细胞传代后第一代,用显微镜观察的细胞形态图;图2b为对照例2的细胞传代后第二代,用显微镜观察的细胞形态图,图2a的放大倍数为10倍,图2b的放大倍数为40倍;
28.图3为对照例3的细胞传代第15天后用显微镜观察的细胞形态图,图3的放大倍数为10倍;
29.图4为本发明的诱导流程框架图;
30.图5诱导人多功能诱导干细胞向间充质干细胞分化的集落形成和细胞形态图,图5的放大倍数为10倍;
31.图6对分化21天人来源诱导多功能干细胞源间充质干细胞进行cd29、cd44、cd105和cd45的免疫荧光图;
32.图7(abc)采用rt
‑
pcr相对定量检测人来源诱导多功能干细胞、人来源诱导多功能干细胞源间充质干细胞、人来源间充质干细胞的mrna表达图;
33.图8为人来源间充质干细胞和人来源诱导多功能干细胞源间充质干细胞细胞形态
的图,图8的放大倍数为10倍;
34.图9间充质干细胞和人来源诱导多功能干细胞源间充质干细胞三系分化,图9的放大倍数为40倍。
具体实施方式
35.为使本发明实施方式的目的、技术方案和优点更加清楚,下面将对本发明实施方式中的技术方案进行清楚、完整地描述。本实例采用的培养基及补充剂均为可以通过市售购买获得的常规产品。
36.实施例1
37.本实施例提供了一种人来源诱导多功能干细胞分化成间充质干细胞的诱导培养基,该诱导培养基包括基础培养基与添加于基础培养基中的血清和添加剂,血清为含量为10%的小牛血清,所述添加剂包括以下含量的组分:10%的无血清替代物、20ng/ml的碱性成纤维细胞生长因子、50μg/ml抗坏血酸、1%1x胰岛素转铁蛋白硒、4.5mm硫代甘油和1%非必需氨基酸。
38.实施例2
39.本实施例提供了一种人来源诱导多功能干细胞分化成间充质干细胞的诱导培养基,该诱导培养基包括基础培养基与添加于基础培养基中的血清和添加剂,血清为含量为10%的小牛血清,添加剂包括以下含量的组分:10%的无血清替代物、20ng/ml的表皮生长因子、20ng/ml的重组人碱性成纤维细胞生长因子、50μg/ml抗坏血酸、1%1x胰岛素转铁蛋白硒、4.5mm硫代甘油和1%非必需氨基酸。
40.实施例3
41.本实施例提供了一种诱导人来源诱导多功能干细胞分化成间充质干细胞的诱导方法,由图4所示,阐述了人诱导多能干细胞向间充质干细胞分化的流程框架图;
42.实验相关培养基及试剂如下:诱导多能干细胞(ips细胞),(细胞来源于实验室体系诱导的ips细胞),实验相关培养基及试剂:ips细胞培养基stemmacs ips
‑
brew xf,human(stemcel l,order no.130
‑
104
‑
368)、胰酶替代物stemmacs
tm
passaging solution xf(stemcell,order no.130
‑
104
‑
688)、人工基质胶(matrigel,bd,cat#356243),胰酶替代物(stemmacs
tm
passaging solution xf),d
‑
pbs(gibco,cat#14190250),胶原酶iv(gibco,cat#17104019),无血清替代物(gibco,cat#10828028),小牛血清(hyclone),表皮生长因子(invtrogen,cat#bms320),重组人碱性成纤维细胞生长因子(gibco,cat#phg0263),ascorbic acid(sigma cat#a7506),1x胰岛素转铁蛋白硒(its,cat#41400
‑
045),硫代甘油(mtg,sigma cat#m6145),mem neea(mem非必需氨基酸,gibco,cat#11140050)),明胶(stemcell,cat#07903),y
‑
27632(sigma,cat#y0503),细胞消化液(accutase invitrogen tm,cat#00
‑
4555
‑
56));人来源间充质干细胞(cyagen,cat#huxma
‑
01001)。
43.实施例3中的第
‑
x天,指的是x天前,以阶段2的开始时间为第0天,如阶段1中的
‑
14天,指的是阶段2试验开始前14天,阶段3的第5天,指的是阶段2试验开始后的第5天;本实施例中所述的室温为10
‑
25℃之间;
44.人来源诱导多功能干细胞分化成间充质干细胞的诱导方法包括以下步骤:
45.阶段1:培养人来源诱导多功能干细胞,具体方法如下:
46.第
‑
14天在15℃条件下,预热足量的ips细胞培养基,在ips细胞培养基中添加y
‑
27632以促进ips细胞贴壁,y
‑
27632的终浓度为10μmol/l,用1ml人工基质胶包被6孔板,解冻ips细胞移入6孔板,每孔1个克隆,每孔加入2ml的ips细胞培养基培养ips细胞,每天更换培养基,第
‑
4天,用1ml的d
‑
pbs缓冲液洗涤孔,去除洗涤液,每孔加入1ml胰酶替代物以消化培养好的ips细胞,在37℃孵育3~5分钟,吸走胰酶替代物,加入1ml添加有y
‑
27632的ips细胞培养基,轻轻地上下吹打以获得细胞悬浮液,在15℃条件下,预热足量的ips细胞培养基,ips细胞培养基中添加y
‑
27632以促进ips细胞贴壁,y
‑
27632的终浓度为10μmol/l,将1ml人工基质胶包被于6孔板,将细胞铺板到已包被人工基质胶的6孔板上,1:10
‑
1:12传代,在37℃培养24小时,在第
‑
3天至第
‑
1天,从孔中吸出添加有y
‑
27632的培养基并用2ml新鲜的添加有y
‑
27632的ips细胞培养基(ips细胞培养基使用前用室温预热)替换。在37℃培养24小时;
47.阶段2:在第0天,将实施例2的诱导培养基在15℃条件下预热半小时,添加y
‑
27632以促进拟胚体(eb)细胞形态形成,y
‑
27632的终浓度为10μmol/l,从孔中吸出添加有y
‑
27632的ips细胞培养基,用1mld
‑
pbs(轻轻洗涤,丢弃,每孔加入1ml浓度为2mg/ml的胶原酶iv消化ips细胞,在37℃孵育45分钟,轻轻地用刮板刮取ips细胞以获得单层细胞,将单层细胞转移至15ml离心管中,该离心管中含有2ml实施例2的诱导培养基(含有浓度为10μmol/l的y
‑
27632),用2ml实施例2(含有浓度为10μmol/l的y
‑
27632)的诱导培养基冲洗孔并将冲洗液加入离心管中,静置3分钟,吸走实施例2(含有浓度为10μmol/l的y
‑
27632)的诱导培养基,吹打单层细胞,使其具有多个大小均一单层形态,将细胞重悬于2ml实施例2(含有浓度为10μmol/l的y
‑
27632)的诱导培养基中,将细胞悬液置于6孔超低吸附培养板中,37℃培养24小时,在第2、4天,用2ml实施例2(含有浓度为10μmol/l的y
‑
27632)的诱导培养基进行培养基更换;
48.阶段3:在第5天,从孔中吸出实施例2的诱导培养基,15℃预热实施例2(含有浓度为10μmol/l的y
‑
27632)的诱导培养基,提前2h将1ml 0.1%明胶包被于6孔板,用2ml实施例2(含有浓度为10μmol/l的y
‑
27632)的诱导培养基进行培养基更换,将细胞按1:3铺板到已包被明胶的6孔板上,37℃培养24小时,在第7、9、11天用2ml实施例2(含有浓度为10μmol/l的y
‑
27632)的诱导培养基进行培养基更换;
49.阶段4:在第12天,吸出实施例2(含有浓度为10μmol/l的y
‑
27632)的诱导培养基,配制并室温预热实施例1的诱导培养基,用1mld
‑
pbs缓冲液洗涤孔,丢弃用于洗涤孔的d
‑
pbs缓冲液,加入1ml细胞消化液以消化imsc,在37℃孵育4分钟,轻轻地上下吹打以获得细胞悬浮液,将细胞悬浮液转移至含有2ml实施例1的诱导培养基15ml离心管,用2ml实施例1的诱导培养基冲洗孔并将冲洗液加入离心管中,300g离心细胞5分钟,将细胞重悬于2ml实施例1的诱导培养基中,将细胞按1:10铺板到已包被人工基质胶的6孔板上,细胞汇合度到达80%左右即可进行传代,每次传代细胞铺板密度为1:3传代;
50.在经过3次阶段4的传代(从开始诱导到结束约12天)即获得成熟的间充质干细胞;
51.人来源诱导多功能干细胞来源如下:
52.实验相关培养基及试剂:stemrna第三代重编程试剂盒(cat#00
‑
0076)nutristem培养基(cat#01
‑
0005);
53.使用stemrna第三代重编程试剂盒诱导人来源间充质干细胞重编程为ips细胞,第0天:将间充质干细胞在间充质干细胞培养基培养,第1天:将培养基换成nutristem培养基,第1
‑
4天每天进行nm
‑
rna cocktail隔夜转染,第10
‑
14天选择原代间充质干细胞来源ips细胞菌落。
54.对照例1
55.对照例1提供了一种利用间充质干细胞培养基诱导人来源诱导多功能干细胞分化成间充质干细胞的诱导方法,其中,间充质干细胞培养基为dmem
‑
ham’s f
‑
12,培养基购自thermo scientific公司,使用时在间充质干细胞培养基中添加含量为20%的无血清替代物和含量为10μm的sb431542(sb)(厂家为selleck,cat#s1067);
56.阶段1:培养人来源诱导多功能干细胞,具体培养方法与实施例3相同;
57.阶段2:取人来源诱导多功能干细胞,接种于人工基质胶包被的6孔板中,每孔添加2ml间充质干细胞培养基(含无血清替代物和sb),每天更换间充质干细胞培养基,维持到第10天;
58.阶段3:于第10天,分别将细胞接种于包被人工基质胶的6孔板和未铺胶6孔板内,用显微镜观察细胞形态,试验结果见图1a和1b;
59.由图1a和1b可知,用对照例1的方法得到的细胞并未出现间充质干细胞形态。
60.对照例2
61.对照例2提供了一种利用间充质干细胞培养基诱导人来源诱导多功能干细胞分化成间充质干细胞的诱导方法,其中,间充质干细胞培养基为dmem
‑
ham’s f
‑
12,培养基购自thermo scientific公司,使用时在间充质干细胞培养基内添加含量为10%的小牛血清;
62.阶段1:培养人来源诱导多功能干细胞,具体步骤与实施例3相同;
63.阶段2:取所述人来源诱导多功能干细胞,接种于6孔板中,每孔添加2ml所述间充质的培养基(添加有小牛血清),每天更换间充质干细胞培养基;
64.待细胞于80%汇合时,将细胞传代,用显微镜观察细胞形态;结果见图2a和图2b;
65.由图2a和图2b可知,用对照例2的方法虽然细胞在传代后第1代出现间充质干细胞形态,但在传代后第2代细胞迅速衰老。
66.对照例3
67.对照例3提供了一种利用间充质干细胞培养基诱导人来源多功能干细胞分化成间充质干细胞的诱导方法,间充质干细胞培养基为dmem
‑
ham’s f
‑
12,培养基购自thermo scientific公司,使用时在间充质干细胞培养基内添加含量为10%的小牛血清和含量为20ng/ml的碱性成纤维细胞生长因子;
68.阶段1:培养人来源诱导多功能干细胞,具体步骤与实施例3相同;
69.阶段2:取所述人来源诱导多功能干细胞,接种于6孔板中,每孔添加2ml间充质干细胞培养基(添加有小牛血清和碱性成纤维细胞生长因子),每天更换间充质干细胞培养基;待细胞于80%汇合时,将细胞传代;在传代第15天用显微镜观察细胞形态,结果见图3;
70.由图3可知,用对照例3的方法虽然细胞在传代后可出现间充质干细胞形态,但在传代后第15天细胞仍未出现汇合现象。
71.试验例1
72.分别取实施例3中阶段1第14天、阶段2第2天、阶段3第1天、阶段4第1天、阶段4第5
天和阶段4第7天的细胞放置于显微镜下观察,试验结果见图5;
73.由图5所示的集落形成和细胞形态图可知,阶段1第14天的细胞边缘光滑,为ips细胞,阶段2第2天的细胞呈拟胚体形态,阶段3第1天,细胞从拟胚体内向外生长,阶段4第1天的细胞已转化为ips来源间充质干细胞,阶段4第5天的细胞为ips来源间充质干细胞继续生长后的状态,阶段4第7天的ips来源间充质干细胞达到70%汇聚的状态。
74.试验例2基因表达的确认
75.使用免疫荧光和rt
‑
pcr相对定量检测法对分化21天人来源诱导多功能干细胞源间充质干细胞的表面标志物和诱导多能干细胞mrna含量进行了研究。
76.免疫荧光实验相关试剂:4%多聚甲醛固定液/pfa固定液(roth,cat#p087),triton x
‑
100(panreac applichem,a4975),牛血清蛋白(sigma
‑
aldrich,cat#a7906
‑
100g),间充质干细胞细胞标记物抗体组(abcam,cat#ab93758),山羊抗小鼠igg h&l(alexa488)(life technologies,cat#a11001),山羊抗兔igg(h+l),第二抗体(invitrogen,cat#a10520);
77.免疫荧光测定方法如下:
78.室温下用4%多聚甲醛(pfa)固定人来源诱导多功能干细胞源间充质干细胞10分钟,吸走4%多聚甲醛pfa,用0.1%的triton x
‑
100使细胞通透10分钟,非特异性抗体结合为用封闭缓冲液(bsa 5g,pbs 100ml)在室温下封闭60分钟,用相应的第一抗体cd29、cd44、cd105、cd29孵育细胞,在黑暗环境中4℃过夜,第2天,将第一抗体吸走,用pbs洗涤细胞3次,用相应的第二抗体(山羊抗小鼠igg h&l、山羊抗兔igg(h+l))在15℃黑暗环境下孵育60分钟,应用荧光显微镜进行拍照。
79.由图6可知,cd29、cd44、cd105在人来源诱导多功能干细胞源间充质干细胞中高表达;不表达cd45,通过免疫荧光染色可以看出通过上述方法分化的间充质干细胞cd29、cd44、cd105阳性,cd45阴性,证明间充质干细胞分化成功。
80.rt
‑
pcr相对定量检测实验相关试剂:maxwell 16mirna提纯试剂盒(promega,cat#as1470),trizol(invi trogen,usa),superscript
tm ii逆转录酶试剂盒(thermo fisher,cat#18064022),sybr green pcr master mix(life technologies,usa);
81.rt
‑
pcr相对定量检测实验步骤将间充质干细胞离心收集下层细胞沉淀,利用maxwell 16mirna提纯试剂盒说明书提取不同处理组总rna,根据superscript
tm ii逆转录酶试剂盒说明书,将100ng rna用superscripttm ii反转录试剂盒反转录为cdna,最后用sybr green pcr master mix和cdna及引物混合,进行rt
‑
pcr检测,人gadph基因为管家基因,rna的相对表达将根据2
‑
δδcq
方程确定,结果如图7所示。
82.由图7可知,oct4、sox2、nanog mrna在人诱导多能干细胞中表达含量较高,在间充质干细胞和人诱导多能干细胞源间充质干细胞中表达相对较低。
83.以上结果均说明人诱导多能干细胞源间充质干细胞有着失去了诱导多能干细胞特点并与间充质干细胞有着一致性。
84.试验例3
85.通过显微镜观察人来源间充质干细胞(cyagen,cat#huxma
‑
01001)和实施例3制备的人来源诱导多功能干细胞源间充质干细胞,结果如图8所示。
86.由图8可知,从细胞外观形态观察,人来源诱导多功能干细胞源间充质干细胞和人
来源间充质干细胞外观形态相似。
87.试验例4
88.人来源间充质干细胞和实施例3制备的人来源诱导多功能干细胞源间充质干细胞进行三系分化试验,实验结果见图9。
89.三系分化实验步骤如下:
90.成脂分化实验相关培养基及试剂:stempro
tm
成脂分化诱导试剂盒(gibco cat#a1007001),油红o(sigma
‑
aldrich cat#o0625),4%多聚甲醛固定液/pfa固定液(roth,cat#p087)。
91.成脂分化染色:在应用stempro
tm
脂肪分化诱导试剂盒诱导14d后进行油红o染色检测脂滴的存在,吸取培养基后,轻轻用37℃预热的pbs清洗细胞三次,并在15℃下用4%pfa固定5
‑
10分钟,油红o染色液是将油红o原液用溶剂溶解而成,与蒸馏水的比例为3:2,用蒸馏水冲洗后,在黑暗中用油红染色液覆盖细胞20分钟,然后去除染料,用蒸馏水清洗细胞三次,照片是用显微镜40倍镜头拍摄。
92.成骨分化实验相关培养基及试剂:stempro
tm
成骨分化诱导试剂盒(gibco cat#a1007201),5
‑
溴
‑4‑
氯
‑3‑
吲哚基
‑
磷酸盐/氯化硝基四氮唑蓝bcip/nbt片(sigma
‑
aldrich cat#b6404),tween 20(sigma
‑
aldrich cat#p9416),4%多聚甲醛固定液/pfa固定液(roth,cat#p087)。
93.成骨分化染色:碱性磷酸酶(alp)的活化是骨细胞鉴定的一个有价值的指标,在应用成骨诱导分化试剂盒培养间充质干细胞第21天,用碱性磷酸酶染色法鉴定骨细胞,吸出培养基后,用37℃预热的pbs轻轻清洗细胞三次,15℃下用4%pfa固定2分钟,用碱性磷酸盐洗涤液(tween 20 0.5ml,pbs 10ml)洗涤后,细胞与碱性磷酸酶染液(bcip/nbt片,10ml蒸馏水)在黑暗中15℃条件下孵育10分钟,每2
‑
3分钟检查一次染色过程,当观察到颜色变化时吸取染料,用蒸馏水冲洗细胞3次,用显微镜和40x镜头对细胞进行拍照。
94.成软骨分化实验相关培养基及试剂:stempro
tm
成软骨分化诱导试剂盒(gibco cat#a1007101),stempro
tm
成软骨分化添加剂(gibco cat#a10064
‑
01),阿尔新蓝(sigma
‑
aldrich,cat#a3157
‑
10g),乙酸(sigma
‑
aldrich,cat#a6283),4%多聚甲醛固定液/pfa固定液(roth,cat#p087)。
95.成软骨分化染色:间充质干细胞在成软骨分化培养基中诱导分化21天,吸走培养基,用37℃预热的pbs轻轻清洗细胞三次,15℃下用4%pfa固定1小时,用蒸馏水冲洗后,在黑暗环境用2ml阿尔新蓝染色液(阿尔新蓝1g,乙酸3ml,蒸馏水100ml,混合后调整ph到2.5)覆盖细胞90分钟,然后去除染色液,用2ml阿尔新蓝洗涤缓冲液(乙酸3ml,蒸馏水100ml)覆盖细胞10分钟,重复洗涤步骤后,对细胞进行洗涤用蒸馏水风干,使用显微镜拍摄具有代表性的照片。
96.由图9可知,人诱导多能干细胞来源的间充质干细胞可成脂、成骨、成软骨分化,有着跟间充质干细胞一样的三系分化潜能。
97.综上,仅为本发明之较佳实施例,不以此限定本发明的保护范围,凡依本发明专利范围及说明书内容所作的等效变化与修饰,皆为本发明专利涵盖的范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1