一种来源于冬生多孔菌的漆酶及其应用
1.本发明属于微生物技术领域,具体涉及一种来源于冬生多孔菌的漆酶及其应用。
背景技术:
2.漆酶(laccase,苯二醇∶氧氧化还原酶,ec 1.10.3.2)是一种含铜的多酚氧化酶,属于蓝色多铜氧化酶(mcos)家族,广泛分布在植物、真菌、少数细菌和昆虫中。漆酶能催化单酚、多酚、苯胺、多环芳香烃等化合物,因而在食品、造纸、纺织、绿色合成、生物电池、胶合板无甲醛粘接以及有机污染物处理等领域展现了重要的应用价值。漆酶是最具有应用前景的氧化还原酶之一。
3.诸多产品和设备的表面需要涂覆涂层以实现装饰、保护或赋予新的功能,对产品和设备的安全、使用效能和寿命至关重要。聚合物涂层是国民经济建设和国防安全非常重要的功能材料,聚合物是涂层的成膜物。材料表面的功能化在诸多领域具有非常重要的应用,聚合物涂层是改变材料表面性能,实现材料表面功能化的手段之一。以简单方法制备复杂材料及纳米涂层材料的设计与合成均是涂层材料研究与开发的热点,新型界面材料的创制及其制备方法与应用也是国际科技竞争的热点。
技术实现要素:
4.本发明的目的在于提供一种来源于冬生多孔菌(polyporus brumalis)的真菌漆酶在催化成膜单体聚合于不同界面生成有机共聚物膜中的应用。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.第一方面,本发明提供一种真菌漆酶,由菌株保藏编号为cctcc no:m 2020809的冬生多孔菌(polyporus brumalis)通过液态发酵法制得,所述真菌漆酶的氨基酸序列如下(1)或(2):
7.(1)酶蛋白的氨基酸序列如seq id no:1所示;
8.(2)在(1)限定的氨基酸序列的基础上氨基酸序列经过一个或者几个氨基酸取代、缺失或添加,且具有漆酶活性的氨基酸序列。
9.上述真菌漆酶的制备方法如下:
10.(1)液体种子培养:取冬生多孔菌(polyporus brumalis)菌株cctcc no:m 2020809斜面菌苔约3cm2接种至500ml三角瓶,每瓶装液体种子培养基150~200ml,25~35℃摇床中,150~200rpm培养3~5天,制备种子液;
11.(2)摇瓶发酵培养:将种子液按体积比为6%~12%的接种量接种至发酵培养基,所述发酵培养基是在500ml三角瓶中的装液量为125~175ml,在25~35℃振荡培养,发酵第1~3天摇床转速为100~150rpm,发酵3天后的摇床转速为160~200rpm,培养11~14天,得到发酵液;
12.漆酶累积于细胞外的发酵液中,无需破碎细胞即可从发酵液中收集或分离、纯化漆酶;
13.(3)粗酶液的制备:发酵液于4℃10000
×
g离心10min,上清液即为漆酶的粗酶液。
14.优选地,液体种子培养基是:玉米粉25~35g/l,豆饼粉10~20g/l,α-淀粉酶30~65u/l,nah2po
4 2~4g/l,kcl 0.8~2g/l,mgso4·
7h2o 1~2g/l,其余为水,ph 5.7~6.5,0.1mpa灭菌25min。
15.优选地,所述发酵培养基具体由下列物质组成:果糖40~50g/l,玉米粉10~15g/l,大豆蛋白胨5.4~10.8g/l,(nh4)2so
4 0~2g/l,kcl 0.8~1.3g/l,nah2po
4 1.5~2g/l,mgso4·
7h2o 0.25~1g/l,cuso4·
5h2o 0.5~1.5mmol/l,vb
1 0.02~0.03g/l,吐温-80 0.3~0.7g/l,香兰素0.4~1.3mmol/l,其余为水,ph 5.7~6.5,0.1mpa灭菌25min。
16.第二方面,本发明提供上述真菌漆酶在催化二类成膜单体于不同界面聚合自组装生成有机共聚物膜中的应用,其特征在于,所述成膜单体一类是含有酚羟基的有机化合物,另一类成膜单体是含有至少两个氨基的有机化合物。
17.优选地,所述成膜单体一类是含有至少两个酚羟基的有机化合物,另一类成膜单体是含有至少两个氨基的有机化合物;或者所述成膜单体一类是含有至少一个酚羟基和一个羧基的有机化合物,另一类成膜单体是含有至少两个氨基的芳胺类有机化合物。
18.优选地,所述界面为气-液界面、液-液界面、固-液界面。
19.本发明的有益效果
20.本发明利用保藏编号cctcc no:m 2020809的冬生多孔菌(polyporus brumalis)通过液态发酵法生产的漆酶可应用于催化含有酚羟基的有机化合物和含有至少两个氨基的有机化合物二类成膜单体于不同界面聚合自组装生成有机共聚物膜,例如催化阿魏酸和对苯二胺在固体材料表面聚合自组装生成附着力极强的有机共聚物膜;催化鸢尾黄素和聚乙烯亚胺(pei)在固体材料表面聚合自组装生成附着力极强的有机共聚物膜,这些共聚物膜属于新型功能高分子材料。这些共聚物膜对固体材料的附着是耐水的,这些共聚物膜对酸、碱、有机溶剂、热的耐受性好,为开发新型功能共聚物黏附层在多个领域的应用提供了环境耐受性的可行性。
21.该有机共聚物膜可以通过二次反应,将功能层引入膜的表面,达到基材表面功能化修饰之目的,实现材料表面的可设计性。本发明来源于冬生多孔菌的漆酶易于实现工业化制备,成本较低,不会形成毫无用处的酶-底物复合物,水是唯一的副产物;对介质中金属离子的敏感性不高;氧化剂可以用分子氧,因而不需要在反应中加入过氧化氢。
22.术语定义及解释
23.除非另有说明,本技术说明书和权利要求书中记载的基团和术语定义,包括其作为实例的定义、示例性的定义、优选的定义、表格中记载的定义、实施例中具体化合物的定义等,可以彼此之间任意组合和结合。
24.术语“成膜单体”是指通过聚合反应而成为共聚物膜的有机化合物分子或分子团。
25.术语“液-液界面”是指在水相和与水相互不相溶的液相之间的界面。
26.术语“自组装膜”是活性分子通过化学键自发吸附在异相界面上而形成的一种有序超分子体系。
27.除非另外定义或由背景清楚指示,否则在本公开中的全部技术与科学术语具有如本公开所属领域的普通技术人员通常理解的相同含义。
0.5g/l,香兰素1mmol/l,其余为水,ph 6.5,0.1mpa灭菌25min。
44.(2)液体种子培养:取冬生多孔菌(polyporus brumalis)cctcc no:m 2020809的斜面菌苔约3cm2接种至500ml三角瓶,每瓶装液体种子培养基150ml,30℃摇床,150rpm培养4天,得到种子液。
45.摇瓶发酵培养:将种子液按体积比为6%的接种量接种至发酵培养基,所述发酵培养基在500ml三角瓶中的装液量为150ml,在30℃振荡培养,发酵第1~3天摇床转速为150rpm,发酵3天后的摇床转速为200rpm,发酵培养13天得到发酵液。发酵液中的漆酶含量为982u/ml。
46.(3)粗酶液的制备:发酵液于4℃10000
×
g离心10min,上清液为漆酶的粗酶液。
47.(4)漆酶的分离纯化:
48.取100ml漆酶的粗酶液边搅拌边分阶段地缓慢加入硫酸铵,使硫酸铵溶液的浓度逐级达到60%,待充分沉淀后,于4℃12000
×
g离心10min,收集沉淀,溶于适量体积的ph 7.0,0.02mol/l柠檬酸-磷酸氢二钠缓冲液中,得到盐析液。将盐析液置于相同的缓冲液中透析过夜,每隔10h更换透析液,直至透析袋内外液体的电导率及ph相同,得到漆酶的透析液。
49.用ph 7.0,0.02mol/l的柠檬酸-磷酸氢二钠缓冲液(a液)平衡装填deae-sepharose fast flow离子交换介质的层析柱。将透析得到的酶液用孔径0.22μm的滤膜过滤后,以2ml/min流速上样,上样量为10ml。上样后,先用a液平衡至基线归零,再分别用含nacl 0~0.5mol/l的柠檬酸-磷酸氢二钠缓冲液(b液)进行连续梯度洗脱,流速为1ml/min,记录波长280nm处的吸光度,收集有活性的组分备用,每管收集2ml。对收集的样品进行漆酶活性和蛋白浓度测定,将具有漆酶活性的洗脱液合并,即为层析柱纯化的漆酶(在本发明中称之为纯酶液),置于-20℃保存备用。上述分离纯化各步骤的结果见表1,其中的比酶活(specific activity)是指每毫克酶蛋白所含的酶活力单位。
50.表1各步分离纯化的结果
51.步骤总酶活(u)总蛋白(mg)比酶活(u/mg)纯化倍数回收率(%)发酵液25168////粗酶液2516827.61911.451.00100.00盐析液1685714.881132.911.2466.98透析液1678814.841131.551.2466.71纯酶液1586712.151305.961.4363.04
52.实施例2.漆酶的酶学性质分析
53.(1)最适温度
54.分别在30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃及70℃,分别以abts、愈创木酚、邻甲联苯胺、dmp、丁香醛连氮、邻苯二酚和对苯二胺为底物,测定实施例4制备的纯酶液中漆酶的活性,酶活最高的温度即为漆酶催化该底物的最适温度,结果见表2。
55.(2)最适ph
56.于55℃,分别以abts、愈创木酚、邻甲联苯胺、dmp、丁香醛连氮、邻苯二酚和对苯二胺为底物,测定在ph为2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5及7.0时的漆酶活性,酶活最高的ph即为漆酶催化该底物的最适ph,结果见表2。
57.表2漆酶对不同底物的最适温度和最适ph
58.底物最适温度(℃)最适phabts553愈创木酚555邻联甲苯胺555dmp554丁香醛连氮556邻苯二酚555对苯二胺554
59.实施例3.漆酶的氨基酸序列
60.本发明实施例1制备的漆酶的氨基酸序列如seq id no:1所示(委托苏州金唯智生物科技有限公司测序所得)。该漆酶序列与ncbi数据库中相关序列的同源性为97%。
61.实施例4.漆酶催化制备共聚物膜(气-液界面膜)
62.(1)以漆酶催化制备阿魏酸-对苯二胺共聚物膜:
63.将0.25g阿魏酸、0.25g对苯二胺溶于125ml 0.05mol/l磷酸三钠-磷酸缓冲溶液(ph 3.0),加入7.5u本发明制备的漆酶,振荡混匀,于50℃烘箱(智城,zfd-5090,中国)中静置13h,溶液的上表面(空气与溶液的界面)形成“阿魏酸-对苯二胺共聚物膜”。
64.红外光谱分析:成膜单体阿魏酸和对苯二胺采用kbr压片法(约2mg样品与300mg kbr混合),在红外光谱仪(bio-rad,fts-6000,美国)上进行检测分析。将清洗后的气-液界面膜置于kbr晶片上,室温晾干,在红外光谱仪(bio-rad,fts-6000,美国)上进行检测分析。
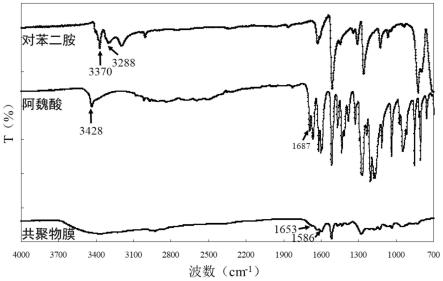
65.成膜单体阿魏酸、对苯二胺和本实施例制备的气-液界面膜(阿魏酸-对苯二胺共聚物膜)的红外光谱,见图1。
66.在图1中,-oh和-nh的伸缩振动峰在3200~3500cm-1
之间,与单体对苯二胺和阿魏酸的图谱对比,共聚物膜的图谱中此处变宽,说明阿魏酸结构中羟基的变化和对苯二胺结构中部分伯胺向仲胺的转变,表明迈克尔加成反应的存在及酰胺键的形成。在1653cm-1
处出现了代表c=n伸缩振动峰,说明了阿魏酸的酚羟基与对苯二胺的氨基之间形成席夫碱键。而且,在单体阿魏酸的图谱中,1687cm-1
处出现了羧基的特征吸收峰,气-液界面膜的图谱中,此峰显著减弱,而在1586cm-1
处出现了酰胺的特征吸收带,表明羧基与氨基反应形成了酰胺键。光谱中这些吸收峰的变化表明在漆酶催化氧化的作用下,阿魏酸与对苯二胺间形成了席夫碱键、酰胺键,并通过迈克尔加成反应进行共价交联,形成共聚物膜。
67.(2)以漆酶催化制备柯因-精氨酸共聚物膜:
68.将0.050g柯因、0.050g精氨酸、5.0mg香兰素溶于35ml 0.05mol/l琥珀酸钠-琥珀酸缓冲溶液(ph 2.0)和15ml丙酮的混合溶剂中,加入7.5u本发明制备的漆酶,充分混匀,于30℃培养箱(智城,zsd-1090,中国)中静置反应3h,溶液的上表面生成“柯因-精氨酸共聚物膜”。
69.将该膜转移到盖玻片上的过程:用注射器将膜下的溶液吸出,重新注入蒸馏水,重复吸液-注液-吸液操作多次;将盖玻片插入膜下的液相中,小心移至膜的下方将膜轻轻捞起,使膜平展地铺在盖玻片上,室温晾干。
70.(3)以漆酶催化制备鸢尾黄素-pei共聚物膜:
71.将0.250g鸢尾黄素、0.250g pei、12.5mg abts溶于175ml 0.05mol/l邻苯二甲酸氢钾-氢氧化钠缓冲溶液(ph 5.0)和75ml乙醇的混合溶剂中,加入50u本发明制备的漆酶,混匀,于60℃烘箱(智城,zfd-5090,中国)中静置反应8h,溶液的上表面生成“鸢尾黄素-pei共聚物膜”。
[0072]“鸢尾黄素-pei共聚物膜”的转移方法:缓慢地排出底部的液体,使膜落在位于容器底部的基片表面。
[0073]
(4)以漆酶催化制备大黄酸-2,4-二氨基-6-甲基-1,3,5-三嗪共聚物膜:
[0074]
将0.125g大黄酸、0.125g 2,4-二氨基-6-甲基-1,3,5-三嗪、20mg丁香醛溶于175ml 0.05mol/l醋酸钠-醋酸缓冲溶液(ph 4.0)和75ml甲醇的混合溶剂中,加入5u本发明制备的漆酶,混匀,于50℃烘箱(智城,zfd-5090,中国)中静置反应10h,溶液的上表面形成“大黄酸-2,4-二氨基-6-甲基-1,3,5-三嗪共聚物膜”。
[0075]
(5)以漆酶催化制备对羟基苯甲酸-2-氟-对苯二胺共聚物膜:
[0076]
将0.125g对羟基苯甲酸、0.250g 2-氟-对苯二胺溶于125ml蒸馏水中,磷酸调ph为6.0,加入0.125u本发明制备的漆酶,混匀,于40℃烘箱(智城,zfd-5090,中国)中静置反应48h。溶液的上表面形成“对羟基苯甲酸-2-氟-对苯二胺共聚物膜”。
[0077]
(6)以漆酶催化制备1,6-二羟基萘-二乙烯三胺共聚物膜:
[0078]
将0.125g 1,6-二羟基萘、0.250g二乙烯三胺、25mg丁香醛溶于200ml 0.05mol/l磷酸氢二钠-柠檬酸缓冲溶液(ph 4.0)和50ml丙酮的混合溶剂中,加入10u本发明制备的漆酶,混匀,于37℃培养箱(智城,zsd-1090,中国)中静置10h,溶液的上表面形成“1,6-二羟基萘-二乙烯三胺共聚物膜”。
[0079]
(7)以漆酶催化制备紫草素-赖氨酸共聚物膜:
[0080]
将0.125g紫草素、0.125g赖氨酸、12.5mg abts溶于175ml 0.05mol/l磷酸氢二钠-柠檬酸缓冲溶液(ph 3.0)和75ml乙醇的混合溶剂中,加入15u本发明制备的漆酶,混匀,于45℃烘箱(智城,zfd-5090,中国)中静置反应5h,溶液的上表面形成“紫草素-赖氨酸共聚物膜”。
[0081]
(8)以漆酶催化制备没食子蓝-2,4,6-三氨基嘧啶共聚物膜:
[0082]
将0.250g没食子蓝、0.250g 2,4,6-三氨基嘧啶溶于250ml 0.05mol/l邻苯二甲酸氢钾-氢氧化钠缓冲溶液(ph 5.0),加入15u本发明制备的漆酶,混匀,于40℃烘箱(智城,zfd-5090,中国)中静置反应10h,溶液的上表面形成“没食子蓝-2,4,6-三氨基嘧啶共聚物膜”。
[0083]
(9)以漆酶催化制备4,4
’‑
二羟基联苯-2,3-二氨基萘共聚物膜:
[0084]
将0.125g 4,4
’‑
二羟基联苯、0.125g 2,3-二氨基萘、15mg abts溶于215ml 0.05mol/l邻苯二甲酸氢钾-氢氧化钠缓冲溶液(ph 5.0)和35ml丙酮的混合溶剂中,加入5u本发明制备的漆酶,于40℃烘箱(智城,zfd-5090,中国)中静置24h,溶液的上表面形成“4,4
’‑
二羟基联苯-2,3-二氨基萘共聚物膜”。
[0085]
(10)以漆酶催化制备双酚a-前黄素共聚物膜:
[0086]
将0.250g双酚a、0.250g前黄素、15mg abts溶于175ml 0.1mol/l磷酸氢二钠-柠檬酸缓冲溶液(ph 4.0)和75ml乙醇的混合溶剂中,加入3u本发明制备的漆酶,混匀,于45℃培养箱(智城,zsd-1090,中国)中静置10h,溶液的上表面形成“双酚a-前黄素共聚物膜”。
[0087]
(11)以漆酶催化制备1,8,9-三羟基蒽-4,4'-二氨基二苯砜共聚物膜:
[0088]
将0.040g 1,8,9-三羟基蒽、0.060g 4,4'-二氨基二苯砜、20mg abts溶于140ml 0.05mol/l磷酸氢二钠-柠檬酸缓冲溶液(ph 5.0)和60ml乙醇的混合溶剂中,加入10u本发明制备的漆酶,混匀,于45℃烘箱(智城,zfd-5090,中国)中静置10h,溶液的上表面形成“1,8,9-三羟基蒽-4,4'-二氨基二苯砜共聚物膜”。
[0089]
(12)以漆酶催化制备香叶木素-1,6-己二胺共聚物膜:
[0090]
将0.025g香叶木素、0.050g 1,6-己二胺溶于225ml 0.05mol/l磷酸三钠-磷酸缓冲溶液(ph 4.0)和25ml二甲基亚砜的混合溶剂中,加入15u本发明制备的漆酶,混匀,于30℃培养箱(智城,zsd-1090,中国)中静置反应5h,溶液的上表面形成“香叶木素-1,6-己二胺共聚物膜”。
[0091]
(13)以漆酶催化制备金松双黄酮-精胺共聚物膜:
[0092]
将0.050g金松双黄酮、0.100g精胺溶于70ml 0.05mol/l磷酸三钠-磷酸缓冲溶液(ph 3.0)和30ml乙醇的混合溶剂中,加入2u本发明制备的漆酶,混匀,于40℃烘箱(智城,zfd-5090,中国)中静置反应6h,溶液的上表面形成“金松双黄酮-精胺共聚物膜”。
[0093]
(14)以漆酶催化制备水仙苷-2,4-二氨基苯甲醚共聚物膜:
[0094]
将0.075g水仙苷、0.125g 2,4-二氨基苯甲醚溶于200ml 0.05mol/l丙二酸钠-丙二酸缓冲溶液(ph 4.0)和50ml乙醇的混合溶剂中,加入5u本发明制备的漆酶,混匀,于10℃培养箱(智城,zsd-1090,中国)中静置反应10h,溶液的上表面形成“水仙苷-2,4-二氨基苯甲醚共聚物膜”。
[0095]
(15)以漆酶催化制备橙皮素-6-羟基-2,4,5-三氨基嘧啶共聚物膜:
[0096]
将0.020g橙皮素、0.020g 6-羟基-2,4,5-三氨基嘧啶溶于140ml 0.05mol/l磷酸三钠-磷酸缓冲溶液(ph 5.0)和60ml乙醇的混合溶剂中,加入10u本发明制备的漆酶,混匀,于55℃烘箱(智城,zfd-5090,中国)中静置反应7h,溶液的上表面形成“橙皮素-6-羟基-2,4,5-三氨基嘧啶共聚物膜”。
[0097]
实施例5.漆酶催化制备共聚物膜(液-液界面膜)
[0098]
(1)以漆酶催化制备柯因-精氨酸共聚物膜:
[0099]
将0.050g柯因、0.050g精氨酸、5.0mg香兰素溶于35ml 0.05mol/l琥珀酸钠-琥珀酸缓冲溶液(ph 2.0)和15ml丙酮的混合溶剂中,加入7.5u本发明制备的漆酶,充分混匀,得到漆酶催化体系(水相)。在水相上覆盖3mm厚的液体石蜡,于30℃培养箱(智城,zsd-1090,中国)中静置3h,液体石蜡和水相的界面处生成“柯因-精氨酸共聚物膜”。“柯因-精氨酸共聚物膜”的转移过程如下:用注射器将“柯因-精氨酸共聚物膜”上侧的大部分液体石蜡及下侧的水相吸出,重新在“柯因-精氨酸共聚物膜”下侧注入蒸馏水,如此重复吸液-注液-吸液操作多次;将盖玻片插入膜下的水相中,小心移至“柯因-精氨酸共聚物膜”的下方将其轻轻捞起,用滤纸吸去膜表面残余的液体石蜡,室温晾干。
[0100]
(2)以漆酶催化制备阿魏酸-对苯二胺共聚物膜:
[0101]
将0.25g阿魏酸、0.25g对苯二胺溶于125ml 0.05mol/l磷酸三钠-磷酸缓冲溶液(ph 3.0),加入7.5u本发明制备的漆酶,充分混匀,得到漆酶催化体系(水相)。在水相上覆盖3mm厚的液体石蜡,于50℃烘箱(智城,zfd-5090,中国)中静置13h,液体石蜡和水相的界面处生成“阿魏酸-对苯二胺共聚物膜”。
[0102]
(3)以漆酶催化制备鸢尾黄素-pei共聚物膜:
[0103]
将0.250g鸢尾黄素、0.250g pei、12.5mg abts溶于175ml 0.05mol/l邻苯二甲酸氢钾-氢氧化钠缓冲溶液(ph 5.0)和75ml乙醇的混合溶剂中,加入50u本发明制备的漆酶,充分混匀,得到漆酶催化体系(水相)。在水相上覆盖3mm厚的液体石蜡,于60℃烘箱(智城,zfd-5090,中国)中静置反应8h,液体石蜡和水相的界面处生成“鸢尾黄素-pei共聚物膜”。
[0104]
(4)以漆酶催化制备大黄酸-2,4-二氨基-6-甲基-1,3,5-三嗪共聚物膜:
[0105]
将0.125g大黄酸、0.125g 2,4-二氨基-6-甲基-1,3,5-三嗪、20mg丁香醛溶于175ml 0.05mol/l醋酸钠-醋酸缓冲溶液(ph 4.0)和75ml甲醇的混合溶剂中,加入5u本发明制备的漆酶,充分混匀,得到漆酶催化体系(水相)。在水相上覆盖3mm厚的液体石蜡,于50℃烘箱(智城,zfd-5090,中国)中静置反应10h,液体石蜡和水相的界面处生成“大黄酸-2,4-二氨基-6-甲基-1,3,5-三嗪共聚物膜”。
[0106]
(5)以漆酶催化制备对羟基苯甲酸-2-氟-对苯二胺共聚物膜:
[0107]
将0.125g对羟基苯甲酸、0.250g 2-氟-对苯二胺溶于125ml蒸馏水中,磷酸调ph为6.0,加入0.125u本发明制备的漆酶,充分混匀,得到漆酶催化体系(水相)。在水相上覆盖3mm厚的液体石蜡,于40℃烘箱(智城,zfd-5090,中国)中静置反应48h。液体石蜡和水相的界面处生成“对羟基苯甲酸-2-氟-对苯二胺共聚物膜”。
[0108]
(6)以漆酶催化制备1,6-二羟基萘-二乙烯三胺共聚物膜:
[0109]
将0.125g 1,6-二羟基萘、0.250g二乙烯三胺、25mg丁香醛溶于200ml 0.05mol/l磷酸氢二钠-柠檬酸缓冲溶液(ph 4.0)和50ml丙酮的混合溶剂中,加入10u本发明制备的漆酶,充分混匀,得到漆酶催化体系(水相)。在水相上覆盖3mm厚的液体石蜡,于37℃培养箱(智城,zsd-1090,中国)中静置10h,液体石蜡和水相的界面处生成“1,6-二羟基萘-二乙烯三胺共聚物膜”。
[0110]
(7)以漆酶催化制备紫草素-赖氨酸共聚物膜:
[0111]
将0.125g紫草素、0.125g赖氨酸、12.5mg abts溶于175ml 0.05mol/l磷酸氢二钠-柠檬酸缓冲溶液(ph 3.0)和75ml乙醇的混合溶剂中,加入15u本发明制备的漆酶,充分混匀,得到漆酶催化体系(水相)。在水相上覆盖3mm厚的液体石蜡,于45℃烘箱(智城,zfd-5090,中国)中静置反应5h,液体石蜡和水相的界面处生成“紫草素-赖氨酸共聚物膜”。
[0112]
(8)以漆酶催化制备没食子蓝-2,4,6-三氨基嘧啶共聚物膜:
[0113]
将0.250g没食子蓝、0.250g 2,4,6-三氨基嘧啶溶于250ml 0.05mol/l邻苯二甲酸氢钾-氢氧化钠缓冲溶液(ph 5.0),加入15u本发明制备的漆酶,充分混匀,得到漆酶催化体系(水相)。在水相上覆盖3mm厚的液体石蜡,于40℃烘箱(智城,zfd-5090,中国)中静置反应10h,液体石蜡和水相的界面处生成“没食子蓝-2,4,6-三氨基嘧啶共聚物膜”。
[0114]
(9)以漆酶催化制备4,4
’‑
二羟基联苯-2,3-二氨基萘共聚物膜:
[0115]
将0.125g 4,4
’‑
二羟基联苯、0.125g 2,3-二氨基萘、15mg abts溶于215ml 0.05mol/l邻苯二甲酸氢钾-氢氧化钠缓冲溶液(ph 5.0)和35ml丙酮的混合溶剂中,加入5u本发明制备的漆酶,充分混匀,得到漆酶催化体系(水相)。在水相上覆盖3mm厚的液体石蜡,于40℃烘箱(智城,zfd-5090,中国)中静置24h,液体石蜡和水相的界面处生成“4,4
’‑
二羟基联苯-2,3-二氨基萘共聚物膜”。
[0116]
(10)以漆酶催化制备双酚a-前黄素共聚物膜:
[0117]
将0.250g双酚a、0.250g前黄素、15mg abts溶于175ml 0.1mol/l磷酸氢二钠-柠檬酸缓冲溶液(ph 4.0)和75ml乙醇的混合溶剂中,加入3u本发明制备的漆酶,充分混匀,得到漆酶催化体系(水相)。在水相上覆盖3mm厚的液体石蜡,于45℃培养箱(智城,zsd-1090,中国)中静置10h,液体石蜡和水相的界面处生成“双酚a-前黄素共聚物膜”。
[0118]
(11)以漆酶催化制备1,8,9-三羟基蒽-4,4'-二氨基二苯砜共聚物膜:
[0119]
将0.040g 1,8,9-三羟基蒽、0.060g 4,4'-二氨基二苯砜、20mg abts溶于140ml 0.05mol/l磷酸氢二钠-柠檬酸缓冲溶液(ph 5.0)和60ml乙醇的混合溶剂中,加入10u本发明制备的漆酶,充分混匀,得到漆酶催化体系(水相)。在水相上覆盖3mm厚的液体石蜡,于45℃烘箱(智城,zfd-5090,中国)中静置10h,液体石蜡和水相的界面处生成“1,8,9-三羟基蒽-4,4'-二氨基二苯砜共聚物膜”。
[0120]
(12)以漆酶催化制备香叶木素-1,6-己二胺共聚物膜:
[0121]
将0.025g香叶木素、0.050g 1,6-己二胺溶于225ml 0.05mol/l磷酸三钠-磷酸缓冲溶液(ph 4.0)和25ml二甲基亚砜的混合溶剂中,加入15u本发明制备的漆酶,充分混匀,得到漆酶催化体系(水相)。在水相上覆盖3mm厚的液体石蜡,于30℃培养箱(智城,zsd-1090,中国)中静置反应5h,液体石蜡和水相的界面处生成“香叶木素-1,6-己二胺共聚物膜”。
[0122]
(13)以漆酶催化制备金松双黄酮-精胺共聚物膜:
[0123]
将0.050g金松双黄酮、0.100g精胺溶于70ml 0.05mol/l磷酸三钠-磷酸缓冲溶液(ph 3.0)和30ml乙醇的混合溶剂中,加入2u本发明制备的漆酶,充分混匀,得到漆酶催化体系(水相)。在水相上覆盖3mm厚的液体石蜡,于40℃烘箱(智城,zfd-5090,中国)中静置反应6h,液体石蜡和水相的界面处生成“金松双黄酮-精胺共聚物膜”。
[0124]
(14)以漆酶催化制备水仙苷-2,4-二氨基苯甲醚共聚物膜:
[0125]
将0.075g水仙苷、0.125g 2,4-二氨基苯甲醚溶于200ml 0.05mol/l丙二酸钠-丙二酸缓冲溶液(ph 4.0)和50ml乙醇的混合溶剂中,加入5u本发明制备的漆酶,充分混匀,得到漆酶催化体系(水相)。在水相上覆盖3mm厚的液体石蜡,于10℃培养箱(智城,zsd-1090,中国)中静置反应10h,液体石蜡和水相的界面处生成“水仙苷-2,4-二氨基苯甲醚共聚物膜”。
[0126]
(15)以漆酶催化制备橙皮素-6-羟基-2,4,5-三氨基嘧啶共聚物膜:
[0127]
将0.020g橙皮素、0.020g 6-羟基-2,4,5-三氨基嘧啶溶于140ml 0.05mol/l磷酸三钠-磷酸缓冲溶液(ph 5.0)和60ml乙醇的混合溶剂中,加入10u本发明制备的漆酶,充分混匀,得到漆酶催化体系(水相)。在水相上覆盖3mm厚的液体石蜡,于55℃烘箱(智城,zfd-5090,中国)中静置反应7h,液体石蜡和水相的界面处生成“橙皮素-6-羟基-2,4,5-三氨基嘧啶共聚物膜”。
[0128]
实施例6.漆酶催化制备共聚物膜(液-固界面膜)
[0129]
(1)以漆酶催化制备阿魏酸-对苯二胺共聚物膜
[0130]
将0.25g阿魏酸、0.25g对苯二胺置于250ml三角瓶中,加入125ml 0.05mol/l磷酸三钠-磷酸缓冲溶液(ph 3.0),将预先去除表面的粉尘、油污、汗迹和塑模润滑剂的聚乙烯(pe)板置于三角瓶中的溶液中,加入7.5u本发明制备的漆酶,混匀,于50℃恒温振荡器(crystal,is-rdv3,美国精骐有限公司)100rpm振荡反应13h,反应结束,pe板表面形成阿魏
fisher scientific,escalab 250xi,美国)测定是否共价键合山梨醇的鸢尾黄素-pei共聚物膜表面的元素组成。与山梨醇反应后膜表面n/o比例由0.699降低至0.522,鸢尾黄素-pei共聚物膜表面含有c、h、n、o四种元素,山梨醇结构中不含n元素,因此,膜表面n/o比例降低,证明了该膜结合了山梨醇分子。
[0142]
共聚物膜引入结构中含有羧基的分子——柠檬酸:将本实施例6(2)制备的覆有鸢尾黄素-pei共聚物膜的pe板置于溶有2g/l柠檬酸的磷酸三钠-磷酸缓冲溶液(0.05mol/l,ph 5.5)中,加入0.25g 1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edc)及0.15g n-羟基琥珀酰亚胺(nhs)以活化羧基,25℃,100rpm振荡反应24h,取出,以无水乙醇清洗多次,再用蒸馏水冲洗,室温晾干。
[0143]
利用x射线光电子能谱仪(xps,thermo fisher scientific,escalab 250xi,美国)测定是否共价键合柠檬酸的鸢尾黄素-pei共聚物膜表面的元素组成。与柠檬酸反应后膜表面n/o比例由0.699降低至0.640,鸢尾黄素-pei共聚物膜表面含有c、h、n、o四种元素,柠檬酸结构中仅含有c、h、o三种元素,不含n元素,反应后的膜表面n/o比例的降低,证明了该膜结合了柠檬酸分子。
[0144]
(3)以漆酶催化制备柯因-精氨酸共聚物膜:
[0145]
将0.050g柯因、0.050g精氨酸、5.0mg香兰素置于250ml三角瓶中,加入35ml 0.05mol/l琥珀酸钠-琥珀酸缓冲溶液(ph 2.0)和15ml丙酮的混合溶剂,将预先去除表面的粉尘、油污、汗迹和塑模润滑剂的pe板置于三角瓶中的溶液中,加入7.5u本发明制备的漆酶,充分混匀,于30℃恒温振荡器(crystal,is-rdv3,美国精骐有限公司)100rpm振荡反应3h,反应结束,pe板表面形成柯因-精氨酸共聚物膜。
[0146]
(4)以漆酶催化制备大黄酸-2,4-二氨基-6-甲基-1,3,5-三嗪共聚物膜:
[0147]
将0.125g大黄酸、0.125g 2,4-二氨基-6-甲基-1,3,5-三嗪、20mg丁香醛置于500ml三角瓶中,加入175ml 0.05mol/l醋酸钠-醋酸缓冲溶液(ph 4.0)和75ml甲醇的混合溶剂,将预先去除表面的粉尘、油污、汗迹和塑模润滑剂的pe板置于三角瓶中的溶液中,加入5u本发明制备的漆酶,混匀,于50℃恒温振荡器(crystal,is-rdv3,美国精骐有限公司)100rpm振荡反应10h,反应结束,pe板表面形成大黄酸-2,4-二氨基-6-甲基-1,3,5-三嗪共聚物膜。
[0148]
(5)以漆酶催化制备对羟基苯甲酸-2-氟-对苯二胺共聚物膜:
[0149]
将0.125g对羟基苯甲酸、0.250g 2-氟-对苯二胺置于500ml三角瓶中,加入125ml蒸馏水,磷酸调ph为6.0,将预先去除表面的粉尘、油污、汗迹和塑模润滑剂的pe板置于三角瓶中的溶液中,加入0.125u本发明制备的漆酶,混匀,于40℃恒温振荡器(crystal,is-rdv3,美国精骐有限公司)100rpm振荡反应48h。反应结束,pe板表面形成对羟基苯甲酸-2-氟-对苯二胺共聚物膜。
[0150]
(6)以漆酶催化制备1,6-二羟基萘-二乙烯三胺共聚物膜:
[0151]
将0.125g 1,6-二羟基萘、0.250g二乙烯三胺、25mg丁香醛置于500ml三角瓶中,加入200ml 0.05mol/l磷酸氢二钠-柠檬酸缓冲溶液(ph 4.0)和50ml丙酮的混合溶剂,将预先去除表面的粉尘、油污、汗迹和塑模润滑剂的pe板置于三角瓶中的溶液中,加入10u本发明制备的漆酶,混匀,于37℃恒温振荡器(crystal,is-rdv3,美国精骐有限公司)100rpm振荡反应10h,反应结束,pe板表面形成1,6-二羟基萘-二乙烯三胺共聚物膜。
[0152]
(7)以漆酶催化制备紫草素-赖氨酸共聚物膜:
[0153]
将0.125g紫草素、0.125g赖氨酸、12.5mg abts置于500ml三角瓶中,加入175ml 0.05mol/l磷酸氢二钠-柠檬酸缓冲溶液(ph 3.0)和75ml乙醇的混合溶剂,将预先去除表面的粉尘、油污、汗迹和塑模润滑剂的pe板置于三角瓶中的溶液中,加入15u本发明制备的漆酶,混匀,于45℃恒温振荡器(crystal,is-rdv3,美国精骐有限公司)100rpm振荡反应5h,反应结束,pe板表面形成紫草素-赖氨酸共聚物膜。
[0154]
(8)以漆酶催化制备没食子蓝-2,4,6-三氨基嘧啶共聚物膜:
[0155]
将0.250g没食子蓝、0.250g 2,4,6-三氨基嘧啶置于500ml三角瓶中,加入250ml 0.05mol/l邻苯二甲酸氢钾-氢氧化钠缓冲溶液(ph 5.0),将预先去除表面的粉尘、油污、汗迹和塑模润滑剂的pe板置于三角瓶中的溶液中,加入15u本发明制备的漆酶,混匀,于40℃恒温振荡器(crystal,is-rdv3,美国精骐有限公司)100rpm振荡反应10h,反应结束,pe板表面形成没食子蓝-2,4,6-三氨基嘧啶共聚物膜。
[0156]
(9)以漆酶催化制备4,4
’‑
二羟基联苯-2,3-二氨基萘共聚物膜:
[0157]
将0.125g 4,4
’‑
二羟基联苯、0.125g 2,3-二氨基萘、15mg abts置于500ml三角瓶中,加入215ml 0.05mol/l邻苯二甲酸氢钾-氢氧化钠缓冲溶液(ph 5.0)和35ml丙酮的混合溶剂,将预先去除表面的粉尘、油污、汗迹和塑模润滑剂的pe板置于三角瓶中的溶液中,加入5u本发明制备的漆酶,于40℃恒温振荡器(crystal,is-rdv3,美国精骐有限公司)100rpm振荡反应24h,反应结束,pe板表面形成4,4
’‑
二羟基联苯-2,3-二氨基萘共聚物膜。
[0158]
(10)以漆酶催化制备双酚a-前黄素共聚物膜:
[0159]
将0.250g双酚a、0.250g前黄素、15mg abts置于500ml三角瓶中,加入175ml 0.1mol/l磷酸氢二钠-柠檬酸缓冲溶液(ph 4.0)和75ml乙醇的混合溶剂,将预先去除表面的粉尘、油污、汗迹和塑模润滑剂的pe板置于三角瓶中的溶液中,加入3u本发明制备的漆酶,混匀,于45℃恒温振荡器(crystal,is-rdv3,美国精骐有限公司)100rpm振荡反应10h,反应结束,pe板表面形成双酚a-前黄素共聚物膜。
[0160]
(11)以漆酶催化制备1,8,9-三羟基蒽-4,4'-二氨基二苯砜共聚物膜:
[0161]
将0.040g 1,8,9-三羟基蒽、0.060g 4,4'-二氨基二苯砜、20mg abts置于500ml三角瓶中,加入140ml 0.05mol/l磷酸氢二钠-柠檬酸缓冲溶液(ph 5.0)和60ml乙醇的混合溶剂,将预先去除表面的粉尘、油污、汗迹和塑模润滑剂的pe板置于三角瓶中的溶液中,加入10u本发明制备的漆酶,混匀,于45℃恒温振荡器(crystal,is-rdv3,美国精骐有限公司)100rpm振荡反应10h,反应结束,pe板表面形成1,8,9-三羟基蒽-4,4'-二氨基二苯砜共聚物膜。
[0162]
(12)以漆酶催化制备香叶木素-1,6-己二胺共聚物膜:
[0163]
将0.025g香叶木素、0.050g 1,6-己二胺置于500ml三角瓶中,加入225ml 0.05mol/l磷酸三钠-磷酸缓冲溶液(ph 4.0)和25ml二甲基亚砜的混合溶剂,将预先去除表面的粉尘、油污、汗迹和塑模润滑剂的pe板置于三角瓶中的溶液中,加入15u本发明制备的漆酶,混匀,于30℃恒温振荡器(crystal,is-rdv3,美国精骐有限公司)100rpm振荡反应5h,反应结束,pe板表面形成香叶木素-1,6-己二胺共聚物膜。
[0164]
(13)以漆酶催化制备金松双黄酮-精胺共聚物膜:
[0165]
将0.050g金松双黄酮、0.100g精胺置于500ml三角瓶中,加入70ml 0.05mol/l磷酸
三钠-磷酸缓冲溶液(ph 3.0)和30ml乙醇的混合溶剂,将预先去除表面的粉尘、油污、汗迹和塑模润滑剂的pe板置于三角瓶中的溶液中,加入2u本发明制备的漆酶,混匀,于40℃恒温振荡器(crystal,is-rdv3,美国精骐有限公司)100rpm振荡反应6h,反应结束,pe板表面形成金松双黄酮-精胺共聚物膜。
[0166]
(14)以漆酶催化制备水仙苷-2,4-二氨基苯甲醚共聚物膜:
[0167]
将0.075g水仙苷、0.125g 2,4-二氨基苯甲醚置于500ml三角瓶中,加入200ml 0.05mol/l丙二酸钠-丙二酸缓冲溶液(ph 4.0)和50ml乙醇的混合溶剂,将预先去除表面的粉尘、油污、汗迹和塑模润滑剂的pe板置于三角瓶中的溶液中,加入5u本发明制备的漆酶,混匀,于10℃恒温振荡器(crystal,is-rdv3,美国精骐有限公司)100rpm振荡反应10h,反应结束,pe板表面形成水仙苷-2,4-二氨基苯甲醚共聚物膜。
[0168]
(15)以漆酶催化制备橙皮素-6-羟基-2,4,5-三氨基嘧啶共聚物膜:
[0169]
将0.020g橙皮素、0.020g 6-羟基-2,4,5-三氨基嘧啶置于500ml三角瓶中,加入140ml 0.05mol/l磷酸三钠-磷酸缓冲溶液(ph 5.0)和60ml乙醇的混合溶剂,将预先去除表面的粉尘、油污、汗迹和塑模润滑剂的pe板置于三角瓶中的溶液中,加入10u本发明制备的漆酶,混匀,于55℃恒温振荡器(crystal,is-rdv3,美国精骐有限公司)100rpm振荡反应7h,反应结束,pe板表面形成橙皮素-6-羟基-2,4,5-三氨基嘧啶共聚物膜。
[0170]
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1