WTN多肽及其在检测前列腺癌中的用途的制作方法
id no:1所示的多肽有90%以上的同源性的多肽,具体地,所述多肽与seq id no:1有90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,100%的同源性。
9.优选地,所述wtn多肽在seq id no:1所示的多肽的第1位、第2位、第3位、第4位、第5位、第6位、第7位、第8位、第9位、第10位、第11位和第12位中的一个或多个位置发生取代、缺失或添加。
10.优选地,所述wtn多肽是seq id no:1所示的多肽。
11.优选地,所述wtn多肽是在seq id no:1所示的多肽主链或侧链末端的氨基、羧基、巯基、酚羟基、咪唑基、胍基、吲哚基、甲硫基等位点进行化学修饰后的产物。
12.优选地,所述的化学修饰包括乙酰化、酰胺化、糖基化、聚乙二醇(peg)修饰、脂肪酸修饰及本领域已知的其它多肽修饰技术。
13.优选地,所述乙酰化和酰胺化包括多肽主链n端乙酰化,多肽主链c端酰胺化。
14.优选地,所述糖基化修饰包括n
‑
糖基化、o
‑
糖基化、s
‑
糖基化、c
‑
糖基化以及糖基磷脂酰肌醇修饰。
15.优选地,所述n
‑
糖基化是通过天冬酰胺使侧链的酰胺氮进行连接。
16.优选地,所述o
‑
糖基化是与丝氨酸或苏氨酸残基上的氧相连。
17.优选地,所述的糖结构包括各种单糖、寡糖和多糖。
18.优选地,所述peg修饰类型包括直链peg,支链peg,同双官能团peg衍生物,异官能团双取代peg衍生物和多臂官能团peg衍生物。
19.优选地,所述脂肪酸修饰可分为不饱和脂肪酸和饱和脂肪酸修饰。
20.优选地,所述饱和脂肪酸包括肉豆蔻酸、棕榈酸。
21.优选地,所述不饱和脂肪酸修饰包括油酸、亚油酸。
22.本发明第二方面提供了一种多肽复合物,所述多肽复合物是在前述wtn多肽的氨基端和/或羧基端以肽键连接结构域;
23.优选地,所述结构域是由氨基酸组成的;
24.优选地,所述结构域包括铰链区、跨膜结构域和/或信号转导结构域;
25.优选地,所述铰链区包括cd8α铰链区、cd28铰链区、cd4铰链区、cd5铰链区、cd134铰链区、cd137铰链区、icos铰链区中的一种或多种的组合。
26.优选地,所述跨膜结构域包括蛋白质的跨膜结构域,所述蛋白质包括:2b4基因表达的蛋白、t细胞受体的α、β或ζ链,cd28,cd3ε,cd45,cd4,cd5,cd8,cd9,cd16,cd22,cd33,cd37,cd64,cd80,cd86,cd123,cd134,cd137和cd154。
27.优选地,所述信号转导结构域包含共刺激结构域和/或初级信号传导结构域。
28.优选地,所述共刺激结构域包括2b4、cd3ζ、ox40、cd2、cd27、cd28、cds、icam
‑
1、lfa
‑
1(cd11a/cd18)、icos(cd278)和4
‑
1bb(cd137)的功能性信号传导结构域。
29.优选地,所述初级信号传导结构域包括cd3
‑
ζ、fcεriγ、fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b和cd66d的一种蛋白或多种蛋白的任意组合的信号传导区;
30.优选地,所述多肽复合物是肿瘤抗原结合肽。
31.优选地,所述肿瘤抗原结合肽的组成是wtn多肽区
‑
铰链区
‑
跨膜结构域
‑
共刺激结构域
‑
初级信号传导结构域或wtn多肽区
‑
铰链区
‑
跨膜结构域
‑
初级信号传导结构域。
32.优选地,所述wtn多肽区包括多个wtn多肽的重复和多个wtn多肽的重复之间的
linker。
33.优选地,所述多个可以是1个、2个、3个、4个、5个。
34.本发明第三方面提供了一种编码前述wtn多肽的dna分子。
35.优选地,所述编码wtn多肽的dna分子序列如seq id no:2所示。
36.本发明第四方面提供了一种编码前述多肽复合物的dna分子。
37.本发明第五方面提供了一种载体,所述载体包含前述编码多肽的dna分子和/或前述多肽复合物的dna分子。
38.优选地,所述载体是表达载体。
39.优选地,所述表达载体中还包括可操作地连接的启动子和转录终止序列。
40.优选地,所述表达载体是质粒表达载体或病毒表达载体。
41.所述质粒表达载体包括但不限于pcdna3.1+/
‑
,pcdna4/hismax b,psectag2 a,pvax1,pbudce4.1,ptracer cmv2,pcdna3.1(
‑
)/myc
‑
his a,pcdna6
‑
myc/his b,pcep4,pires,piresneo,pires hyg3,pcmv
‑
myc,pcmv
‑
ha,pires
‑
puro3,pires
‑
neo3,pcaggs,psilencer1.0,psilencer2.1
‑
u6 hygro,psilencer3.1
‑
h1hygro,psilencer3.1
‑
h1neo,psilencer4.1
‑
cmv neo。
42.优选地,所述病毒表达载体包括慢病毒载体、腺病毒载体、腺相关病毒表达载体或其他类型病毒载体。
43.优选地,所述病毒表达载体包括但不限于plko.1,plvx
‑
ires
‑
zsgreen1,pcdh
‑
ef1
‑
luc2
‑
t2a
‑
tdtomato,pcdh
‑
mscv
‑
mcs
‑
ef1
‑
puro,pcdh
‑
mscv
‑
mcs
‑
ef1
‑
copgfp,plvx
‑
zsgreen1
‑
c1,padeasy
‑
1,pshuttle
‑
cmv,pshuttle,padtrack,padtrack
‑
cmv,pshuttle
‑
ires
‑
hrgfp
‑
1,pshuttle
‑
ires
‑
hrgfp
‑
2,pshuttle
‑
cmv
‑
lacz,pshuttle
‑
cmv
‑
egfp
‑
c,pxc1,pbhge3,paav
‑
mcs,paav
‑
rc,phelper,paav
‑
lacz,plk0.1
‑
puro,plk0.1
‑
cmv
‑
tgfp,plko.1
‑
puro
‑
cmv
‑
tgfp,plk0.1
‑
cmv
‑
neo,plk0.1
‑
neo,plko.1
‑
neo
‑
cmv
‑
tgfp,plko.1
‑
puro
‑
cmv
‑
tagcfp,plko.1
‑
puro
‑
cmv
‑
tagyfp,plko.l
‑
puro
‑
cmv
‑
tagrfp,plko.1
‑
puro
‑
cmv
‑
tagfp635,plko.
‑
puro
‑
ubc
‑
turbogfp,plko.l
‑
puro
‑
ubc
‑
tagfp635,plko
‑
puro
‑
iptg
‑
1xlaco,plko
‑
puro
‑
iptg
‑
3xlaco,plpl,plp2,plp/vsv
‑
g,pentr/u6,plenti6/block
‑
it
‑
dest,plenti6
‑
gw/u6
‑
laminshrna,pcdnal,2/v5
‑
gw/lacz,plenti6.2/n
‑
lumio/v5
‑
dest,pgcsil
‑
gfp和lenti6.2/n
‑
lumio/v5
‑
gw/lacz。
44.本发明第六方面提供了一种宿主细胞,所述宿主细胞包含前述多肽、前述多肽复合物、前述编码wtn多肽的dna分子、前述多肽复合物的dna分子和前述载体中的一种或多种。
45.优选的,所述宿主细胞包括原核细胞和真核细胞。
46.优选的,所述原核细胞是细菌细胞,如农杆菌、大肠杆菌。
47.优选的,所述细菌细胞包括革兰氏阴性微生物和革兰氏阳性微生物。
48.优选的,所述真核细胞是真菌细胞,即酵母细胞。
49.优选地,所述真核细胞是哺乳动物细胞、昆虫细胞、植物细胞或藻类细胞。
50.优选地,所述哺乳动物细胞包括人源细胞或非人源的细胞。
51.优选地,所述人源细胞是免疫细胞。
52.优选地,所述免疫细胞包括t细胞、b细胞、k细胞和nk细胞中的一种或多种。
53.优选地,所述免疫细胞是nk细胞或t细胞。
54.优选地,所述免疫细胞是自体或异体的。
55.优选地,所述免疫细胞来源于自体静脉血、自体骨髓、脐带血和胎盘血等的单个核细胞。
56.优选地,所述宿主细胞包括商品化的细胞株,如293细胞、293t细胞、293ft细胞、293ltv细胞、293ebna细胞、sw480细胞、u87mg细胞、hos细胞、c8166细胞、mt
‑
4细胞、molt
‑
4细胞、hela细胞、ht1080细胞、te671细胞、cos1细胞、cos7细胞、cv
‑
1细胞、bmt10细胞。
57.本发明第七方面提供了一种药物组合物,所述药物组合物包括前述多肽、前述多肽复合物、前述编码wtn多肽的dna分子、前述多肽复合物的dna分子、前述载体和前述宿主细胞中的一种或多种。
58.优选地,所述药物组合物还包括药学上可接受的赋形剂和/或添加剂。
59.优选地,所述赋形剂包括但不限于缓冲体系、增稠剂、稳定剂、中和试剂、保湿剂。
60.优选地,所述添加剂包括但不限于充填剂、结合剂、增湿剂、助流剂、稳定剂、防腐剂、乳化剂。
61.优选地,所述药物组合物的给药途径为肠道给药或非肠道给药,如口服、静脉注射、肌肉注射、皮下注射、鼻腔、口腔黏膜、眼、肺和呼吸道、皮肤、阴道、直肠等。
62.优选地,所述药物组合物的给药剂型可以是液体剂型、固体剂型或半固体剂型。
63.优选地,所述液体剂型可以是溶液剂(包括真溶液和胶体溶液)、乳剂(包括o/w型、w/o型和复乳)、混悬剂、注射剂(包括水针剂、粉针剂和输液)、滴眼剂、滴鼻剂、洗剂和搽剂等。
64.优选地,所述固体剂型可以是片剂(包括普通片、肠溶片、含片、分散片、咀嚼片、泡腾片、口腔崩解片)、胶囊剂(包括硬胶囊、软胶囊、肠溶胶囊)、颗粒剂、散剂、微丸、滴丸、栓剂、膜剂、贴片、气(粉)雾剂等。
65.优选地,所述半固体剂型可以是软膏剂、凝胶剂、糊剂等。
66.优选地,所述药物组合物可以制成普通制剂、也可以制成是缓释制剂、控释制剂、靶向制剂及各种微粒给药系统。
67.本发明第八方面提供了一种与psma特异性结合的wtn多肽的缀合物。
68.优选地,所述缀合物是将可检测标记物连接在所述wtn多肽上。
69.优选地,所述连接是共价键连接或物理吸附。
70.优选地,所述连接是非肽键的连接。
71.优选地,所述可检测标记物不包括天然氨基酸成分。
72.优选地,所述可检测标记物包括放射性标记物、化学发光标记物、荧光标记物、量子点、测温标记物或免疫聚合酶链式反应标记物。
73.优选地,所述放射性标记物包括例如3h、14c、32p、33p、35s、90y、99tc、111in、125i、131i、177lu、166ho和153sm。
74.优选地,所述化学发光标记物包括吖啶酯、硫酯、磺酰胺、鲁米诺、异鲁米诺、菲啶鎓酯。
75.优选地,所述荧光标记物包括5
‑
荧光素、6
‑
羧基荧光素、3'6
‑
羧基荧光素、5(6)
‑
羧基荧光素、6
‑
六氯
‑
荧光素、6
‑
四氯荧光素、异硫氰酸荧光素、罗丹明、藻胆蛋白和r
‑
藻红蛋
白。
76.优选地,所述荧光标记物是荧光分子。
77.优选地,所述荧光分子是fitc。
78.优选地,所述可检测标记物可以发出可检测信号;优选地,所述可检测信号包括光学信号或电学信号。优选地,所述光学信号包括荧光信号、光吸收信号、红外吸收信号、拉曼散射信号或化学发光信号。
79.本发明第九方面提供了一种制备前述宿主细胞的方法,所述方法包括将前述编码wtn多肽的dna分子、前述多肽复合物的dna分子、前述载体中的一种或多种导入细胞中的步骤。
80.优选地,所述导入细胞的方法包括热激法、磷酸钙沉淀、转染法、粒子轰击、微注射、电穿孔等等。
81.本发明第十方面提供了一种制备前述wtn多肽的方法,所述方法包括在适宜大量表达蛋白的培养环境中培养前述宿主细胞;
82.优选地,所述方法还包括提取和纯化多肽的步骤。
83.本发明第十一方面提供了一种检测psma的方法,所述方法包括将前述wtn多肽的缀合物与待检测样品接触的步骤。
84.优选地,所述方法还包括处理样品的步骤。
85.优选地,所述检测是非诊断目的的。
86.优选地,所述待检测样品是疑似含有psma的样品。
87.优选地,所述样品可以是细胞,也可以是样本或培养物(包括微生物培养物),甚至包括合成来源的样本。
88.优选地,所述样品来源于病毒、细菌、微生物、土壤、水源、人体、动物、植物等。
89.优选地,所述样品包括组织切片,例如活检和尸检样品,以及用于组织学目的的冷冻切片。此类样品包括体液,例如血液和血液成分或产品(例如,血清,血浆,血小板,红细胞等),痰液,组织,培养的细胞(例如,原代培养物,外植体和转化的细胞)粪便,尿液,滑液,关节组织,滑膜组织,滑膜细胞,成纤维细胞样滑膜细胞,巨噬细胞样滑膜细胞,免疫细胞,造血细胞,成纤维细胞,巨噬细胞,t细胞等。
90.优选地,所述方法使用的是免疫检测方法,所述免疫检测方法包括但不限于酶联免疫法、放射免疫法、荧光免疫法、化学发光免疫法、电化学发光免疫法等。
91.本发明第十二方面提供了一种检测psma的试剂盒,所述试剂盒包括前述wtn多肽的缀合物;
92.优选地,所述试剂盒中还包括样本处理液、缓冲液、离子强度调节剂、表面活性剂和防腐剂中的一种或多种。
93.优选地,所述试剂盒还包括检测psma所需的仪器或装置。
94.本发明第十三方面提供了前述多肽、前述多肽复合物、前述编码wtn多肽的dna分子、前述多肽复合物的dna分子或前述载体或前述宿主细胞在制备中前述药物组合物中的应用。
95.本发明第十四方面提供了前述多肽、前述多肽复合物、前述编码wtn多肽的dna分子、前述多肽复合物的dna分子或前述载体在制备前述宿主细胞中的应用。
96.本发明第十五方面提供了前述编码wtn多肽的dna分子、前述多肽复合物的dna分子在制备前述载体中的应用。
97.本发明第十六方面提供了前述多肽、前述多肽复合物、前述编码wtn多肽的dna分子、前述多肽复合物的dna分子、前述载体、前述宿主细胞或前述药物组合物在制备治疗癌症的药物中的应用。
98.优选地,所述癌症是前列腺癌。
99.本发明第十七方面提供了前述多肽、前述多肽复合物、前述编码wtn多肽的dna分子、前述多肽复合物的dna分子、前述载体、前述宿主细胞或前述药物组合物在制备诊断癌症的试剂盒中的应用。
100.优选地,所述癌症是前列腺癌。
101.优选地,所述诊断是检测的psma。
102.优选地,所述试剂盒是前述试剂盒。
附图说明
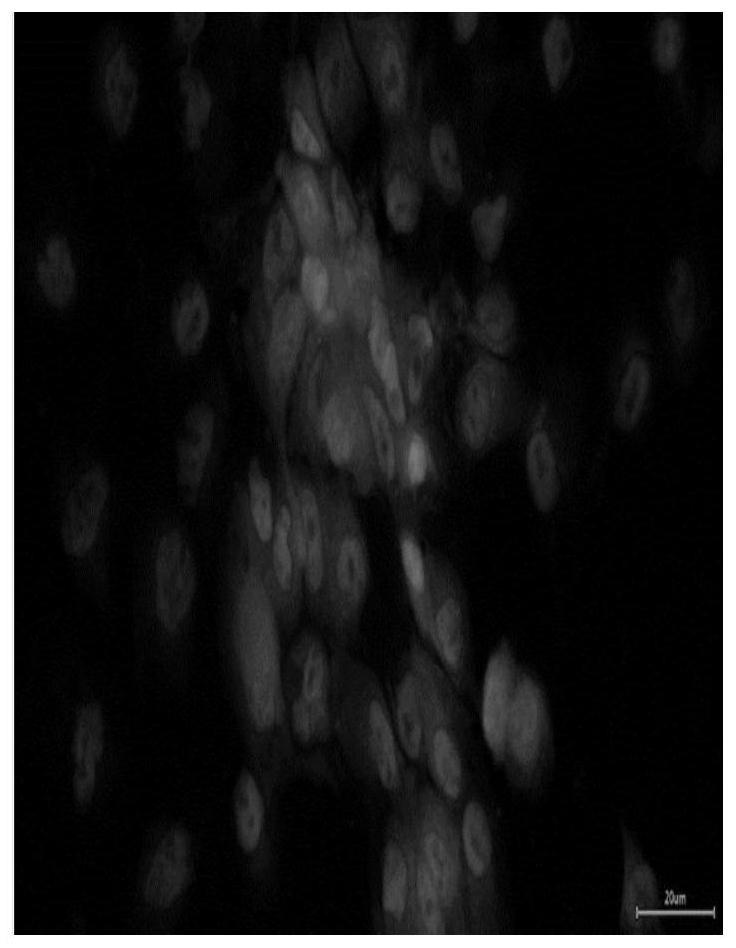
103.图1为多肽wtn与psma表达量较高的lncap细胞系的免疫荧光结果。
104.图2为多肽wtn与psma表达量低的pc3细胞系的免疫荧光结果。
具体实施方式
105.下面结合实施例对本发明做进一步的说明,以下所述,仅是对本发明的较佳实施例而已,并非对本发明做其他形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更为同等变化的等效实施例。凡是未脱离本发明方案内容,依据本发明的技术实质对以下实施例所做的任何简单修改或等同变化,均落在本发明的保护范围内。
106.实施例1、肽库筛选
107.1、实验目的
108.本发明采用ph.d.
‑
12噬菌体展示肽库试剂盒筛选出与psma特异性结合的多肽wtn。
109.2、ph.d.
‑
12噬菌体展示肽库试剂盒组成
110.随机十二肽噬菌体展示文库:100μl,1.5
×
10
13
pfu/ml,贮存于含50%甘油的tbs溶液中,复杂度~2.7
×
109个转化子;
‑
28giii测序引物:5
’‑
hogtatgggattttgctaaacaac
‑3’
,100pmol,1pmol/μl;
‑
96giii测序引物:5
’‑
hoccctcatagttagcgtaacg
‑3’
,100pmol/μl,1pmol/μl;e.coli er2738宿主菌f’laciqδ(lacz)m15 proa+b+zzf::tn10(tetr)/fhua2 supe thiδ(lac
‑
proab)δ(hsdms
‑
mcrb)5(rk
–
mk
–
mcrbc
–
):该菌株以含50%甘油的菌体培养物形式提供,非感受态细胞,贮存于
‑
70℃;链霉亲和素streptavidin,冻干粉1.5mg;生物素:10mm 100μl。
111.3、实验方法
112.第一天
113.根据需要同时在其上进行文库淘选的靶分子的数量和种类不同,淘选试验在单个灭菌聚苯乙烯培养皿、12或24孔板、96孔微量板中进行,每种靶分子至少包被一个板(或一个孔),下述方法中给出的量是60
×
15mm培养皿的用量,括号中为微孔板的用量,其他中等
尺寸的孔相应地调整此用量,但每种情况下,加入的噬菌体数量都是相同的:1.5
×
10
11
个病毒子;
114.(1)准备100μg/ml的靶分子溶液(溶于0.1m ph 8.6的nahco3),若需要稳定靶分子,也可使用其他相似离子强度的缓冲液(含金属离子等);
115.(2)每板(孔)加入1.5ml(微孔板每孔150μl)上述溶液,反复旋转直到表面完全湿润;
116.(3)在增湿容器(如:排列有湿纸巾的可封口塑料盒)中4℃轻微震荡,孵育过夜,平板在此容器中4℃贮存备用;
117.第二天
118.(4)挑er2738单克隆(噬菌体滴度测定时铺的板)于10ml lb液体培养基中,如果同一天扩增洗脱的噬菌体,也可将er2738接种于20ml lb液体培养基,用250ml三角瓶,37℃剧烈震荡培养;
119.(5)倒掉每板中的包被液,板倒置在干净的纸巾上用力拍甩以除去残余溶液,每板(或孔)加满封阻液,4℃作用至少1h;
120.(6)速洗板6次,每次均旋转以使板或孔的底部及边缘均被洗到,倾去缓冲液,倒置在干净纸巾上拍甩以除去残余溶液(或使用自动洗板机);
121.(7)用1ml(微孔板则用100μl)的tbst缓冲液稀释4
×
10
10
的噬菌体(即10μl的原始文库),然后加到已包被好的板上,室温温和摇动10
‑
60min;
122.(8)倾倒除去未结合噬菌体,倒置板在干净的纸巾上拍甩除去残余溶液;
123.(9)按6中所述方法用tbst缓冲液洗板10次,每次换一干净纸巾以避免交叉污染;
124.(10)根据所研究的分子间相互作用,用1ml(微孔板则用100μl)适当的洗脱缓冲液洗脱结合的噬菌体,将靶分子的已知配体以0.1
‑
1mm的浓度溶于tbs溶液中或者用游离靶分子溶液(~100μg/ml溶于tbs中)从固定靶分子上将结合的噬菌体竞争性洗脱下来,室温温和摇动10
‑
60min,将洗脱液吸入另一干净微量离心管中;也可用非特异性缓冲液如0.2m glycine
‑
hcl(ph 2.2),1mg/ml bsa来分离已结合的分子:温和摇动>10min,洗脱液吸入另一干净微量离心管中,然后再用150μl(微量孔则用15μl)1m tris
‑
hcl(ph 9.1)中和上述洗脱液;
125.(11)按上述常规m13方法中的程序测定少量(~1μl)洗脱物的滴度,如需要,可对第一或第二轮洗脱物滴度测定所得的噬菌斑进行测序,方法见下述:必要时可将剩余洗脱物4℃贮存过夜,第二天扩增,这时,可将er2738在lb
‑
tet培养基中过夜培养,第二天将培养物1:100稀释于20ml lb中(用250ml三角瓶盛装),加入未扩增洗脱物,37℃剧烈摇动培养4.5h,继续第13步;
126.(12)扩增剩余洗脱物:将洗脱物加入到20ml er2738培养物中(菌体处于对数前期),37℃剧烈摇动培养4.5h;
127.(13)将培养物转入一离心管中,然后,4℃10,000rpm离心10min。上清液转入另一离心管中,再离心;
128.(14)将上清的上部80%转入一新鲜管中,加入1/6体积的peg/nacl,让噬菌体4℃沉淀至少60min,过夜;
129.第三天
130.(15)4℃10,000rpm离心peg沉淀15min,倒掉上清液,再短暂离心,吸去残留上清液;
131.(16)沉淀物重悬于1ml tbs中,悬液转入微量离心管中,4℃离心5min使残余细胞沉淀;
132.(17)上清转入另一新鲜微量离心管,用1/6体积的peg/nacl再沉淀,冰上孵育15
‑
60min,4℃离心10min,弃上清,再短暂离心,用微量移液器吸去残余上清;
133.(18)沉淀物重悬于200μl tbs,0.02%nan3中,离心1min,沉淀任何残余的不溶物,上清转入新鲜管中,此即为扩增后的洗脱物;
134.(19)根据上述常规m13方法用lb/iptg/xgal平板滴定扩增后的洗脱物,4℃贮存;
135.(20)再包被一个板或孔准备第二轮淘选时用;
136.第四和第五天
137.(21)计数板上蓝斑数确定滴度,用这个值来计算相应于1
‑2×
10
11
pfu的加入量;若滴度太低,接下来的几轮淘选可用低至109pfu的噬菌体加入量进行试验;
138.(22)进行第二轮淘选:用第一轮淘选扩增的洗脱物中1
‑2×
10
11
pfu的噬菌体量重复步骤4
‑
18,在清洗步骤中将tween的浓度增至0.5%(v/v);
139.(23)在lb/iptg/xgal平板上测定第二轮淘选所得洗脱物扩增后的滴度;
140.(24)再包被一个板或孔准备第三轮淘选时用;
141.第六天
142.(25)进行第三轮淘选:用第二轮淘选扩增的洗脱物中2
×
10
11
pfu的噬菌体量重复步骤4
‑
11,清洗步骤中同样用0.5%(v/v)的tween;
143.(26)在lb/iptg/xgal平板上测定第三轮淘选所得洗脱物未扩增时的滴度,第三轮洗脱物不必再扩增,除非还要进行第四轮淘选,滴度测定时得到的噬菌斑可做测序用:只要注意平板培养时间不要超过18h,培养时间过长容易出现缺失,其余洗脱物4℃贮存;
144.(27)挑一er2738单克隆于lb
‑
tet培养基中培养过夜。
145.4、实验结果
146.实验结果显示,筛选得到的与psma特异性结合的多肽wtn,其氨基酸序列为wtnhyhssvryg(seq id no:1)。
147.实施例2、wtn多肽特异性的验证
148.将wtn多肽分别与psma表达量较高的lncap细胞系及psma表达量低的pc3细胞系进行免疫荧光检测,所用荧光标记物为fitc(即fitc标记的wtn多肽)。
149.wtn多肽与lncap细胞系的荧光检测如图1所示,wtn多肽与pc3细胞系的荧光检测如图2所示。
150.图1中,圆点中心是细胞核,圆点周围的浅色是wtn与细胞表面抗原psma结合而展现的荧光。图2中仅有细胞核的染色。wtn所标记的细胞表面荧光只在图1中出现,证明wtn与细胞表面抗原psma的结合具有很高的特异性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1