以外泌体为载体的miRNA给药系统及其应用的制作方法
以外泌体为载体的mirna给药系统及其应用
技术背景
1.本发明属于生物医药领域,涉及一种以外泌体为载体的mirna给药系统及其应用。
背景技术:
[0002][0003]
外泌体(exosomes)是细胞分泌到胞外的一种囊泡(extracellular vesicles,evs),其大小为30
‑
150nm,具有双层膜结构和茶托状形态,存在于细胞培养上清液、血清、血浆、唾液、尿液、羊水以及其它生物体液中;外泌体携带有多种蛋白质、脂类、rna等重要信息,参与细胞间的分子传递。
[0004]
外泌体(exosome)是由大多数细胞分泌的小膜泡。内泡由细胞室向内出芽形成,称为多泡体(mvb)。当mvb与质膜融合时,这些内部的囊泡被释放为外泌体,外泌体可以将dna、rna和蛋白质转移到远处的受体细胞,并影响细胞行为和生理的各个方面。但是如何将外泌体作为药物载体,把特定的dna、rna、蛋白质或者小分子药物表达在外泌体中是目前有待解决的。
[0005]
目前已经使用各种方法(例如电穿孔、挤压和超声处理)用于将治疗剂加载到evs中。然而,电穿孔的方式条件苛刻,效率低下并且破坏了外泌体双层膜结构;挤压和超声处理等方式则不适用于dna、rna、蛋白质等大分子药物。
[0006]
本发明旨在通过基因改造mirna,使得mirna具有特定的序列,并在外泌体中富集,进而在外泌体中特异表达特定mirna目的,实现以外泌体为载体的mirna给药系统。
技术实现要素:
[0007]
根据本发明的一个方面,本发明提供了一种hnrnpa2b1特异性识别的分选基序,所述分选基序包括如下核心序列:g
‑
x
‑
y
‑
g,其中x为g、a、u,y为a、u;
[0008]
在本发明的具体实施方案中,所述分选基序包括如下序列:m
‑
g
‑
x
‑
y
‑
g,其中,m为a、u;x为g、a、u,y为a、u。
[0009]
在本发明的具体实施方案中,所述分选基序包括如下序列:n
‑
m
‑
g
‑
x
‑
y
‑
g,其中,m为a、u;n为a、c、g、u;x为g、a、u,y为a、u。
[0010]
在本发明的具体实施方案中,所述分选基序包括如下序列:n
‑
m
‑
g
‑
x
‑
y
‑
g,其中,m为a、c、g、u;n为a、c、g、u;x为g、a、u,y为a、u。
[0011]
在本发明的具体实施方案中,所述分选基序包括如下序列:l
‑
n
‑
m
‑
g
‑
x
‑
y
‑
g,其中,m为a、c、g、u;n为a、c、g、u;l为a、c、g、u;x为g、a、u,y为a、u。
[0012]
根据本发明的另一个方面,本发明提供了一种rna多核苷酸,所述rna多核苷酸包括前面所述的分选基序。
[0013]
进一步,本发明的rna多核苷酸包括一个或多个前面所述的分选基序,并且可包含多于一个相同的前面所述的分选基序或不同的前面所述的分选基序。跟更为详细地,可以将基本上无限数量前面所述的分选基序和不同前面所述的分选基序的组合引入任何单个多核苷酸中,以用于实现增强的膜结构递送的潜力。
[0014]
在一些实施方案中,包含前面所述的分选基序的rna多核苷酸包括天然存在的rna也包括非天然存在的rna。
[0015]
所述天然存在的rna包括编码rna和非编码rna。非编码rna包括mirna、ncrna。在本发明的具体实施方案中,所述非编码rna是mirna。编码rna是mrna。
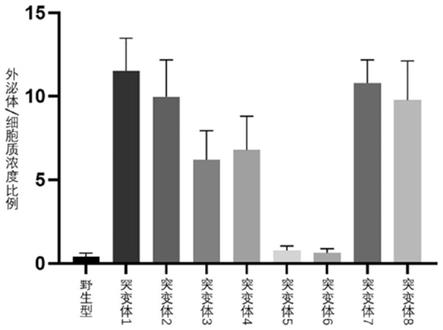
[0016]
所述非天然存在的rna包括所述分选基序与天然存在的rna连接形成的产物、含有所述分选基序的天然存在的rna与非天然存在的功能性多核苷酸连接形成的产物、所述分选基序与非天然存在的功能性多核苷酸连接形成的产物。
[0017]
进一步,所述功能性多核苷酸包括短发夹rna(shrna)、或短干扰rna(sirna)、成簇的规则间隔的短回文重复序列(crispr)指导rna。
[0018]
进一步,前面所述的分选基序连接于天然存在的rna或功能性多核苷酸的末端,所述连接可以是直接连接或间接连接。所述间接连接可以通过ires连接。
[0019]
在本发明的具体实施方案中,所述rna多核苷酸序列如seq id no:1
‑
6所示。
[0020]
根据本发明的又一个方面,本发明提供了一种dna多核苷酸,所述dna多核苷酸表达前面所述的rna多核苷酸。
[0021]
在本发明的具体实施方案中,所述dna多核苷酸序列是能够产生seq id no:1
‑
6所示的rna序列的shrna对应的dna。
[0022]
优选地,所述dna多核苷酸序列如seq id no:11、seq id no:13
‑
18所示。
[0023]
根据本发明的又一个方面,本发明提供了一种核酸衍生物,所述核酸衍生物包含前面所述的rna多核苷酸或前面所述的dna多核苷酸。
[0024]
进一步,所述核酸衍生物还包括前面所述的rna多核苷酸或前面所述的dna多核苷酸的修饰部分。
[0025]
所述修饰可以改善核苷酸的功能、生物利用度、稳定性等。合适的修饰及其制备方法是本领域周知的。本文公开的多核苷酸可以包含一种或多种修饰,或非天然存在的元件或核酸。在优选的方面,所述核酸包含2
’‑
o
‑
甲基类似物。在某些情况下,所述核酸包含3'硫代磷酸酯核苷酸间键或其他锁核酸(lna)。在某些情况下,所述核酸包含arca帽。可以使用其他化学修饰的核酸或核苷酸,例如2'
‑
位糖修饰、2'
‑
o
‑
甲基化、2'
‑
氟修饰、2'nh2修饰、5
‑
位嘧啶修饰、8
‑
位嘌呤修饰、环外胺的修饰、4
‑
硫尿苷的取代、5
‑
溴或5
‑
碘
‑
尿嘧啶的取代、骨架修饰、甲基化、非常规的碱基配对组合(如异胞苷和异胍)等。修饰还可以包括3'和5'修饰,例如加帽。例如,所述核酸可以被聚乙二醇化。
[0026]
根据本发明的又一个方面,本发明提供了含有前面所述的rna多核苷酸、前面所述的dna多核苷酸、或前面所述的核酸衍生物的载体。
[0027]
本发明的“载体”是用作将外来遗传物质转移到细胞中的寡核苷酸分子(dna或rna)。载体可以是用于在细胞中表达外源遗传物质的表达载体。这样的载体可以包括启动子序列,其与编码要表达的基因序列的核苷酸序列可操作地连接。载体还可以包括终止密码子和表达增强子。本领域已知的任何合适的载体、启动子、增强子和终止密码子可用于本发明。合适的载体包括质粒、二元载体、病毒载体和人工染色体(例如酵母人工染色体)。
[0028]
根据本发明的又一个方面,本发明提供了一种含有前面述的rna多核苷酸、前面所述的dna多核苷酸前面所述的核酸衍生物或前面所述的载体的微生物。
[0029]
本发明的微生物包括细菌、放线菌、真菌、病毒、原生动物、藻类等。
[0030]
进一步,所述微生物是病毒。
[0031]
可用于本发明的病毒包括但不限于腺病毒、腺相关病毒、慢病毒、逆转录病毒。
[0032]
进一步,所述病毒是慢病毒。
[0033]
根据本发明的又一个方面,本发明提供了一种含有前面所述的rna多核苷酸、前面所述的dna多核苷酸、前面所述的核酸衍生物或前面所述的载体的细胞。
[0034]
进一步,所述细胞表达hnrnpa2b1或其功能类似物和前面所述的rna多核苷酸或前面所述的核酸衍生物。
[0035]
进一步,所述细胞分泌膜结构。
[0036]
根据本发明的又一个方面,本发明提供了一种含有前面所述的rna多核苷酸或前面所述的核酸衍生物的膜结构。
[0037]
进一步,所述膜结构中表达所述hnrnpa2b1或其功能类似物和前面所述的rna多核苷酸或前面所述的核酸衍生物;
[0038]
进一步,所述膜结构包括外泌体、囊泡、微囊泡、微颗粒、内体来源的囊泡、多囊泡体或凋亡小体。
[0039]
在本发明的具体实施方案中,所述膜结构是外泌体。
[0040]
进一步,所述膜结构分泌所述前面所述的rna多核苷酸。
[0041]
根据本发明的又一个方面,本发明提供了一种组合物或试剂盒,所述组合物或试剂盒包括前面所述的rna多核苷酸、前面所述的dna多核苷酸、前面所述的核酸衍生物、前面所述的载体、前面所述的微生物、前面所述的细胞、前面所述的膜结构。
[0042]
进一步,所述组合物或试剂盒还包含hnrnpa2b1或其功能类似物、编码hnrnpa2b1或其功能类似物的核酸、包含所述核酸的载体、包含所述核酸或载体的微生物。
[0043]
进一步,所述组合物是药物组合物,所述药物组合物还包括药学上可接受的载体。
[0044]
本发明所述的膜结构和组合物可以通过多种途径施用或配制以用于施用,包括但不限于耳、颊、结膜、皮肤、牙科、电渗析、宫颈内、窦内、气管内、肠内、硬膜外、羊膜外、体外、血液透析、浸润、间质、腹内、羊膜内、动脉内、关节内、胆管内、支气管内、囊内(intrabursal)、心内、软骨内、尾内(intracaudal)、海绵体内、腔内、脑内、侧脑室内、脑池内、角膜内、冠内(牙科)、冠状动脉内、海绵体内(intracorporus cavernosum)、皮内、椎间盘内、导管内、十二指肠内、硬膜内、表皮内、食管内、胃内、牙龈内、回肠内、病变内、腔内、淋巴管内、髓内、脑膜内、肌内、眼内、卵巢内、心包内、腹膜内、胸膜内、前列腺内、肺内、窦内、脊柱内、滑膜内、腱内、睾丸内、鞘内、胸内、小管内、瘤内、鼓室内、子宫内、血管内、静脉内、静脉推注、静脉滴注、心室内、膀胱内、玻璃体内、离子电渗疗法、冲洗、喉、鼻、鼻胃、封闭敷裹技术、眼科、口腔、口咽、其他、肠胃外、经皮、关节周、硬膜外、神经周、牙周、直肠、呼吸(吸入)、眼球后、软组织、蛛网膜下、结膜下、皮下、舌下、粘膜下、局部、透皮、经粘膜、经胎盘、经气管、经鼓室、输尿管、尿道、和/或阴道给药,和/或上述给药途径的任何组合。本发明的组合物可以配制成液体或固体形式。可以配制流体制剂通过注射到人体或动物体的选定区域来给药。
[0045]
根据本发明的又一个方面,本发明提供了一种mirna给药系统,所述mirna给药系统包括前面所述的组合物。
[0046]
根据本发明的又一个方面,本发明提供了前面所述的细胞的制备方法,所述方法
包括将前面所述的rna多核苷酸、前面所述的dna多核苷酸、前面所述的核酸衍生物或前面所述的载体导入所述细胞中。
[0047]
可以通过使用任何合适的技术将前面所述的rna多核苷酸、前面所述的dna多核苷酸、前面所述的核酸衍生物或前面所述的载体引入细胞中,所述技术的实例包括但不限于电穿孔、孵育、细胞活化和转染、脂质转染、脂质递送、脂质体递送、聚合物转染、聚合物递送、通过肽递送(即但不限于阳离子肽、两亲性肽、细胞穿透肽)、钙或镁沉淀和离子沉淀(也称为dna
‑
磷酸钙沉淀)。
[0048]
进一步,所述细胞的制备方法还包括:在细胞中表达所述hnrnpa2b1或其功能类似物。
[0049]
在本发明的具体实施方案中,将所述hnrnpa2b1或其功能类似物的载体导入细胞中从而使得细胞表达所述hnrnpa2b1或其功能类似物。
[0050]
根据本发明的又一个方面,本发明提供了前面所述的膜结构的制备方法,所述制备方法包括将前面所述的rna多核苷酸、前面所述的核酸衍生物导入所述膜结构中。
[0051]
可以通过使用任何合适的技术将前面所述的rna多核苷酸、前面所述的核酸衍生物直接引入所述膜结构中,所述技术的实例包括但不限于电穿孔、孵育、细胞活化和转染、脂质转染、脂质递送、脂质体递送、聚合物转染、聚合物递送、通过肽递送(即但不限于阳离子肽、两亲性肽、细胞穿透肽)、钙或镁沉淀和离子沉淀(也称为dna
‑
磷酸钙沉淀)。
[0052]
进一步,利用所述hnrnpa2b1或其功能类似物将前面所述的rna多核苷酸或前面所述的核酸衍生物导入所述膜结构中。
[0053]
在本发明的具体实施方案中,前面所述的膜结构的制备方法包括:细胞中表达hnrnpa2b1或其功能类似物、前面所述的rna多核苷酸。
[0054]
进一步,所述制备方法包括将前面所述的rna多核苷酸、前面所述的dna多核苷酸、前面所述的核酸衍生物或前面所述的载体导入所述细胞中;将表达hnrnpa2b1或其功能类似物的载体导入细胞中。
[0055]
进一步,所述制备方法还包括分离纯化所述细胞产生的膜结构。
[0056]
本领域技术人员将理解如何分离根据本发明制备的外泌体。通常,从细胞上清液中收集外泌体,并且可以根据周知的方案通过差速离心或密度离心来分离。可以将包含多核苷酸的外泌体与不包含多核苷酸的外泌体分离,并且可以获得外泌体的亚群。可以使用标准方法从外泌体中分离本发明的多核苷酸。
[0057]
根据本发明的又一个方面,本发明提供了将rna导入膜结构的方法,所述方法包括利用hnrnpa2b1或其功能类似物将包含前面所述的分选基序的rna导入到膜结构中。
[0058]
进一步,将rna导入膜结构的方法包括:细胞中表达hnrnpa2b1或其功能类似物、前面所述的分选基序的rna;
[0059]
更进一步,将rna导入膜结构的方法还包括分离纯化所述细胞产生的所述膜结构。
[0060]
本发明的所述膜结构包括外泌体、囊泡、微囊泡、微颗粒、内体来源的囊泡、多囊泡体或凋亡小体;优选地,所述膜结构是外泌体。
[0061]
优选地,所述rna是mirna。
[0062]
根据本发明的又一个方面,本发明提供了一种应用,所述应用包括以下任一项:
[0063]
1)前面所述的分选基序在将rna分选进入膜结构中的应用。
[0064]
进一步,前面所述的分选基序在利用hnrnpa2b1功能类似物将rna分选进入膜结构中的应用;优选地,所述rna是mirna;所述膜结构是前面所述的膜结构;
[0065]
2)前面所述的分选基序在制备mirna给药系统中的应用。
[0066]
3)前面所述的细胞、前面所述的膜结构在制备mirna给药系统中的应用。
[0067]
4)前面所述的细胞、前面所述的膜结构在制备治疗与前面所述的rna多核苷酸相关的疾病的药物中的应用。
[0068]
进一步,所述疾病包括但不限于遗传性疾病、炎性疾病、癌症、自身免疫性疾病、心脑血管疾病、胃肠道疾病、神经变性疾病。
[0069]
所述疾病的实例包括但不限于:克罗恩病、溃疡性结肠炎、强直性脊柱炎、类风湿性关节炎、多发性硬化、系统性红斑狼疮、结节病、特发性肺纤维化、银屑病、肿瘤坏死因子(tnf)受体相关周期性综合征(traps)、白介素
‑
1受体拮抗剂缺乏(dira)、子宫内膜异位、自身免疫性肝炎、硬皮病、肌炎、中风、急性脊髓损伤、血管炎、格林
‑
巴利综合征、急性心肌梗死、ards、脓毒症、脑膜炎、脑炎、肝衰竭、非酒精性脂肪性肝炎(nash)、非酒精性脂肪肝病(nafld)、肾衰竭、心力衰竭或任何急性或慢性器官衰竭以及相关的基础病因、移植物抗宿主病、杜氏肌营养不良和其他肌营养不良、所有溶酶体贮积病(诸如i型、ii型和/或iii型戈谢病,法布里病,mpsi、ii(亨特综合征)和iii,a、b和c型尼曼匹克症,庞贝病,胱氨酸病等)、尿素循环障碍(诸如n
‑
乙酰谷氨酸合成酶缺乏、氨基甲酰磷酸合成酶缺乏、鸟氨酸氨甲酰转移酶缺乏症、瓜氨酸血症(精氨酸琥珀酸合成酶缺乏)、精氨酸琥珀酸尿症(精氨酸琥珀酸裂解酶缺乏)、精氨酸血症(精氨酸酶缺乏)、高鸟氨酸血症、高氨血症、高瓜氨酸尿症(hhh)综合征(线粒体鸟氨酸转运蛋白缺乏)、瓜氨酸血症ii(柠檬素(一种天冬氨酸谷氨酸转运蛋白)缺乏)、赖氨酸尿蛋白不耐受(y+l氨基酸转运蛋白1突变)、乳清酸尿症(尿苷单磷酸合成酶umps缺乏))、神经退行性疾病(包括阿尔茨海默氏病、帕金森氏病、gba相关帕金森氏病、亨廷顿氏病和其他三核苷酸重复相关疾病)、痴呆、als、癌症诱导的恶病质、厌食症、2型糖尿病和各种癌症。实际上所有类型的癌症都是本发明的相关疾病靶,例如,急性淋巴细胞白血病(all)、急性髓性白血病、肾上腺皮质癌、aids相关癌症、aids相关淋巴瘤、肛门癌、阑尾癌、星形细胞瘤、小脑或脑、基底细胞癌、胆管癌、膀胱癌、骨肿瘤、脑干神经胶质瘤、脑癌、脑肿瘤(小脑星形细胞瘤、脑星形细胞瘤/恶性神经胶质瘤、室管膜瘤、髓母细胞瘤、幕上原始神经外胚层肿瘤、视觉通路和下丘脑神经胶质瘤)、乳腺癌、支气管腺瘤/类癌、伯基特淋巴瘤、类癌瘤(儿童期、胃肠道)、不明原发癌、中枢神经系统淋巴瘤、小脑星形细胞瘤/恶性神经胶质瘤、宫颈癌、慢性淋巴细胞白血病、慢性髓性白血病、慢性骨髓增生性障碍、结肠癌、皮肤t细胞淋巴瘤、促纤维增生性小圆细胞肿瘤、子宫内膜癌、室管膜瘤、食道癌、颅外生殖细胞瘤、性腺外生殖细胞瘤、肝外胆管癌、眼癌(眼内黑色素瘤、视网膜母细胞瘤)、胆囊癌、胃(gastric)(胃(stomach))癌、胃肠道类癌肿瘤、胃肠道间质瘤(gist)、生殖细胞瘤(颅外、性腺外或卵巢)、妊娠滋养细胞肿瘤、神经胶质瘤(脑干神经胶质瘤、脑星形细胞瘤、视觉通路和下丘脑神经胶质瘤)、胃类癌、毛细胞白血病、头颈癌、心脏癌、肝细胞(肝)癌、霍奇金淋巴瘤、下咽癌、眼内黑色素瘤、胰岛细胞癌(内分泌胰腺)、卡波西肉瘤、肾癌(肾细胞癌)、喉癌、白血病((急性淋巴细胞性(也被称为急性淋巴细胞白血病)、急性髓性(也被称为急性髓性白血病)、慢性淋巴细胞性(也被称为慢性淋巴细胞白血病)、慢性髓性(也被称为慢性髓性白血病)、毛细胞白血病))、唇癌和口腔癌、腔癌、脂肪肉瘤、肝癌(原发性)、肺癌(非小细
胞、小细胞)、淋巴瘤、aids相关淋巴瘤、伯基特淋巴瘤、皮肤t细胞淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、髓母细胞瘤、梅克尔细胞癌、间皮瘤、具有隐匿性原发性的转移性鳞状颈癌、口腔癌、多发性内分泌瘤综合征、多发性骨髓瘤/浆细胞瘤、蕈样肉芽肿、骨髓增生异常/骨髓增生性疾病、髓性白血病、慢性髓性白血病(急性、慢性)、骨髓瘤、鼻腔鼻窦癌、鼻咽癌、成神经细胞瘤、口腔癌、口咽癌、骨肉瘤/骨恶性纤维组织细胞瘤、卵巢癌、卵巢上皮癌(表面上皮
‑
间质肿瘤)、卵巢生殖细胞瘤、卵巢低恶性潜能肿瘤、胰腺癌、胰岛细胞癌、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、松果体星形细胞瘤、松果体生殖细胞瘤、松果体母细胞瘤和幕上原始神经外胚层肿瘤、垂体腺瘤、胸膜肺母细胞瘤、前列腺癌、直肠癌、肾细胞癌(肾癌)、视网膜母细胞瘤、横纹肌肉瘤、唾液腺癌、肉瘤(尤文氏家族肿瘤肉瘤、卡波西肉瘤、软组织肉瘤、子宫肉瘤)、塞扎里综合征、皮肤癌(非黑色素瘤、黑色素瘤)、小肠癌、鳞状细胞癌、鳞状颈癌、胃癌、幕上原始神经外胚层肿瘤、睾丸癌、喉癌、胸腺瘤和胸腺癌、甲状腺癌、肾盂和输尿管移行细胞癌、尿道癌、子宫癌、子宫肉瘤、阴道癌、外阴癌、华氏巨球蛋白血症和/或肾母细胞瘤。
[0070]
优选地,mirna给药系统包含前面所述的膜结构。
[0071]
另外,本发明还提供了一种治疗方法,所述治疗方法可用于治疗患有与前面所述的rna多核苷酸相关的疾病的受试者,所述方法包括以下步骤:向所述受试者施用有效量的前面所述的膜结构、前面所述的组合物。
[0072]
本发明使用的hnrnpa2b1功能类似物的序列与hnrnpa2b1序列同源性至少50%以上。
[0073]
本发明的hnrnpa2b1可以是任何物种的,包括但不限于人、鼠、兔子、狗、猪、羊、狗、猫、鸡、鸭、蝙蝠、猴、猩猩、豹、狮子、熊、鲸、鹿、虫、鸵、鸟、象、猞猁。
[0074]
hnrnpa2b1及其功能类似物包括以下名称的基因:q2hj60、a0a6p6ibu0、a0a6p4vnc8、a0a3q7vrt9、a0a024ra28、a0a6i9i2j2、a0a6j0adz6、a0a2y9pda3、x2d2s5、a0a2u3zcu7、a0a6p6id23、a0a2k6bdj1、a0a2k5u0d5、a0a2k6jwl6、a0a671eis7、a0a6p6if65、a0a2r9brm8、a0a096n5a7、a0a7n5p0a5、a0a667ggk5、a0a7k7wh05、a0a7k7m4j5、a0a7l0jzb4、i7dke4、a0a7k7as03、a0a7k8mwy0、i7dag9、a0a7l3wp50、i7ehr8、a0a493tem9、r0jq46、u3ix39、a0a7k4lps5、a0a093hhh7、a0a7j8hcf6、a0a6j0wti9、a0a6j2mnx6、a0a2k6s1a4、a0a3q1mme4、a0a384bpw4、a0a6j0ag81、a0a2y9p0c4、i2cyl4、g3rll0、f6qe39、a0a6p5bqt7、a0a671eec0、a0a6p3ih56、a0a7j8hba4、a0a6d2vu23、a0a6j2mte5、a0a6j0a3x9、a0a2k6nkx6、a0a3q7p561、f7hpz0、a0a2y9ffj7、a0a671ee50、a0a2u3xjb9、a0a6p5bqt9、f7hpy3、a0a2u3v9d2、a0a6j2ben5、a0a4x1u184、a0a6p3ipj3、a0a2k5r389、a0a383z8q9、k7dry9、a0a493tle9、a0a7k4kjm5、i7e8b4、a0a7k7v0y7、a0a7l0wss2、i7dkd9、a0a7k9b0x6、i7ek78、a0a493t6i5、a0a7i2v4n0、a0a383z945、a0a2y9pb46、a0a383z950、a0a2k5i2d4、a0a341c8b8、a0a6p5bka5、a0a673v426、a0a452fnm4、a0a0d9rnx3、a0a341c8q6、a0a452sly2、a0a6j3ik02、a0a452slv3、a0a384bpx3、a0a2k6jwl5、a0a2k5i2f9、a0a1u7u6y2、g9k4k2、a0a6p4vtk1、a0a2i2y8m3、a0a384bpz2、a0a2k6s1c2、a0a2k6bdi1、a0a6j2mt87、g1lhd9、g1ry30、a0a3q7wfs0、a0a2k5m1h0、w5pk95、a0a7j8hb45、a0a3q7rsc4、a0a2k5r395、a0a2y9ffk0、h2qua8、a0a2k6nky2、m3xcq1、a0a6d2w088、a0a2y9h1m9、a0a6p3trd9、a0a2k5m1j4、a0a3q7rv50、a0a2j8vdv7、a0a6p3tmw5、a0a3q7s2n7、a0a2j8vdx4、h0xd32、a0a4x1u3q9、
a0a2k5zzw9、q9tup1、a0a2i3h506、l8i257、a0a3q2i397、a0a4x1ty93、a0a673vde0、a0a673vd85、a0a6j2bhx1、a0a2k5zzx9、a0a7j8d5s0、a0a3q2gw64、a0a3q2l4i4、a0a5f4cpi7、f1q1k6、a0a667gl70、a0a667gl97、a0a7n5jlh2、a0a6p3irb5、a0a2y9h1p6、a0a4w2g0q6、a0a6j3ila9、m3uz37、a0a3q7wfr4、a0a6j3ik79、a0a6d2x320、a0a4w2ht96、a0a481cjy0、a0a4w2hxk0、a0a6j0wwv5、a0a341c7k7、a0a6p3q6m5、a0a452fnl0、a0a2y9jgp4、a0a6j0wty4、a0a6p4vff4、a0a2i2uvj9、a0a7f8qlh1、a0a3q7pfc9、a0a6j3rws9、a0a2k5ebq7、a0a2k5ebj8、a0a340y0v8、a0a340xxq8、a0a2i3lgk2、a0a2y9ffa3、a0a6p3qb55、a0a7j8d5u4、a0a2u3v9d5、a0a7j8d6e8、a0a2r9biq7、a0a1s3ftk1、a0a6i9lee0、g3h2j8、a0a1u8cxe8、a0a0p6jcq8、a0a1s3fv39、a0a286xdn9、a0a3q0c931、a0a3q0ccm9、a0a6j0dtx5、b2gv69、a0a6p5pd14、a0a286y4n7、a0a6j0dmc8、q3uth2、a0a1s3fvm8、a0a7l0pak3、a0a7k9z0w4、a0a7k9v0v1、i7e8b8、a0a7k7a260、a0a7k7l858、g1ndw3、a0a7l3jw29。
[0075]
可用于本发明的细胞可以是原核生物或真核生物。优选地,所述细胞是真核细胞,例如酵母细胞、植物细胞、昆虫细胞或哺乳动物细胞。
[0076]
可用于本发明的产生膜结构的细胞可以称为源细胞,是指可以是能够在合适的条件下产生膜结构的任何类型的细胞,例如在悬浮培养中或在贴壁培养中或任何在其他类型的培养系统中。根据本发明的源细胞还可以包括在体内产生外泌体的细胞。根据本发明的源细胞可以选自宽范围的细胞和细胞系,其可以在悬浮或贴壁培养物中生长或适于悬浮生长。本发明的源细胞可以选自包含以下的群组:间充质干细胞或基质细胞(可从例如骨髓、脂肪组织、华顿氏胶、围产期组织、胎盘、牙芽、脐带血、皮肤组织等获得)、成纤维细胞、羊膜细胞(并且更具体地任选地表达各种早期标记物的羊膜上皮细胞),髓样抑制细胞、m2极化的巨噬细胞、脂肪细胞、内皮细胞、成纤维细胞等。特别感兴趣的细胞系包括人脐带内皮细胞(huvec)、人胚胎肾(hek)细胞、内皮细胞系(诸如微血管或淋巴内皮细胞)、红细胞、红系祖细胞、软骨细胞、不同来源的msc、羊膜细胞、羊膜上皮(ae)细胞、通过羊膜穿刺术获得的或来自胎盘的任何细胞、来自气道或肺泡的上皮细胞、成纤维细胞、内皮细胞等。此外,免疫细胞(诸如b细胞、t细胞、nk细胞、巨噬细胞、单核细胞、树突细胞(dc))也在本发明的范围内,并且基本上任何类型的能够产生膜结构的细胞也涵盖在本文中。通常,膜结构基本上可以源自任何细胞源,无论是原代细胞源还是永生化的细胞系。膜结构来源的源细胞可以是任何胚胎、胎儿和成人体细胞干细胞类型,包括诱导的多能干细胞(ipsc)和通过任何方法获得的其他干细胞。当治疗神经系统疾病时,人们可以考虑利用例如原代神经元、星形胶质细胞、少突胶质细胞、小胶质细胞和神经祖细胞作为源细胞。源细胞可以是待治疗的患者的同种异体、自体或甚至异种性质,即细胞可以来自患者自身或来自不相关的、匹配的或不匹配的供体。在某些情况下,从医学角度来看,同种异体细胞可能是优选的,因为它们可以提供免疫调节作用,该免疫调节作用可能无法从患有某种适应症的患者的自体细胞中获得。例如,在治疗炎性或退行性疾病的背景下,同种异体msc或ae作为产生外泌体的细胞源可能非常有益,这是因为它们的膜结构并且特别是它们的外泌体的固有的免疫调节作用。特别感兴趣的细胞系包括人脐带内皮细胞(huvec)、人胚胎肾(hek)细胞(诸如hek293细胞、hek293t细胞、无血清hek293细胞、悬浮hek293细胞)、内皮细胞系(诸如微血管或淋巴内皮细胞)、红细胞、红系祖细胞、软骨细胞、不同来源的msc、羊膜细胞、羊膜上皮(ae)细胞、通过羊膜穿刺术获得的或来自胎盘的任何细胞、气道或肺泡上皮细胞、成纤维细胞、内皮细胞、
上皮细胞等。
[0077]
本发明的膜结构包括外泌体、微囊泡(mv)或从内泌体、内溶酶体和/或溶酶体途径或从亲代细胞的质膜分泌的任何其他类型的囊泡。一般而言,本发明涉及由细胞分泌、产生和/或衍生的任何类型的囊泡结构,包括但不限于外泌体、囊泡、微囊泡、微颗粒、内体来源的囊泡、多囊泡体或凋亡小体。
附图说明
[0078]
图1显示plko.1
‑
mir
‑
151a
‑
5p
‑
puro慢病毒载体结构示意图;
[0079]
图2显示plko.1
‑
mir
‑
155
‑
5p
‑
puro慢病毒载体结构示意图;
[0080]
图3显示plv
‑
ef1a
‑
hnrnpa2b1
‑
ires
‑
hygro慢病毒载体结构示意图;
[0081]
图4显示mir
‑
151a
‑
5p和mir
‑
155
‑
5p在外泌体中的表达水平结果图;
[0082]
图5显示mir
‑
155
‑
5p及其突变体在外泌体中的表达水平结果图。
具体实施方式
[0083]
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
[0084]
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均为常规生化试剂,可从商业途径得到。
[0085]
实施例1 ggag基序对外泌体靶向的影响
[0086]
一、mirna慢病毒表达载体构建
[0087]
1、以plko.1
‑
puro质粒(sigma,货号shc001)为mirna表达的骨架载体,酶切位点是agei和ecori。
[0088]
2、以渐冻症相关的mirna(hsa
‑
mir
‑
151a
‑
5p和hsa
‑
mir
‑
155
‑
5p)为例,构建载体:
[0089]
hsa
‑
mir
‑
151a
‑
5p的序列为ucgaggagcucacagucuagu(seq id no:10),hsa
‑
mir
‑
151a
‑
5中存在ggag序列;
[0090]
hsa
‑
mir
‑
155
‑
5p的序列为uuaaugcuaaucgugauagggguu(seq id no:7),hsa
‑
mir
‑
155
‑
5p中不存在ggag序列。
[0091]
3、基因合成hsa
‑
mir
‑
151a
‑
5p和hsa
‑
mir
‑
155
‑
5p的shrna结构,合成公司为安徽通用生物科技有限公司,将hsa
‑
mir
‑
151a
‑
5p/hsa
‑
mir
‑
155
‑
5p的shrna结构插入plko.1
‑
puro质粒的agei和ecori之间,载体命名为plko.1
‑
mir
‑
151a
‑
5p
‑
puro和plko.1
‑
mir
‑
155
‑
5p
‑
puro(载体示意图如图1和图2所示);
[0092]
hsa
‑
mir
‑
151a
‑
5p的shrna结构序列为:
[0093]
5`
‑
ccggtcgaggagctcacagtctagtctcgagactagactgtgagctcctcgatttttg
‑
3`(seq id no:11);
[0094]
hsa
‑
mir
‑
155
‑
5p的shrna结构序列为:
[0095]
5`
‑
ccggttaatgctaatcgtgataggggttctcgagaacccctatcacgattagcattaatttttg
‑
3`(seq id no:12)。
[0096]
二、hnrnpa2b1慢病毒表达载体构建
[0097]
1、以plv
‑
ef1a
‑
ires
‑
hygro质粒(addgene,货号plasmid#85134)为hnrnpa2b1表达的骨架载体,酶切位点是ecori和hpa1。
[0098]
2、基因合成hnrnpa2b1序列(其核苷酸序列如seq id no:21所示,氨基酸序列如seq id no:22所示),合成公司为安徽通用生物科技有限公司,将hnrnpa2b1序列插入plv
‑
ef1a
‑
ires
‑
hygro质粒的ecori和hpa1之间,载体命名为plv
‑
ef1a
‑
hnrnpa2b1
‑
ires
‑
hygro(载体示意图如图3所示)。
[0099]
三、慢病毒包装
[0100]
1、细胞接种:10cm dish接种1.5
×
107个293t细胞。加10ml含10%fbs(hyclone,sh30084.03)的dmem(赛默飞世尔科技,11965084)培养基,37℃,5%co2培养箱过夜培养,16
‑
24h后转染;
[0101]
2、细胞转染:细胞生长的交汇度达到80
‑
90%,准备转染。转染体系如下:
[0102]
表1转染体系
[0103][0104]
b液逐滴加入a液中,边加边摇匀,室温22
‑
26℃静置15min。逐滴加到培养皿中,轻轻摇匀,5%co2,37℃过夜培养。
[0105]
3、转染换液:16
‑
18h后,去掉含转染试剂的培养基,加入10ml含10%fbs的dmem,5%co2,37℃条件下继续培养,(此时开始细胞上清液中将产出病毒)。
[0106]
4、病毒第一次收获:从转染开始算48h后,收获细胞上清,转移到50ml离心管中,3,000rpm离心10min,上清用0.45μm滤膜过滤,4℃保存。细胞加入10ml含10%fbs的dmem,5%co2,37℃条件下继续培养。
[0107]
5、病毒第二次收获:收获细胞上清,转移到50ml离心管中,3,000rpm离心10min,上
清用0.45μm滤膜过滤,4℃保存。细胞用10%消毒液(84消毒液)处理后丢弃。
[0108]
6、病毒浓缩:将收集到的慢病毒组分用0.45μm滤器过滤去除细菌污染,将过滤后组分与lenti
‑
xtm concentrator(clonetech,631232)按照体积比3:1混合,轻轻颠倒混匀。
[0109]
7、4℃孵育30min或过夜。
[0110]
8、4℃1,500g离心45min,离心后会在管底看到白色沉淀。
[0111]
9、小心吸去上清液,不能破坏白色沉淀。
[0112]
10、用适当体积慢病毒保存液重悬沉淀,并将慢病毒分装、保存于
‑
80℃。
[0113]
四、慢病毒感染间充质干细胞
[0114]
1、慢病毒转染前18
‑
24小时,将间充质干细胞以1
×
105/cm2铺到10cm培养皿中。
[0115]
2、第二天,用含有8μg/ml polybrene(yeasen,40804es76)的新鲜培养基替换原培养基,加入适量病毒悬液。37℃孵育。
[0116]
3、继续培养24小时,用新鲜培养基替换含有病毒的培养基。
[0117]
4、继续培养。在转染后72
‑
96小时后。添加1μg/ml puromycin(yeasen,60210es25)和50μg/ml hygromycin(yeasen,60224es03)筛选阳性细胞。
[0118]
5、继续培养,收集阳性细胞培养液。
[0119]
6、阳性细胞培养液在2000
×
g离心30分钟,去除细胞碎片,保存在2
‑
8度。
[0120]
五、外泌体提取检测
[0121]
1、使用总外泌体分离试剂(赛默飞世尔科技,4478359)分离提取外泌体。
[0122]
2、将阳性细胞培养液与总外泌体分离试剂按照2:1比例混合,2
‑
8度静置过夜。
[0123]
3、第二天将上述混合液在2
‑
8度,以10000g离心力离心2小时。
[0124]
4、离心后,去除上清液,使用总外泌体分离试剂重悬,得到外泌体,2
‑
8度可以保存1周。
[0125]
5、qpcr检测外泌体中mir
‑
151a
‑
5p和mir
‑
155
‑
5p表达水平。
[0126]
六、结果
[0127]
结果如图4所示,mir
‑
151a
‑
5p在外泌体中高表达,而mir
‑
155
‑
5p在外泌体中低表达。上述结果表明,ggag基序影响mirna靶向外泌体。
[0128]
实施例2基因突变hsa
‑
mir
‑
155
‑
5p改变其外泌体靶向
[0129]
一、步骤
[0130]
1、通过基因合成改变hsa
‑
mir
‑
155
‑
5p序列结构,产生以下突变体:
[0131]
表2 hsa
‑
mir
‑
155
‑
5p突变体
[0132]
野生型uuaaugcuaaucgugauagggguu seq id no:7突变体1uuaaugcuaaucgugauaggaguu seq id no:1突变体2uuaaugcuaaucgugauagguguu seq id no:2突变体3uuaaugcuaaucgugauagaaguu seq id no:3突变体4uuaaugcuaaucgugauaguuguu seq id no:4突变体5uuaaugcuaaucgugaucggaguu seq id no:8突变体6uuaaugcuaaucgugaugggaguu seq id no:9突变体7uuaaugcuaaucgugacaggaguu seq id no:5突变体8uuaaugcuaaucgugagaggaguu seq id no:6
[0133]
2、重复实施例1
‑
5,qpcr检测外泌体中mir
‑
155
‑
5p及其突变体表达水平。
[0134]
突变体1的shrna结构序列为:
[0135]
5`
‑
ccggttaatgctaatcgtgataggagttctcgagaacuccuaucacgauuagcauuaatttttg
‑
3`(seq id no:13);
[0136]
突变体2的shrna结构序列为:
[0137]
5`
‑
ccggttaatgctaatcgtgataggtgttctcgagaacaccuaucacgauuagcauuaatttttg
‑
3`(seq id no:14);
[0138]
突变体3的shrna结构序列为:
[0139]
5`
‑
ccgguuaaugcuaaucgugauagaaguuctcgagaacuucuaucacgauuagcauuaa tttttg
‑
3`(seq id no:15);
[0140]
突变体4的shrna结构序列为:
[0141]
5`
‑
ccgguuaaugcuaaucgugauagaaguuctcgagaacuucuaucacgauuagcauuaatttttg
‑
3`(seq id no:16);
[0142]
突变体5的shrna结构序列为:
[0143]
5`
‑
ccgguuaaugcuaaucgugaucggaguuctcgagaacuccgaucacgauuagcauuaa tttttg
‑
3`(seq id no:19);
[0144]
突变体6的shrna结构序列为:
[0145]
5`
‑
ccgguuaaugcuaaucgugaugggaguuctcgagaacucccaucacgauuagcauuaatttttg
‑
3`(seq id no:20);
[0146]
突变体7的shrna结构序列为:
[0147]
5`
‑
ccgguuaaugcuaaucgugacaggaguuctcgagaacucccaucacgauuagcauuaatttttg
‑
3`(seq id no:17);
[0148]
突变体8的shrna结构序列为:
[0149]
5`
‑
ccgguuaaugcuaaucgugagaggaguuctcgagaacuccucucacgauuagcauuaatttttg
‑
3`(seq id no:18)。
[0150]
二、结果
[0151]
结果如图5所示,野生型mir
‑
155
‑
5p、突变体5、突变体6在外泌体中低表达;突变体1,2,3,4,7,8在外泌体中高表达。
[0152]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1