一种抗幽门螺旋杆菌重组抗体、制备方法及用途与流程
1.一种抗幽门螺旋杆菌重组抗体、制备方法及用途,本发明属于生物医药技术领域,具体涉及抗体工程技术领域。
背景技术:
2.幽门螺旋杆菌(helicobacter pylori)简称hp,是一种革兰氏阴性微需氧的细菌,生存于胃部及十二指肠的各个区域内,它与慢性胃炎、消化性胃溃疡、胃癌和胃黏膜相关组织淋巴瘤(malt)等胃部疾病相关,被世界卫生组织归为i类致癌因子。我国幽门螺旋杆菌感染率高达58.07%染,属于世界上感染率较高的地区。基于抗生素、质子泵抑制剂和铋剂联合,开发出的“三联”药物疗法虽然是目前根除hp感染的有效方法,但该药物疗法存在诸多弊端:(1)药物价格昂贵,治疗周期长,病人依从性较差。(2)长期药物治疗使耐药菌增多及肠道菌群失调。(3)药物治疗难以避免“反复治疗,反复感染”的局面。因此研究开发具有预防性、治疗性及无毒副作用的新型药物是控制幽门螺旋杆菌感染切实有效的方法,并逐渐成为国内外学者研究防治幽门螺旋杆菌感染策略的热点。
3.生物医药的发展和抗体技术的快速,为那些传统传统疾病的治疗提供了新的治疗策略。通常我们所说的单克隆抗体是全长抗体,虽然单克隆抗体具有纯度高、效价高、特异性强、结构均一、血清交叉反应少、制备成本低等多种优点,但其分子量在150~196kda之间。这么大的分子量在实际运用中常遇到组织渗透性差、易降解等问题,因此,高亲和力、高特异性、分子量小的基因工程抗体是当前重组抗体技术研发的趋势所在。
4.虽然与完整抗体相比,单链抗体(scfv抗体)具有更好的细胞穿透性。然而,由于单链抗体体积太小、对抗原的亲和力低,限制了单链抗体的快速清除效果。fab片段是由一个完整的轻链和重链靠氮端的一半(vh和ch1)通过键间二硫键结合在一起,与scfv抗体相比,fab抗体具有较大的分子质量、对抗原的亲和力更高。然而,传统的fab抗体需要用木瓜蛋白酶水解天然抗体,再经分离纯化后才得到fab抗体,制备工序繁琐。
技术实现要素:
5.本发明的目的在于:提供一种抗幽门螺旋杆菌重组抗体、制备方法及用途,以解决现有的fab抗体制备工序繁琐和稳定性低的缺陷。
6.本发明采用的技术方案如下:
7.一种抗幽门螺旋杆菌重组抗体,所述抗体为rfab,包括v
h
和v
l
,v
h
和v
l
由一端全人源c
h1‑
c
l
片段融合构成,v
h
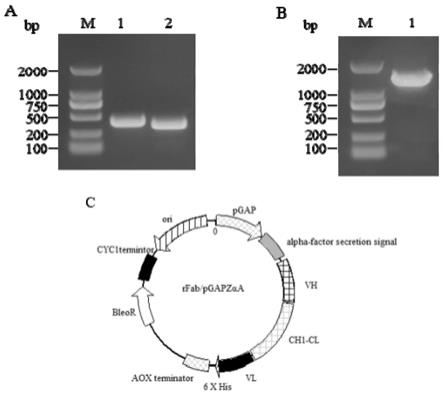
的氨基酸序列如seq id no:1所示,v
l
的氨基酸序列如seq id no:2所示,c
h1‑
c
l
的氨基酸序列如seq id no:3所示。
8.本技术的技术方案中,通过基因重组技术将fab抗体中轻链和重链通过一段全人源 c
h1‑
c
l
片段连接构成rfab,同时解决了fab抗体制备工序繁琐和稳定性低的缺点;制备的抗幽门螺旋杆菌全人源单链抗体具有穿透性强,分子量小,同时保留了天然抗体的主要生物学活性和特异性,操作简便。
9.优选的,c
h1‑
c
l
之间由(gly4ser)3连接,rfab的氨基酸序列如seq id no:4所示。
10.一种抗幽门螺旋杆菌重组抗体的中间表达载体,中间表达载体由权利要求2所述的全人源c
h1‑
c
l
基因序列插入载体pgapzαa中得到,得到的中间表达载体为c
h1‑
c
l
/pgapzαa,编码c
h1‑
c
l
的核酸序列为seq id no:5所示,中间表达载体为c
h1‑
c
l
/pgapzαa的核酸序列如seq id no:6所示。
11.一种表达抗幽门螺旋杆菌重组抗体的真核表达载体,真核表达载体由抗幽门螺旋杆菌重组抗体的v
h
和v
l
序列插入到所述的中间表达载体c
h1‑
c
l
/pgapzαa中得到,得到的真核表达载体为rfab/pgapzαa,编码v
h
的核酸序列如seq id no:7所示,编码v
l
的核酸序列如seq id no:8所示,编码抗幽门螺旋杆菌重组抗体的核酸序列如seq id no:9所示,真核表达载体为rfab/pgapzαa的序列如seq id no:10所示。
12.一种抗幽门螺旋杆菌重组抗体的真核表达菌株,将所述的真核表达载体rfab/pgapzαa 线性化后,电击转入真核表达菌株毕赤酵母gs115株系,筛选得到的表达rfab的重组基因工程菌株。
13.一种抗幽门螺旋杆菌重组抗体的制备方法,将所述的表达rfab的重组基因工程菌株发酵后,经ni
‑
nta镍离子交换层析,获得抗幽门螺旋杆菌重组抗体rfab。
14.所述的抗幽门螺旋杆菌重组抗体在制备成用于检测幽门螺旋杆菌感染的试剂盒中的用途。
15.所述的抗幽门螺旋杆菌重组抗体在制备用于预防和/或治疗因幽门螺杆菌感染引起的疾病的抗体制剂中的用途。
16.本技术的技术方案中,v
h
为重链可变区;v
l
为轻链可变区。
17.综上所述,由于采用了上述技术方案,本发明的有益效果是:
18.1、本发明中,通过基因重组技术将fab抗体中轻链和重链通过一段全人源c
h1‑
c
l
片段连接构成rfab,同时解决了fab抗体制备工序繁琐和稳定性低的缺点;
19.2、本发明中,制备的抗幽门螺旋杆菌全人源单链抗体具有穿透性强,分子量小,同时保留了天然抗体的主要生物学活性和特异性,操作简便;
20.3、本发明中,通过包含c
h1‑
c
l
片段的中间表达载体,在c
h
1上游和c
l
片下游带有多克隆位点,可以将不同的v
h
和v
l
插入到c
h1‑
c
l
/pgapzαa载体中,从而为开发其他特异的重组rfab提供中间材料。
附图说明
21.图1为本发明随机从从天然全人源scfv抗体文库中挑取的部分克隆子小量表达后 elisa筛选阳性单链抗体;
22.图2为对筛选的6株阳性克隆与十种常见菌交叉反应活性进行elisa检测。
23.图3中a为c
h1‑
c
l
的扩增结果,b为c
h1‑
c
l
/pgapzαa的结构示意图;
24.图4中a为对抗幽门螺旋杆菌scfv基因的v
h
和v
l
片段的扩增结果;b为重组片段 v
h
‑
c
h1‑
c
l
‑
v
l
的pcr鉴定结果;c为重组载体rfab/pgapzαa的结构示意图;
25.图5为western blot检测重组蛋白rfab在转化株酵母中的表达情况;
26.图6中a为sds
‑
page鉴定纯化的重组抗体rfab;b为western blot检测纯化的重组抗体rfab;
27.图7中a为western blot验证重组抗体rfab与幽门螺旋杆菌以及十种常见菌全蛋白提取物的结合活性;b为elisa检测纯化的rfab与幽门螺旋杆菌菌体以及十种常见菌菌体的结合活性。
具体实施方式
28.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
29.实施例1
30.抗幽门螺旋杆菌的培养
31.a、幽门螺旋杆菌培养基:称取哥伦比亚琼脂39g加入到1l双蒸水中,经121℃,20min 灭菌后冷却至50℃,加入温育的脱纤维绵羊血和幽门螺旋杆菌选择性添加物分别至终浓度为7%和4%。
32.b、取冷冻保存的幽门螺旋杆菌立即放入37℃水浴30s,取100μl涂布于哥伦比亚选择性培养基上,置于co2培养箱,37℃(o
2 5%、co
2 10%、n
2 85%)活化24h。经两次活化后,转接至新配置的哥伦比亚选择性培养基上,培养12h。
33.实施例2
34.利用噬菌体展示抗体库技术筛选抗幽门螺旋杆菌单链抗体
35.本实验室前期已构建了天然全人源scfv抗体文库,文库容量达到2.5
×
108,多样性好。用幽门螺旋杆菌作为抗原,采用免疫磁珠法对天然全人源scfv抗体文库进行噬菌体展示富集,从富集后的scfv抗体文库中随机挑选克隆子,进行单克隆子噬菌体扩增表达,对表达的scfv以抗m13
‑
hrp单克隆抗体进行噬菌体elisa检测。本实施例的具体实验如下:
36.(1)向ep管中加入1.5ml 5%mpbs封闭过夜后,弃掉mpbs,用pbs洗涤3次。
37.(2)取100μl浓度为1.72
×
10
13
的cfu噬菌体单链抗体文库和200μl5%mpbs,加入到已封闭好的ep管中混匀后冰浴1h。
38.(3)3300g离心10min,将上清加入到200μl细胞浓度约为106个/ml混合菌液中(包括沙门氏菌、酿酒酵母、枯草芽孢杆菌、嗜酸乳杆菌、瑞士乳杆菌、植物乳杆菌、乳链球菌、双歧杆菌、鼠李糖乳杆菌以及灭活后的大肠杆菌,按等比例混合),混匀37℃水浴30min。
39.(4)3300g离心10min,将上清转移到200μl细胞浓度约为106个/ml幽门螺旋杆菌细胞悬液中,混匀,37℃水浴30min。
40.(5)3300g离心10min,弃上清,用含1%tween20的pbs洗涤5次,再用pbs洗涤5 次,去掉非特异性结合的噬菌体。
41.(6)用1ml tbs
‑
胰蛋白酶(10μg/ml)重新悬浮幽门螺旋杆菌,37℃洗脱30min。
42.(7)取50μl洗脱下的噬菌体感染950μl e.coli tg1(od
600
=0.4),37℃水浴30min。
43.(8)取900μl经噬菌体感染后的tg1,涂布于含100μg/ml氨苄青霉素和1%葡萄糖的tye平板上,37℃过夜培养。
44.(9)刮下平板上的菌落,加入到200ml 2
×
ty培养基(含100μg/ml氨苄青霉素和1%葡萄糖)中,37℃培养12h,扩增筛选后的噬菌体。然后添加12μl浓度为6.3
×
10
13
pfu的 km13,经拯救释放含scfv片段的噬菌体,用于下一轮筛选。
45.(10)按照上述(1)至(9)程序,对单链抗体文库进行反复5轮筛选。
46.(11)取50μl最后一轮筛选后得到的噬菌体感染950μl e.coli tg1(od
600
=0.4),37℃水浴30min。
47.(12)用pbs以10倍梯度稀释至10
‑
6,各稀释梯度分别取100μl涂布于含100μg/ml氨苄青霉素和1%葡萄糖的tye平板上,37℃过夜培养。
48.(13)随机挑选96各单菌落,分别接入到含100μl 2
×
ty(含100μg/ml氨苄青霉素和 1%葡萄糖)细胞培养板中,37℃过夜培养。
49.(14)每孔取2μl转移到另一块每孔含200μl 2
×
ty(含100μg/ml氨苄青霉素和1%葡萄糖)细胞培养板中,37℃培养2h,再向每孔中加入1μl浓度为6.3
×
10
13
pfu的km13, 37℃继续培养1h。
50.(15)将培养物1800g离心10min,弃上清,每孔加入200μl新鲜的2
×
ty(含100μg/ml 氨苄青霉素和1%葡萄糖)重悬细胞,37℃过夜培养,经拯救释放含scfv片段的噬菌体。
51.实施例3
52.筛选结果的elisa检测
53.(1)步骤b(实施例2)培养好的幽门螺旋杆菌刮至含有1mlpbs缓冲液的1.5mlep 管中,混匀,反复洗涤3次。
54.(2)每孔加入100μl 0.25%戊二醛,37℃培养2h,固定细胞。
55.(3)每孔200μl pbs洗涤,去除未固定的幽门螺旋杆和多余的戊二醛,反复洗涤5次。
56.(4)每孔加入300μl 2%脱脂牛奶封闭酶标板,37℃培养2h;用200μl pbs洗去多余脱脂牛奶,反复洗涤5次。
57.(5)每孔加入200μl脱脂牛奶,同时每孔加入10μl km13拯救的带有scfv单克隆的噬菌体,震荡混匀,37℃浮育1h。
58.(6)每孔用200μl 0.1%tween20的pbs反复洗涤5次,去除非特异性结合的噬菌体。
59.(7)每孔加入200μl用脱脂牛奶稀释5000倍的hrp
‑
anti
‑
m13,37℃浮育1h。
60.(8)再用200μl含0.2%tween20的pbs反复洗涤5次,去除残留液体。
61.(9)每孔加入100μl tmb(100μg/ml tmb溶于0.1mol/l醋酸钠溶液,ph6.0,添加 30%h2o2的比例为1:5000),37℃显色5min。
62.(10)每孔加入50μl 1mol/lh2so4终止反应,测定450下的吸光值。
63.图1elisa结果显示,随机挑取的96个克隆子中有6株阳性克隆图1为采用elisa筛选出的部分克隆子,将450nm下的吸光值大于1.5的第21、45、49、54、64以及第79株阳性克隆分别命名为scfv1
‑
scfv6。
64.阳性克隆交叉反应的测定
65.按实施例2所示方法用戊二醛分别将沙门氏菌、酿酒酵母、枯草芽孢杆菌、嗜酸乳杆菌、瑞士乳杆菌、植物乳杆菌、乳链球菌、双歧杆菌、鼠李糖乳杆菌以及灭活后的大肠杆菌等 10中常见菌和幽门螺旋杆菌分别固定于酶标板中,采用elisa的方法测定筛选到的阳性克隆与各菌的结合效果。
66.结果显示,筛选到的6株阳性克隆中,scfv1、scfv2、scfv4、scfv6与各菌均无交叉反应活性,图2。
67.实施例4
68.通用载体ch1
‑
cl/pgapzαa的构建
69.通过ncbi数据库检索到人源igg的ch1和cl区域基因序列,以ggtggtggtggttctggtggtggtggttctggtggtggtggttct序列将ch1和cl基因连接,最后提交至金唯至公司,将该片段人工合成至pet
‑
28a载体,以上游扩增引物 5
’‑
gcggtaccatgccatctgttttcccattg
‑3’
和下游扩增引物 5
’‑
gcgtcgacagctctgttgaaagacttaacg
‑3’
,
70.按照如下组分扩增ch1
‑
cl片段
[0071][0072]
得到的带有限制性酶切位点kpni和sali的ch1
‑
cl片段,将该片段和pgapzαa以kpni 和sali双酶切后,用t4 dna ligase连接,构建成通用载体ch1
‑
cl/pgapzαa,ch1
‑
cl 的扩增结果如图3a,ch1
‑
cl/pgapzαa的结构示意图如图3b,图3b中pgap表示gap 启动子,alpha
‑
factor secretion signal表示a分泌因子信号;ch1
‑
cl表示重链恒定区1
‑
轻链恒定区;6x his表示6x组氨酸标签,aox terminator表示aox终止子,bleor表示博兰霉素基因,cyc1terminator表示cyc1终止子,ori表示复制起始位点。
[0073]
实施例5
[0074]
抗幽门螺旋杆菌单链抗体的v
h
和v
l
片段的扩增
[0075]
选取实施例3中具有最高od
450
吸收值和无交叉反应的阳性克隆scfv6进行大量表达后用质粒小量抽提试剂盒提取噬菌体质粒,并送至金唯至公司测序。上游测序引物: 5
’‑
caggaaacagctatgac
‑3’
,下游测序引物:5
’‑
ctatgcggccccattca
‑3’
。
[0076]
根据测序结果,分别设计扩增v
h
片段和v
l
片段的引物。v
h
片段上游引物: 5
’‑
gtctcggatcggtaccatgaagtacttgttgccaac
‑3’
,下游引物: 5
’‑
gaaaacagatggcatagtaccagaaccaccagaagaaacagtaac
‑3’
;vl片段上游引物:5
’‑
tttcaacagagctgttgacggtggttctactgacatccaaatgactc
‑3’
,下游引物:5
’‑
gatgatgatgatgatggtcgacagcagcagcaccgttagac
‑3’
;
[0077]
按照如下组分扩增重链可变区和轻链可变区,
[0078][0079]
扩增反应条件为98℃10s,52℃5s,72℃1min,30次循环;72℃10min,4℃∞。
[0080]
扩增出来的v
h
和v
l
片段,按上海生工胶回收纯化试剂盒纯化回收。
[0081]
将通用载体c
h1‑
c
l
/pgapzαa以kpni和sali完全双酶切后,用酚氯仿抽提乙醇沉淀法进行纯化。
[0082]
将纯化的v
h
和v
l
片段和酶切、纯化后的c
h1‑
c
l
/pgapzαa按诺维赞提供的clonexpress ii one step试剂盒进行连接,连接产物转化dh5α感受态细胞、提取质粒,送至金唯至进行测序,测序引物为:gcacaaatttccggctgaagct和 gaggaacagtcatgtctaagg。vh和vl扩增结果图4a、同源重组后vh
‑
ch1
‑
cl
‑
vl 鉴定结果图4b、rfab
‑
pgapzαa结构示意,图4c,图4c中,pgap表示gap启动子, alpha
‑
factor secretion signal表示a分泌因子信号;vh表示重链可变区,ch1
‑
cl表示重链恒定区1
‑
轻链恒定区;vl表示轻链可变区,6x his表示6x组氨酸标签,aox terminator 表示aox终止子,bleor表示博兰霉素基因,cyc1terminator表示cyc1终止子,ori表示复制起始位点。
[0083]
重组质粒rfab
‑
pgapzαa以限制性核酸内切酶avrii线性化后,用电击转化法导入毕赤酵母gs115。
[0084]
western blot验证重组蛋白表达
[0085]
将转化株酵母接中至ypd培养基中,30℃培养18h后,5000g离心5min,分别收集培养基和菌体。用饱和硫酸铵沉淀法浓缩并粗提培养基中的分泌蛋白;用超声破碎法破碎菌体细胞,破碎完成后,于4℃,12000rpm离心20min,收集上清。
[0086]
将来自培养基中的粗提蛋白和破碎上清用于western blot检测:将粗提蛋白和破碎细胞上清沸水浴10min后,直接点种至硝酸纤维素薄膜,晾干后用5%脱脂牛奶封闭1h,以小鼠抗6
×
his标签抗体为一抗,4℃过夜浮育;以兔抗小鼠igg
‑
hrp抗体为二抗,检测重组蛋白rfab表达情况。
[0087]
图5显示培养基中和酵母细胞中均含有重组蛋白表达。
[0088]
重组抗体rfab的纯化
[0089]
按照镍离子亲和层析柱(上海生工)说明书进行。
[0090]
sds
‑
page(图6a)和western blot(图6b)验证抗体蛋白经镍离子亲和层析柱纯化后结果,结果证实成功纯化出抗体蛋白。
[0091]
实施例5重组抗体rfab功能的验证
[0092]
一、重组抗体rfab与幽门螺旋杆菌蛋白的结合活性
[0093]
将实例1培养的幽门螺旋杆菌以及十种常见菌用超声波破碎裂解,破碎上清进行 sds
‑
page,并转移至硝酸纤维素薄膜。
[0094]
转膜封闭后以纯化的重组抗体rfab室温浮育1h,pbs洗涤三次后,再以anti
‑6×
his igg
‑
hrp室温下浮育1h,洗涤后在化学发光成像仪中曝光检测。
[0095]
图7a为western blot验证重组抗体rfab与幽门螺旋杆菌蛋白的结合活性,结果显示,重组抗体rfab只特异的与幽门螺旋杆菌蛋白发生结合。
[0096]
二、重组抗体rfab与幽门螺旋杆菌菌体的结合
[0097]
按实例3中的方法将幽门螺旋杆菌以及十种常见菌固定于酶标板中,每孔加入300μl 2%脱脂牛奶封闭酶标板,37℃培养2h;用200μl pbs洗去多余脱脂牛奶,反复洗涤5次。
[0098]
每孔加入200μl脱脂牛奶,同时每孔加入10μl纯化后的rfab,震荡混匀,37℃浮育 1h。
[0099]
每孔用200μl 0.1%tween20的pbs反复洗涤5次,去除未异性结合的rfab。
[0100]
每孔加入200μl用脱脂牛奶稀释5000倍的hrp
‑
anti
‑6×
his,37℃浮育1h。
[0101]
再用200μl含0.2%tween20的pbs反复洗涤5次,去除残留液体。
[0102]
每孔加入100μl tmb(100μg/ml tmb溶于0.1mol/l醋酸钠溶液,ph6.0,添加30%h2o2的比例为1:5000),37℃显色5min。
[0103]
每孔加入50μl 1mol/lh2so4终止反应,测定450和650nm下的吸光值。
[0104]
图7b为elisa验证重组抗体rfab与幽门螺旋杆菌菌体的特异结合活性,结果显示,重组抗体rfab仅与幽门螺旋杆菌可发生特异结合。
[0105]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1