一种高效分离制备狗牙根原生质体的方法
1.本发明属于生物技术领域,具体涉及一种高效分离制备狗牙根原生质体的方法。
背景技术:
2.狗牙根(cynodon dactylon l.)是禾本科画眉草亚科狗牙根属的草本植物,是一种重要的暖季型草坪草和牧草,具有生长快、绿期长、耐践踏、耐修剪、耐盐碱、适口性好等诸多优点,在中国南方地区被广泛用于运动场、公园和绿化带的草坪建植以及边坡、荒地的放牧草场建植,具有重要的经济价值。
3.除拥有上述优良特性外,狗牙根作为禾本科的野生草种,还具有常异交、染色体倍性复杂的特点,使用传统的杂交育种方法培育狗牙根新品种异常困难。植物细胞去除细胞壁后的原生质体类似动物细胞,易于摄取dna质粒、病毒、细胞器等外源物质,不仅可用来研究基因的亚细胞定位与表达调控机制,也可以应用于dna转化、制备融合细胞进行基因工程和细胞工程育种。草坪草、牧草等禾本科植物难以采用农杆菌介导法转基因,因此,在草坪草和牧草育种中原生质体技术尤为重要,是目的基因转化和表达的有效途径。
4.目前已有许多植物的原生质体得到成功分离和应用(yoo sd,cho yh,sheen j.arabidopsis mesophyll protoplasts:a versatile cell system for transient gene expression analysis.nat protoc,2007,2:1565
‑
1572;trinidad jl,longkumer t,kohli a.rice protoplast isolation and transfection for transient gene expression analysis.methods mol biol,2021,2238:313
‑
324;burris kp,dlugosz em,collins ag,stewart cn jr,lenaghan sc.development of a rapid,low
‑
cost protoplast transfection system for switchgrass(panicum virgatum l.).plant cell rep,2016,35:693
‑
704;yu g,cheng q,xie z,xu b,huang b,zhao b.an efficient protocol for perennial ryegrass mesophyll protoplast isolation and transformation,and its application on interaction study between lpnol and lpnyc1.plant methods.2017,13:46;ren r,gao j,yin d,li k,lu c,ahmad s,wei y,jin j,zhu g,yang f.highly efficient leaf base protoplast isolation and transient expression systems for orchids and other important monocot crops.front plant sci,2021,12:626015)。这些所报道的原生质体分离方法均使用了能够促进细胞壁分解的酶对细胞进行处理,使之脱离细胞壁的束缚成为游离的原生质体。但由于不同植物及器官细胞壁的化学成分不同,需要不断尝试才可探索出能够获得特定植物原生质体所合适的酶的组合和浓度范围。酶解液中甘露醇起着至关重要的作用,作为渗透压稳定剂,适宜浓度的甘露醇能够保持原生质体的完整,使其不会膨胀破裂,而不同植物细胞渗透压并不相同,因此不同植物分离原生质体的酶解液所需的甘露醇浓度也是不同的。常用于植物原生质体分离的材料有叶片、愈伤组织、根、表皮和悬浮细胞等,其中叶片具备取材方便、来源广泛等优势,所以成为原生质体分离的最佳材料。相比其他植物,狗牙根原生质体的研究应用非常匮乏。作为一种禾本科的单子叶植物,狗牙根叶片细且长,革质化严重,对其进行操作处理较
为不便,原生质体的制备较常见的双子叶植物存在更多困难(彭小群,唐然,解新明.禾本科植物原生质体分离研究进展.中国农学通报,2015,31(01):252
‑
257.)。截至目前,有关狗牙根原生质体只有其与匍匐剪股颖原生质体融合的报道(梁雪莲,陈平,佘伟标,黄黉.匍匐翦股颖和狗牙根原生质体融合研究.中国草地学报,2009,31(04):63
‑
68.),且文中未详细阐述获得狗牙根原生质体的分离方法。随着狗牙根基因组序列信息的释放,大量狗牙根重要基因的功能特征有待进一步的鉴定。基因功能的解析需要一定的技术体系支撑。建立高效的狗牙根原生质体分离方法不仅能够为狗牙根的细胞工程育种提供基础技术支撑,也将加快狗牙根功能基因组学及后续许多基础研究的进程。
技术实现要素:
5.发明目的:针对现有技术中存在的问题,本发明提供一种高效分离制备狗牙根原生质体的方法,并借助绿色荧光蛋白对狗牙根原生质体质粒瞬时转化体系进行验证,旨在成功建立狗牙根叶片原生质体分离系统,弥补狗牙根原生质体制备的空白,为狗牙根功能基因分析和遗传转化等研究提供技术支持。
6.技术方案:为了实现上述目的,本发明所述一种高效分离制备狗牙根原生质体的方法,包括以下步骤:
7.(1)从狗牙根植株剪下幼嫩叶片,刮去叶片下表皮后,将叶片撕成长条,置于培养皿中;
8.(2)在培养皿中加入含纤维素酶和离析酶的酶解缓冲液,抽真空使酶解缓冲液充分浸润叶片;
9.(3)将含酶解缓冲液和叶片长条的培养皿于黑暗避光环境中室温进行酶解;
10.(4)将酶解液过滤离心去除上清;
11.(5)采用洗涤缓冲液洗涤细胞去除残余酶液;
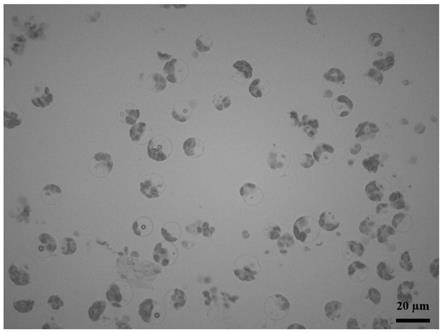
12.(6)洗涤后的细胞离心后用维持缓冲液重悬获得原生质体细胞,室温避光培养。
13.其中,步骤(1)中使用刀片刮去叶片下表皮后,用尖头镊子将叶片撕成宽度为0.4
‑
0.6mm的长条。
14.其中,步骤(2)中酶解缓冲液包括20mm吗啉乙磺酸,0.52m甘露醇,20mm氯化钾,10mm氯化钙,0.1%牛血清白蛋白,ph值为5.7。
15.其中,步骤(2)中酶解缓冲液含质量分数2%
‑
4%纤维素酶和质量分数0.6%
‑
0.8%离析酶。
16.其中,步骤(2)中抽真空时间为60分钟。
17.其中,步骤(3)中将含酶解缓冲液和叶片长条的培养皿放置于水平摇床上,于黑暗避光环境中以30
‑
50转/分钟的低转速晃动酶解缓冲液,室温酶解6
‑
8小时。
18.其中,步骤(4)所述将酶解液过滤离心去除上清为用吸管将三层纱布过滤后的酶解液转入圆底离心管中,以100
‑
300g的低速离心5
‑
10分钟,去除上清。
19.其中,步骤(5)所述洗涤细胞去除残余酶液为用吸管吸取1
‑
2ml洗涤缓冲液,轻轻吹吸重悬细胞,冰上静置20
‑
40分钟,所述洗涤缓冲包括2mm吗啉乙磺酸,154mm氯化钠,128mm氯化钙,5mm氯化钾,ph值为5.7。
20.其中,步骤(6)所述洗涤后的细胞离心后采用维持缓冲液重悬获得原生质体细胞
的方法为将步骤(5)重悬后的细胞100
‑
300g低速离心5
‑
10分钟,去除上清,加入1
‑
2ml维持缓冲液,轻轻吹吸重悬细胞,室温避光培养,所述的维持缓冲液包括4mm吗啉乙磺酸,0.52m甘露醇,16mm氯化镁,ph值为5.7。
21.有益效果:与现有技术相比,本发明具有以下优点:
22.(1)本发明首次提出一种详细的狗牙根原生质体分离制备方法。本发明的方法直接使用室外草坪中生长的狗牙根为材料制备原生质体,无需进行组织培养和其他无菌操作,整个过程操作简单便捷。
23.(2)本发明通过精确设定不同缓冲液的组分配比以及特定的甘露醇浓度,实现了分离过程中狗牙根叶片细胞渗透压的稳定维持。通过本发明的实验步骤,可以从1克叶片中分离获得6.72
×
106个完整的狗牙根原生质体细胞。
24.(3)本发明克服了狗牙根叶片细小不易操作的困难。在参考用刀片切割处理双子叶植物叶片以获得叶片长条进而分离原生质体的基础上,考虑到狗牙根叶脉平行的特点,改用尖锐的镊子撕裂狗牙根叶片,操作更快捷且分离叶片表皮效果更佳。
25.(4)本发明制备的狗牙根原生质体既可以用于狗牙根内源基因的生物学功能验证和亚细胞定位分析,也可以用于原生质体愈伤组织诱导、无性系变异以及和其他植物的原生质体细胞进行细胞融合等细胞工程育种。
附图说明
26.图1为狗牙根叶片原生质体分离流程图;
27.图2为光学显微镜拍摄的成功分离制备的狗牙根原生质体照片(标尺长度为20μm);
28.图3为不同浓度甘露醇条件下的狗牙根原生质体分离效果照片(标尺长度为20μm);
29.图4为激光共聚焦显微镜拍摄的转化pbi121
‑
tb1
‑
egfp后成功在细胞核中显现绿色荧光的狗牙根原生质体照片(标尺长度为2μm)。
具体实施方式
30.以下结合附图和实施例对本发明作进一步说明。
31.下述实施例便于更好的理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。实施例中所用到的实验材料,如无特殊说明,均为自常规生化试剂商店购买得到。
32.国审狗牙根品种
‘
阳江’狗牙根:江苏省中国科学院植物研究所草业研究中心国家主要暖季型草坪草种质库;pbi121
‑
egfp质粒:北京华越洋生物科技有限公司;大肠杆菌dh5α:生工生物工程(上海)股份有限公司。
33.纤维素酶:养乐多(日本)股份有限公司,10,000u/g;离析酶:养乐多(日本)股份有限公司,3,000u/g
34.实施例1
35.狗牙根原生质体的分离制备。
36.1、狗牙根叶片撕裂成条:用剪刀从正常生长、无病害的
‘
阳江’狗牙根植株剪下幼
嫩叶片,用清水洗涤叶片去除附着的尘埃等杂质。用刀片刮去叶片下表皮后,用镊子将叶片撕成宽度约为0.4
‑
0.6mm的长条,实验材料鲜重约为0.5g,置于培养皿中。
37.2、加入纤维素酶和离析酶真空抽滤:在培养皿中加入酶解缓冲液(20mm吗啉乙磺酸,0.52m甘露醇,20mm氯化钾,10mm氯化钙,质量分数0.1%牛血清白蛋白,质量分数4%纤维素酶,质量分数0.8%离析酶,ph值为5.7)至叶片长条被盖没为止,轻轻晃动培养皿润湿叶片长条后,将培养皿置于连接真空泵的干燥器中,抽真空(0.8mpa)60分钟,使酶解缓冲液充分浸润叶片。
38.3、纤维素酶和离析酶孵育酶解去除细胞壁:将含酶解缓冲液和叶片长条的培养皿用锡箔纸包裹遮光,放置于水平摇床上,设置摇床转速为50转/分钟,使叶片长条在酶解缓冲液不断地低速晃动,室温酶解8小时。
39.4、离心收集酶解的细胞:在漏斗中叠放三层纱布后,用吸管吸取酶解8小时后的、呈绿色的酶解液至漏斗中,用圆底离心管收集滤液。将离心管置于离心机中,设置转速为100g,离心5分钟后,取出离心管,用吸管吸去上清。
40.5、洗涤细胞去除残余酶液:用吸管吸取1ml洗涤缓冲液(2mm吗啉乙磺酸,154mm氯化钠,128mm氯化钙,5mm氯化钾,ph值为5.7),紧贴离心管管壁释放缓冲液至离心管中,用吸管轻轻吹吸沉淀的细胞使细胞重悬后,将离心管置于冰上静置30分钟。
41.6、重新离心获得原生质体细胞:将离心管置于离心机中,设置转速为100g,离心5分钟,取出离心管,用吸管吸去上清。用吸管吸取1ml维持缓冲液(4mm吗啉乙磺酸,0.52m甘露醇,16mm氯化镁,ph值为5.7),紧贴离心管管壁释放缓冲液至离心管中,用吸管轻轻吹吸沉淀的细胞使细胞重悬后,用移液器按200μl/管的规格分装至2ml离心管中,得到狗牙根原生质体,室温避光静置。
42.7、吸取10μl狗牙根原生质体在光学显微镜下观察原生质体分离效果,结果如图2显示,一个视野下能观察到较多的狗牙根原生质体,且细胞碎片较少。通过血细胞计数板稀释计算,采用本实施例1的方法其中1克叶片能够分离获得6.72
×
106个完整的狗牙根原生质体细胞。
43.对比例1
44.所有步骤均按照实施例1的方法进行,仅有的不同之处在于:替换酶解缓冲液和维持缓冲液的甘露醇浓度。
45.1、酶解缓冲液和维持缓冲液的甘露醇浓度均分别替换成0.4m、0.48m、0.55m和0.58m。
46.2、维持缓冲液甘露醇浓度保持为0.52m,酶解缓冲液甘露醇浓度分别替换成0.4m、0.48m、0.55m和0.58m。
47.3、酶解缓冲液甘露醇浓度保持为0.52m,维持缓冲液甘露醇浓度分别替换成0.4m、0.48m、0.55m和0.58m。
48.不同条件下狗牙根原生质体分离的结果如图3所示。酶解缓冲液和维持缓冲液中甘露醇浓度替换为(a)0.4m、和(b)0.48m、(c)0.55m和(d)0.58m条件下;维持缓冲液甘露醇浓度保持为0.52m,酶解缓冲液甘露醇浓度替换为(e)0.4m、(f)0.48m、(g)0.55m、(h)0.58m条件下;酶解缓冲液甘露醇浓度保持为0.52m,维持缓冲液甘露醇浓度替换为(i)0.4m、(j)0.48m、(k)0.55m、(l)0.58m,显微镜观察发现其分离效果均明显不及本发明实施例1的方
法。具体表现为1g叶片中狗牙根叶片分离数目均不超过7.47
×
105个,显著低于本发明的实施例1的数量。
49.实施例2
50.狗牙根teosinte branched1(tb1)基因和egfp基因在原生质体中的融合表达
51.1、狗牙根tb1基因的克隆。
52.使用天根生化科技(北京)有限公司的rnaprep植物总rna提取试剂盒提取
‘
阳江’狗牙根叶片的总rna,操作步骤按试剂盒自带说明书进行。使用宝生物(大连)有限公司的逆转录试剂盒将狗牙根叶片rna逆转录为cdna,操作步骤按试剂盒自带说明书进行。
53.根据已在ncbi登录的狗牙根tb1基因(登录号mg523158)核苷酸序列设计扩增其去除终止密码子的全长开放阅读框的引物tb1
‑
f(序列:tctagaatgtttcctttctgtgattc)和tb1
‑
r(序列:ggatccgtaaaaacgtgagttggcaaa),上下游引物5’端分别加上限制性内切酶xbai和bamhi的识别碱基序列tctaga和ggatcc。
54.以上述逆转录获得的狗牙根叶片cdna为模板,pcr扩增获得狗牙根tb1基因。电泳,切胶回收pcr产物,连接宝生物(大连)有限公司的19
‑
t载体,得到连接产物,转入大肠杆菌dh5α中,抗性筛选挑取阳性克隆,将阳性克隆进行液体培养,提取阳性克隆质粒进行测序。
55.2、pbi121
‑
tb1
‑
egfp载体的构建。
56.提取上述测序验证的含有狗牙根tb1基因片段的19
‑
t载体质粒和pbi121
‑
egfp质粒,使用xbai和bamhi两个限制性内切酶于37℃酶切8小时。电泳,切胶回收狗牙根tb1基因片段和pbi121
‑
egfp载体酶切片段,使用t4dna连接酶将摩尔比为3:1的狗牙根tb1基因片段和pbi121
‑
egfp载体酶切片段进行连接,连接条件为16℃、8小时。
57.将连接产物转化大肠杆菌dh5α,涂布卡那霉素抗性平板,挑取阳性克隆,将阳性克隆进行液体培养。提取质粒,使用xbai和bamhi两个限制性内切酶于37℃酶切2小时,电泳验证克隆的正确性,得到pbi121
‑
tb1
‑
egfp质粒。
58.3、pbi121
‑
tb1
‑
egfp质粒转化狗牙根原生质体。
59.用移液器吸取20μl酶切验证正确的pbi121
‑
tb1
‑
egfp质粒,加到含200μl实施例1制备的原生质体的2ml离心管中,立即用移液器加入等体积220μl的peg4000溶液(0.4g/ml peg4000,0.52m甘露醇,100mm氯化钙),用手指轻弹混匀,室温静置20分钟。
60.用移液器吸取440μl的洗涤缓冲液(2mm吗啉乙磺酸,154mm氯化钠,128mm氯化钙,5mm氯化钾,ph值为5.7),紧贴离心管管壁释放缓冲液至离心管中,轻柔的上下颠倒离心管,使液体混合均匀。将离心管置于离心机中,设置转速为100g,离心5分钟后,取出离心管,用吸管吸去上清。
61.用移液器吸取1ml维持缓冲液(4mm吗啉乙磺酸,0.52m甘露醇,16mm氯化镁,ph值为5.7),紧贴离心管管壁释放缓冲液至离心管中,用吸管轻轻吹吸沉淀的细胞使细胞重悬后,室温避光培养12小时,使用激光共聚焦显微镜观察记录gfp绿色荧光的亚细胞分布。结果如图4所示,当pbi121
‑
tb1
‑
egfp在狗牙根原生质体中表达时,在细胞核能检测到清晰的gfp信号。这个结果证明使用本发明的方法制备的狗牙根原生质体适用于亚细胞定位实验。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1