一种蒲公英内生真菌及其应用
1.本发明属于植物内生真菌次级代谢产物领域,具体涉及一种蒲公英内生真菌及其应用。
背景技术:
2.蒲公英是一种中草药材,含有多种化学活性物质,包括萜、黄酮、香豆素、酚酸、甾醇类、色素等,这些化合物具有抗菌消炎、利胆保肝、抗肿瘤、抗氧化等生物活性,目前在临床上被广泛应用。研究表明,植物内生真菌可以产生与其宿主植物相同或相似的生理活性成分,对大规模生产蒲公英药用产品具有重要的意义。近年来,关于蒲公英内生真菌的分离及筛选研究屡见报道,其发酵粗产物显示了抗菌、抗肿瘤等生物活性,但蒲公英内生真菌的活性次级代谢产物研究报道相对较少。本发明提供一株蒲公英内生真菌epicoccum sorghinum 1-2并对其次级代谢产物进行分离及抗菌活性研究,从中分离得到了5个顶环氧菌素类化合物(1~5)及2个苯酚类化合物(6,7),其中化合物1和2为首次报道的新化合物。
技术实现要素:
3.本发明提供一种蒲公英内生真菌epicoccum sorghinum 1-2。所述蒲公英内生真菌epicoccum sorghinum 1-2的菌种保藏信息:保藏单位名称:中国微生物菌种保藏管理委员会普通微生物中心;保藏单位地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所;保藏日期:2021年7月13日;保藏编号:cgmcc no.22470;分类命名:高粱附球菌epicoccum sorghinum。
4.本发明的另一实施方案提供一种上述蒲公英内生真菌epicoccum sorghinum 1-2的次级代谢产物或其药学上可接受的盐,其特征在于所述次级代谢产物具有化合物1-7所示的结构:
[0005][0006]
本发明的另一实施方案提供上述蒲公英内生真菌epicoccum sorghinum 1-2在制备化合物1、2、3、4、5、6和/或7中的应用。
[0007]
本发明的另一实施方案提供上述蒲公英内生真菌epicoccum sorghinum 1-2在制备化合物1、2中的应用。
[0008]
本发明的另一实施方案提供上述蒲公英内生真菌epicoccum sorghinum 1-2在制备化合物1、2、6中的应用。
[0009]
本发明的另一实施方案提供上述蒲公英内生真菌epicoccum sorghinum 1-2在制备抗菌药物中的应用。
[0010]
本发明的另一实施方案提供一种化合物1、2、3、4、5、6和/或7的制备方法,其特征在于包括如下步骤:
[0011]
(1)在菌种培养基中对e.sorghinum 1-2进行菌种培养,得种子液;
[0012]
(2)将步骤(1)得到的种子液接种到发酵培养基中进行发酵培养,室温静置培养;
[0013]
(3)将步骤(2)得到的发酵物中的发酵液和菌体分离,发酵液用有机溶剂萃取1~4次,优选2~3次,合并萃取液后减压浓缩得到发酵液浸膏,再经色谱分离即可得到化合物1、2、3、4、5、6和/或7。
[0014]
步骤(1)中所述菌种培养基优选pdb马铃薯液体培养基,其配方为蒸馏水1l,土豆200g(煮沸取汁),葡萄糖20g。培养条件:28℃摇床(150r/min)培养3天。
[0015]
步骤(2)中所述发酵培养基优选pdb马铃薯液体培养基,其配方为蒸馏水1l,土豆200g(煮沸取汁),葡萄糖20g。培养条件:室温静置培养28-30天。
[0016]
步骤(3)中有机溶剂优选乙酸乙酯、甲醇、乙醇中的一种或几种。所述色谱分离优选减压硅胶柱层析、正相硅胶柱层析、凝胶柱层析、反相硅胶柱层析、高效液相色谱分离制备中的一种或几种混合。
[0017]
所述色谱分离优选如下方案:首先用减压硅胶柱对粗浸膏进行梯度洗脱(石油醚:乙酸乙酯=100:0至0:100),最终获得6个组分(frs.1~6)。fr.4经过正相硅胶柱色谱分离(石油醚-二氯甲烷-甲醇),得到frs.4.1~4.8。fr.4.2经过反相硅胶(ods)柱层析和半制备
型高效液相色谱(hplc)分离得到化合物1和2。fr.4.6经过ods柱层析和半制备型hplc分离得到化合物3。将fr.4.1经过正相硅胶柱洗脱得到frs.4.1.1~4.1.4,其中fr.4.1.3再次经过正相柱、反相柱以及半制备型hplc分离得到化合物5。fr.5通过正相柱分离得到组分frs.5.1~5.10,其中fr.5.2和fr.5.8经过凝胶柱(二氯甲烷-甲醇)、半制备hplc分离分别得到化合物6和4;fr.3经凝胶柱分离(二氯甲烷-甲醇)、半制备hplc分离得到化合物7。
[0018]
本发明的另一实施方案提供上述化合物1、2、3、4、5、6和/或7在制备抗菌药物中的应用,尤其是针对金黄色葡萄球菌、粪肠球菌感染。特别是针对耐甲氧西林的金黄色葡萄球菌atcc 4300和atcc 33591。
[0019]
本发明的另一实施方案提供一种抗菌药物,其特征在于所述抗菌药物以化合物1、2、3、4、5、6和/或7作为有效成分。
[0020]
本发明中术语“药学上可接受的盐”是指非毒性的无机或有机酸和/或碱的加成盐,可参见“salt selection for basic drugs”,int.j.pharm.(1986),33,201
–
217。
附图说明
[0021]
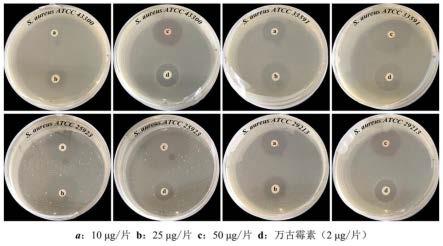
图1是化合物6针对4种金黄色葡萄球菌抑菌圈图。
具体实施方式
[0022]
为了便于对本发明的进一步理解,下面提供的实施例对其做了更详细的说明。但是这些实施例仅供更好的理解发明而并非用来限定本发明的范围或实施原则,本发明的实施方式不限于以下内容。
[0023]
实施例1
[0024]
1仪器与材料
[0025]
avance 600核磁共振波谱仪(德国bruker公司);agilent dd2 400mhz型核磁共振波谱仪(美国agilent公司);maxis超高分辨飞行时间质谱仪(德国bruker公司);高压灭菌锅(tomysx-300sx-500,上海珂淮仪器有限公司);电子天平(fa11004,上海舜宇恒平科学仪器有限公司);旋转蒸发仪(r-210,buchi实验室设备贸易有限公司);超净工作台(airiechsw-cj-2fd,苏净集团苏州安泰空气技术有限公司);电热恒温鼓风干燥箱(dhg-9143bs,上海新苗医疗机械制造有限公司);台式微量高速冷冻离心机(himacct15re,日本日立公司);回旋振荡器(zd-8801-11,上海康华生化仪器制造有限公司)。
[0026]
琼脂,葡萄糖(国药集团化学试剂有限公司);氘代试剂(美国cil公司);甲醇(色谱级,天津四友精细化学品有限公司);提取和分离所用甲醇、乙酸乙酯、二氯甲烷、石油醚等均为分析纯产品(国药集团化学试剂有限公司)。
[0027]
2菌株来源与发酵
[0028]
菌株epicoccum sorghinum1-2分离于扬州大学扬子津校园内的蒲公英样品的根部,保藏于扬州大学环境科学与工程学院海洋科学与技术研究所和中国微生物菌种保藏管理委员会普通微生物中心。该菌经形态学观察及分子生物学鉴定(its-rdna),确定其种属为epicoccum sorghinum,其its序列已经提交到ncbi网站,登陆号为mz148819.1。
[0029]
(1)将e.sorghinum 1-2菌种从冻存管中取出,接种到pda马铃薯琼脂培养基(蒸馏水1l,土豆200g(煮沸取汁),葡萄糖20g,琼脂20g)平板上复苏培养,然后将生长良好的菌株
接种到pdb马铃薯液体培养基(蒸馏水1l,土豆200g(煮沸取汁),葡萄糖20g)中,于28℃摇床(150r/min)培养3天制成种子液备用。
[0030]
(2)将种子液分别接种到75瓶pdb培养基中(1l锥形瓶,每瓶加培养基400ml),室温静置培养30天后结束发酵。利用纱布将菌体和发酵液分离,发酵液用乙酸乙酯萃取3次,经减压浓缩后得到粗浸膏16.5g。
[0031]
(3)首先用减压硅胶柱对粗浸膏进行梯度洗脱(石油醚:乙酸乙酯=100:0至0:100),最终获得6个组分(frs.1~6)。fr.4经过正相硅胶柱色谱分离(石油醚-二氯甲烷-甲醇),得到frs.4.1~4.8。fr.4.2经过反相硅胶(ods)柱层析和半制备型高效液相色谱(hplc)分离得到化合物1(7mg)和2(15mg)。fr.4.6经过ods柱层析和半制备型hplc分离得到化合物3(20mg)。将fr.4.1经过正相硅胶柱洗脱得到frs.4.1.1~4.1.4,其中fr.4.1.3再次经过正相柱、反相柱以及半制备型hplc分离得到化合物5(8.7mg)。fr.5通过正相柱分离得到组分frs.5.1~5.10,其中fr.5.2和fr.5.8经过凝胶柱(二氯甲烷-甲醇)、半制备hplc分离分别得到化合物6(10.0mg)和4(5.0mg);fr.3经凝胶柱分离(二氯甲烷-甲醇)、半制备hplc分离得到化合物7(3.7mg)。
[0032][0033]
结构鉴定
[0034]
化合物1为淡黄色粉末。在其1h nmr谱中显示了1个烯氢信号(δ
h 7.08),3个苯环氢信号(δ
h 7.34、6.82、6.80),3个含氧次甲基信号(δ
h 5.99、4.66、4.26),1个含氧亚甲基信号(δ
h 4.10),1个甲氧基信号(δ
h 3.37)和1个与苯环相连的甲基信号(δ
h 2.54)。其
13
c nmr谱给出了1个α,β不饱和酮羰基碳信号(δ
c 194.0),1个酯羰基碳信号(δ
c 170.4),8个苯环或双键碳信号(δ
c 161.7、143.4、141.8、136.5、134.6、123.5、116.0、115.1),3个含氧次甲基信号(δ
c 77.6、70.8、67.1),1个含氧亚甲基信号(δ
c 68.8),1个甲氧基碳信号(δ
c 58.8)和1个甲基信号(δ
c 23.0)。以上数据表明化合物1含有1个顶环氧菌素片段和1个6-甲基水杨酸片段,两个片段通过酯键相连接。该结构与已知化合物4,5-dihydroxy-6-(6'-methylsalicyloxy)-2-hydroxymethyl-2-cyclohexen-l-one(3)的结构非常相似。仔细比较化合物1和3的氢谱和碳谱,发现二者差别仅在于化合物1比2多出了1个甲氧基信号。化合
物1的c-7的化学位移为δ
c 68.8,与化合物2的c-7的化学位移(δ
c 57.3)相比明显移向低场,表明多出的甲氧基与化合物1的c-7位相连接。因此,化合物1的平面结构得以确定,是化合物3的c-7位羟基被甲基化的衍生物。
[0035]
化合物1的相对构型通过耦合常数确定。化合物1的氢谱显示,h-4与h-5之间的耦合常数为4.2hz,而h-5与h-6之间的耦合常数为10.8hz,表明h-4与h-5在环己烯酮环平面的相同侧,而h-5与h-6在环己烯酮环平面的异侧。这与已知化合物3的相对构型一致。化合物3的绝对构型为4r,5r,6s,而化合物1是3的甲基化产物,推测其绝对构型与3一致,为4r,5r,6s。因此,新化合物1命名为(4r,5r,6s)-4,5-dihydroxy-6-(6'-methylsalicyloxy)-2-methoxymethyl-2-cyclohexen-l-one。
[0036]
化合物2为淡黄色粉末,与化合物1作为混合物共同分离得到。虽尝试了多种分离方法,仍无法将化合物1和2成功分离。氢谱显示化合物1和2的摩尔浓度比约为2:1,可以很清楚的区分两个化合物的信号。化合物2与化合物1的氢谱非常相似,明显不同之处在于,在氢谱中化合物2比化合物1少了1个甲氧基信号和1个含氧亚甲基信号,取而代之的是1个与双键相连的甲基信号(δ
h 1.84),表明化合物2的c-7为ch3。两者的碳谱差异也验证了该结构差异之处。化合物2与已报道的化合物(4r,5r,6r)-4,5-dihydroxy-6-(6
′‑
methylsalicyloxy)-2-methyl-2-cyclohexen-1-one的平面结构相同,然而仔细比较分析两个化合物的h-4,h-5和h-6的耦合常数发现两者手性碳构型存在差异。化合物2的h-4与h-5之间的耦合常数为4.2hz,而h-5与h-6之间的耦合常数为10.8hz,表明其构型与化合物1一致。因此新化合物2被鉴定为(4r,5r,6s)-4,5-dihydroxy-6-(6
′‑
methylsalicyloxy)-2-methyl-2-cyclohexen-1-one。
[0037]
表1化合物1和2的核磁共振氢谱和碳谱(600/150mhz,acetone-d6)数据
[0038][0039]
化合物3为淡黄色粉末。1h nmr(600mhz,dmso-d6)δ
h 7.20(1h,t,j=7.8hz,4
′‑
h),6.94(1h,d,j=6.0hz,3-h),6.74(1h,d,j=7.8hz,5
′‑
h),6.72(1h,d,j=7.8hz,3
′‑
h),5.68(1h,d,j=10.2hz,6-h),4.42(1h,m,4-h),4.10(2h,m,7-h),4.00(1h,brd,j=10.2hz,5-h),2.37(3h,s,7
′‑
h)。
13
c nmr(150mhz,dmso-d6)δ
c 192.8(c-1),167.4(c-8
′
),156.1(c-2
′
),141.9(c-2),138.3(c-3),137.6(c-6
′
),131.4(c-4
′
),121.0(c-1
′
),119.2(c-5
′
),113.7(c-3
′
),75.9(c-6),69.4(c-5),65.4(c-4),57.3(c-7),20.2(c-7
′
)。以上波谱数据与文献报道基本一致,因此鉴定化合物3为(4r,5r,6s)-4,5-dihydroxy-6-(6'-methylsalicyloxy)-2-hydroxymethyl-2-cyclohexen-1-one。
[0040]
化合物4为棕褐色固体。1h nmr(400mhz,dmso-d6)δ
h 6.67-6.62(1h,brs,3-h),4.40(1h,brs,4-h),4.04(2h,s,7-h),4.00(1h,d,j=7.9hz,6-h),3.70(1h,dd,j=7.9,3.5hz,5-h)。以上波谱数据与文献报道基本一致,因此鉴定化合物4为(-)-gabosine e。
[0041]
化合物5为无色粉末。1h nmr(400mhz,dmso-d6)δ
h 5.26(1h,d,j=7.4hz,2-h),4.36-4.24(1h,m,3-h),3.91(1h,d,j=6.7hz,6-h),3.28(1h,ddd,j=4.1,2.7,2.0hz,5-h),3.21(1h,dd,j=4.0,1.6hz,4-h),1.66(3h,t,j=1.7hz,7-h)。
13
c nmr(100mhz,dmso-d6)δ
c 132.7(c-1),123.6(c-2),64.9(c-6),63.7(c-3),54.6(c-5),53.6(c-4),20.8(c-7)。
以上波谱数据与文献报道基本一致,因此鉴定化合物5为theobroxide。
[0042]
化合物6为棕褐色粉末。高分辨质谱hr-esi-ms显示分子离子峰m/z:173.0011(calcd for c7h6clo3,173.0005,[m-h]-),不饱和度为4。1h nmr(400mhz,dmso-d6)δ
h 9.10(1h,s,2-oh),8.39(1h,s,5-oh),6.73(1h,d,j=2.8hz,6-h),6.60(1h,d,j=2.8hz,4-h),5.19(1h,s,7-oh),4.46(2h,s,7-h)。
13
c nmr(100mhz,dmso-d6)δ
c 150.5(c-5),141.7(c-2),132.8(c-1),120.6(c-3),113.4(c-4),112.9(c-6),58.8(c-7)。以上数据与文献报道基本一致
[21]
,因此鉴定化合物6为3-chlorogentisyl alcohol。
[0043]
化合物7为无色粉末。1h nmr(400mhz,acetone-d6)δ
h 8.23(1h,s,3-oh),7.12(1h,t,j=7.8hz,5-h),6.86(1h,brs,2-h),6.80(1h,dd,j=7.8,2.4hz,4-h),6.69(1h,dd,j=8.0,2.4hz,6-h),4.55(2h,d,j=5.2hz,7-h),4.11(1h,t,j=5.7hz,7-oh)。
13
c nmr(100mhz,acetone-d6)δ
c 157.9(c-3),144.3(c-1),129.1(c-5),117.5(c-6),113.7(c-4),113.4(c-2),63.7(c-7)。以上波谱数据与文献报道基本一致,因此鉴定化合物7为3-hydroxybenzyl alcohol。
[0044]
实施例2抗菌活性评价
[0045]
采用滤纸片法测定化合物1~7的抗菌活性,7种指示菌株包括金黄色葡萄球菌(staphylococcus aureus atcc 4300、atcc 33591、atcc 25923、atcc 29213),粪肠球菌(enterococcus faecalis atcc 51299),屎肠球菌(enterococcus faecium atcc 35667),大肠杆菌(escherichia coli atcc 25922)。配置细菌用肉膏蛋白胨lb培养基(去离子水1l,胰蛋白胨10g,酵母提取物5g、nacl 10g,ph 7.0),待温度冷却到30~40℃时加入200μl指示菌株混合均匀,制作平板备用。将化合物配置成50μg/μl的甲醇溶液,分别用移液枪吸取0.2、0.5及1μl溶液到滤纸片上,待甲醇充分挥干后,贴在混有指示菌的lb平板上。采用万古霉素为阳性对照药,测试浓度为2μg/片。每组设置3组平行实验。放置于37℃细菌培养箱培养18~24h后观察是否产生抑菌圈,并测量抑菌圈直径(抑菌圈直径=空白圈直径-滤纸片直径,单位mm)。结果见表2,化合物6对4种金黄色葡萄球菌和粪肠球菌具有抑菌活性,尤其是对4种金黄色葡萄球菌显示了较强的抗菌活性(图1),其中包括2株耐甲氧西林的金黄色葡萄球菌atcc 4300和atcc 33591。推测其活性可能与其分子中的氯原子和酚羟基有关。化合物6的抗菌活性值得深入研究。
[0046]
表2化合物6的抗菌活性结果(抑菌圈,mm)
[0047][0048]
参考文献
[0049]
[1]卢护木,詹振宇,李蜜,等.涠洲岛珊瑚礁海洋真菌的分离鉴定及其抗mrsa活性筛[j].广西科学,2020,27(05):520-525.
[0050]
[2]venkatasubbaiah p,chilton w s.an epoxydon-derived ester from a phoma sp.pathogenic to rhubarb[j].journal of natural products,1992,55(5):639-643.
[0051]
[3]li c y,chang c c,tsai y h,et al.anti-inflammatory,antiplatelet aggregation,and antiangiogenesis polyketides from epicoccum sorghinum:toward an understating of its biological activities and potential applications[j].acs omega,2020,5(19):11092-11099.
[0052]
[4]malak l g,ibrahim m a,bishay d w,et al.antileishmanial metabolites from geosmithia langdonii[j].journal of natural products,2014,77(9):1987-1991.
[0053]
[5]kumar v,das p,ghosal p,et al.syntheses of(-)-gabosine a,(+)-4-epi-gabosine a,(-)-gabosine e,and(+)-4-epi-gabosine e[j].tetrahedron,2011,67(25):4539
–
4546.
[0054]
[6]nakamori k,matsuura h,yoshihara t,et al.potato micro-tuber inducing substances from lasiodiplodia theobromae[j].phytochemistry,1994,35(4):835
–
839.
[0055]
[7]chen l,fang y,zhu t,et al.gentisyl alcohol derivatives from the marine-derived fungus penicillium terrestre[j].journal of natural products,2008,71(1):66
–
70.
[0056]
[8]alfaro c,urios a,gonz
á
lez m c,et al.screening for metabolites from penicillium novae-zeelandiae displaying radical-scavenging activity and oxidative mutagenicity:isolation of gentisyl alcohol[j].mut.res.-genetic toxicology and environmental mutagenesis,2003,539(1-2):187-194.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1