一株高效拮抗青霉菌和灰霉菌的生防菌及其在猕猴桃贮藏中的应用
1.本发明涉及一株高效拮抗青霉菌和灰霉菌的生防菌及其在猕猴桃贮藏中的应用,属于农产品贮藏技术领域。
背景技术:
2.猕猴桃原产我国,因具有极高含量的维生素c而被称为“vc之王”、“水果之王”,并且其果肉清香,水分丰富,食之酸甜可口,深受人们喜爱。然而,猕猴桃采后贮藏期间极易遭受病原菌侵染,据统计,全球每年猕猴桃因采后腐烂而造成的损失高达20
‑
30%,给猕猴桃产业带来巨大的经济损失,极大地限制了该产业的快速发展。
3.引起猕猴桃采后腐烂的真菌病害主要有灰霉病和青霉病等。灰霉病(botrytis cinerea)是猕猴桃上最重要的采后病害,其入侵方式多样,菌丝体、孢子或者菌核可在不利环境中长时间存活,遇到适宜环境即快速生长。青霉病由扩展青霉(penicillium expansum)侵染引起,不仅会导致猕猴桃果实腐烂,而且会产生对人体有毒的棒曲霉素,危及食品安全。
4.目前猕猴桃采后贮藏保鲜的传统方法主要是低温贮藏,通过低温降低水果的呼吸作用从而达到“休眠”状态,降低猕猴桃的腐烂,延长保藏期。但青霉和灰霉孢子可以在冰点以上的温度长期存活,因此低温贮藏无法解决猕猴桃采后青霉和灰霉污染问题。化学抑菌剂,如 1
‑
甲基环丙烯(1
‑
mcp)等,在猕猴桃贮藏保鲜上得到了广泛的应用,显著延长了猕猴桃的贮藏时间和货架期;然而,经1
‑
mcp处理和长期低温贮藏的猕猴桃在出库后,果实在货架期经常出现不能正常后熟软化,固有风味淡和食用品质严重下降的问题,甚至还出现果实烂而不软的“僵尸果”现象,均对猕猴桃的销售和商品性造成极大的影响。同时,化学抑菌剂不仅污染环境,而且容易残留,对人体健康具有潜在威胁,并且长期使用,可能会导致耐药菌株的出现。
5.生防菌(英文名称biocontrol bacteria),指的是那些有益微生物,主要有细菌、真菌、放线菌等,杀灭或压低病原生物数量以控制植物病害发生、发展的一类措施;其实质就是利用微生物种间或种内的抗生、竞争、重寄生、溶菌作用,或者通过微生物代谢产物诱导植物抗病性等,来抑制某些病原物的存活和活动。生防菌对人畜无毒、对环境有良好的兼容性,利用生物防治作用,采用安全高效的拮抗菌杀菌剂是一种“绿色防腐”技术,其应用于猕猴桃贮藏保鲜将具有重要意义和商业价值。
技术实现要素:
6.本发明的目的在于提供一株高效拮抗青霉菌和灰霉菌的生防菌及其在猕猴桃贮藏中的应用。
7.为实现上述目的及其他相关目的,本发明提供的技术方案是:一株高效拮抗青霉菌和灰霉菌的生防菌pan.vagans bwl1,已于2021年1月4日保藏于中国典型培养物保藏中
心 (cctcc),保藏编号为cctcc no:m2021001。
8.为实现上述目的及其他相关目的,本发明提供的技术方案是:一种生防菌pan.vagansbwl1的微生物制剂,其特征在于:所述生防菌pan.vagans bwl1的微生物制剂的生防菌 pan.vagans bwl1的活菌数大于或等于108cfu/ml。
9.优选的技术方案为:制备方法包括:
10.步骤1:将生防菌pan.vagans bwl1接种于lb培养基后于23
‑
27℃摇床中培养12
‑
18h;
11.步骤2:按体积百分比5
‑
10%,将步骤1得到的菌液接种于新的lb培养基进行扩大培养;
12.步骤3:对步骤2的培养物以5000
‑
7000
×
g离心4
‑
6min,弃上清,然后加入1/5体积的磷酸盐缓冲液重悬浮;
13.步骤4:加入羧甲基纤维素钠、糊精和海藻酸钠,搅拌均匀后真空低温干燥,粉碎并且过300目筛后即得生防菌pan.vagans bwl1的微生物制剂。
14.为实现上述目的及其他相关目的,本发明提供的技术方案是:一种猕猴桃贮藏的方法,由权利要求2制得的生防菌pan.vagans bwl1的微生物制剂稀释得到的菌液作用于猕猴桃的外表面。
15.优选的技术方案为:生防菌pan.vagans bwl1的微生物制剂与猕猴桃的质量比为10: 40000
‑
60000。
16.优选的技术方案为:向生防菌pan.vagans bwl1的微生物制剂添加其体积的20
‑
30倍的水,溶解后喷洒于猕猴桃上。
17.优选的技术方案为:向生防菌pan.vagans bwl1的微生物制剂添加其体积的20
‑
30倍的水,将猕猴桃浸没后,再取出。
18.由于上述技术方案运用,本发明与现有技术相比具有的优点是:
19.1、本发明筛选得到一株生防菌pan.vagans bwl1,能够高效拮抗青霉菌和灰霉菌。
20.2、由生防菌pan.vagans bwl1制得的生物菌剂可以延长猕猴桃的贮藏时间。
附图说明
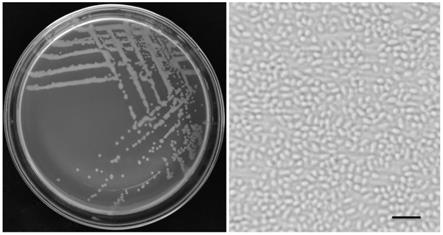
21.图1为pan.vagansbwl1的形态照片。
22.图2为pan.vagansbwl1对青霉菌和灰霉菌的抑菌效果。
23.图3为pan.vagansbwl1对青霉菌的孢子萌发、芽管伸长的抑制作用。
24.图4为pan.vagansbwl1对灰霉菌的孢子萌发、芽管伸长的抑制作用。
25.图5为pan.vagansbwl1对猕猴桃青霉病的抑制效果。
26.图6为pan.vagansbwl1对猕猴桃灰霉病的抑制效果。
27.图7为pan.vagansbwl1对猕猴桃青霉病自然发病的抑制效果。
28.图8为pan.vagansbwl1对猕猴桃灰霉病自然发病的抑制效果。
具体实施方式
29.以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本实施例所揭露的内容轻易地了解本发明的其他优点及功效。
30.实施例1:一株高效拮抗青霉菌和灰霉菌的生防菌及其在猕猴桃贮藏中的应用
31.一株高效拮抗青霉菌和灰霉菌的生防菌pan.vagans bwl1,已于2021年1月4日保藏于中国典型培养物保藏中心,地址:中国湖北省武汉市武昌区八一路299号武汉大学校内,保藏编号为cctcc no:m2021001。生防菌pan.vagans bwl1分离自健康柑橘果实表面,是果实习居菌,采用平板对峙法,发现生防菌pan.vagans bwl1对青霉菌和灰霉菌均具有抑制作用。生防菌pan.vagans bwl1分离、筛选、鉴定方法如下。
32.(1)拮抗菌的分离
33.取市售健康柑橘,放入已灭菌的500ml烧杯中,加入灭菌水200ml,150r/min振荡1h。取悬浮培养液稀释成10
‑1、10
‑2、10
‑3后,取100μl涂布到lb固体平板上,25℃倒置静止培养24h。挑取单菌落到新的lb固体平板进行划线培养,对获得的单克隆菌株第二次划线培养,获得纯种菌株。
34.获得的菌株保藏于30%的甘油中,置于
‑
80℃低温环境中。
35.(2)拮抗菌的筛选
36.猕猴桃采后病原菌青霉菌和灰霉菌孢子悬浮液的制备。采用pda培养基(平板或斜面) 分别对青霉菌和灰霉菌菌株进行活化培养,适宜温度下,青霉菌培养7天,灰霉菌培养14天,刮下菌丝,加入含20ml无菌水的三角瓶中,震荡1min,双层灭菌纱布过滤去除菌丝,通过血球计数板测孢子浓度,并将孢子浓度调整为105个/ml,即得到青霉菌孢子悬浮液和灰霉菌孢子悬浮液。
37.pda培养基即常用的马铃薯葡萄糖琼脂培养基。
38.菌株的抑菌效果测试采用平板对峙法。将青霉菌和灰霉菌菌丝块分别接种于pda平板上,25℃培养7天,此时青霉菌大约长到2/3
‑
3/4盘,灰霉菌长到3/4盘至满盘,以打孔器从平板上靠近菌丝边缘位置取直径0.5cm的青霉菌和灰霉菌菌饼,接种到新的pda平板上,25℃培养3
‑
5天;将已纯化的细菌接种于液体lb培养基中,25℃培养过夜,以接种环蘸取菌液在培养了青霉菌和灰霉菌的pda平板上划线,25℃培养3天后观察抑菌效果。
39.所述的lb培养基,其制作方法为:在950ml的去离子水中加入酵母提取物5g,胰蛋白胨10g,nacl 10g,溶解后以5m的naoh调节ph至7.0,定容至1l,121℃高压蒸汽灭菌20min后备用。
40.(3)拮抗菌的鉴定
41.选取有抑制效果的菌株,通过对16s rdna、atp synthase(atpd)和recombinase(reca)基因进行扩增并测序,在ncbi(美国国家生物技术信息中心)数据库中进行比对,将菌株鉴定为 pan.vagans,并将菌株编号为bwl1。16s rdna、atpd和reca基因扩增片段已提交至ncbi 数据库,序列号依次为mw133037、mw221267和mw221265。
42.鉴定所用引物、pcr反应条件以及扩增片段序列如下:
43.16srdna基因扩增片段测序结果:
[0044]5’‑
gcagtcggacggtagcacagagagcttgctcttgggtgacgagtggcggacgggtgagtaat gtctggggatctgcccgatagagggggataaccactggaaacggtggctaataccgcataacgtcgc aagaccaaagagggggaccttcgggcctctcactatcggatgaacccagatgggattagctagtagg cggggtaatggcccacctaggcgacgatccctagctggtctgagaggatgaccagccacactggaac tgagacacggtccagactcctacgggaggcagcagtggggaatattgcacaatgggcgcaagcctga tgcagccatgccgcgtgtatgaagaaggccttcg
ggttgtaaagtactttcagcggggaggaaggcg atgcggttaataaccgcgtcgattgacgttacccgcagaagaagcaccggctaactccgtgccagca gccgcggtaatacggagggtgcaagcgttaatcggaattactgggcgtaaagcgcacgcaggcggtc tgttaagtcagatgtgaaatccccgggcttaacctgggaactgcatttgaaactggcaggcttgagtc ttgtagaggggggtagaattccaggtgtagcggtgaaatgcgtagagatctggaggaataccggtgg cgaaggcggccccctggacaaagactgacgctcaggtgcgaaagcgtggggagcaaacaggattag ataccctggtagtccacgccgtaaacgatgtcgacttggaggttgttcccttgaggagtggcttccgg agctaacgcgttaagtcgaccgcctggggagtacggccgcaaggttaaaactcaaatgaattgacgg gggcccgcacaagcggtggagcatgtggtttaattcgatgcaacgcgaagaaccttacctactcttg acatccacggaatttggcagagatgccttagtgccttcgggaaccgtgagacaggtgctgcatggct gtcgtcagctcgtgttgtgaaatgttgggttaagtcccgcaacgagcgcaacccttatcctttgttgc cagcgattcggtcgggaactcaaaggagactgccggtgataaaccggaggaaggtggggatgacgt caagtcatcatggcccttacgagtagggctacacacgtgctacaatggcgcatacaaagagaagcaa cctcgcgagagcaagcggacctcacaaagtgcgtcgtagtccggatcggagtctgcaactcgactcc gtgaagtcggaatcgctagtaatcgtggatcagaatgccacggtgaatacgttcccgggccttgtaca caccgcccgtcacaccatgggagtgggttgcaaaagaagtaggtagcttaacctcggaggcgct
‑3’
。
[0045]
atpd基因扩增片段测序结果:
[0046]5’‑
agtatgaatggtgatgcgcgtctggtgctggaagttcagcaacagctcggcggcggcgtagta cgtaccatcgcaatgggtacgtctgacggcctgaagcgtggtctgagcgtcaacgacctgcagaaac cgattcaggtacccgtcggtaaagcgaccctgggccgtatcatgaacgttctcggcgagccaatcgat atgaaaggcgagctgaaagaagaagatggcagcgcagtagagatcgcctctattcaccgcgcagccc cttcttatgaagatcagtctaactcgcaggaactgctggaaaccggcatcaaggttatcgacctgatg tgtccgtttgctaaaggcggtaaagtcggtctgttcggtggtgcgggtgtaggtaaaaccgtcaaca tgatggaactgatccgtaacatcgcggctgaacactcaggttactcagtgtttgccggtgtgggtgag cgtactcgtgagggtaacgacttctaccacgaaatgactgactctaacgttatcgataaagttgcact ggtctatggccagatgaacgagccgccgggtaaccgtctgcgcgtagcactgaccggtctgaccatg gcggaaaaattccgtgatgaaggccgcgacgttctgctgttcatcgataacatctaccgttataccctg gccggtacagaagtttctgcactgctgggtcgtatgccatctgcggtaggttaccagccaacgctggc agaagagatgggtgtgttgcaggagcgtattacctccaccaagaccggttcaatcacctccgtacag gccgtttacgtccctgcggatgacctgactgacccatcaccagcaactacctttgcgcacttagactc aacggtaacgctgagccgtcagatcgcctctctgggtatctacccggccgttgacccgctggactcta ccagccgtcagctggatccgctggttgtcggtcaggagcactatgatgttgcacgtggcgttcagtca ctgctgcagcgttatcaggaactgaaagacatcatcgccatcctcggtatggatgagctgtctgaaga agacaaactgctggtggcacgtgcgcgtaagattcagcgcttcctgtctcagccgttcttcgttgcag aagtattcaccggttcaccgggcaaatacgtgacgctgaaagacactatccgtggctttaaaggcatc atggaaggtgagtttgaccacctgccaagagc
‑3’
。
[0047]
reca基因扩增片段测序结果:
[0048]5’‑
gcgtaaggtaaacctgtgcctttatcgatgccgagcatgcgcttgatccggtttacgccaaga aactcggcgtagacattgataacctgctctgctctcagccagacactggtgagcaggcgctggaaat ttgtgatgcgctggcgcgctctggtgccgttgacgtgatcatcgtcgactccgtcgcggcgctgacgc ctaaagcggaaatcgaaggtgaaatcggtgactcacacatgggcctcgcggcacgtatgatgagcca ggcgatgcgtaaactggccggtaacctgaagcagtccaataccctgctgattttcatcaaccagatcc gtatgaaaattggtgtgatgtttggtaacccggaaaccaccactggtggtaacgcgctgaagttctac gcctctgtccgtcttgatatccgccgtatcggtgcaat
caaagagggcgataacgtggtcggcagtga gacccgcgttaaagtggtgaaaaacaaaatcgccgcgccattcaaacaggctgagttccagatcatg tacggcgaaggtatcaatacctttggtgagctggtcgacctgggcgtgaagcacaagctgattgaaa aagcgggtgcatggtacagctacaatggcgacaag
‑3’
。
[0049]
pcr扩增体系:
[0050][0051][0052]
表中所列为扩增生防菌pan.vagans bwl1菌株16s rdna、atp synthase(atpd)和 recombinase(reca)基因序列所用的pcr体系。
[0053]
基因引物和pcr条件:
[0054][0055]
表中所列为扩增生防菌pan.vagans bwl1菌株16s rdna、atp synthase(atpd)和 recombinase(reca)基因序列所用的引物以及pcr扩增时的退火温度和延伸时间。pcr具体条件为:预变性95℃
×
4min、[95℃
×
20s、退火温度
×
20s、72℃
×
1延伸时间]
×
35循环、 72℃
×
10min。pcr结束后,凝胶电泳验证片段大小无误后,将pcr产物送测序公司进行测序。
[0056]
一株高效拮抗青霉菌和灰霉菌的生防菌及其在猕猴桃贮藏中的应用,包括以下技术步骤。
[0057]
(1)制作生防菌pan.vagans bwl1的微生物制剂
[0058]
生防菌pan.vagans bwl1的微生物制剂,生防菌pan.vagans bwl1活菌数不少于 108cfu/ml。该菌制剂由以下方法配制:
[0059]
(1.1)采用lb培养基,以接种环蘸取生防菌pan.vagans bwl1接种于lb培养基后于25℃摇床中培养12
‑
18h;
[0060]
(1.2)取(1)中菌液,按5
‑
10%(v/v)接种于新鲜lb培养基进行扩大培养;
[0061]
(1.3)6000
×
g离心5min,弃上清,加入1/5体积磷酸盐缓冲液(0.5m,ph7.0)重悬浮;
[0062]
(1.4)加入10%(w/v)羧甲基纤维素钠、0.5%(w/v)糊精、0.2%(w/v)海藻酸钠,搅拌均匀,真空低温干燥(真空表压
‑
0.05~
‑
0.100mpa、温度20~30℃),粉碎并且过300目筛。所制得菌剂2
‑
20℃保存。
[0063]
(2)猕猴桃采后病害拮抗菌制剂的使用方法
[0064]
(2.1)制得的生物抗菌剂加20
‑
30倍(v/w)的水,充分溶解后,喷洒于猕猴桃上,10g 菌剂可处理40
‑
60kg猕猴桃;
[0065]
(2.2)猕猴桃晾干后,低温保存。
[0066]
经过发明方法贮藏猕猴桃,青霉病和灰霉病受到显著抑制;低温贮藏30
‑
45d后,出库常温存放7d,腐烂率降低60%以上。
[0067]
(一)拮抗菌对青霉菌和灰霉菌的孢子萌发和芽管伸长的影响
[0068]
将生防菌pan.vagans bwl1接种于lb培养基(胰化蛋白胨10g/l,酵母提取物5g/l,nacl 5g/l,ph7.0)中,25℃培养过夜,10000
×
g离心10min,取上清液,按10%加入pda培养基 (购自杭州百思生物科技有限公司)中,倒平板。分别将青霉菌和灰霉菌孢子涂布于该平板上,25℃培养12h后,检测孢子萌发率和芽管长度。每个重复包含9个平行,每个平行包含 100个孢子。同时设置不作任何处理的pda以及添加10%lb培养基的pda对照。
[0069]
由图3可知,生防菌pan.vagans bwl1发酵液对青霉孢子萌发率及芽管长度有显著抑制作用。添加发酵液后,孢子萌发率降低32.4%(p<0.05),芽管长度减少73.2%(p<0.05)。由图4可知,pan.vagans bwl1发酵液对灰霉孢子萌发率无显著影响,然而,添加发酵液处理中的芽管长度下降58.4%(p<0.05)。这些结果表明,pan.vagans bwl1处理可显著抑制青霉菌和灰霉菌孢子的萌发。
[0070]
(二)拮抗菌对猕猴桃青霉病和灰霉病的抑制作用
[0071]
1、穿刺接种
[0072]
将pan.vagansbwl1接种于lb培养基中,25℃培养过夜,6000
×
g离心10min,去上清,加入50mm磷酸盐缓冲液(ph 7.0)重悬,使菌浓度≈108cfu/ml,选择无损伤、无病害的猕猴桃,用清水清洗后,以1%次氯酸钠表面消毒3min后以无菌水冲洗干净,置于超净台中晾干。在果实中间部位打孔,在孔中加入10μlpan.vagansbwl1菌悬液,对照组中以10μl 磷酸盐缓冲液代替bwl1菌悬液。待液体完全吸收后,在孔中接种10μl病原菌孢子悬浮液 (105个/ml),待液体完全吸收后,将果实置于塑料筐中,放入装有清水的平皿以保持湿度,在框外套上塑料袋,21℃放置7d。将果实削皮后统计发病率,测量病斑直径。每个重复含6 个重复,每个重复含3个平行,每个平行含20个猕猴桃果实。
[0073]
由图5可知,与对照组(只接种青霉孢子)相比,处理组(接种青霉孢子和pan.vagansbwl1 菌液)猕猴桃发病程度较轻,病斑直径降低64.3%(p<0.05)。由图6可知,
处理组(接种灰霉孢子和pan.vagansbwl1菌液)猕猴桃病斑直径较对照组(只接种灰霉孢子)降低63.8% (p<0.05)。这些结果表明,pan.vagansbwl1处理可显著抑制猕猴桃采后青霉病和灰霉病。
[0074]
2、自然发病
[0075]
为模拟pan.vagansbwl1对猕猴桃贮藏后自然发病的影响,我们采用喷洒接种方式,将 pan.vagansbwl1接种于lb培养基中,25℃培养过夜,6000
×
g离心10min,去上清,加入 50mm磷酸盐缓冲液(ph 7.0)重悬,使菌浓度≈108cfu/ml,选择无损伤、无病害的猕猴桃,用清水清洗后,以1%次氯酸钠表面消毒3min后以无菌水冲洗干净,置于超净台中晾干。均匀喷洒pan.vagansbwl1菌悬液,对照组中以10μl磷酸盐缓冲液代替bwl1菌悬液。待猕猴桃表面完全干燥后,向猕猴桃均匀喷洒病原菌(青霉菌或灰霉菌)孢子悬浮液,待猕猴桃表面完全干燥后,放入塑料筐中,放入装有清水的平皿以保持湿度,在框外套上塑料袋,21℃放置15d,统计发病率。每个重复含6个重复,每个重复含3个平行,每个平行含20个猕猴桃果实。
[0076]
由图7可知,与对照组(只喷洒青霉孢子)相比,处理组(喷洒青霉孢子和pan.vagansbwl1 菌液)猕猴桃发病程度较轻,发病率降低72.1%(p<0.05)。由图8可知,处理组(喷洒灰霉孢子和pan.vagansbwl1菌液)猕猴桃发病率较对照组(只喷洒灰霉孢子)降低74.4% (p<0.05)。这些结果表明,pan.vagansbwl1处理可显著抑制猕猴桃采后青霉病和灰霉病。
[0077]
图1为pan.vagansbwl1形态。标尺=50μm。pan.vagansbwl1在25℃、lb培养基上生长1天后,形成黄色、凸起、边缘光滑的菌落,颜色由起初的淡黄色逐渐变成明亮的黄色。通过显微镜观察可知,菌体为短杆状,近似椭圆,长度10
‑
12μm。
[0078]
图2为pan.vagansbwl1对青霉菌和灰霉菌的抑菌效果。a为pan.vagansbwl1与青霉菌的平板对峙照片;b为pan.vagansbwl1与灰霉菌的平板对峙照片。在pan.vagansbwl1 生长的方向,青霉菌和灰霉菌菌丝生长受到明显抑制。
[0079]
图3为pan.vagansbwl1对青霉菌的孢子萌发、芽管伸长的抑制作用。标尺=10μm。a 为青霉菌孢子萌发照片;b为青霉菌孢子萌发率和芽管长度数据。由图可知,在含pan. vagansbwl1发酵液的pda平板上(bwl1),青霉菌孢子萌发率和芽管长度均显著低于对照组。
[0080]
图4为pan.vagansbwl1对灰霉菌的孢子萌发、芽管伸长的抑制作用。标尺=100μm。a 为灰霉菌孢子萌发照片;b为灰霉菌孢子萌发率和芽管长度数据。由图可知,在含pan. vagansbwl1发酵液的pda平板上(bwl1),灰霉菌孢子萌发率和对照组无显著性差异,然而,芽管长度显著低于对照组。
[0081]
图5为pan.vagansbwl1对猕猴桃青霉病的抑制效果。穿刺接种后,pan.vagansbwl1 处理组(bwl1)病斑显著小于对照组。
[0082]
图6为pan.vagansbwl1对猕猴桃灰霉病的抑制效果。穿刺接种后,pan.vagansbwl1 处理组(bwl1)病斑显著小于对照组。
[0083]
图7为pan.vagansbwl1对猕猴桃青霉病自然发病的抑制效果。喷洒接种后,pan. vagansbwl1处理组(bwl1)发病率显著低于对照组。
[0084]
图8为pan.vagansbwl1对猕猴桃灰霉病自然发病的抑制效果。喷洒接种后,pan. vagansbwl1处理组(bwl1)发病率显著低于对照组。
[0085]
实施例2:一株高效拮抗青霉菌和灰霉菌的生防菌及其在猕猴桃贮藏中的应用
[0086]
一株高效拮抗青霉菌和灰霉菌的生防菌pan.vagans bwl1,已于2021年1月4日保藏于中国典型培养物保藏中心(cctcc),保藏编号为cctcc no:m2021001。
[0087]
一种生防菌pan.vagans bwl1的微生物制剂,其特征在于:所述生防菌pan.vagansbwl1的微生物制剂的生防菌pan.vagans bwl1的活菌数大于或等于108cfu/ml。
[0088]
优选的技术方案为:制备方法包括:
[0089]
步骤1:将生防菌pan.vagans bwl1接种于lb培养基后于23℃摇床中培养18h;
[0090]
步骤2:按体积百分比5%,将步骤1得到的菌液接种于新的lb培养基进行扩大培养;
[0091]
步骤3:对步骤2的培养物以5000
×
g离心4min,弃上清,然后加入1/5体积的磷酸盐缓冲液重悬浮;
[0092]
步骤4:加入羧甲基纤维素钠、糊精和海藻酸钠,搅拌均匀后真空低温干燥,粉碎并且过300目筛后即得生防菌pan.vagans bwl1的微生物制剂。
[0093]
一种猕猴桃贮藏的方法,由权利要求2制得的生防菌pan.vagans bwl1的微生物制剂稀释得到的菌液作用于猕猴桃的外表面。
[0094]
优选的实施方式为:生防菌pan.vagans bwl1的微生物制剂与猕猴桃的质量比为10: 40000。
[0095]
优选的实施方式为:向生防菌pan.vagans bwl1的微生物制剂添加其体积的20
‑
30倍的水,溶解后喷洒于猕猴桃上。
[0096]
优选的实施方式为:向生防菌pan.vagans bwl1的微生物制剂添加其体积的20
‑
30倍的水,将猕猴桃浸没后,再取出。
[0097]
以上所述者仅为用以解释本发明之较佳实施例,并非企图具以对本发明做任何形式上之限制,是以,凡有在相同之发明精神下所作有关本发明之任何修饰或变更,皆仍应包括在本发明意图保护之范畴。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1