SDX在制备男性不育症检测试剂盒中的应用
sdx在制备男性不育症检测试剂盒中的应用
技术领域
1.本发明涉及生物医学检测技术领域,特别涉及sdx在制备男性不育症检测试剂盒中的应用。
背景技术:
2.据最新调查显示,至2021年,我国不孕不育率高达15%,而男性不育发病率高达10%,仅次于心血管疾病和肿瘤,严重威胁人类种族延续。遗传学异常是男性不育的重要病因之一,涉及多种疾病,例如由于染色体异常或基因变异导致的非梗阻性无精子症可高达25%。对致病基因进行检测,可明确男性不育病因,有助于治疗药物选择,从而有效提高生育率,符合我国优生优育的国策。男性性发育异常(disorders of sex development,dsd)患者主要以外生殖器男性化不足为特征,可有性腺发育异常,伴或不伴苗勒管结构。根据患者染色体情况,分为(46,xy dsd)、(46,xx dsd)及性染色体异常导致的dsd。其中,(46,xy dsd)发病率约为1/6000,患者内外生殖器均可表现为部分甚至完全女性化,当(46,xy dsd)患者性腺发育异常导致卵巢或者卵睾体的发生,即表现为特发性性别逆转(xy female)。特发性性别逆转症(xy female)遗传背景复杂,大部分由基因变异导致,自从上世纪90年代科学家发现sry(sex
‑
determining region on the y chromosome)的基因突变会导致人类完全性的性别逆转(xy female),仅有不到十个基因突变被鉴定与特发性性别逆转症(xy female)的发生相关,其遗传学病因和发病机制仍有待探索及进一步研究。
3.因此,有必要开发一种与男性不育症有关的基因,对明确特发性男性性发育异常与男性不育的病因及靶向治疗及科研具有重要的实践意义。
技术实现要素:
4.本发明目的是提供sdx在制备男性不育症检测试剂盒中的应用,本发明发现特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症的发生与sdx基因异常或sdx基因编码蛋白表达水平异常相关。通过检测sdx基因序列或sdx蛋白表达水平可明确判断特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症与sdx基因相关,在改善男性不育方面具有重要的意义,为诊断基因遗传导致的特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症具有重要研究意义,为临床研究进一步提供了基础。
5.本发明采用如下技术方案:
6.本发明提供了sdx在制备男性不育症检测试剂盒中的应用,所述应用包括:检测sdx基因异常和/或sdx蛋白表达水平异常情况。
7.进一步地,所述男性不育症包括特发性性别逆转、男性精囊腺缺失和年龄依赖性男性不育症中的至少一种。
8.进一步地,所述sdx基因异常包括以下异常中的至少一种:基因的启动子或者增强子序列突变,基因编码序列存在单或多碱基序列缺失、插入或替换。
9.进一步地,所述sdx蛋白表达水平异常包括以下异常中的至少一种:sdx蛋白表达减少,sdx蛋白提前终止或表达缺失,sdx蛋白重要功能域中氨基酸缺失、插入或替换。
10.进一步地,所述男性不育症检测试剂盒包括sdx基因检测试剂盒和/或sdx蛋白表达水平检测试剂盒。
11.进一步地,所述sdx基因检测试剂盒包括全基因组测序检测试剂。
12.进一步地,所述sdx蛋白表达水平检测试剂盒包括特异性结合sdx蛋白的抗体。
13.本发明还提供了一种特异性结合sdx蛋白的抗体在制备男性不育症检测试剂盒中的应用。
14.本发明实施例中的一个或多个技术方案,至少具有如下技术效果或优点:
15.本发明提供的sdx在制备男性不育症检测试剂盒中的应用,本发明发现特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症的发生与sdx基因异常或sdx基因编码蛋白表达水平异常相关。因此通过检测sdx基因序列或sdx蛋白表达水平可明确判断特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症与sdx基因相关,在改善男性不育方面具有重要的意义,为诊断基因遗传导致的特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症具有重要研究意义,为临床研究进一步提供了基础。同时,通过检测特发性性别逆转(46,xy female)和男性精囊腺缺失,以及年龄依赖性男性不育患者sdx基因序列及蛋白表达对明确特发性男性性发育异常与男性不育的病因及靶向治疗及科研具有重要的实践意义。
附图说明
16.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
17.图1为sdx在人和鼠中的蛋白序列保守性分析;
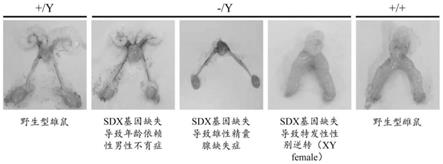
18.图2为sdx基因缺陷小鼠表现为特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症的图示;
19.图3为sdx蛋白在小鼠和人类睾丸组织定位模式的荧光验证结果。
具体实施方式
20.下文将结合具体实施方式和实施例,具体阐述本发明,本发明的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发明,而非限制本发明。
21.在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。
22.除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等,均可通过市场购买获得或者可通过现有方法获得。
23.本技术实施例的技术方案为解决上述技术问题,总体思路如下:
24.本技术发明人在探索由遗传因素(基因突变)在导致男性性发育异常(disorders of sex development,dsd)的过程中,通过对模式动物c57/6j雄性小鼠的性别分化相关蛋白组学研究,我们发现,鼠源sdx异常会导致雄鼠发生完全性的性别逆转(xy female)现象,并且,在未发生性别逆转的sdx缺失雄鼠中,部分雄鼠表现为特发性精囊腺缺失,随着年龄的增长,所有未发生性别逆转的sdx缺失雄鼠睾丸与野生型雄鼠睾丸的大小差异越来越大,并且表现为明显的生精缺陷和雄性不育,而未发生性别逆转的sdx缺失年轻雄鼠却是可育的。
25.本技术发明人进一步揭示,鼠源sdx的缺失会导致xy小鼠胚胎性别分化时期,具有双性分化潜能性腺向雄性性腺分化的缺陷。
26.我们通过对比sdx基因在人类与小鼠中的蛋白序列发现,sdx蛋白序列在小鼠和人类中高度保守,蛋白定位模式也完全一致,因而sdx在人类中的功能应该与小鼠一致。
27.随后通过开展实验首次发现特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症的发生与sdx基因异常或sdx基因编码蛋白表达水平异常相关。
28.因此通过检测sdx基因序列或sdx蛋白表达水平可明确判断特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症与sdx基因相关,在改善男性不育方面具有重要的意义,为诊断基因遗传导致的特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症具有重要研究意义,为临床研究进一步提供了基础。
29.所述sdx基因异常可以通过全基因组测序检测,sdx基因编码蛋白表达水平能够通过特异性结合sdx蛋白的抗体进行检测。因此可以制备成男性不育症检测试剂盒。
30.需要说明的是,本发明中人类基因sdx(mum1l1;pwwp3b)位于染色体xq22.3,nc_000023.11(106168278..106208961),包含6个外显子,目前证实具有两种转录本(nm_001171020.2;nm_152423.5),但是它们都编码同一种蛋白,呈现生殖系统高表达谱。目前sdx基因及sdx编码蛋白结构及功能仍有待进一步研究。
31.人类基因sdx的序列:如seq id no.1所示;
32.人类sdx有效编码序列(coding sequence):如seq id no.2所示;
33.人类sdx基因编码的蛋白序列为:如seq id no.3所示;
34.下面将结合实施例及实验数据对本技术的sdx在制备男性不育症检测试剂盒中的应用进行详细说明。
35.实施例1
36.1、构建sdx基因缺陷小鼠模型
37.方法:利用crispr/cas9技术,通过同源重组的原理,对靶基因进行基因敲除操作。具体过程如下:设计并体外转录guide rna(grna)。
38.grna1:acccccacatatgatcctca(如seq id no.4所示);
39.grna2:ccatttgatgacctattcaa(如seq id no.5所示)
40.将cas9、grna同时注射到小鼠的受精卵中。cas9蛋白在grna引导下结合到靶位点进而造成dna双链断裂(dsb:double
‑
strand break),迫使细胞进行紧急修复。通常条件下,细胞偏向于使用非同源末端连接(nhej:nonhomologous dna end joining)的方式对断裂的双链进行修复,进而造成靶位点基因的缺失突变,从而实现对靶基因的敲除。
41.2、分离并观察sdx基因缺陷小鼠,对模式动物c57/6j小鼠的进行解剖,并分离其相
关生殖系统进行观察
42.结果如图2所示,表明sdx基因缺陷小鼠表现为特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症。
43.3、通过对比sdx基因在人类与小鼠中的蛋白序列结果如图1所述,表明sdx蛋白序列在小鼠和人类中高度保守,蛋白定位模式也完全一致,因而sdx在人类中的功能应该与小鼠一致。
44.实施例2
45.1、荧光验证sdx蛋白在小鼠和人类睾丸组织定位模式的方法:
46.分别取成年雄鼠和人的睾丸组织固定脱水,脱水后于
‑
80℃用neg
‑
50(thermo fisher scientific),进行包埋,最后进行冰冻切片。取出冰冻切片,分别经封闭、一抗孵育、洗涤、二抗孵育、洗涤,最后盖玻片封片,于荧光显微镜下观察并采集图像。
47.2、荧光验证sdx蛋白在小鼠和人类睾丸组织定位模式的结果:
48.结果如图3所示,表明sdx蛋白在小鼠和人类睾丸组织中定位模式完全一致,均表达的表达定位于sertoli cells(sox9 positive)中。
49.因此,综合sdx基因在人类与小鼠中的蛋白序列的高度保守性以及完全一致的组织细胞表达定位模式,sdx在人类中的功能应该是与小鼠一致的。我们有充分的理由推测,在人类中,特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症的发生与sdx基因异常或sdx基因编码蛋白表达水平异常相关。
50.随后我们通过相关收集特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育患者的外周血,通过检测sdx基因序列或者/和sdx蛋白表达水平,证实确实特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育患者存在sdx基因异常和/或sdx蛋白表达水平异常情况(具体见实施例3和实施例4)。
51.实施例3检测基因组中sdx基因序列
52.1、材料
53.收集特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育患者的外周血200微升(μl)。
54.2、提取血液组织基因组
55.采用血液基因提取试剂盒(品牌:tiangen,货号:dp304),具体操作按说明书执行,主要操作如下:
56.(1)处理血液样品(当选用血液样品为200ul时,无需处理)。
57.(2)加入20μl proteinase k溶液,混匀。
58.加入200μl缓冲液gb,充分颠倒混匀,70℃放置10分钟(min),溶液应变清亮,简短离心除去管盖内壁的水珠。
59.(3)加人200μl无水乙醇,充分振荡混匀15秒(s),此时可能会出现絮状沉淀,简短离心除去管盖内壁的水珠。
60.(4)将上一步所得溶液和絮状沉淀都加入一个吸附柱cb3中(吸附柱放入收集管中),12000转每分钟(rpm)离心30秒(s),倒掉废液,将吸附柱cb3放回收集管中。
61.(5)向吸附柱cb3中加入500μl缓冲液gd(使用前请先检查是否已加入无水乙醇),12000转每分钟(rpm)离心30秒(s),倒掉废液,将吸附柱cb3放入收集管中。
62.(6)向吸附柱cb3中加入600μl漂洗液pw(使用前请先检查是否已加入无水乙醇),12000转每分钟(rpm)离心30秒(s),倒掉废液,将吸附柱cb3放入收集管中。
63.(7)重复操作步骤(7)。
64.(8)将吸附柱cb3放回收集管中,12000转每分钟(rpm)离心2分钟(min),倒掉废液。将吸附柱cb3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。
65.(9)将吸附柱cb3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50
‑
200μl洗脱缓冲液te,室温放置2
‑
5分钟(min),12000转每分钟(rpm)离心2分钟(min),将溶液收集到离心管中。
66.(10)将dna溶液保存至
‑
20℃或者
‑
80℃。
67.3、将所得患者外周血基因组dna溶液送至测序公司进行全基因组测序检测。
68.4、分析基因组中sdx基因序列
69.(1)sdx基因外显子序列没有突变,可确定患者特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症与sdx基因无关。
70.需要分析其他基因突变或者考虑其他病因。
71.(2)sdx基因的启动子或者增强子序列突变:
72.若sdx基因启动子或者增强子序列中碱基发生突变,最终编码蛋白表达未发生改变,故特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症与sdx基因无关;
73.若sdx基因启动子或者增强子序列中碱基发生突变,最终导致sdx蛋白表达水平显著减少,故特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症与sdx基因有关。
74.(3)sdx基因编码序列存在碱基缺失或插入:
75.sdx基因外显子序列中碱基发生非3整倍数缺失或插入,编码蛋白必定受到影响,故患者特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症与sdx相关;
76.若发生3整倍数缺失或插入可导致编码蛋白中缺失或插入额外氨基酸残基,且改变位点发生在重要功能域中可导致sdx活性降低,需要进一步确定编码蛋白序列,具体需参考蛋白表达及功能验证。
77.(4)sdx基因编码序列存在碱基替换:
78.若sdx基因外显子序列中碱基发生同义突变(碱基替换后未改变编码氨基酸种类),最终编码蛋白未发生改变,故特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症与sdx基因无关;
79.若sdx基因外显子序列中碱基发生无义突变(碱基替换后导致蛋白翻译提前终止),最终影响sdx蛋白活性及功能,故特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症与sdx基因有关。
80.(5)全基因组测序分析过程中,同样需要分析其他已报道与特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症相关的基因组相关序列,如果患者结合了其他已报道相关基因的突变,可考虑多基因变异导致上述疾病的发生。
81.实施例4、检测sdx编码蛋白表达水平
82.1、获取组织
83.通过组织穿刺(需要专业医务人员)获取特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育患者的生殖器官组织。
84.2、制备蛋白样品
85.(1)100μl ripa裂解液(品牌:beyotime,货号:p0013k),并且加入终浓度为1x蛋白酶抑制剂cocktail(品牌:roche,货号:11836145001),裂解组织,冰上研磨40次,4℃摇床翻滚裂解30分钟(min),再于4℃12000g离心10分钟(min),取上清。
86.(2)通过bca法测定蛋白浓度(品牌:beyotime,货号:p0012)。
87.(3)加入5x sds
‑
page蛋白上样缓冲液(品牌:abclonal,货号:rm00001),混合后沸水10min后冰上冷却。
88.3、蛋白免疫印迹反应
89.(1)根据使用说明书安装制胶器,分别制备3%的浓缩胶和12%分离胶。
90.(2)上样:蛋白上样量为10~100ng。
91.(3)电泳:上样完成后,连通电泳仪电源,注意正负极需连接正确,设定适宜的电泳参数,浓缩胶电泳参数为恒压80v,待样本进入分离胶时,可将电泳调至120v。当溴酚蓝电泳到凝胶底部时,停止电泳,关闭电泳仪电源。
92.(4)转膜:取出玻板中的凝胶,在夹板上依次放一块多孔垫、一张滤纸、凝胶、pvdf膜、三张滤纸、一块多孔垫(“三明治”结构),将转好的膜放在转膜槽,冰上320ma恒流转膜100分钟(min)。
93.(5)封闭:将膜从“三明治”结构中取出,放入合适的抗体孵育槽中,加入5%的脱脂牛奶/tbst buffer(质量/体积)室温封闭1h。
94.(6)一抗孵育:实验室自制兔抗人源sdx多克隆抗体,并且用3%的牛血清白蛋白(bsa)/tbst buffer(质量/体积)进行稀释,稀释比例为1:100~1:200;gapdh兔单克隆抗体(品牌:abclonal,货号:a19056),稀释比例为1:500~1:2000。一抗孵育,4℃过夜。
95.(7)洗涤:一抗孵育结束后,加入tbst buffer洗涤4次,5min/次。
96.(8)二抗孵育:二抗hrp goat anti
‑
rabbit igg(h+l)
97.(品牌:abclonal,货号:as014)用tbst buffer按照1:5000比例进行
98.稀释。室温孵育1h。
99.(9)洗涤:二抗孵育结束后,加入tbst buffer洗涤4次,5min/次。
100.(10)显影:ecl显影液(品牌:thermo fisher scientific,货号:1863094),避光混合a、b液后滴加到pvdf膜上进行数字显影。
101.4、数据计算
102.通过bca法蛋白定量,以gapdh(不同细胞内含量变化不大,不受目标蛋白变化影响)作为内参蛋白可对sdx蛋白进行相对定量(取sdx蛋白与内参蛋白的比值作为计量值),对照组蛋白(正常睾丸和卵巢组织)。将不同样品的显影图像进行灰度处理并计算灰度值或灰度面积。
103.5、结果分析
104.若检测组与对照组无差异(位置、含量):表明特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育患者sdx蛋白表达水平与正常人无异,同时,若基因
序列正确可进一步排除sdx异常导致特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症的可能性。
105.若检测组sdx蛋白含量显著减少:结合sdx基因序列信息(启动子或者增强子序列突变),可提高判断sdx导致特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症的可能性。
106.若检测组sdx蛋白条带位置改变:结合sdx基因序列信息,表明sdx蛋白提前终止,或因插入碱基导致终止密码子丢失而加入新序列;若不伴随表达量增加,提示蛋白功能可能未受影响,若蛋白表达量增加提示突变导致蛋白功能受损;但蛋白功能具体是否受影响需要进一步行蛋白互作实验(co
‑
ip或gst poll
‑
down)证实。
107.若检测组sdx蛋白含量增加:提示sdx蛋白活性降低,结合sdx基因序列信息(功能域突变)及蛋白互作实验(蛋白结合下降),可提高判断sdx导致特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症的可能性。
108.6、组织固定脱水
109.穿刺得到的组织用4%pfa/pbs(质量/体积)于4℃固定2小时,再用30%sucrose/pbs(质量/体积)于4℃脱水过夜。
110.7、组织包埋与切片
111.将脱水好的组织于
‑
80℃用neg
‑
50(thermo fisher scientific),进行包埋,包埋完成后进行冰冻切片。
112.8、冰冻切片免疫荧光
113.封闭:用阻水笔在切片上将组织周围画圈围住,用10%山羊血清/tbs buffer(体积/体积)将样本完全覆盖,切片放置于湿盒内,置于室温孵育1小时。
114.一抗孵育:去除封闭液,直接在样本上滴加10%山羊血清/tbs buffer(体积/体积)配制的一抗工作液(实验室自制兔抗人源sdx多克隆抗体,稀释比例:1:50),样本需完全覆盖,切片需放置于湿盒内,室温孵育过夜。
115.用缓冲液tbst洗涤1次,5分钟;用缓冲液tbs洗涤3次,每次5分钟。
116.二抗孵育:在样本上滴加10%山羊血清/tbs buffer(体积/体积)配制的荧光二抗工作液
‑
alexa fluor 488
‑
conjugated goat anti
‑
rabbit igg(h+l)(品牌:abclonal,货号:as053),样本需完全覆盖,避光,室温孵育1小时。
117.用缓冲液tbst洗涤1次,5分钟;用缓冲液tbs洗涤3次,每次5分钟;
118.染核:在样本上滴加含dapi荧光衰减封片剂,然后加盖盖玻片封片,再于荧光显微镜下观察并采集图像。
119.9、结果分析
120.检测组sdx蛋白荧光信号消失:结合sdx基因序列信息,及蛋白免疫印迹结果分析,表明sdx蛋白表达缺失或者提前终止,进一步证明特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症由sdx异常导致。
121.检测组sdx蛋白荧光信号与对照组一致:
122.sdx基因外显子序列没有突变,并且蛋白免疫印迹结果显示检测组sdx蛋白的大小和含量与对照组无差异,进一步排除sdx异常导致特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症的可能性。
123.若sdx基因外显子序列发生3整倍数缺失或插入,并且,蛋白免疫印迹结果显示检测组sdx蛋白条带位置改变,异常表达的sdx活性可能受到影响,表明患者特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症可能与sdx异常相关,需要进一步确定编码蛋白序列,具体需要结合蛋白功能验证。
124.检测组sdx蛋白荧光信号减弱:结合sdx基因组测序序列变异信息,及蛋白免疫印迹实验中sdx表达量结果分析,可提高判断sdx导致特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育症的可能性。
125.实施例3和实施例4的结果证实:特发性性别逆转(xy female)和男性精囊腺缺失,以及年龄依赖性男性不育患者的外周血检测存在sdx基因异常和/或sdx蛋白表达水平异常情况。
126.最后,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
127.尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
128.显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1