一种卡巴尼氏致病杆菌NN7及其应用
一种卡巴尼氏致病杆菌nn7及其应用
技术领域
1.本发明涉及一种卡巴尼氏致病杆菌nn7及其应用,属于生物技术领域,是利用生物防治的方法抑制西瓜专化型的尖孢镰刀菌,适用于现代生态农业西瓜枯萎病的防治。
背景技术:
2.多汁清甜的西瓜不仅是我国多数家庭夏日必需的消暑水果,而且是我国重要的农业经济作物,其广泛种植给瓜农创造了可观的经济收益。然而近年来,西瓜枯萎病害的发病率逐年增高,发病程度日益严重,给农业经济的发展造成了较为严重的损失。西瓜枯萎病是由尖孢镰刀菌西瓜专化型(fusarium oxysporum f.sp.niveum,fon)侵染西瓜所致,是在世界范围内广泛发生的土传真菌病害。fon通常侵染西瓜的维管束,西瓜被成功侵染后发病迅速,其整个生长期均可发病,以结果期发病最重,防治难度较大。目前,传统化学防治的方法污染问题严重,人类健康受到化学农药威胁;嫁接法虽有防治效果但会导致西瓜对根结线虫更为敏感而加重根结线虫病害,所以对效果显著、环境友好、人畜安全的西瓜枯萎病防治方法的需求迫在眉睫。
3.昆虫病原线虫(entomopathogenic nematodes,epns)在欧美国家已经得到了大量的研究,其在害虫防治中的应用也已经较为成熟,但如何将其肠道内携带的共生菌应用于生物防治的课题还未得到足够的关注。卡巴尼氏致病杆菌(xenorhabdus cabaniltasii)nn7菌株分离自昆虫病原线虫,关于此种菌株尚未见其在生物防治领域的报道,其代谢产物丰富多样,在西瓜枯萎病防治中的研究应用值得更多关注和开发。
技术实现要素:
4.发明目的:针对现有生物防治手段防治西瓜枯萎病效果欠佳的现状,本发明提供一种新的昆虫病原线虫共生菌菌株,该共生菌菌株为新的菌株,其名称为卡巴尼氏致病杆菌(xenorhabdus cabaniltasii)nn7菌株,其具有与已发表的伯氏致病杆菌nn6菌株相近的对尖孢镰刀菌西瓜专化型1号生理小种孢子萌发的抑制能力,但是nn7菌株抑制尖孢镰刀菌西瓜专化型1号生理小种菌丝生长的能力显著高于nn6菌株,在西瓜枯萎病防治领域具有更优秀的开发潜力。
5.技术方案:为了解决上述技术问题,本发明所采用的技术方案为:一种卡巴尼氏致病杆菌(xenorhabdus cabaniltasii)nn7菌株,所述菌株的保藏编号为cctcc no:m2021760,于2021年6月24日保藏于中国典型培养物保藏中心,保藏地址为:中国武汉武汉大学,分类命名为xenorhabdus cabaniltasii nn7。
6.本发明内容还包括所述的卡巴尼氏致病杆菌(xenorhabdus cabaniltasii)nn7菌株在制备生防菌剂中的应用。
7.本发明内容还包括一种生防菌剂,所述生防菌剂含有所述的卡巴尼氏致病杆菌(xenorhabdus cabaniltasii)nn7菌株的全菌液、无菌滤液或菌细胞悬液中的一种或几种。
8.其中,所述生防菌剂的剂型包括但不仅限于液体菌剂,还可以是其他剂型。
9.其中,上述的生防菌剂的制备方法,包括如下步骤:
10.1)用接种环蘸取nn7适量菌液,在nbta+sp培养基上划线,28~30℃恒温培养24~48h;
11.2)挑取蓝绿色单菌落,接种于lb+sp液体培养基,28~30℃、160~220rpm振荡培养12~24h;
12.3)取2)培养的菌液以2~10%的接种量接种于ysg摇瓶发酵培养基,28~30℃、150~220rpm振荡培养48~86h得菌株全菌液;
13.其中,所述制备方法还包括以下步骤:
14.4)将步骤3)获得的全菌液离心得到菌体沉淀和上清液;
15.5)离心所得的菌体沉淀用无菌水稀释混匀得到菌细胞悬液。
16.其中,所述制备方法还包括以下步骤:将权利要求6步骤4)离心所得的上清液用孔径0.22μm的滤膜过滤除菌得无菌滤液。
17.其中,上述步骤1)中的nbta+sp培养基配方为胰蛋白胨10g/l、酵母提取物5g/l、氯化钠10g/l、琼脂15g/l、溴百里酚蓝0.025g/l、丙酮酸钠1g/l、氯化三苯基四氮唑0.04g/l、去离子水1l。
18.其中,上述步骤2)中的lb+sp液体培养基配方为胰蛋白胨10g/l、氯化钠10g/l、酵母提取物5g/l、丙酮酸钠1g/l、去离子水1l。
19.其中,上述步骤3)中的ysg摇瓶发酵培养基配方为甘油6.9g/l、大豆蛋白胨25.17g/l、七水合硫酸镁1.57g/l、硫酸铵2.55g/l、磷酸二氢钾0.87g/l、三水合磷酸氢二钾1.48g/l、硫酸钠1.81g/l、去离子水1l。
20.本发明内容还包括所述的卡巴尼氏致病杆菌(xenorhabdus cabaniltasii)nn7菌株、所述的生防菌剂在抑制尖孢镰刀菌西瓜专化型1号生理小种孢子萌发和菌丝生长方面的应用。
21.本发明内容还包括所述的卡巴尼氏致病杆菌(xenorhabdus cabaniltasii)nn7菌株、所述的生防菌剂在防治西瓜枯萎病中的应用。
22.有益效果:本发明与现有共生菌菌株相比,其优点在于,本发明提供一种新型昆虫病原线虫共生菌卡巴尼氏致病杆菌(xenorhabdus cabaniltasii)nn7菌株,其生防菌剂制备简单、环境友好、具有更良好的抑菌活性,适用于对西瓜枯萎病的防治。本发明对于保护生态环境,提高农产品的附加值具有重要的意义。试验表明:ysg培养基发酵培养得到的卡巴尼氏致病杆菌(xenorhabdus cabaniltasii)nn7生防菌剂对尖孢镰刀菌西瓜专化型孢子萌发和菌丝生长的抑制效果优异,对孢子萌发的抑制率最高可达100%,对菌丝生长的抑制率最高可达50.74%,而ysg培养基发酵培养得到nn6菌株对菌丝生长的抑制率为31.47%,ys培养基发酵培养得到的nn6菌株对菌丝生长的抑制率仅为4.86%,并且nn7菌株胞外粗蛋白的孢子萌发的半抑制浓度值(ic50)为3.912ug/ml,显著低于其它共生菌胞外粗蛋白的ic50值,因此卡巴尼氏致病杆菌(xenorhabdus cabaniltasii)nn7菌株在西瓜枯萎病防治领域具有更良好的应用价值。
附图说明
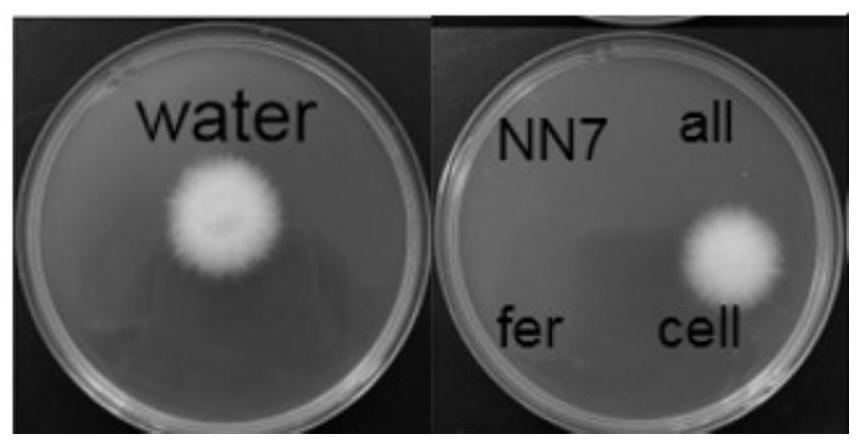
23.图1:卡巴尼氏致病杆菌nn7的全菌液all、无菌滤液fer和菌细胞悬液cell对尖孢
镰刀菌西瓜专化型1号生理小种孢子萌发的抑制效果图;注:water为对照组,all为全菌液处理组,fer为无菌滤液处理组,cell为菌细胞悬液处理组;
24.图2:卡巴尼氏致病杆菌nn7对尖孢镰刀菌西瓜专化型1号生理小种菌丝生长的抑制率;注:water为对照组处理,all表示全菌液处理,fer表示无菌滤液处理,cell表示菌细胞悬液处理;“*”表示单因素方差分析中p
‑
value<0.05;fon
‑
1表示尖孢镰刀菌西瓜专化型1号生理小种;
25.图3:ysg培养的nn7菌株全菌液与ysg、ys培养的伯氏致病杆菌nn6全菌液对尖孢镰刀菌西瓜专化型1号生理小种孢子萌发的显微镜观察图和孢子萌发抑制率统计图;注:ysg6、ysg7分别为ysg培养的伯氏致病杆菌nn6和卡巴尼氏致病杆菌nn7,ys6为ys培养的伯氏致病杆菌nn6;
26.图4:ysg培养的nn7菌株全菌液与ysg、ys培养的伯氏致病杆菌nn6全菌液液对尖孢镰刀菌西瓜专化型1号生理小种孢子萌发的抑制效果图;
27.图5:ysg培养的nn7菌株全菌液与ysg、ys培养的伯氏致病杆菌nn6全菌液胞外粗蛋白对尖孢镰刀菌西瓜专化型1号生理小种孢子萌发的半抑制浓度值(ic50);
28.图6:ysg培养的nn7菌株全菌液与ysg、ys培养的伯氏致病杆菌nn6全菌液液对尖孢镰刀菌西瓜专化型1号生理小种菌丝生长的抑制率。
具体实施方式
29.下面通过具体的实施例对本发明进一步说明,应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干变型和改进,这些也应视为属于本发明的保护范围。
30.下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。本发明的昆虫病原线虫共生菌菌株卡巴尼氏致病杆菌(xenorhabdus cabaniltasii)nn7以甘油菌的形式保藏在
‑
80℃冰箱中。本发明的卡巴尼氏致病杆菌nn7菌株,保藏号为cctcc m 2021760,2021年6月24日保藏于中国典型培养物保藏中心。本发明的伯氏致病杆菌(xenorhabdus bovienii)的高毒力菌株nn6,保藏编号为:cctcc no:m 2020097,该菌株的相关记载参见中国发明专利申请号为2020103761565的具体内容。
31.实施例1:卡巴尼氏致病杆菌nn7全菌液的制备
32.将本发明的卡巴尼氏致病杆菌nn7甘油菌原种在nbta+sp培养基(胰蛋白胨10g/l、酵母提取物5g/l、氯化钠10g/l、琼脂15g/l、溴百里酚蓝0.025g/l、丙酮酸钠1g/l、氯化三苯基四氮唑0.04g/l、去离子水1l)上划线,28~30℃恒温培养24~48h。挑取蓝绿色单菌落,接种于lb+sp液体培养基(胰蛋白胨10g/l、氯化钠10g/l、酵母提取物5g/l、丙酮酸钠1g/l、去离子水1l),28~30℃、160~220rpm振荡培养12~24h。活化好的菌液以2~10%的接种量接种于ysg摇瓶发酵培养基(甘油6.9g/l、大豆蛋白胨25.17g/l、七水合硫酸镁1.57g/l、硫酸铵2.55g/l、磷酸二氢钾0.87g/l、三水合磷酸氢二钾1.48g/l、硫酸钠1.81g/l、去离子水1l),28~30℃、150~220rpm振荡培养48~86h得菌株全菌液。
33.实施例2:实施例1制备的卡巴尼氏致病杆菌nn7全菌液中菌细胞悬液和无菌滤液的制备方法
34.实施例1制备的nn7全菌液以10000rpm离心10min得到菌体沉淀和上清液;离心所
得的菌体沉淀用无菌水稀释混匀得到菌细胞悬液;离心所得的上清液用孔径0.22μm的滤膜过滤除菌得无菌滤液。
35.实施例3:尖孢镰刀菌西瓜专化型1号生理小种分生孢子悬液和pda平板的制备
36.取本发明的尖孢镰刀菌西瓜专化型1号生理小种菌丝滤纸片,在无菌超净台中将滤纸片接于pda固体培养基中央,置于25℃恒温培养箱纯化培养4~6d得到尖孢镰刀菌pda平板。向pda中加入适量无菌水,用无菌枪头轻轻刮取菌丝,将充满菌丝的无菌水接入pda液体培养基,28℃、200rpm振荡培养72h。将摇好的孢子用六层灭菌纱布过滤,过滤后4℃、3000rpm离心5min,离心完成后弃上清,用无菌水多次清洗离心沉淀,沉淀再用无菌水重悬得分生孢子悬液,将孢子悬浮液稀释至1
×
105个/ml后得分生孢子悬液。其中,所述pda固体培养基配方为:马铃薯葡萄糖琼脂粉39g/l、去离子水1l。其中,所述pda液体培养基配方为:将新鲜马铃薯去皮洗净切碎,称取200g的马铃薯,加入1l去离子水,煮至马铃薯呈泥状,用纱布过滤留取滤液。向马铃薯滤液加入15g葡萄糖,高压蒸汽灭菌后冷却贮存备用。
37.实施例4:实施例1、实施例2制备的卡巴尼氏致病杆菌nn7全菌液、菌细胞悬液和无菌滤液对尖孢镰刀菌西瓜专化型1号生理小种孢子萌发的抑制
38.取本发明实施例1、实施例2制备的卡巴尼氏致病杆菌nn7全菌液、菌细胞悬液和无菌滤液、实施例3制备的尖孢镰刀菌分生孢子悬液、0.5%的葡萄糖溶液各10μl,总体积30μl均匀混合并滴于无菌凹玻片中央,以只加无菌水的处理组作为对照,每个处理组重复三个凹玻片。在9cm塑料培养皿中铺垫6cm无菌滤纸,加入2ml无菌水湿润滤纸,将凹玻片置于保湿培养皿,28℃恒温萌发12h。萌发完成后,取所述混合样品,滴加于pda固体培养基中央。25℃恒温培养48h后,观察平板孢子萌发情况。试验结果显示,卡巴尼氏致病杆菌nn7的全菌液、无菌滤液对尖孢镰刀菌西瓜专化型1号生理小种孢子的萌发具有完全的抑制作用,抑制率可达100%。孢子萌发抑制效果如图1所示。
39.实施例5:实施例1、实施例2制备的卡巴尼氏致病杆菌nn7全菌液、菌细胞悬液和无菌滤液对尖孢镰刀菌西瓜专化型1号生理小种菌丝生长的抑制
40.用0.75cm孔径的真菌打孔器切取实施例3制备的尖孢镰刀菌pda固体平板,置于新的pda固体培养基中央。在相距病原菌菌饼2cm处对称放置4个内径为0.6cm的无菌牛津杯,取实施例1制备的卡巴尼氏致病杆菌nn7全菌液、实施例2制备的菌细胞悬液、无菌滤液200μl加入到牛津杯,以等体积无菌水作为对照。将牛津杯平板平稳放置于25℃培养箱中培养,当对照组菌丝生长至牛津杯外边缘时,测量菌板中心到菌丝生长边缘的最小距离并测定菌丝生长抑制率。试验重复三次。菌丝生长抑制率计算公式为(r0
‑
rn)/r0
×
100%,其中r0为对照菌丝生长直径,rn为处理组菌丝生长直径。试验结果显示,卡巴尼氏致病杆菌nn7全菌液对尖孢镰刀菌1号生理小种菌丝生长的抑制率为50.74%、无菌滤液的抑制率为48.97%、菌细胞悬液的抑制率为28.26%。综合来看,卡巴尼氏致病杆菌nn7的全菌液抑制效果更为显著。菌丝生长抑制效果及抑制率统计如图2所示。
41.实施例6:实施例1制备的nn7菌株全菌液与ysg、ys培养的伯氏致病杆菌nn6菌株全菌液对尖孢镰刀菌西瓜专化型1号生理小种孢子萌发抑制效果的比较
42.取实施例1制备的nn7菌株全菌液、ysg和ys培养的伯氏致病杆菌nn6菌株全菌液、实施例3制备的尖孢镰刀菌分生孢子悬液、0.5%的葡萄糖溶液各10μl,总体积30μl均匀混合并滴于无菌凹玻片中央,以只加无菌水的处理组作为对照,每个处理组重复三个凹玻片。
在9cm塑料培养皿中铺垫6cm无菌滤纸,加入2ml无菌水湿润滤纸,将凹玻片置于保湿培养皿,28℃恒温萌发12h。12h后,在光学显微镜下观察孢子萌发情况,当对照组孢子萌发率大于85%时,统计各处理组孢子萌发情况,计算相对萌发抑制率。当分生孢子芽管长度大于分生孢子短半径即视为萌发。根据下面公式a计算孢子萌发率,根据公式b计算相对萌发率,再根据公式c计算相对萌发抑制率(r代表分生孢子萌发率,ng代表已萌发的分生孢子数,nt代表调查的分生孢子总数;rg代表经过处理的校正后的分生孢子发芽率,rt代表处理组分生孢子萌发率,r0代表对照组分生孢子萌发率;i代表分生孢子萌发的相对抑制率)。并从处理后的孢子悬液中取6μl均匀滴加到pda平板上,25℃恒温培养48h后,观察孢子是否会正常萌发生长成菌丝。
43.a:r=ng/nt
×
100;
44.b:rg=rt/r0
×
100;
45.c:i=(r0
‑
rg)/r0
×
100。
46.其中,所述的ys摇瓶发酵培养基配方为磷酸二氢铵0.5g/l、磷酸二氢钾0.5g/l、七水合硫酸镁0.2g/l、氯化钠5g/l、酵母提取物5g/l。
47.孢子萌发抑制试验结果显示,12h后,在光学显微镜下观察ysg培养基发酵培养得到的卡巴尼氏致病杆菌nn7菌株全菌液、ysg和ys培养的伯氏致病杆菌nn6菌株全菌液对尖孢镰刀菌孢子萌发的相对抑制率都为100%;但是将处理后的孢子悬液滴加到pda平板上,25℃恒温培养48h后,ys培养基培养的nn6菌株的全菌液处理的尖孢镰刀菌孢子萌发长出菌丝,ysg培养基培养的nn7和nn6菌株的全菌液处理的孢子始终未有菌丝萌发(图3、图4)。这个结果表明ysg培养的nn7和nn6完全抑制了尖孢镰刀菌孢子的萌发,而ys培养的nn6菌株则不能完全抑制对尖孢镰刀菌孢子的萌发。
48.实施例7:实施例1制备的nn7菌株全菌液与ysg、ys培养的伯氏致病杆菌nn6菌株全菌液的胞外粗蛋白对尖孢镰刀菌西瓜专化型1号生理小种孢子萌发的半抑制浓度值(ic50)的比较
49.将各处理组发酵液于8000r
·
min
‑
1离心15分钟去沉淀,向上清液边搅拌边加入固体硫酸按,调节硫酸铵饱和度到80%,将溶液放在磁力搅拌器上搅拌过夜(4℃),使蛋白充分沉淀。将蛋白溶液于10000r
·
min
‑1离心30min(4℃)。弃上清保留沉淀;将沉淀溶于少量25mmol/l tris
‑
hcl缓冲液(ph 7.2)进行溶解,沉淀溶解后放入透析袋透析24
‑
48小时(4℃),每隔3
‑
6小时换透析缓冲液一次,以彻底除去硫酸铵得到粗蛋白溶液;将各处理组粗蛋白根据bradford蛋白定量法测定其含量,标曲的方程为y=0.0019x+0.5424,r2值为0.9525,用孢子萌发抑制法测定各处理组粗蛋白对fon
‑
1孢子萌发的半最大抑制浓度(ic50),分别将各处理组粗蛋白调节为不同浓度进行孢子萌发抑制实验,再根据graphpad prism 8软件计算各处理组蛋白对fon
‑
1孢子萌发的半抑制浓度值(ic50),试验结果显示,ysg培养基发酵培养得到的卡巴尼氏致病杆菌nn7菌株粗蛋白的ic50为3.91,显著低于ysg和ys培养基得到nn6菌株的粗蛋白。各处理组粗蛋白对fon
‑
1孢子萌发的半抑制浓度值(ic50)如图5所示。
50.实施例8:实施例1制备的nn7菌株全菌液与ysg、ys培养的伯氏致病杆菌nn6菌株全菌液对尖孢镰刀菌西瓜专化型1号菌丝生长抑制效果的比较
51.伯氏致病杆菌nn6菌株对菌丝生长抑制的试验方法同实施例5。试验结果显示,在
菌丝生长抑制效果方面,卡巴尼氏致病杆菌nn7全菌液的菌丝生长抑制率最高可达50.74%,而ysg培养基发酵培养得到的nn6菌株全菌液对菌丝生长的抑制率为31.47%,ys培养基发酵培养得到的nn6菌株全菌液对菌丝生长的抑制率仅为4.86%,卡巴尼氏致病杆菌nn7全菌液具有更为优异的对菌丝生长的抑制效果。菌丝生长抑制率统计如图6所示。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1