裂解液及其应用的制作方法
1.本发明涉及分子生物学技术领域,尤其涉及裂解液及其应用。
背景技术:
2.近年来,随着荧光定量pcr技术的不断成熟,该技术在科研及检验领域得到了广泛的应用,成为分子生物学领域不可或缺的一项重要技术。特别是在进行遗传背景分析过程中,口腔拭子作为重要的生物分析样本,时常需要对口腔细胞进行荧光定量pcr检测。
3.相对于普通pcr而言,荧光定量pcr检测对样品要求较高,但是,由于口腔拭子中存在有很多pcr反应抑制物(例如:口腔拭子含有蛋白质,脂肪,抗凝剂等),使得用口腔拭子直接进行荧光定量pcr反应变得尤为困难。因此,现在临床上往往先要从口腔拭子样本中纯化出dna,才能进行样本的dna扩增。
4.提取口腔拭子基因组的方法种类非常多,例如硅胶模离心柱吸附法,磁珠法等。通常口腔拭子中核酸提取方法包括以下4个过程:1.通过裂解液裂解口腔脱落细胞,释放核酸物质。2.通过离心柱或纳米磁珠特异性吸附核酸物质,去除其他杂质。3.通过漂洗液洗掉挂在离心柱或纳米磁珠表面的化学试剂残留和蛋白残留。4.加入洗脱液将核酸从离心柱或纳米磁珠上洗脱下来。这类提取方法由于核酸提取纯化过程耗时长,成本较高,步骤繁多,增加了基因污染的风险。并且,这些步骤中,最为关键的是细胞裂解步骤,该步骤中细胞裂解的程度决定了后期扩增的效果。目前常用的裂解液中多含有蛋白酶k成分,利用蛋白酶k对细胞进行裂解需要于37℃孵育,增加了裂解的步骤。且为了维持蛋白酶k的活性,需要低温冷藏和运输给存储和运输带来了不便。而如果在纯化过程中没有完全将蛋白酶k除去,则会影响后期的扩增反应。
5.因此,本领域渴望能够研发一种不含有蛋白酶k的裂解剂,从而使口腔拭子样本经过简单处理就可以作为模板进行荧光定量pcr扩增检测方法,满足科研和医学领域快速检测的要求。
技术实现要素:
6.有鉴于此,本发明要解决的技术问题在于提供适用于口腔细胞的无蛋白酶k的裂解液及其应用。
7.实验表明,本发明所述的裂解液即便不添加蛋白酶k,也能够对口腔细胞起到良好的裂解效果。
8.本发明提供的裂解液,其包括水、tris
‑
hcl、tween、triton x
‑
100和edta。
9.所述裂解液中,所述tris
‑
hcl的ph值为8.3。该裂解液中,以吐温和triton x
‑
100作为去污剂,从而起到良好的裂解作用。经验证,选择吐温
‑
20的裂解效果由于其他吐温系列的表面活性剂。其中吐温
‑
20与triton x
‑
100的质量比优选为8:1,当吐温
‑
20与triton x
‑
100在该比例下时,裂解所得产物的扩增效果最优。
10.本发明实施例中,所述裂解液由水和如下组分组成:10~30mm tris
‑
hcl,0.5wt%
~1wt%tween、0.01wt%~1wt%triton x
‑
100和1~20mm edta。
11.一些具体实施例中,所述裂解液其由水和如下组分组成:20mm tris
‑
hcl,0.8wt%tween
‑
20、0.1wt%triton x
‑
100和10mm edta。
12.本发明所述的裂解液在动物细胞样品裂解中的应用。
13.本发明所述的裂解液在制备试剂盒中的应用,所述试剂盒为动物细胞样品核酸提取试剂盒或荧光pcr前处理试剂盒。
14.本发明所述的动物细胞样品为动物的口腔拭子样品。所述动物包括人类。
15.本发明所述的动物细胞样品核酸提取试剂盒中包括本发明所述的裂解液和bsa溶液。所述核酸为动物的基因组dna。
16.一些实施例中,所述裂解液和bsa溶液的体积比为200:4。
17.所述bsa溶液中,bsa的浓度为20mg/ml。
18.本发明还提供了一种动物细胞样品的核酸提取方法,其将待提取的样品与所述的裂解液混合,经涡旋振荡后,与牛血清白蛋白溶液混合,再次经涡旋振荡后,60~70℃孵育8~12min后,再经90~100℃孵育4~6min,经离心后获得含有核酸的上清液。
19.本发明中,所述所述待提取样品为口腔拭子,所述核酸为基因组dna。
20.在该提取方法中,每份口腔拭子与200μl所述裂解液混合。
21.所述牛血清白蛋白溶液中牛血清白蛋白的浓度为20mg/ml,所述牛血清白蛋白溶液的体积与所述核酸裂解液的体积比为4:200。
22.所述60~70℃孵育前经瞬时离心;所述90~100℃孵育前也经瞬时离心。所述离心为以12000转/分钟,离心5分钟。
23.一些实施例中,所述孵育的包括65℃孵育10min后,再经95℃孵育5min。
24.一种动物细胞样品的荧光定量pcr检测方法,其包括:以本发明所述的试剂盒进行前处理获得扩增模板,以引物进行扩增。
25.本发明在确保裂解液稳定性良好的情况下,配置简单且易制备的裂解液。该裂解液包括水、tris
‑
hcl、tween、triton x
‑
100和edta。该裂解液可以保证裂解过程不需要加入蛋白酶k仍可以完成核酸提取,缩短裂解液提取样本核酸的周期,降低裂解液成本。该提取核酸的方法快速简单,成本低廉,检测灵敏,且用该方法提取的基因组与商品化试剂盒提取的基因组的检测结果相近。以该试剂提取口腔拭子基因组dna,在20分钟内完成核酸提取,通过稀释一定倍数样本,进行于荧光定量pcr检测。
附图说明
26.图1示8份来源不同的人口腔样本荧光pcr扩增检测;
27.图2、3、4分别示各样品分别稀释三个梯度,平行检测三次的结果。
具体实施方式
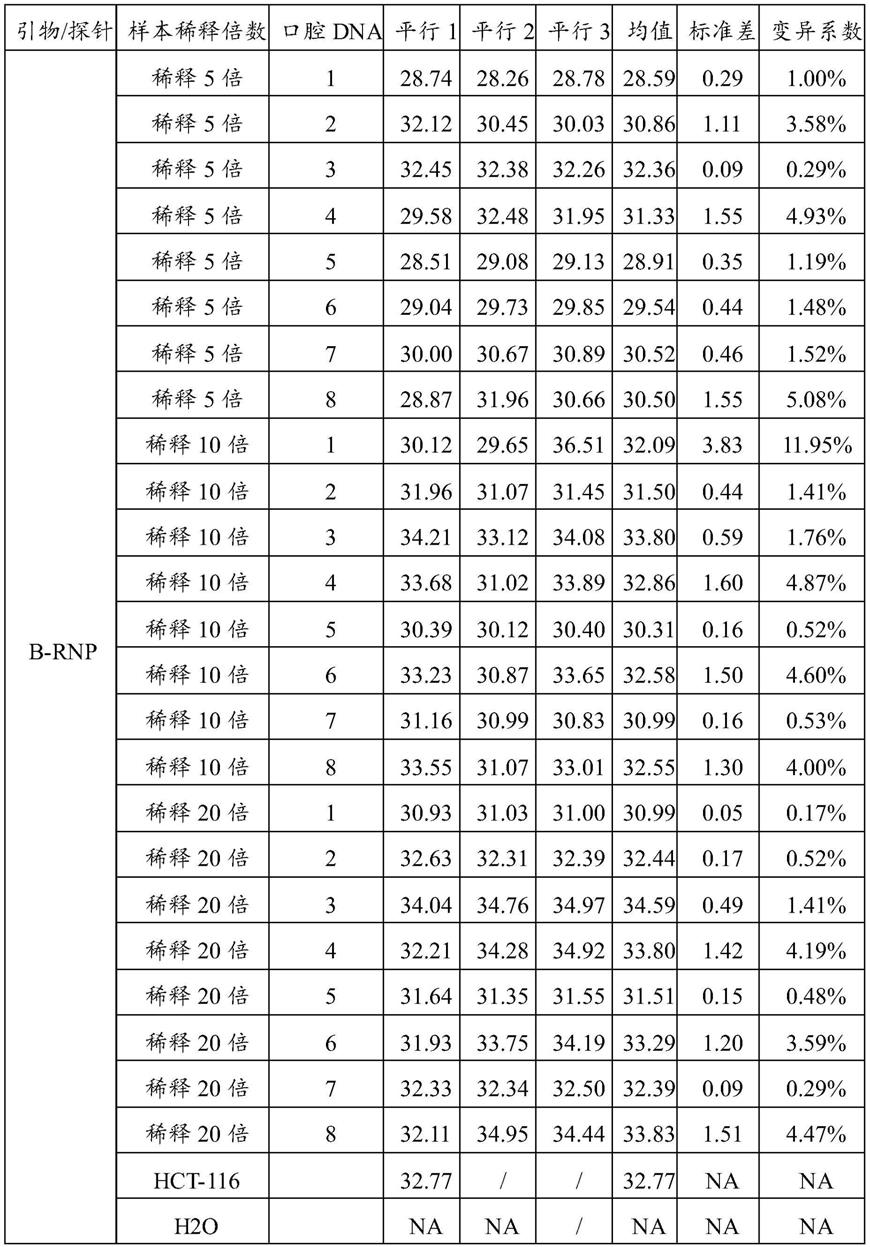
28.本发明提供了裂解液及其应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当
变更与组合,来实现和应用本发明技术。
29.本发明采用的试材皆为普通市售品,皆可于市场购得。下面结合实施例,进一步阐述本发明:
30.实施例1
31.一种快速提取口腔拭子基因组dna裂解液的配置:
32.裂解液组分:tris
‑
hcl 8.5 20mm,0.8%tween
‑
20,0.1%triton x
‑
100,10mmedta。
33.配置10ml裂解液:
34.(1)移液器吸取1m tris
‑
hcl 8.5溶液2ml加入干净无菌的15ml离心管中;
35.(2)稀释tween
‑
20,先稀释至8%tween
‑
20,即取80μl tween
‑
20加入910μl超纯水中,颠倒混匀即可;
36.(3)移液器吸取1ml步骤(2)中已配置好的8%tween
‑
20加入到步骤(1)中的15m离心管;
37.(4)稀释triton x
‑
100,先稀释至10%triton x
‑
100,即取100μl triton x
‑
100加入900μl超纯水中,颠倒混匀即可;
38.(5)将步骤(4)中获得的10%triton x
‑
100继续稀释至1%trionx
‑
100,即取100μl 10%tween
‑
20加入900μl超纯水中,颠倒混匀即可;
39.(6)移液器吸取1ml步骤(5)中已配置好的1%triton x
‑
100加入到步骤(1)中的15m离心管;
40.(7)吸取0.5m的edta溶液200μl。
41.(8)向15ml离心管加入5.8ml超纯水补足至10ml,颠倒混匀,裂解液配置完成。
42.实施例2
43.裂解液快速提取口腔拭子基因组dna的方法:
44.(1)将口腔拭子样本放入1.5ml离心管中;
45.(2)向步骤(1)的离心管中加入200μl核酸裂解液,涡旋振荡后;
46.(3)再向步骤(2)中加入4μl 20mg/ml的牛血清白蛋白,涡旋振荡后,进行瞬时离心;
47.(4)将离心管放置65℃金属浴中孵育10分钟;
48.(5)瞬时离心后,将离心管放置95℃金属浴中孵育5分钟;
49.(6)取出离心管在离心机中常温离心,以12000转/分钟,离心5分钟;
50.(5)吸取离心管底部上清液到干净1.5ml离心管中,避免吸取到沉淀;
51.(6)该上清液即为提取的基因组dna,可将上清液稀释5
‑
10倍进行qpcr。
52.实施例3
53.一种可用于荧光pcr扩增的快速提取口腔拭子基因组的方法中的荧光pcr扩增反应液,包括浓度或含量和组分如表1。
54.表1
55.qpcr组成体积模板/阳性质控/阴性对照2μl5
×
multiplex qrt
‑
pcr bufferⅱ4μl
multi rt enzyme mixⅱ1μlf primer(10μm)0.5μlr primer(10μm)0.5μlp primer(10μm)0.4μl灭菌水补水至20μl
56.其中:
57.f primer序列为accagtagctgtttctgaactcttcac
58.r primer序列为attggtcttgattttccctgtac
59.p primer序列为agatttggacctgcgagcg
60.将所述的荧光pcr扩增反应液对口腔样本中rnase的进行荧光pcr扩增,方法如下:取(实施例2)上清液5μl,分别稀释5倍、10倍和20倍,加入到配制好的荧光pcr反应液,于伯乐荧光pcr仪中进行扩增。
61.所述的荧光pcr扩增程序如下:
62.第一步骤:95℃,3min,循环1次。
63.第二步骤:95℃15s,58℃30s(收集荧光),循环40次。
64.结果分析:平行扩增的荧光定量pcr反应中,阴性对照无扩增,阳性质控有扩增说明反应体系正常。
65.用本发明处理了8份来源不同的人口腔样本,然后用rnase引物进行荧光pcr扩增检测,结果如图1所示,所有反应孔的背景信号好、ct值都在28~36之间,荧光扩增曲线呈典型的s型,说明本发明实例3提供的口腔拭子样本快速提取法用于荧光pcr扩增的方法具有较好的可行性。将8份不同来源不同的人血液样本进行荧光pcr扩增检测,每份样本稀释三个梯度:稀释5倍、稀释10倍、稀释20倍,每个梯度样本平行三次,结果分别如图2、图3、图4所示(每张图都包含了8个样本的扩增曲线)。
66.表2
[0067][0068]
由图和表2可见,每个样本的平行实验,其曲线的ct值很接近,如表2所示(“na”:表示操作该平行实验但没有扩增数据,“/”:表示没有操作该平行实验)。说明本发明实例提供的血液样本快速提取法用于荧光pcr扩增的方法有可靠的重复性以及较好的均一性。
[0069]
对比例1蛋白酶k加入与否对比测试
[0070]
(1)取5份口腔拭子样本放入1.5ml离心管中,加入4μl蛋白酶k;另取5份口腔拭子
样本放入1.5ml离心管中,不加蛋白酶k。
[0071]
(2)上述样本都加入200μl核酸裂解液,涡旋振荡后。
[0072]
(3)加入4μl 20mg/ml的牛血清白蛋白,涡旋振荡后,进行瞬时离心。
[0073]
(4)将离心管放置65℃金属浴中孵育10分钟。
[0074]
(5)瞬时离心后,将离心管放置95℃金属浴中孵育5分钟。
[0075]
(6)取出离心管在离心机中常温离心,以12000转/分钟,离心5分钟。
[0076]
(5)吸取离心管底部上清液到新1.5ml离心管中,避免吸取到沉淀。
[0077]
(6)该上清液即为提取的基因组dna,将上清液稀释5倍进行qpcr。
[0078]
(7)所用qpcr检测基因为人ransep,所用体系为
[0079]
qpcr组成体积模板/阳性质控/阴性对照2μl5
×
multiplex qrt
‑
pcr bufferⅱ4μlmulti rt enzyme mix
ꢀⅱ
1μlf primer(10μm)0.5μlr primer(10μm)0.5μlp primer(10μm)0.4μl灭菌水补水至20μl
[0080]
(8)qpcr所用条件为
[0081]
第一步骤:95℃,3min,循环1次。
[0082]
第二步骤:95℃15s,58℃30s(收集荧光),循环40次。
[0083]
结果分析:平行扩增的荧光定量pcr反应中,阴性对照无扩增,阳性质控有扩增说明反应体系正常。
[0084]
(9)实验结果统计见下表:
[0085]
表3
[0086][0087]
备注:ntc代表不加模板的阴性质控;n/a代表无ct值。
[0088]
(10)结论:加入蛋白酶k(ct均值为31.162)和不加蛋白酶k(ct均值为30.680)的ct值无明显差异,说明即便不添加蛋白酶k本发明所述的裂解液也能够获得良好的裂解效果。
[0089]
对比例2 edta加入与否对比测试:
[0090]
(1)取8份口腔拭子样本放入1.5ml离心管中,另取8份口腔拭子样本放入1.5ml离心管中。
[0091]
(2)前8个样本加入含10mm edta的200μl核酸裂解液,后8个样本加入不含10mm edta的200μl核酸裂解液,涡旋振荡后,进行瞬时离心。
[0092]
(3)将离心管放置65℃金属浴中孵育10分钟。
[0093]
(4)瞬时离心后,将离心管放置95℃金属浴中孵育5分钟。
[0094]
(5)取出离心管在离心机中常温离心,以12000转/分钟,离心5分钟。
[0095]
(6)吸取离心管底部上清液到新1.5ml离心管中,避免吸取到沉淀。
[0096]
(7)该上清液即为提取的基因组dna,将上清液稀释5倍进行qpcr。
[0097]
(8)所用qpcr检测基因为人ransep,所用体系为
[0098]
qpcr组成体积模板/阳性质控/阴性对照2μl5
×
multiplex qrt
‑
pcr bufferⅱ4μlmulti rt enzyme mixⅱ1μlf primer(10μm)0.5μlr primer(10μm)0.5μl
p primer(10μm)0.4μl灭菌水补水至20μl
[0099]
(9)qpcr所用条件为
[0100]
第一步骤:95℃,3min,循环1次。
[0101]
第二步骤:95℃15s,58℃30s(收集荧光),循环40次。
[0102]
结果分析:平行扩增的荧光定量pcr反应中,阴性对照无扩增,阳性质控有扩增说明反应体系正常。
[0103]
(10)实验结果统计见下表:
[0104][0105]
备注:ntc代表不加模板的阴性质控;n/a代表无ct值。
[0106]
(10)结论:裂解液含10mm edta(ct均值为31.029)和裂解液不含10mm edta(ct均值为34.217)的ct值有明显差异,故为了保证后续qpcr结果的稳定性,本发明裂解液含10mm edta。
[0107]
对比例3裂解产物稀释与否对比测试:
[0108]
(1)取8份口腔拭子样本放入1.5ml离心管中。
[0109]
(2)上述样本都加入200μl核酸裂解液,涡旋振荡后。
[0110]
(3)加入4μl 20mg/ml的牛血清白蛋白,涡旋振荡后,进行瞬时离心。
[0111]
(4)将离心管放置65℃金属浴中孵育10分钟。
[0112]
(5)瞬时离心后,将离心管放置95℃金属浴中孵育5分钟。
[0113]
(6)取出离心管在离心机中常温离心,以12000转/分钟,离心5分钟。
[0114]
(5)吸取离心管底部上清液到新1.5ml离心管中,避免吸取到沉淀。
[0115]
(6)该上清液即为提取的基因组dna,将上清液不稀释、稀释5倍、稀释10倍后分别进行qpcr。
[0116]
(7)所用qpcr检测基因为人ransep,所用体系为
[0117]
qpcr组成体积模板/阳性质控/阴性对照2μl5
×
multiplex qrt
‑
pcr bufferⅱ4μlmulti rt enzyme mixⅱ1μlf primer(10μm)0.5μlr primer(10μm)0.5μlp primer(10μm)0.4μl灭菌水补水至20μl
[0118]
(8)qpcr所用条件为
[0119]
第一步骤:95℃,3min,循环1次。
[0120]
第二步骤:95℃15s,58℃30s(收集荧光),循环40次。
[0121]
结果分析:平行扩增的荧光定量pcr反应中,阴性对照无扩增,阳性质控有扩增说明反应体系正常。
[0122]
(9)实验结果统计见下表:
[0123][0124]
[0125]
备注:ntc代表不加模板的阴性质控;n/a代表无ct值。
[0126]
(10)结论:不稀释(ct均值为32.855)比稀释10倍(ct均值为32.085)和稀释5倍(30.326)的结果更差,故稀释操作对qpcr有益,其中稀释5倍比稀释10倍效果更好,故选择稀释5倍。
[0127]
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1