羧酸类药物的β-酮亚砜衍生物及其制备方法和应用
羧酸类药物的
β
‑
酮亚砜衍生物及其制备方法和应用
技术领域
1.本发明属于有机合成技术领域,具体涉及一种羧酸类药物的β
‑
酮亚砜衍生物及其制备方法和应用。
背景技术:
2.β
‑
酮亚砜是一般有机合成中重要的原料,尤其是用作药物合成的前体。而且是农药和医药领域的一类重要的活性物质。该类化合物具有广谱生物活性,包括杀虫、杀菌、除草、抗肿瘤、抗病毒等作用,目前已经成为化学界和生物界研究的热点之一。
3.阿司匹林或乙酰水杨酸(asa)是缓解疼痛,发烧和炎症的最广泛使用的药物;吲哚美辛、萘普生是一种“经典”非甾体类抗炎药(nsaid),甘草次酸是从甘草的根中提取的五环三萜类,具有抗肿瘤,抗炎,抗溃疡和降血糖特性。这几种药物在实际使用时,羧酸对肠和胃的刺激性均比较大,对人体具有一定的毒害。有证据表明,亚砜化合物或磺酰胺化合物,进入人体后,对肠和胃的刺激都会减少,具有高活性、低毒和高附加值的优点。
4.多年来,已经开发出许多制备β
‑
酮亚砜的方法。例如,glen a.russell等报道称,dmso(二甲基亚砜)可以在叔丁醇钾(ko
t
bu)或氢化钠(nah)的强碱溶液中,和酯反应,生成β
‑
酮亚砜。但是,对于高分子酯,尤其是高分子芳香酯,往往难以制备,或者难以制备纯度较高的高分子酯类。
5.再如,sayed h.r.abdi等研究发现,在贵金属催化剂(例如钯或钛)存在下,多种氧化剂(例如h2o2、naclo、h5io6、phicl2、cro3、kmno4、khso5、ch3co3h等)可以氧化相应的亚砜或砜,形成β
‑
酮亚砜。然而,这些合成方法中,需要有毒的重金属并且需要贵金属,对环境不利且成本高。
6.s.thea等报道了一种通过酰氯与dmso反应合成β
‑
酮亚砜的方法,被证明是获取β
‑
酮亚砜的最为经济的、绿色的途径之一,且酰氯来源广泛,大部分化合物可制备品质较高的酰氯化合物,这有利于得到大部分化合物的β
‑
酮亚砜衍生物。然而,报道指出的酰氯与dmso反应,β
‑
酮亚砜的收率仅为5%~16%,难以实现量产及工业化生产。
技术实现要素:
7.有鉴于此,本发明提供一种羧酸类药物的β
‑
酮亚砜衍生物,以解决现有技术中存在的羧酸类药物对人体副作用较大的技术问题。
8.本发明还提供一种羧酸类药物的β
‑
酮亚砜衍生物的制备方法,以解决现有技术中存在的通过酰氯与dmso反应合成β
‑
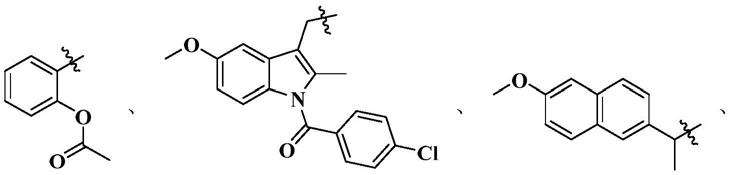
酮亚砜的过程中,β
‑
酮亚砜产率过低的技术问题。
9.本发明还提供一种羧酸类药物的β
‑
酮亚砜衍生物的应用,用于制备预防和/或治疗炎症、恶性肿瘤、高血压、高血糖、高血脂中的至少一种的药物,以降低现有药品对人体的毒害性。
10.本发明解决其技术问题所采用的技术方案是:
11.一种羧酸类药物的β
‑
酮亚砜衍生物,具有以下通式:
[0012][0013]
其中,r为其中,r为中的一种。
[0014]
一种如上所述的羧酸类药物的β
‑
酮亚砜衍生物的制备方法,在cac2与tea的共同存在下,r
‑
cocl与dmso反应,制得β
‑
酮亚砜衍生物,反应通式如下式。
[0015][0016]
优选地,所述羧酸类药物的β
‑
酮亚砜衍生物的制备方法还包括以下步骤:首先由r
‑
cooh制备r
‑
cocl。
[0017]
优选地,包括以下步骤:在惰性气体保护下,向dmso、cac2及tea的混合液中,缓慢滴加r
‑
cocl,常温下,反应预定时间,得到反应液;反应液依次经淬灭、萃取、洗涤、干燥后,得到β
‑
酮亚砜衍生物粗品;β
‑
酮亚砜衍生物粗品经纯化,制备β
‑
酮亚砜衍生物成品。
[0018]
优选地,r
‑
cocl与cac2或nah的摩尔比是1:(0.2~2)。
[0019]
优选地,r
‑
cocl与dmso的摩尔比是1:(2~28)。
[0020]
优选地,cac2与tea的摩尔比是1:(0.8~1.5)。
[0021]
优选地,在低温下,向dmso、cac2及tea的混合液中,缓慢滴加r
‑
cocl。
[0022]
优选地,反应预定时间为0.5h~2h。
[0023]
一种如上所述的羧酸类药物的β
‑
酮亚砜衍生物在制备预防和/或治疗炎症、恶性肿瘤、高血压、高血糖、高血脂中的至少一种的药物中的应用。
[0024]
由上述技术方案可知,本发明提供了一种羧酸类药物的β
‑
酮亚砜衍生物及其制备方法和应用,其有益效果是:以羧酸(r
‑
cooh)类药物的酰氯衍生物(r
‑
cocl)为原料,在cac2与tea的共同存在下,制备该类药物的β
‑
酮亚砜衍生物,一方面,在cac2与tea的共同存在下,所制备的β
‑
酮亚砜衍生物的产率高达49%~64%,且绿色环保,反应过程温和,操作简单。另一方面,所制备的β
‑
酮亚砜衍生物中,作为治疗各自适应症的药物,进入人体后,对肠和胃的刺激减少,具有高活性、低毒和高附加值的优点。
附图说明
[0025]
图1为本发明实施例一制备得到的β
‑
酮亚砜衍生物(a)的1h nmr谱图。
[0026]
图2为本发明实施例一制备得到的β
‑
酮亚砜衍生物(a)的
13
c nmr谱图。
[0027]
图3为本发明实施例一制备得到的β
‑
酮亚砜衍生物(a)的质谱图。
[0028]
图4为本发明实施例六(1)制备得到的β
‑
酮亚砜衍生物(b)的1h nmr谱图。
[0029]
图5为本发明实施例六(1)制备得到的β
‑
酮亚砜衍生物(b)的
13
c nmr谱图。
[0030]
图6为本发明实施例六(1)制备得到的β
‑
酮亚砜衍生物(b)的质谱图。
[0031]
图7为本发明实施例六(2)制备得到的β
‑
酮亚砜衍生物(c)的1h nmr谱图。
[0032]
图8为本发明实施例六(2)制备得到的β
‑
酮亚砜衍生物(c)的
13
c nmr谱图。
[0033]
图9为本发明实施例六(2)制备得到的β
‑
酮亚砜衍生物(c)的质谱图。
[0034]
图10为本发明实施例六(3)制备得到的β
‑
酮亚砜衍生物(d)的1h nmr谱图。
[0035]
图11为本发明实施例六(2)制备得到的β
‑
酮亚砜衍生物(d)的
13
c nmr谱图。
[0036]
图12为本发明实施例六(2)制备得到的β
‑
酮亚砜衍生物(d)的质谱图。
具体实施方式
[0037]
以下结合本发明的附图,对本发明实施例的技术方案以及技术效果做进一步的详细阐述。
[0038]
一具体实施方式中,一种羧酸类药物的β
‑
酮亚砜衍生物,具有以下通式:
[0039][0040]
其中,r为其中,r为中的一种。
[0041]
也就是说,上述r是基于乙酰水杨酸(阿司匹林)、吲哚美辛、萘普生、ac
‑
甘草次酸为前驱体,合成的β
‑
酮亚砜衍生物。值得说明的是,r基团不仅仅限于上述四种物质,还包括诸如普利类(如依那普利、卡托普利、贝那普利、培哚普利)在内的其他分子结构里包含羧酸基团的药品或者化合物。
[0042]
一种如上所述的羧酸类药物的β
‑
酮亚砜衍生物的制备方法,在cac2与tea的共同存在下,r
‑
cocl与二甲基亚砜反应,制得β
‑
酮亚砜衍生物,反应通式如下式。
[0043][0044]
进一步地,所述羧酸类药物的β
‑
酮亚砜衍生物的制备方法还包括以下步骤:首先由r
‑
cooh制备r
‑
cocl。即由羧酸类药物制备该药物的酰氯形态,例如,r
‑
cooh在80℃下,在二氯甲烷(dcm)溶液中,与二氯亚砜(socl2)反应生成r
‑
cocl。
[0045]
具体地,所述羧酸类药物的β
‑
酮亚砜衍生物的制备方法包括以下步骤:在惰性气体保护下,向dmso、cac2及tea的混合液中,缓慢滴加r
‑
cocl,常温下,反应预定时间,得到反应液;反应液依次经淬灭、萃取、洗涤、干燥后,得到β
‑
酮亚砜衍生物粗品;β
‑
酮亚砜衍生物粗品经纯化,制备β
‑
酮亚砜衍生物成品。
[0046]
其中,惰性气体选自n2、氩气、氙气中的一种或多种,优选使用氩气作为保护气体。
[0047]
作为优选,酰氯与cac2的摩尔比是1:(0.2~2),最优地,酰氯与cac2的摩尔比是1:1.2。
[0048]
作为优选,酰氯与dmso的摩尔比是1:(2~28),最优地,酰氯与dmso的摩尔比为1:7。
[0049]
作为优选,cac2与tea的摩尔比是1:(0.8~1.5),最优地,cac2与tea的摩尔比是1:1。
[0050]
作为优选,在低温下,例如,将反应容器置于冰水浴中,向dmso、cac2及tea的混合液中,缓慢滴加酰氯。
[0051]
作为优选,反应预定时间为0.5h~2h。
[0052]
作为优选,用饱和氯化铵溶液对反应液进行淬灭,用乙酸乙酯萃取,用饱和食盐水洗涤,再用无水硫酸钠干燥。过滤浓缩得到β
‑
酮亚砜衍生物粗品。β
‑
酮亚砜衍生物粗品通过硅胶柱层析分离纯化,制备β
‑
酮亚砜衍生物成品。
[0053]
在cac2与tea的共同存在下,含有羧酸基团的药物的酰氯衍生物与dmso反应,制得β
‑
酮亚砜衍生物,β
‑
酮亚砜衍生物的产率为49%~64%,且绿色环保,反应过程温和,操作简单。
[0054]
所制备的β
‑
酮亚砜衍生物中,作为治疗各自适应症的药物,进入人体后,对肠和胃的刺激减少,具有高活性、低毒和高附加值的优点。
[0055]
同时,cac2廉价易得,大幅度降低了β
‑
酮亚砜衍生物的生产成本。在cac2存在下,酰氯与dmso反应,制得β
‑
酮亚砜衍生物,同时会副产乙炔气体,不仅为cac2制备乙炔提供了新的反应途径,也为cac2赋予了新的用途。
[0056]
以下通过具体实施例,进一步说明本发明的技术方案与技术效果。
[0057]
实施例一
[0058]
以乙酰水杨酰氯为反应原料,探索cac2对酰氯与dmso反应的影响。具体如下:
[0059]
设对照组1个,在50ml烧瓶中加入5ml(70mmol)dmso,编号0,备用。
[0060]
设置cac2实验组5个,在5个50ml烧瓶中分别加入5ml(70mmol)dmso,并分别加入2mmol、5mmol、10mmol、12mmol、20mmol的cac2,编号1
‑
5,备用。
[0061]
在氩气保护下,冰水浴中,于10分钟之内向编号0
‑
5的烧瓶中加入1.986g(10mmol)乙酰水杨酰氯,移去冰水浴并在室温下反应0.5小时。反应结束后,用20ml饱和氯化铵溶液淬灭,用乙酸乙酯萃取,用饱和食盐水洗涤,再用无水硫酸钠干燥。过滤浓缩得到粗品。粗品通过硅胶柱层析分离纯化,得无色液体。
[0062]
选取上述制备得到的无色液体分别进行核磁共振和质谱分析;其中1h nmr谱、
13
c nmr谱和质谱图如图1
‑
3所示。
[0063]
由图1
‑
3可知:1h nmr(400mhz,cdcl3)δ8.04(d,j=7.8,1.6hz,1h),7.56(t,j=7.8,1.7hz,1h),7.31(t,j=7.6,1.2hz,1h),7.10(d,j=8.1,1.2hz,1h),5.33(s,2h),2.36(s,3h),2.26(s,3h);
[0064]
13
c nmr(101mhz,cdcl3)δ169.6,164.1,150.7,134.2,131.8,126.1,123.9,122.9,69.0,21.0,15.4;
[0065]
hrms(esi)calcd for c
11
h
12
nao4s[m+na]
+
:263.0349;found:263.0347;
[0066]
因此可以确定制备得到的产物为式1所示的β
‑
酮亚砜衍生物(a)。
[0067][0068]
称取上述制备得到β
‑
酮亚砜衍生物(a)的质量,再将称取质量
÷
理论产量
×
100%,得到上述制备方法的产率,见表1。
[0069]
表1方法0
‑
5制备的β
‑
酮亚砜衍生物(g)的产率
[0070][0071]
由上述实施过程可以看出,通过cac2参与乙酰水杨酰氯和dmso制备β
‑
酮亚砜衍生物(a),可显著提高β
‑
酮亚砜衍生物(a)的产率,且随着cac2的用量的提高,β
‑
酮亚砜衍生物(a)的产率提高,当乙酰水杨酰氯与cac2的物质的量的比达到1:1以上时,硝基苯甲酮亚砜的产率不发生明显变化。
[0072]
同时,发明人在实验过程中发现,采用nah或cah2或ko
t
bu作为底物,参与乙酰水杨酰氯和dmso制备β
‑
酮亚砜衍生物(a)的过程时,混合物剧烈反应,如果进料速度控制不当,体系将无法控制地喷出反应物料,酿成实验事故。而cac2参与反应时,反应温和,易于控制。
[0073]
实施例二
[0074]
以乙酰水杨酰氯为反应原料,探索cac2和tea共同作用,对酰氯与dmso反应的影响。
[0075]
设置tea实验组5个,在5个50ml烧瓶中分别加入5ml(70mmol)dmso,然后分别加入12mmol的cac2,并分别加入2mmol、5mmol、10mmol、12mmol、15mmol的tea,编号6
‑
10,备用。
[0076]
在氩气保护下,冰水浴中,于10分钟之内向编号6
‑
10的烧瓶中加入1.986g(10mmol)乙酰水杨酰氯,移去冰水浴并在室温下反应0.5小时。反应结束后,用20ml饱和氯化铵溶液淬灭,用乙酸乙酯萃取,用饱和食盐水洗涤,再用无水硫酸钠干燥。过滤浓缩得到粗品。粗品通过硅胶柱层析分离纯化,得无色液体,即为β
‑
酮亚砜衍生物(a)。
[0077]
称取上述制备得到β
‑
酮亚砜衍生物(a)的质量,再将称取质量
÷
理论产量
×
100%,得到上述制备方法的产率,见表2。
[0078]
表2方法6
‑
10制备的β
‑
酮亚砜衍生物(g)的产率
[0079][0080]
由上述过程可以看出,采用tea(三乙胺)配合cac2,能够有效提高β
‑
酮亚砜衍生物(a)的产率。且当cac2与tea的摩尔比是1:(0.8~1.5),β
‑
酮亚砜衍生物(a)的产率达到最高的64%。
[0081]
实施例三
[0082]
探索不同dmso加入量对β
‑
酮亚砜衍生物(a)的产率的影响。
[0083]
在保持对乙酰水杨酰氯(10mmol)、tea(12mmol)、cac2(12mmol)的加入量及其他反应条件不变的情况下,改变dmso加入量,计量产物β
‑
酮亚砜衍生物(a)的产率。结果表明,dmso保持过量,既作为反应底物,又作为反应溶剂,其加入量对β
‑
酮亚砜衍生物(a)的产率影响有限。
[0084]
实施例四
[0085]
探索不同反应停留时间对β
‑
酮亚砜衍生物(a)的产率的影响。
[0086]
在保持dmso(70mmol)、乙酰水杨酰氯(10mmol)、tea(12mmol)、cac2(12mmol)的加入量及其他反应条件不变的情况下,改变反应停留时间,计量产物β
‑
酮亚砜衍生物(a)的产率。结果表明,当反应时间超过30min,延长反应停留时间对β
‑
酮亚砜衍生物(a)的产率影响有限。
[0087]
实施例五
[0088]
探索不同cac2纯度对β
‑
酮亚砜衍生物(a)的产率的影响。
[0089]
在保持dmso(70mmol)、乙酰水杨酰氯(10mmol)、tea(12mmol)、cac2(12mmol)的加入量及其他反应条件不变的情况下,分别采用纯度为98%的高纯度cac2和纯度为75%的工业cac2参与反应。计量产物β
‑
酮亚砜衍生物(a)的产率。结果表明,采用纯度为75%的工业
cac2参与反应,相比采用纯度为98%的高纯度cac2参与反应,β
‑
酮亚砜衍生物(a)的产率降低约8%~15%,但依然可以保持较高的β
‑
酮亚砜衍生物(a)的产率。
[0090]
实施例六
[0091]
探索cac2和tea共同存在下,不同类型的酰氯与dmso反应生成对应的β
‑
酮亚砜衍生物及β
‑
酮亚砜衍生物的产率。
[0092]
(1)、cac2催化吲哚美辛酰氯与二甲基亚砜反应生成β
‑
酮亚砜衍生物(b),反应方程式如式2所示:
[0093][0094]
上述β
‑
酮亚砜衍生物(b)的制备方法如下:在氩气保护下,向50ml烧瓶中加入5ml(70mmol)二甲基亚砜、1.7ml(12mmol)三乙胺和768mg(12mmol)碳化钙,冰水浴下,于10分钟之内加入3.762g(10mmol)吲哚美辛酰氯,移去冰水浴并在室温下反应0.5小时。反应结束后,用20ml饱和氯化铵溶液淬灭,用乙酸乙酯萃取,用饱和食盐水洗涤,再用无水硫酸钠干燥。过滤浓缩得到粗品。粗品通过硅胶柱层析分离纯化,得β
‑
酮亚砜衍生物(b)无色液体2.17g,产率为52%。
[0095]
选取上述制备得到的β
‑
酮亚砜衍生物(b)分别进行核磁共振和质谱分析;其中1h nmr谱、
13
c nmr谱和质谱图如图4
‑
6所示;
[0096]
由图4
‑
6可知:1h nmr(400mhz,cdcl3)δ7.65(d,j=8.2hz,2h),7.46(d,j=8.2hz,2h),6.97(s,1h),6.87(d,j=9.0hz,1h),6.67(d,1h),5.15(d,j=1.1hz,2h),3.83(s,3h),3.71(s,2h),2.39(s,3h),2.16(s,3h);
[0097]
13
c nmr(101mhz,cdcl3)δ170.6,168.3,156.1,139.4,136.1,133.9,131.3,130.9,130.6,129.2,115.0,112.3,111.8,101.3,68.9,55.8,30.5,15.5,13.5;
[0098]
hrms(esi)calcd for c
21
h
21
clo4s[m+h]
+
:418.0874;found:418.0874。
[0099]
因此可以确定制备得到的产物为式2所示的β
‑
酮亚砜衍生物(b)。
[0100]
(2)、cac2催化萘普生酰氯与二甲基亚砜反应生成β
‑
酮亚砜衍生物(c),反应方程式如式3所示:
[0101][0102]
上述β
‑
酮亚砜衍生物(c)的制备方法如下:在氩气保护下,向50ml烧瓶中加入5ml(70mmol)二甲基亚砜、1.7ml(12mmol)三乙胺和768mg(12mmol)碳化钙,冰水浴下,于10分钟之内加入2.487g(10mmol)萘普生酰氯,移去冰水浴并在室温下反应0.5小时。反应结束后,用20ml饱和氯化铵溶液淬灭,用乙酸乙酯萃取,用饱和食盐水洗涤,再用无水硫酸钠干燥。过滤浓缩得到粗品。粗品通过硅胶柱层析分离纯化,得β
‑
酮亚砜衍生物(c)无色液体1.62g,产率为56%。
[0103]
选取上述制备得到的β
‑
酮亚砜衍生物(c)分别进行核磁共振和质谱分析;其中1h nmr谱、
13
c nmr谱和质谱图如图7
‑
9所示。
[0104]
由图7
‑
9可知:1h nmr(400mhz,cdcl3)δ7.72(s,1h),7.69(d,j=5.9hz,2h),7.41(d,j=8.5,1.8hz,1h),7.15(d,j=9.0,2.3hz,1h),7.12(s,1h),5.13(s,2h),3.92(s,4h),2.07(s,3h),1.60(d,j=7.1hz,3h);
[0105]
13
c nmr(101mhz,cdcl3)δ174.4,157.8,135.5,133.8,129.4,129.0,127.3,126.3,126.1,119.2,105.7,68.5,55.4,45.6,18.5,15.3;
[0106]
hrms(esi)calcd for c
16
h
18
nao3s[m+na]
+
:313.0869;found:313.0862;
[0107]
因此可以确定制备得到的产物为式3所示的β
‑
酮亚砜衍生物(c)。
[0108]
(3)、cac2催化ac
‑
甘草次酸酰氯与二甲基亚砜反应生成β
‑
酮亚砜衍生物(d),反应方程式如式4所示:
[0109][0110]
上述β述酮亚砜衍生物(d)的制备方法如下:在氩气保护下,向50ml烧瓶中加入20ml(280mmol)二甲基亚砜、2.8ml(20mmol)三乙胺和768mg(12mmol)碳化钙,冰水浴下,于10分钟之内加入1.406g(10mmol)ac
‑
甘草次酸酰氯,移去冰水浴并在30℃下反应2小时。反应结束后,用20ml饱和氯化铵溶液淬灭,用乙酸乙酯萃取,用饱和食盐水洗涤,再用无水硫酸钠干燥。过滤浓缩得到粗品。粗品通过硅胶柱层析分离纯化,得β
‑
酮亚砜衍生物(d)白色固体2.85g,产率为49%。
[0111]
选取上述制备得到的β
‑
酮亚砜衍生物(d)分别进行核磁共振和质谱分析;其中1h nmr谱、
13
c nmr谱和质谱图如图10
‑
12所示。
[0112]
由图10
‑
12可知:1h nmr(400mhz,chloroform
‑
d)δ5.67(s,1h),5.25
–
5.10(m,2h),4.51(dd,j=11.6,4.8hz,1h),2.79(dt,j=13.6,3.7hz,1h),2.36(s,1h),2.26(s,3h),2.19
–
2.11(m,1h),2.05(s,3h),2.03
–
1.98(m,2h),1.94(dt,j=13.7,3.3hz,1h),1.83(td,j=13.5,4.5hz,1h),1.64(dddd,j=29.6,16.1,9.2,3.4hz,5h),1.41(dd,j=8.3,3.4hz,2h),1.38(s,1h),1.36(s,3h),1.17(d,j=5.6hz,6h),1.13(s,3h),1.07
–
0.98(m,1h),0.88(s,7h),0.81(s,4h);
[0113]
13
c nmr(101mhz,cdcl3)δ200.21,176.18,169.29,128.71,80.75,77.48,77.37,77.16,76.84,68.38,61.87,55.16,48.40,45.54,44.22,43.34,41.17,38.94,38.19,37.72,37.08,32.85,31.99,31.24,28.65,28.28,28.19,26.55,23.71,23.48,18.83,17.52,16.83,16.56,15.86;
[0114]
hrms(esi)calcd for c
34
h
53
o5s[m+h]
+
:573.3609;found:573.3594;
[0115]
因此可以确定制备得到的产物为式4所示的β
‑
酮亚砜衍生物(d)。
[0116]
以下通过具体生物化学实验,进一步说明本发明的技术效果。
[0117]
本实验为不同浓度的β
‑
酮亚砜衍生物a及β
‑
酮亚砜衍生物d对人肝癌细胞hepg2和人肾正常细胞hek
‑
293t在48h的体外抑制活性研究,以阿司匹林、甘草次酸、长春新碱(vcr)作为对照组。
[0118]
实验方法:取对数生长期,生长状态良好的待测细胞(人肝癌细胞hepg2和人肾正常细胞hek
‑
293t),用1640完全培养基调整密度到5
×
104个/ml,悬浊液接种到96孔培养板中,每孔100μl,于37℃过夜培养(在细胞孔周围孔内加入100μl无菌pbs);
[0119]
待细胞贴壁生长良好24h后,吸收旧的培养液,向各个培养孔中加入10μl不同浓度的β
‑
酮亚砜衍生物a、β
‑
酮亚砜衍生物d、阿司匹林、甘草次酸、长春新碱(vcr),每个浓度设3个平行重复孔,同时设等体积二甲基亚砜(dmso)溶剂的和不含药物培养基的空白对照孔,及于37℃,5%co2的培养箱内继续培养。
[0120]
将待测物质培养48h后,弃去上清液,并利用倒置显微镜观察细胞形态;然后,每孔加10μl(2mg/ml in pbs)mtt,继续培养4h后,吸出孔内培养上清液,每孔加入150μl二甲基亚砜,震荡10min使蓝紫色结晶物溶解充分后,于波长568nm处用酶标仪测定每孔样品的吸光度值(a),取平均值。
[0121]
实验结果如表1、2、3所示:
[0122]
表1 48小时hepg2细胞抑制率
[0123][0124]
表2 48小时hek
‑
293t细胞抑制率
[0125][0126]
表3细胞毒性活性
[0127][0128]
由表1、2、3可以看出,对于本发明制备得到的β
‑
酮亚砜衍生物a和β
‑
酮亚砜衍生物d,其表现出优秀的对肝癌细胞hepg2的细胞抑制率,和/或较小的细胞毒性,能够被应用于治疗肝癌或制备治疗肝癌及其他肿瘤的药物。
[0129]
以上所揭露的仅为本发明较佳实施例而已,当然不能以此来限定本发明之权利范围,本领域普通技术人员可以理解实现上述实施例的全部或部分流程,并依本发明权利要求所作的等同变化,仍属于发明所涵盖的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1