一种融合蛋白及其应用的制作方法
1.本发明涉及生物医药技术领域,具体而言,涉及一种融合蛋白及其应用。
背景技术:
2.免疫力是人体自身的防御机制,是人体识别和消灭外来侵入的任何异物(病毒、细菌等),处理衰老、损伤、死亡、变性的自身细胞以及识别和处理体内突变细胞和病毒感染细胞的能力。
3.现代免疫学认为,免疫力是人体识别和排除“异己”的生理反应。人体内执行这一功能的是免疫系统。
4.如今对于人们的健康威胁最大的癌症均与免疫力相关,如何提高机体的免疫力,是如今亟待解决的问题之一。
5.鉴于此,特提出本发明。
技术实现要素:
6.本发明的目的在于提供一种融合蛋白及其应用。
7.本发明是这样实现的:
8.第一方面,本发明实施例提供了一种融合蛋白,其包含相互连接的白细胞介素2和白细胞介素7;其中,所述白细胞介素2的氨基酸序列如seqidno.1所示。
9.第二方面,本发明实施例提供了一种分离的核酸,其含有:编码如前述实施例所述的融合蛋白的碱基序列。
10.第三方面,本发明实施例提供了如前述实施例所述的融合蛋白或如前述实施例所述的分离的核酸在制备治疗免疫缺陷相关疾病或用于提高免疫力的药物中的应用。
11.第四方面,本发明实施例还提供了一种药物组合物,其包括如前述实施例所述的融合蛋白或如前述实施例所述的分离的核酸。
12.第五方面,本发明实施例还提供了如前述实施例所述的药物组合物在制备用于治疗或辅助治疗癌症的药物中的应用。
13.本发明具有以下有益效果:
14.本发明通过对白细胞介素2的序列进行重构,重构后的白细胞介素2和白细胞介素7组成的融合蛋白能够有效促进b细胞增殖,从而达到提高机体的免疫力的技术效果;此外,该融合蛋白与抗癌药物联合应用,能进一步提高抗癌药物的治疗效果,提高患者的存活率,为肿瘤治疗和研究提供一种新的途径。
附图说明
15.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这
些附图获得其他相关的附图。
16.图1为实施例5中改进型il2
‑
il7融合蛋白以及多种il2蛋白与il2受体α亚基、il2受体β亚基以及il2受体βγ亚基亲和力的分析结果;
17.图2为实施例5中改进型il2
‑
il7融合蛋白与il7受体α亚基的亲和力分析结果;
18.图3为实施例5中改进型il2
‑
il7融合蛋白对t细胞及亚型的增殖活性;
19.图4为实施例5中改进型il2
‑
il7融合蛋白对b细胞的增殖活性;
20.图5为实施例5中改进型il2
‑
il7融合蛋白以及天然il2、il7联合pd
‑
l1单抗在小鼠ct26结肠癌模型中对肿瘤增殖的抑制作用;
21.图6为实施例5中改进型il2
‑
il7融合蛋白以及天然il2、il7联合pd
‑
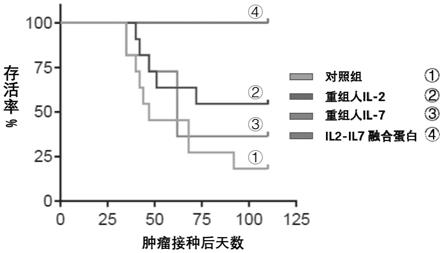
l1单抗对小鼠ct26结肠癌模型整体最终生存率的比较结果。
具体实施方式
22.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
23.首先,本发明实施例提供了一种融合蛋白,所述融合蛋白包含相互连接的白细胞介素2和白细胞介素7;其中,所述白细胞介素2的氨基酸序列如seqidno.1所示。
24.白细胞介素是由多种细胞产生并作用于多种细胞的一类细胞因子。由于最初是由白细胞产生又在白细胞间发挥作用,所以由此得名。
25.白细胞介素2(il
‑
2),也称为t细胞生长因子(tcgf),是一种15.5kda的球状糖蛋白,在淋巴细胞生成,存活和体内稳态中起着重要作用。il
‑
2通过与il
‑
2受体(il
‑
2r)结合来介导其作用,il
‑
2受体由多达三个单独的亚基组成,它们的不同关联可以产生其对il
‑
2的亲和力不同的受体形式。α(cd25),β(cd122)和γ(yc,cd132)亚基的缔合产生il
‑
2的三聚体高亲和力受体。
26.经一系列创造性劳动,本发明实施例中对白细胞介素2进行了重构,与野生型白细胞介素2(序列可参照:myrmqllscialslalvtnsaptssstkktqlqlehllldlqmilnginnyknpkltrmltfkfympkkatelkhlqcleeelkpleevlnlaqsknfhlrprdlisninvivlelkgsettfmceyadetativeflnrwitfcqsiistlt)的相比,重构后的白细胞介素2(seqidno.1)仅能与白介素2受体β、γ亚基发生相互作用,与白介素2α亚基在生物学水平上不相互作用。发明人发现,将重构后的白细胞介素2与白细胞介素7组成融合蛋白,相对于未重构的白细胞介素2和白介素7而言,具有更好的提高免疫力的效果。
27.白细胞介素7(il
‑
7),是骨髓和胸腺基质细胞分泌的造血生长因子,分子量为25kd。il
‑
7的靶细胞主要为淋巴细胞,对来自人或小鼠骨髓的b祖细胞、胸腺细胞及外周成熟的t细胞等均有促生长活性。
①
与干细胞生长因子(scf)协同能够刺激b前体发生有丝分裂,这一效应可被tgf和所抑制;但对b祖细胞(pro
‑
b)的生长没有明显作用。
②
促进双阴性胸腺细胞的成熟,提供胚胎胸腺细胞发育过程中tcr基因重组的始动信号;但对成熟t细胞无明显作用。
③
诱导胸腺细胞或外周血淋巴细胞产生lak细胞活性,其效应细胞主要为cd8+亚群;但il
‑
7诱导的lak细胞不具有nk活性。
④
il
‑
7能刺激髓样前体细胞和巨核细胞产生集
落形成单位和血小板,使机体从环磷酰胺的免疫抑制作用中恢复过来;在较高浓度时,il
‑
7还能增强巨噬细胞的细胞毒活性,诱导单核细胞分泌细胞因子。
28.在没有限制的情况下,本发明实施例中的白细胞介素7可以为野生型的白细胞介素7(未改进过或未重构过的),野生型白细胞介素7的序列可通过现有基因数据库获取。
29.优选地,所述白细胞介素7的氨基酸序列如seqid no.2或seqid no.3所示。
30.优选地,所述白细胞介素7的氨基酸序列如seqidno.2所示,此为重构后的白细胞介素7。
31.野生型的氨基酸序列如seqidno.3所示(mfhvsfryifglpplilvllpvassdcdiegkdgkqyesvlmvsidqlldsmkeigsnclnnefnffkrhicdankegmflfraarklrqflkmnstgdfdlhllkvsegttillnctgqvkgrkpaalgeaqptksleenkslkeqkklndlcflkrllqeiktcwnkilmgtkeh)。
32.野生型il7由于其天然结构属性,在体外(非生理)环境下极易发生聚集与降解,对临床应用造成较大的挑战。基于此,本发明通过截去野生型il7第1
‑
26位氨基酸,并添加由三个氨基酸组成的寡肽,大幅提供il7重组蛋白的稳定性。因此,本发明使用的改进型il7与野生型il7相比,大幅降低野生型il7的聚集与降解,提高了il7蛋白的结构稳定性。
33.优选地,所述融合蛋白还包括免疫球蛋白fc段;所述白细胞介素2、所述白细胞介素7以及所述fc段三者之间均通过连接肽相互连接。融合蛋白引入fc片段,可以避免重组il2及il7在体内被溶酶体降解,同时,fc片段可以通过与fcrn受体结合,延长融合蛋白在体内的半衰期。fcrn可以在酸性小泡内(ph<7.0)和igg的fc片段结合,保护融合蛋白结构完整,并在ph等于7.4的血液环境下,释放融合蛋白。igg亚型1、2及4均可以与fcrn相互作用,可有效延长融合蛋白在人体内的作用半衰期。
34.优选地,所述fc段包括:igg1、igg2、igg3和igg4中至少一种免疫球蛋白的fc片段。
35.优选地,fc段为免疫球蛋白2亚型及4亚型的混合,氨基酸序列如seqidno.4所示。fc的作用在于延长融合蛋白在体内的半衰期,尽量降低fc介导的细胞毒性与补体毒性。因此,fc片段采用igg2及igg4亚型混合组成,与单独igg2及igg4相比,可进一步降低fc介导的补体依赖细胞毒性、以及抗体依赖的细胞毒性。
36.在一些实施例中,本发明不对连接肽的序列作任何限制,只要能将上述fc、白细胞介素2以及白细胞介素7连接的连接肽均属于本技术的保护范围。优选地,所述连接肽为(ggggs)
n
;其中,n选自大于0的整数。可选地,1≤n≤10。
37.优选地,所述融合蛋白由式1或式2表示;
38.式1:n端
‑
白细胞介素2
–
连接肽
–
fc
–
连接肽
–
白细胞介素7
–
c端;
39.式2:n端
‑
白细胞介素7
–
连接肽
–
fc
–
连接肽
–
白细胞介素2
–
c端。
40.优选地,所述融合蛋白的氨基酸序列如seqidno.5所示。
41.本发明实施例提供了一种分离的核酸,其含有:编码如前述实施例所述的融合蛋白的碱基序列。
42.本发明实施例提供了一种重组载体,其含有:前述实施例所述的分离的核酸。可选地,所述重组载体为表达载体或克隆载体。
43.本发明实施例还提供了一种宿主细胞,其含有:前述实施例所述的重组载体。
44.在一些实施例中,所述宿主细胞选自原核细胞和真核细胞中的任意一种。原核细胞可为大肠杆菌细胞,真核细胞可选自酵母细胞、植物细胞和动物细胞中的任意一种。
45.本发明实施例还提供了如前述任意实施例所述的融合蛋白或如前述任意实施例所述的分离的核酸在制备治疗免疫缺陷相关疾病或用于提高免疫力的药物中的应用。
46.本发明实施例还提供了一种药物组合物,其包括如前述任意实施例所述的融合蛋白或如前述任意实施例所述的分离的核酸。
47.优选地,所述组合物还包括pd
‑
l1抗体。
48.此外,本发明实施例还提供了如前述任意实施例所述的药物组合物在制备用于治疗或辅助治疗癌症的药物中的应用。
49.优选地,所述癌症选自:结肠癌、增补转移性黑色素瘤以及转移性肾细胞癌中的至少一种。
50.以下结合实施例对本发明的特征和性能作进一步的详细描述。
51.实施例1
52.本实施例提供了一种融合蛋白,其结构如下:
53.式1:n端
–
白细胞介素2
–
连接肽
–
fc
–
连接肽
–
白细胞介素7
–
c端。
54.其中,白细胞介素2的氨基酸序列如seqidno.1所示,具体为:pkkkiqlhaehalydalmilnivktnsppaeekledyafnfelileeiarlfesgdqkdeaekakrmkewmkrikttasedeqeemanaiitilqswifs。
55.白细胞介素7的氨基酸序列如seqidno.2所示,具体为:dcdiegkdgkqyesvlmvsidqlldsmkeigsnclnnefnffkrhicdankegmflfraarklrqflkmnstgdfdlhllkvsegttillnctgqvkgrkpaalgeaqptksleenkslkeqkklndlcflkrllqeiktcwnkilmgtkeh。
56.连接肽的氨基酸序列为ggggs。
57.fc为免疫球蛋白2亚型及4亚型的混合序列(seqidno.4),具体为aeskygppcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslg。
58.融合蛋白的氨基酸序列如seq id no.5所示:mplllllpllwagalapkkkiqlhaehalydalmilnivktnsppaeekledyafnfelileeiarlfesgdqkdeaekakrmkewmkrikttasedeqeemanaiitilqswifsggggsggggsggggsaeskygppcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgggggsggggsggggsmgmdcdiegkdgkqyesvlmvsidqlldsmkeigsnclnnefnffkrhicdankegmflfraarklrqflkmnstgdfdlhllkvsegttillnctgqvkgrkpaalgeaqptksleenkslkeqkklndlcflkrllqeiktcwnkilmgtkeh。
59.实施例2
60.本实施例提供了一种融合蛋白,大致与实施例1提供的融合蛋白相同,区别在于融合蛋白的表达式不同,区别如下:
61.式2:n端
–
白细胞介素7
–
连接肽
–
fc
–
连接肽
–
白细胞介素2
–
c端。
62.融合蛋白的氨基酸序列如seq id no.6所示:mplllllpllwagalamgmdcdiegkdgkqyesvlmvsidqlldsmkeigsnclnnefnffkrhicdankegmflfraarklrqflkmnstgdfdlhllkvsegttillnctgqvkgrkpaalgeaqptksleenkslkeqkklndlcflkrllqeiktcwnkilmgtkehggggsggggsg
gggsaeskygppcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgggggsggggsggggspkkkiqlhaehalydalmilnivktnsppaeekledyafnfelileeiarlfesgdqkdeaekakrmkewmkrikttasedeqeemanaiitilqswifs。
63.实施例3
64.本实施例提供了一种融合蛋白,大致与实施例1提供的融合蛋白相同,区别在于连接肽的序列不同,区别如下:
65.连接肽的序列为ggggsggggs。
66.实施例4
67.本实施例提供了一种融合蛋白,大致与实施例1提供的融合蛋白相同,区别在于连接肽的序列不同,区别如下:
68.连接肽的序列为ggggsggggsggggs。
69.实施例5
70.1、改进型il2
‑
il7融合蛋白(实施例1提供的融合蛋白)的表达载体、细胞株的构建以及蛋白制备。
71.根据实施例1提供的融合蛋白的氨基酸序列信息,通过真核生物简并密码子将seqidno.5所述的氨基酸序列转化为dna序列,该序列在维持翻译后氨基酸序列不变的情况下,通过哺乳动物细胞偏好密码子优化后,获得优化后的dna表达序列。
72.以此dna为基础通过分子克隆方式连接至含谷氨酰胺合成酶表达筛选系统(gs
‑
selection system),通过脂质体为媒介转染至仓鼠卵巢细胞内(cho cell line),随后通过加入含有谷氨酰胺合成酶抑制剂的全合成培养基进行阳性克隆筛选,筛选获得的阳性克隆进行摇瓶扩增及补料批次培养后,从发酵液上清中获得上述融合重组蛋白。
73.融合蛋白的纯化根据其自身fc结构,通过proteina亲和层析,阴阳离子交换层析制备获得最终纯化产物。
74.2、改进型il2
‑
il7融合蛋白以及多种il2蛋白分别与il2受体(il2r)α亚基、il2受体β亚基以及il2受体βγ亚基亲和力的分析。
75.实验过程
76.生物素化的人或小鼠il
‑
2rα,il
‑
2rβ和il
‑
2rβγ复合受体被固定在抗生蛋白链菌素包被的芯片上,以在biacore t200上进行分析(ge healthcare)。不相关的生物素化蛋白被固定在参考通道中减去非特异性结合。少于100个回应固定每个配体的最大单位(ru),以最大程度地降低传质效果。人il
‑
2,小鼠il
‑
2,super
‑
2以及改进型il2
‑
il7融合蛋白按照三倍体积进行梯度稀释,模拟物在固定的配体上流动60秒并解离测量时间为240秒。对于il
‑
2rβγ复合物结合研究,饱和浓度的人il
‑
2rβ(3μm)或小鼠il
‑
2rβ(5μm)被添加到指定的浓度不同类型il2蛋白中。表面再生:在15m中暴露于1m mgcl2中15秒进行所有相互作用,乙酸钠ph 5.5。spr实验在hbs
‑
p+缓冲液(ge)在25℃时补充0.2%牛血清白蛋白(bsa),所有结合研究均以50l/min的流速进行,以防止分析物重新绑定。实验结果如图1所示。
77.实验结论
78.表1改进型il2与受体的亲和力
[0079][0080]
改进型il
‑
2融合蛋白(同改进型il2
‑
il7融合蛋白)与传统il
‑
2不同,其与天然il
‑
2rα亚基的亲和力几乎为零,两者在体外水平不发生相互结合;其次,改进型il
‑
2融合蛋白保留了与il
‑
2rβ和il
‑
2rβγ复合体的相互作用。改进型il
‑
2融合蛋白较天然重组il2消除了il
‑
2rα亚基结合与激活能力,保留了结合与激活il
‑
2rβγ受体的能力。
[0081]
3、改进型il2
‑
il7融合蛋白与il7受体α亚基的亲和力分析。
[0082]
实验过程
[0083]
使用以下方法测量il7与il
‑
7rα的结合动力学,在25℃下孵育cm5传感器芯片。il
‑
7rα与cm5传感器芯片通过耦合胺或硫醇的方式偶联。在偶联实验前,首先去除il
‑
7rα分子间二硫键,il
‑
7rα在1.5mm dtt,4℃条件下还原放置30分钟。还原后,il
‑
7rα立即通过洗脱柱脱盐(pd
‑
10柱)放入10mm napo4缓冲液(ph 7.4)中,浓缩至200μl,并储存在4℃。
[0084]
在准备il
‑
7rα的硫醇偶联时,首先用10mm hepes(ph 7.4),150mm nacl,3mm edta和0.005%tween 20以10ml/min的速度洗涤cm5传感器芯片10分钟。每个流通池分别注入10ml n
‑
羟基琥珀酰亚胺/n
‑
乙基
‑
n0
‑
(3
‑
二甲基氨基丙基)碳二亚胺(nhs/edc),然后注入20ml 2
‑
(2
‑
吡啶基二硫代)乙胺盐酸盐(pdea),然后在流通池2
–
4上注入10
–
50ml还原的il
‑
7rα(在10mm乙酸钠[ph 4.5]中为50
–
100mg/ml)。流通池1用作参考池。用含1m nacl的20mm naac(ph 4.5)中的35ml注射50mm还原型谷胱甘肽封闭流动池。随后加入不同浓度梯度的融合蛋白测定其与il
‑
7rα间的亲和力。实验结果如图2所示。
[0085]
实验结论:改进型il2
‑
il7融合蛋白与天然il
‑
7相比,其与il
‑
7rα受体间的亲和力分别为56nm(融合蛋白il
‑
7)与62nm(天然il
‑
7)。
[0086]
4、改进型il2
‑
il7融合蛋白对小鼠t细胞以及b细胞的增殖作用。
[0087]
实验过程:
[0088]
4.1、对t细胞的增殖作用。
[0089]
使用easysep t细胞分离试剂盒(stem cell technologies)从小鼠脾脏(c57bl/6j,购自jackson实验室)中分离t细胞。将细胞以10,000个细胞/孔的密度接种在96孔培养皿中并添加rpmi1640培养基。随后,在培养基中分别添加小鼠il
‑
2和改进型il2
‑
il7融合蛋白(如图3所示)。在37℃下孵育5天后,通过cell titer
‑
glo发光细胞活力测定(promega)测量了细胞存活和增殖情况。实验结果如图3所示。
[0090]
实验结论:在体外t细胞增殖能力上,改进型il2
‑
il7融合蛋白较鼠il2对t细胞的增殖能力有所增强,达到促进t细胞增殖的能力;从t细胞增殖的亚型上,与天然il2相比,改进型il2
‑
il7融合蛋白仅能促进毒性t细胞的增殖,不促进调节t细胞的增殖,从而可以完成对特定亚型t细胞的增殖作用。
[0091]
4.2、对b细胞的增殖作用。
[0092]
pbmc细胞采购于上海儒百生物科技有限公司,pbmc用磷酸盐缓冲盐水(pbs)以2:1的比例稀释,随后样品加入ficollpaque(ge healthcare,1.078g/ml)分离试剂中以850g离心25分钟分离出单核细胞。收集单核细胞,以无血清rpmi1640(gibco)培养基洗涤细胞两次,并添加10%fbs(gibco)。将105个单核细胞接种在96孔板中,每孔添加250μl含20%胎牛
血清(fbs;gibco)和1%青霉素/链霉素(gibco)的rpmi1640(gibco)培养基中,此外培养基中还添加了b细胞存活所需的干细胞因子(stem cell factor,scf),在此基础上添加相同浓度的各类细胞因子观察其对b细胞的增殖活性,包括了:rhil
‑
2、rhil
‑
7以及融合蛋白。在培养21天的过程中,通过流式细胞仪分析其生长情况。
[0093]
通过流式细胞仪分析细胞增殖的过程中使用的单克隆抗体为cd34(percp;克隆581;abcam)和cd20(pe;克隆2h7;bd biosciences)。在第0、7、14和21天通过流式细胞术评估收获的细胞。使用碘化丙锭(1.0mg/ml;invitrogen)排除了死亡细胞。通过收集10000至30000个细胞时间并使用bd分选器(bd ebioscience)来分析制作facs图。通过perttuterho软件(版本:2.5.1)分析获得的数据。实验结果如图4所示。
[0094]
实验结论:在体外b细胞增殖能力上,改进型il2
‑
il7融合蛋白较rhil2及rhil7单独对b细胞的增殖能力有所增强,达到促进b细胞增殖的能力。
[0095]
5.改进型il
‑
2、il
‑
7融合蛋白联合pd
‑
l1单抗在ct26结肠癌肿瘤模型中的应用。
[0096]
实验过程:
[0097]
ct26细胞采购自中国科学院典型培养物保藏委员会细胞库,在实验第0天将5
×
105个细胞浓缩于50μl以1:1比例混合dmem(gibco)培养基与matrigel(corning)佐剂的混合物中,通过皮下注射的方式从balb/c小鼠的腹侧进行接种,从第6天开始,当肿瘤体积达到100mm3左右时,每天通过腹膜内(i.p.)注射溶解于50μl pbs(gibco)的rhil
‑
2、rhil
‑
7以及改进型il2
‑
il7融合蛋白。当肿瘤体积达到1300mm3时,对小鼠实施安乐死。观测动物存活时间并统计最终存活率。实验结果如图5和图6所示。
[0098]
实验结论:改进型il2
‑
il7融合蛋白在与pd
‑
l1单抗联合作用于ct26结肠癌小鼠模型的治疗中,其对小鼠肿瘤的增殖抑制作用较不适用细胞因子、以及单独使用rhil2或rhil7有着更为显著,同时小鼠的最终存活率显著提高。
[0099]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1