重组嗜盐单胞菌及构建方法与催化丙酮酸生产乙偶姻的应用
1.本发明属于生物工程技术与应用领域,具体涉及重组嗜盐单胞菌及构建方法与催化丙酮酸生产乙偶姻的应用。
背景技术:
2.乙偶姻,又名3
‑
羟基
‑2‑
丁酮,单体为无色或淡黄色液体,二聚体为白色结晶粉末。乙偶姻存在与很多食品中,具有奶香气味,常用作食品添加剂来提升食物中的奶香味。乙偶姻早前就被美国能源部列为30种值得优先开发的平台化合物之一,也是4
‑
c平台化合物的一种,广泛应用于很多领域,如材料、医药生产和化学合成等领域,也是重要化学品如2,3
‑
丁二醇,液态烃燃料和杂环化合物的前体物。
3.目前,乙偶姻工业化生产的主要方法是化学合成法和生物合成法。化学合成法主要包括2,3
‑
丁二醇的氧化、丁酮的氯化水解和丁二酮的部分加氢等方法。但由于这些工艺能耗大,得率低且对环境有一定的污染,所以近年来,利用生物法生产乙偶姻越来越受研究者的关注。
4.生物合成法主要有微生物合成法,体外酶催化合成法和全细胞催化合成法。
5.微生物生产乙偶姻的特点主要有:产量较高,但得率较低,生产周期长,主要原因可能是微生物代谢复杂,体内合成不易调控。因此也有研究者使用基于纯化酶的体外合成生物系统生产乙偶姻,目前已实现从2,3
‑
丁二醇、丙酮酸、甘油、乳酸、木糖等生产乙偶姻。cui等在体外酶催化体系中,利用α
‑
乙酰乳酸合成酶和α
‑
乙酰乳酸脱羧酶,催化395.6g/l丙酮酸生产了186.7g/l乙偶姻,达到理论得率的94.3%。但纯化酶系统存在目前还无法彻底解决的缺点,如酶的制备成本较高,酶的稳定性较低。
6.相比之下,全细胞催化具有很多明显的优势:制备简单,成本低,效率高,稳定性好等,目前已实现利用全细胞催化以meso
‑
2,3
‑
丁二醇,双乙酰,葡萄糖和乙醛为底物合成乙偶姻,且乙偶姻的产量都较高。zhou等
1.利用氧化葡糖杆菌全细胞催化生产乙偶姻,以2,3
‑
丁二醇为底物,最终乙偶姻的产量达到165.9g/l。虽然乙偶姻的产量很高,但底物2,3
‑
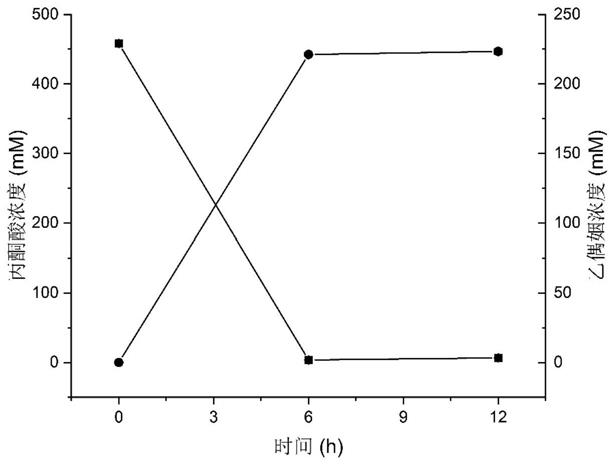
丁二醇价格昂贵。目前全细胞催化方法中,以乙醛为底物的催化体系中,乙偶姻的产量最高,达到222g/l
2.,但该催化体系使用的细胞密度较高,达到30g cdw/l,且其底物乙醛较贵,难以储存,属于危险品,不利于乙偶姻的工业化制备。因此亟待开发一种利用廉价安全的全细胞催化方法。
技术实现要素:
7.本发明的目的是克服现有技术的不足,提供一种重组嗜盐单胞菌。
8.本发明的第二个目的是提供一种重组嗜盐单胞菌的构建方法。
9.本发明的第三个目的是提供一种重组嗜盐单胞菌催化丙酮酸生产乙偶姻的应用。
10.本发明的技术方案概述如下:
11.一种重组嗜盐单胞菌的构建方法,包括如下步骤:
12.(1)在野生型嗜盐单胞菌halomonas sp.td01保藏登记号为cgmccno.4353基因组上整合mmp1 rna聚合酶表达单元,得到halomonas sp.td1.0;再将halomonas sp.td1.0基因组上聚羟基烷烃酸合成酶亚基基因phac敲除,得到halomonas sp.td1.0
△
phac;
13.所述mmp1 rna聚合酶表达单元的核苷酸序列如seq id no.8所示;
14.所述聚羟基烷烃酸合成酶亚基基因phac的核苷酸序列如seq id no.9所示;
15.(2)在高拷贝表达载体pn59上通过cpec的方法,插入p
mmp1
,得到pn59
‑
pmmp1,并在pn59
‑
p
mmp1
的多克隆位点区域插入rbs
‑
aldc
‑
s2
‑
alss,得到高拷贝表达载体pn59
‑
p
mmp1
‑
rbs
‑
aldc
‑
s2
‑
alss;
16.所述高拷贝表达载体pn59的核苷酸序列如seq id no.1所示;
17.所述p
mmp1
为iptg诱导型启动子,其核苷酸序列如seq id no.2所示;
18.所述rbs为大肠杆菌escherichia coli mg1655强核糖体结合位点,其核苷酸序列如seq id no.3所示;
19.所述aldc为枯草芽孢杆菌bacillus subtilis 168来源的α
‑
乙酰乳酸脱羧酶基因,其核苷酸序列如seq id no.4所示;
20.所述s2的核苷酸序列如seq id no.5所示;
21.所述alss为枯草芽孢杆菌bacillus subtilis 168来源的α
‑
乙酰乳酸合成酶基因,其核苷酸序列如seq id no.6所示;
22.(3)在低拷贝表达载体pn85上通过cpec的方法插入p
mmp1
‑
rbs
‑
aldc,得到低拷贝表达载体pn85
‑
p
mmp1
‑
rbs
‑
aldc;
23.所述低拷贝表达载体pn85的核苷酸序列如seq id no.7所示;
24.(4)向步骤(1)获得的halomonas sp.td1.0
△
phac中导入高拷贝表达载体pn59
‑
p
mmp1
‑
rbs
‑
aldc
‑
s2
‑
alss,得到重组嗜盐单胞菌tdz
‑
1;再向所述tdz
‑
1中导入低拷贝表达载体pn85
‑
p
mmp1
‑
rbs
‑
aldc,得到重组嗜盐单胞菌tdz
‑
2。
25.上述构建方法构建的重组嗜盐单胞菌。
26.上述重组嗜盐单胞菌催化丙酮酸生产乙偶姻的应用。
27.上述应用,包括如下步骤:
28.1)权利要求2的重组嗜盐单胞菌在60lb液体培养基中进行培养,培养至od
600
为0.6
‑
0.8,加入终浓度为0.5mm的iptg,18
‑
30℃下诱导12
‑
16h,离心收集菌体;
29.2)按比例,向容器中加入底物丙酮酸,使终浓度为460
‑
800mm,加入步骤1)获得的菌体,使od
600
=5
‑
15,加入10mm的mgcl2,0.2mm硫胺素焦磷酸,余量为ph 6.0的100mm高渗磷酸缓冲液,混合均匀后在40
‑
45℃,220rpm反应,得到乙偶姻。
30.有益效果
31.本发明利用重组嗜盐单胞菌进行全细胞催化丙酮酸生产乙偶姻,与体外酶催化相比,效率高,反应周期短,成本低,环保。
附图说明
32.图1为重组嗜盐单胞菌转化460mm丙酮酸生产乙偶姻的生产曲线。
33.图2为重组嗜盐单胞菌转化800mm丙酮酸生产乙偶姻的生产曲线。
具体实施方式
34.下面结合实施例对本发明做进一步说明,下述实施例是为了使本领域的技术人员能够更好的理解本发明,但对本发明不作任何限制。
35.枯草芽孢杆菌购自bgsc芽孢杆菌遗传储备中心(bacillus genetic stock center),
36.20010315,美国,http://www.bgsc.org/。
37.escherichia coli s17
‑
1λpir,购自biovector质粒载体菌种细胞基因保藏中心,20191011,中国,http://www.biovector.net/。
38.lb液体培养基:胰蛋白胨10g/l,酵母提取物5g/l,氯化钠20g/l,蒸馏水定容。
39.20lb固体培养基:胰蛋白胨10g/l,酵母提取物5g/l,氯化钠20g/l,蒸馏水定容至1l,加2%琼脂。
40.60lb液体培养基包括:胰蛋白胨10g/l,酵母提取物5g/l,氯化钠60g/l,蒸馏水定容至1l,5m naoh水溶液调ph至9.0;
41.100mm高渗磷酸缓冲液(ph=6.0)包括:0.1m na2hpo4水溶液和0.1m nah2po4水溶液以1:7.13体积比混合,添加nacl使终浓度60g/l;
42.cpec质粒构建方法来源于如下文章:quan,j.and j.tian(2009)."circular polymerase extension cloning of complex gene libraries and pathways."plos one 4(7):e6441.
43.pn59载体(pseva341,the standard european vector architecture(seva):a coherent platform for the analysis and development of complex prokaryotic phenotypes(2013).nucleic acids research,41,75)
44.pn85载体(pseva321,the standard european vector architecture(seva):a coherent platform for the analysis and development of complex prokaryotic phenotypes(2013).nucleic acids research,41,75)
45.乙偶姻标准品从sigma公司(http://www.sigmaaldrich.com/sigma
‑
aldrich)购买。
46.所用限制性内切酶、去磷酸化酶、dna连接酶等、分子生物学试剂从thermo公司购买(http://www.thermoscientificbio.com/fermentas)。
47.所用丙酮酸钠,丙酮酸等其他生化试剂(如胰蛋白胨,酵母抽提物,nacl,磷酸氢二钠,磷酸二氢钠、iptg、mgcl2等)从生工生物工程(上海)股份有限公司购买(http://www.sangon.com/)。
48.iptg(异丙基β
‑
d
‑1‑
硫代吡喃半乳糖苷)
49.实施例1:嗜盐单胞菌突变体halomonas sp.td1.0
△
phac的构建
50.在野生型嗜盐单胞菌halomonas sp.td01(已于2010年11月9日保藏于中国微生物菌株保藏管理委员会普通微生物中心,保藏登记号为cgmcc no.4353)基因组上整合mmp1rna聚合酶表达单元,得到halomonas sp.td1.0;
51.具体步骤为:在野生型嗜盐单胞菌halomonas sp.td01(cgmcc no.4353)基因组上整合mmp1 rna聚合酶表达单元,得到halomonas sp.td1.0,以实现当iptg存在时类t7启动子的激活转录,具体操作方法记载在如下文献中:zhao h,zhang h m,chen x,li t,wu q,
et al.(2016).novel t7
‑
like expression systems used for halomonas.metabolic engineering,128,公众可根据文献内容改造halomonas sp.td01获得halomonas sp.td1.0;
52.进一步利用crispr/cas9技术(方法记录在如下文献中:qin q,ling c,zhao y,yang t,yin j,guo y,et al.(2018).crispr/cas9 editing genome of extremophile halomonas spp.metabolic engineering,s1096717618300053.)将halomonas sp.td1.0基因组上编码聚羟基烷烃酸合成酶亚基基因phac敲除,得到halomonas sp.td1.0
△
phac作为本发明的底盘细胞。
53.所述mmp1 rna聚合酶表达单元的核苷酸序列如seq id no.8所示;
54.所述聚羟基烷烃酸合成酶亚基基因phac的核苷酸序列如seq id no.9所示
55.实施例2:重组表达载体和重组嗜盐单胞菌的构建
56.1)载体pn59
‑
p
mmp1
‑
rbs
‑
aldc
‑
s2
‑
alss和重组嗜盐单胞菌tdz
‑
1的构建
57.以引物pn59
‑
f(seq id no.10)为上游引物,以pn59
‑
r(seq id no.11)为下游引物,以pn59载体(seq id no.1)为模板,经pcr,制备片段pn59
‑
1;
58.以引物p
mmp1
‑
f(seq id no.12)上游引物,以p
mmp1
‑
r(seq id no.13)为下游引物,以seq id no.2所示p
mmp1
片段为模板,经pcr,制备片段p
mmp1
‑
1;
59.利用片段pn59
‑
1和p
mmp1
‑
1,经cpec方法制备载体pn59
‑
p
mmp1
;
60.以引物rbs
‑
aldc
‑
s2
‑
f(seq id no.14)为上游引物,以rbs
‑
aldc
‑
s2
‑
r(seq id no.15)为下游引物,以枯草芽孢杆菌(bacillus subtilis 168)基因组为模板,经pcr,制备含有rbs(大肠杆菌escherichia coli mg1655强核糖体结合位点,seq id no.3)、基因aldc(枯草芽孢杆菌bacillus subtilis 168来源的α
‑
乙酰乳酸脱羧酶基因seq id no.4)和部分s2的片段rbs
‑
aldc
‑
1。
61.以引物s2
‑
alss
‑
f(seq id no.16)为上游引物,以s2
‑
alss
‑
r(seq id no.17)为下游引物,以枯草芽孢杆菌(bacillus subtilis 168)基因组为模板,经pcr,制备含有另一部分s2和基因alss(为枯草芽孢杆菌bacillus subtilis 168来源的α
‑
乙酰乳酸合成酶基因,seq id no.6)的片段alss
‑
1,最后利用引物rbs
‑
aldc
‑
s2
‑
f和s2
‑
alss
‑
r,利用片段rbs
‑
aldc
‑
1和alss
‑
1,制备融合片段rbs
‑
aldc
‑
s2
‑
alss,其中s2的核苷酸序列如seq id no.5所示。然后将融合片段rbs
‑
aldc
‑
s2
‑
alss与pn59
‑
p
mmp1
通过bamhi/sdai双酶切,经连接、转化后得到载体pn59
‑
p
mmp1
‑
rbs
‑
aldc
‑
s2
‑
alss。将该载体电转至大肠杆菌s17
‑
1λpir,得到含pn59
‑
p
mmp1
‑
rbs
‑
aldc
‑
s2
‑
alss载体的大肠杆菌s17
‑
1λpir。
62.将上述含pn59
‑
p
mmp1
‑
rbs
‑
aldc
‑
s2
‑
alss载体的大肠杆菌s17
‑
1λpri与实施例1所述的嗜盐单胞菌halomonas sp.td1.0
△
phac接合。具体步骤为:将含pn59
‑
p
mmp1
‑
rbs
‑
aldc
‑
s2
‑
alss载体的大肠杆菌s17
‑
1λpri接种于5ml含25mg/l氯霉素抗性的lb液体培养基中,将halomonas sp.td1.0
△
phac接种于5ml 60lb液体培养基中,分别于37℃,220rpm培养12h。收集1ml含pn59
‑
p
mmp1
‑
rbs
‑
aldc
‑
s2
‑
alss载体的大肠杆菌s17
‑
1λpri菌液和1ml halomonas sp.td1.0
△
phac菌液,分别用lb液体培养基和60lb液体培养基洗涤两次,以体积比为1:1比例混匀,滴种于20lb固体培养基上,37℃接合12h。最后涂布于含25mg/l氯霉素抗性60lb固体平板上,挑取单菌落pcr验证,得到重组嗜盐单胞菌tdz
‑
1。
63.2)载体pn85
‑
p
mmp1
‑
rbs
‑
aldc和重组嗜盐单胞菌tdz
‑
2的构建
64.以引物pn85
‑
f(seq id no.18)为上游引物,以pn85
‑
r(seq id no.19)为下游引物,以pn85载体(seq id no.7)为模板,经pcr,制备片段pn85
‑
1。
65.以引物p
mmp1
‑
rbs
‑
aldc
‑
f(seq id no.20)为上游引物,以p
mmp1
‑
rbs
‑
aldc
‑
r(seq id no.21)为下游引物,以pn59
‑
p
mmp1
‑
rbs
‑
aldc
‑
s2
‑
alss载体为模板,经pcr,制备片段p
mmp1
‑
rbs
‑
aldc。
66.利用片段pn85
‑
1和p
mmp1
‑
rbs
‑
aldc,经cpec方法制备载体pn85
‑
p
mmp1
‑
rbs
‑
aldc。将该载体电转至大肠杆菌s17
‑
1λpir,得到含pn85
‑
p
mmp1
‑
rbs
‑
aldc载体的大肠杆菌s17
‑
1λpir。
67.将上述含pn85
‑
p
mmp1
‑
rbs
‑
aldc载体的大肠杆菌s17
‑
1λpri与重组嗜盐单胞菌tdz
‑
1 tdz
‑
1接合。最后接合产物涂布于含25mg/l氯霉素和100mg/l壮观霉素和50mg/l卡那霉素抗性的60lb固体平板上,挑取单菌落pcr验证,得到重组嗜盐单胞菌tdz
‑
2。
68.实施例3:重组嗜盐单胞菌tdz
‑
2催化丙酮酸生产乙偶姻的应用,包括如下步骤:
69.(1)将重组嗜盐单胞菌tdz
‑
2从平板上挑取单菌落,接种到5ml含25mg/l氯霉素和100mg/l壮观霉素抗性和50mg/l卡那霉素的60lb液体培养基中,37℃,220rpm培养12h,再以1%接种量转接至200ml含25mg/l氯霉素和100mg/l壮观霉素和50mg/l卡那霉素抗性的60lb液体培养基中,在37℃,220rpm条件下培养至od
600
为0.6
‑
0.8,加入终浓度为0.5mm的iptg(异丙基β
‑
d
‑1‑
硫代吡喃半乳糖苷),30℃,220rpm下诱导12h后,4℃,4500rpm收集菌体,利用100mm高渗磷酸缓冲液(ph 6.0)重悬洗涤一次菌体,再4℃,4500rpm离心菌体,最后用少量的100mm高渗磷酸缓冲液(ph 6.0)将菌体重悬。
70.(2)按比例,向容器中加入底物丙酮酸,使终浓度为460mm,加入步骤(1)获得的菌体,使od
600
=5,加入10mm的mgcl2,0.2mm硫胺素焦磷酸,余量为ph 6.0的100mm高渗磷酸缓冲液,反应总体积为10ml,混合均匀后在40℃,220rpm反应6h后,重组嗜盐单胞菌tdz
‑
2的丙酮酸转化率可达99.2%,乙偶姻的产量达到206.1mm,得率达到0.448mol/mol,是理论得率的89.6%。产率达到34.4mm/h。
71.实施例4:重组嗜盐单胞菌tdz
‑
2催化丙酮酸生产乙偶姻的应用,包括如下步骤:
72.(1)将重组嗜盐单胞菌tdz
‑
2从平板上挑取单菌落,接种到5ml含25mg/l氯霉素和100mg/l壮观霉素抗性和50mg/l卡那霉素的60lb液体培养基中,37℃,220rpm培养12h,再以1%接种量转接至200ml含25mg/l氯霉素和100mg/l壮观霉素和50mg/l卡那霉素抗性的60lb液体培养基中,在37℃,220rpm条件下培养至od
600
为0.6
‑
0.8,加入终浓度为0.5mm的iptg(异丙基β
‑
d
‑1‑
硫代吡喃半乳糖苷),18℃,220rpm下诱导16h后,4℃,4500rpm收集菌体,利用100mm高渗磷酸缓冲液(ph 6.0)重悬洗涤一次菌体,再4℃,4500rpm离心菌体,最后用少量的100mm高渗磷酸缓冲液(ph 6.0)将菌体重悬。
73.(2)按比例,向容器中加入底物丙酮酸,使终浓度为460mm,加入步骤(1)获得的菌体,使od
600
=15,加入10mm的mgcl2,0.2mm硫胺素焦磷酸,余量为ph 6.0的100mm高渗磷酸缓冲液,反应总体积为10ml,混合均匀后在45℃,220rpm反应6h后得到乙偶姻,结果如图1所示,重组嗜盐单胞菌tdz
‑
2的丙酮酸转化率可达99.2%,乙偶姻的产量达到221mm,得率达到0.487mol/mol,是理论得率的97.4%。产率达到36.8mm/h。
74.实施例5:重组嗜盐单胞菌tdz
‑
2催化丙酮酸生产乙偶姻的应用,包括如下步骤:
75.(1)将重组嗜盐单胞菌tdz
‑
2从平板上挑取单菌落,接种到5ml含25mg/l氯霉素和
100mg/l壮观霉素抗性和50mg/l卡那霉素的60lb液体培养基中,37℃,220rpm培养12h,再以1%接种量转接至200ml含25mg/l氯霉素和100mg/l壮观霉素和50mg/l卡那霉素抗性的60lb液体培养基中,在37℃,220rpm条件下培养至od
600
为0.6
‑
0.8,加入终浓度为0.5mm的iptg(异丙基β
‑
d
‑1‑
硫代吡喃半乳糖苷),25℃,220rpm下诱导14h后,4℃,4500rpm收集菌体,利用100mm高渗磷酸缓冲液(ph 6.0)重悬洗涤一次菌体,再4℃,4500rpm离心菌体,最后用少量的100mm高渗磷酸缓冲液(ph 6.0)将菌体重悬。
76.(2)按比例,向容器中加入底物丙酮酸,使终浓度为800mm,加入步骤(1)获得的菌体,使od
600
=9.6,加入10mm的mgcl2,0.2mm硫胺素焦磷酸,余量为ph 6.0的100mm高渗磷酸缓冲液,反应总体积为10ml,混合均匀后在45℃,220rpm反应2h后,结果如图2所示,重组嗜盐单胞菌tdz
‑
2的丙酮酸转化率可达97.1%,乙偶姻的产量达到320.5mm,得率达到0.400mol/mol,是理论得率的80.0%。产率达到160.2mm/h。
77.实施例6:补料法生产乙偶姻应用
78.为进一步提高乙偶姻产量,通过补料法进行乙偶姻的生产。
79.(1)将重组嗜盐单胞菌tdz
‑
2从平板上挑取单菌落,接种到5ml含25mg/l氯霉素和100mg/l壮观霉素抗性和50mg/l卡那霉素的60lb液体培养基中,37℃,220rpm培养12h,再以1%接种量转接至200ml含25mg/l氯霉素和100mg/l壮观霉素和50mg/l卡那霉素抗性的60lb液体培养基中,在37℃,220rpm条件下培养至od
600
为0.6
‑
0.8,加入终浓度为0.5mm的iptg(异丙基β
‑
d
‑1‑
硫代吡喃半乳糖苷),30℃,220rpm下诱导12h后,4℃,4500rpm收集菌体,利用100mm高渗磷酸缓冲液(ph 6.0)重悬洗涤一次菌体,再4℃,4500rpm离心菌体,最后用少量的100mm高渗磷酸缓冲液(ph 6.0)将菌体重悬。
80.(2)按比例,向容器中加入底物丙酮酸,使终浓度为800mm,加入步骤(1)获得的菌体,使od
600
=10,10mm的mgcl2,0.2mm硫胺素焦磷酸,余量为ph 6.0的100mm高渗磷酸缓冲液,反应总体积为10ml,混合均匀后在45℃,220rpm反应,每反应2h后测体系ph值,用质量比为4:1的丙酮酸/丙酮酸钠混合溶液调整体系ph至反应最适ph(6.0
‑
6.5),8h后,重组嗜盐单胞菌tdz
‑
2的丙酮酸转化率可达96.8%,乙偶姻的产量达到1041mm,得率达到0.426mol/mol,是理论得率的85.2%。产率达到130.2mm/h。
81.参考文献:
82.[1]zhou x,zhou x,zhang h,et al.improving the performance of cell biocatalysis and the productivity of acetoin from 2,3
‑
butanediol using a compressed oxygen supply.process biochem,2018,64:46
‑
50.
[0083]
[2]peng k,guo d,lou q,et al.synthesis of ligustrazine from acetaldehyde by a combined biological
–
chemical approach.acs synth biol,2020,9(11):2902
‑
2908.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1