利用人肝癌细胞HepG2/C3A作为生物反应器生产重组人血清白蛋白的制作方法
利用人肝癌细胞hepg2/c3a作为生物反应器生产重组人血清白蛋白
技术领域
1.本发明属于生物技术领域,具体涉及一种利用人肝癌细胞hepg2/c3a作为生物反应器生产重组人血清白蛋白。
背景技术:
2.治疗性重组蛋白是利用生物技术产生的,用于补偿身体某种蛋白缺乏或缺陷导致疾病的一类药品。当今有超过数千种重组蛋白药品在全球被批准上市,其中抗体药物已经成为最重要的生物药物。目前治疗性重组蛋白产品的商业重要性和需求仍在逐年快速增长[1
‑
3]。
[0003]
有多种反应器(细胞表达体系)生产重组蛋白药物,这些表达体系包括细菌细胞、酵母细胞、植物细胞、昆虫细胞以及哺乳动物细胞(包括人的细胞)。最合适的表达体系取决于所要表达的重组蛋白的属性。由于重组蛋白药物最终要用于人体,因此哺乳动物细胞是首选的表达体系。哺乳动物细胞不仅能够产生分子量大,结构复杂的蛋白,而且这类细胞产生的重组蛋白在蛋白的翻译后修饰方面和人体产生的天然蛋白更加相似或完全相同,从而使得哺乳动物细胞产生的重组蛋白具有高活力、高稳定性和低免疫原性的特点[2, 3]。
[0004]
人类大约50 % 的蛋白都有糖基化修饰,即将多糖链共价交联到蛋白质天冬酰胺残基的氨基n原子上(nitrogen
‑
linked glycosylation,n
‑
glycosylation),或者丝氨酸或苏氨酸残基羟基氧原子上(oxygen
‑
glycosylation,o
‑
glycosylation)[4]。天然状态没有糖基化修饰的蛋白如果发生糖基化则可能对蛋白的功能带来负面的影响,天然状态具有糖基化修饰的蛋白其糖基化对于该蛋白的活性和稳定性则是必需的,例如许多分泌蛋白和膜蛋白。糖蛋白的多糖链位置、数目和糖链结构对于蛋白质来说有多种功能,包括维持蛋白质的结构、维持蛋白质的稳定性和活力。糖蛋白药物的半衰期、药物动力学和免疫原性主要受到糖链的影响[2, 3]。
[0005]
糖基化修饰发生于内质网和高尔基体,内质网糖基化修饰酶系在物种间保守,而高尔基体内的糖基化修饰酶系存在物种间差异[4]。因此相同的蛋白在酵母、植物、昆虫和哺乳动物细胞等不同的重组蛋白表达体系中表达,其发生的糖基化修饰模式具有非常大的差异,相同的蛋白即使是在不同的哺乳动物细胞中表达,其糖基化模式也可能有所不同。这种糖基化模式的不同对糖蛋白的产量、构象、免疫原性和蛋白质的活性带来不同的影响。选择合适的细胞种类以获得与人体内天然蛋白相似或相同的糖基化,对保证人用糖蛋白药物的有效性和安全性至关重要[4, 5]。
[0006]
目前大多数的重组蛋白治疗药物,如重组抗体,主要在哺乳动物细胞反应器中表达,其中使用最为广泛的是中国仓鼠卵巢细胞cho(chinese hamster ovary cells)。其它的非人哺乳动物细胞包括bhk21(baby hamster kidney), ns0和sp2/0(murine myeloma cells)等。人细胞反应器主要是人胚肾细胞hek293及其衍生细胞[2, 3]。
[0007]
哺乳动物细胞产生的重组蛋白的糖基化修饰和人细胞产生的糖基化修饰仍然存
在差异,特别是在糖基化蛋白的多糖末端,也就是最为暴露和具有免疫原性的部位。哺乳动物细胞产生的糖蛋白与人细胞产生的糖蛋白的糖基化末端结构上的不同在于:第一,人体内的糖基化蛋白的n
‑
多糖末端没有galactose
‑
α1,3
‑
galactose(简称α
‑
gal)修饰,但来源于鼠科动物细胞(例如cho细胞)的糖蛋白在其糖链末端含有α
‑
gal;第二,人体内的糖蛋白的n
‑
多糖不含非人唾液酸,但来源于鼠科动物的糖蛋白在其糖末端含有鼠源唾液酸(n
‑
glycolylneuraminic acid,neu5gc)。
[0008]
人体会自动产生针对α
‑
gal和neu5gc这二个表位多糖结构的抗体,使得含有这类多糖结构的重组蛋白药物用于人体时具有提高了的免疫原性[1]并导致重组蛋白药物的半衰期缩短,药效受到影响。另外,因人体缺乏分解neu5gc的酶,导致neu5gc不能够被分解,只能通过代谢整合到其它糖蛋白上,从而诱发更为广泛和严重的免疫反应[3]。因此哺乳细胞,如鼠源细胞系,所表达的重组糖基化蛋白的糖基不仅影响其产率,具有免疫原性,也影响药物的有效性。以cho等非人细胞为表达体系表达重组蛋白,在研发早期需要花费很多的人力、物力和财力用于筛选能够被人体所接受的糖型,而且也要面对药物研发后期由于糖型差异带来的高免疫原性最终导致药物研发失败的风险[2
‑
4]。
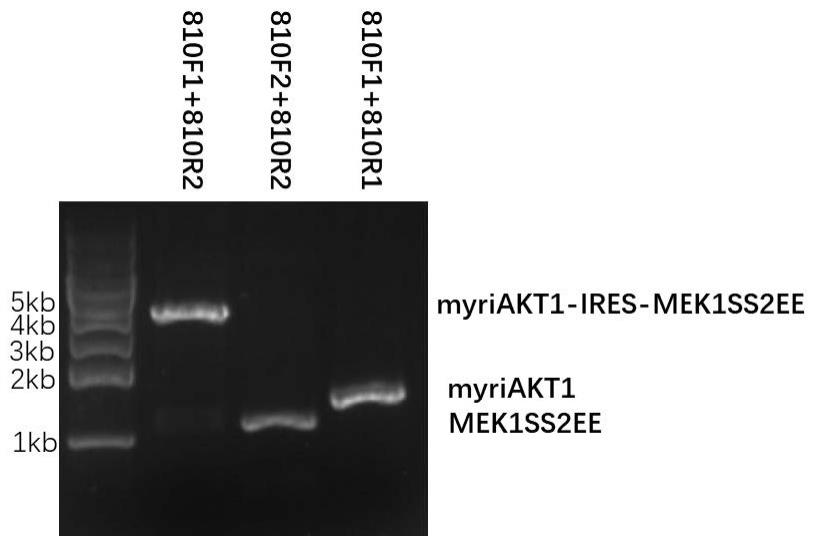
[0009]
人细胞系是表达重组蛋白药物最好的选择,因为人细胞系所产的蛋白的翻译后修饰,包括蛋白质糖基化、磺酸化等翻译后修饰,是和人体内的生理条件下的天然蛋白非常接近或完全相同的。这种正确的糖基化修饰和其它翻译后修饰不仅能保证糖蛋白的稳定性和活性,将极大减少人体针对非人表位抗原诱导的免疫反应。因此人的细胞系是更加合适的治疗性重组蛋白的表达体系[3, 5]。
[0010]
hek293是人胚肾细胞经过腺病毒基因转化得到的细胞系,在科学研究中广泛用于瞬时表达重组蛋白,最近几年被广泛用于生产病毒载体。但是hek293细胞极易黏连成团,导致其难以适应工业化大规模反应器的培养条件[2, 3]。
[0011]
cho et al等将293s和人悬浮细胞株2b8 (a burkitt’s lymphoma derivative)融合,经筛选得到杂交细胞hkb (hybrid of kidney and b cells)[6],其中一株hkb11以比较高的效率表达il
‑
2,il
‑
4, icam
‑
1 和rfviii(相较于hek293和cho)。
[0012]
per.c6 细胞由crucell and dsm biologics制造,由人胚视网膜细胞(human embryonic retinoblasts)用腺病毒基因ad5 e1a和e1b转化得到,最初用于生产免疫接种和基因治疗的所需的重组人腺病毒载体。最近per.c6被用于重组蛋白药物的生产。该细胞是最有可能在重组药物蛋白生产中取代鼠源cho细胞的人源细胞[2, 3]。
[0013]
cevec公司采用腺病毒遗传物质e1/pix将原代人羊膜细胞永生化并经筛选得到cap细胞[3]。该公司声称该细胞产生的蛋白具有人的翻译后修饰,避免了非人的糖基化修饰,因而具有提高了比活力。
[0014]
ht
‑
1080是从人的纤维瘤衍生的一株细胞,被shire等用于生产治疗蛋白[2, 3]。
[0015]
尽管这些人源细胞潜在的有可能用于重组蛋白的工业化生产,并且由若干种人源细胞表达的重组蛋白药物上市并体现了人源细胞表达体系的优势,但是到目前为止,尚未有任何一株人源细胞株能够像cho细胞一样被政府监管机构接受并被行业广泛用于重组蛋白的工业化生产。我国尚未有公司开发新的人源细胞株用于重组蛋白或疫苗的生产[2, 3]。
[0016]
哺乳动物细胞大规模培养是生物制药下游重要和通用的技术,在生物药行业发挥
极为重要的作用。其关键技术在于实现哺乳动物细胞的无血清培养和悬浮培养。悬浮培养相对贴壁培养能够在单位体积产生更多的细胞,并能够实现大规模培养,从而能生产更多的生物制品[1]。
[0017]
血清是培养哺乳动物细胞时必须添加的营养物。血清不仅能够提供重要的营养物质,血清当中的激素、生长因子和结合蛋白对于动物细胞的生长和增殖是必需的,因此无血清培养通常会导致哺乳动物细胞死亡。
[0018]
但是,由于血清昂贵、成分复杂、批次之间差异巨大,使得下游纯化工艺复杂化[7]。血清还是潜在的细菌、支原体和病毒等污染源头。因此,哺乳动物细胞或人细胞的无血清培养是通过基因工程细胞株生产重组蛋白药物中非常关键的因素,对于降低成本和减少血清给最终产品品质带来负面影响非常关键[7]。
[0019]
因此,研发人源细胞用作反应器需要设法让人源细胞脱离血清后仍能生长,并且能够悬浮培养。
[0020]
人血浆中多种物质被提纯作为蛋白药物使用,例如多种凝血因子和人血清白蛋白。人血清白蛋白(human serum albumin , hsa)是由肝脏细胞的血浆中最为丰富的蛋白质,正常人血中的含量大约为42克/升,占血浆总蛋白的60%[8]。hsa作为载体物质,负责生物分子如氨基酸、激素、脂肪酸、离子、其它生物学活性分子及药物等在血液中的运输。hsa还具有维持血浆胶体渗透压、作为营养物质和促伤口愈合和抗氧化的作用[8, 9]。
[0021]
hsa作为药物在临床上具有十分重要的价值。可用于治疗各种创伤、烧伤、外科手术过程中或手术后失血、水肿、危重病人补液、以及许多慢性消耗性疾病,如肿瘤等。还可用作赋形剂,活性药物稳定剂[10],安慰剂,细胞培养基添加物等[11]。基于hsa重要而广泛的功能,hsa是大宗临床一线用药,对临床医学应用具有重大的战略意义[12
‑
17]。
[0022]
迄今为止,临床使用的hsa是以供血者的血液提取得到的。由于原料血可能存在的致病微生物或病毒污染,人血源白蛋白在安全上令人担忧。我国由于采浆和血制品相关政策限制,加剧了人血白蛋白的供应不足。即使是在目前政策性抑制需求情形下每年仍然有300吨/年的缺口。基于以上原因,工业化生产药品级重组hsa以替代血浆来源hsa具有非常广阔的市场需求[9, 12, 18
‑
20]。
[0023]
我国重组hsa(recombinant human serum albumin , rhsa)产业化的呈现出良好的发展势头[9, 20
‑
23]。中国目前已能用重组dna技术在酵母和水稻中批量生产rhsa[9, 18, 24, 25]。我国较早开展rhsa研究的华北制药采用酵母体系生产药用辅料rhsa,产品已经规模化生产。通化东宝克服酵母表达体系存在的免疫原性强、下游纯化工艺复杂[26]和成本高等困难,生产的rhsa获得了国家药监部门的临床实验许可[27, 28]。武汉禾元生物通过基因工程实现了在水稻中规模化生产rhsa,并解决了水稻表达的rhsa存在着多位点的糖基化修饰问题[29
‑
33],也获得了国家监管部门的临床试验许可[9, 27, 30, 33]。酵母rhsa和水稻rhsa分别在不同的方面解决了重组白蛋白产业化中遇到来的问题[27, 30],尽管这二种rhsa的临床应用仍要面临大样本人群的试验,但无疑是重组白蛋白产业化取得的巨大的进步[12, 18, 34]。
[0024]
药用级的rhsa对其天然构象、修饰和纯度等提出了极高的要求。但是如果回归到本源,在人细胞中重组表达人血白蛋白,能够一举有效解决重组白蛋白产业化方面的多个难题。第一,在人细胞中表达的重组白蛋白的构象和血浆中的白蛋白相同,因而其运输功能
和调节渗透压的功能和血浆来源的hsa相同。第二,从人细胞中表达的重组白蛋白不会存在糖基化修饰,没有水稻表达体系rhsa的糖基化修饰带来的免疫原问题。第三,人细胞表达体系的宿主蛋白杂质对于人体而言并不是异源蛋白,其带来的免疫反应很小或没有[2, 3]。
[0025]
肝脏在人体内执行非常重要而广泛的功能,包括控制脂类、碳水化合物和氨基酸代谢,许多外源分子也在肝内实现生物转换[35, 36]。肝脏是唯一能合成人血白蛋白和多种具有重要功能的蛋白质和酶类的器官[35],如转铁蛋白、多种凝血因子等[37, 38]。原代肝细胞和永生化肝细胞系或肝癌细胞系在体外长期培养过程中,也仍然保留许多原代肝细胞的特征,包括肝特异性蛋白的表达、加工和分泌体系[36, 39]。因此,人肝细胞是很好的人细胞蛋白表达体系的候选细胞。
[0026]
hepg2是从肝癌组织获得的细胞系,具有上皮细胞的形态,并保留了部分肝细胞的功能,不具有成瘤性,基因组中不存在肝炎病毒[40, 41]。多种难以在其他细胞中重组表达的蛋白在hepg2能被高效地表达,如凝血因子,甲胎蛋白,白蛋白,转铁蛋白、血纤维蛋白溶酶原,纤维蛋白原等[37, 38],hepg2也被广泛用于肝癌和肝细胞相关的研究[40
‑
42]。从hepg2细胞中筛选出的具有更强的接触抑制和蛋白合成能力的细胞c3a [43]。hepg2/c3a是生物人工肝系统选用的细胞系[43
‑
45]。
[0027]
akt1是一种serine/threonine激酶,在细胞的增殖和生存中发挥非常重要的作用[46]。akt发挥功能必须首先激活。akt1的激活需要其thr308和ser473均发生磷酸化。细胞内akt1的激活方式为akt1首先被定位到细胞膜上并在膜上发生thr308的磷酸化[47],并在另一个位点ser473再发生磷酸化,最终实现完全激活[48]。因此,通过将akt1与膜定位信号(例如src蛋白的肉豆蔻基化细胞膜定位信号)融合,从而产生能持续性的定位到细胞膜上的akt1融合蛋白,即产生激活型的akt1。另外,通过直接将akt1的thr308和ser473都突变为模拟磷酸化的谷氨酸即获得激活型的akt1。
[0028]
ras/raf/mek/erk信号通路和细胞的生长和凋亡密切相关,mek1是传递该通路信号的重要分子。mek1 ser218 和ser222的磷酸化使其完全激活,从而引发下游细胞生长信号传导以发挥其促进细胞生长的功能。通过直接将mek1的ser218和ser222均突变为模拟磷酸化的谷氨酸即获得激活型的mek1。
技术实现要素:
[0029]
本发明将src蛋白的肉豆蔻基化细胞膜定位信号与akt1融合获得激活型的akt1(myriakt1),将mek1的ser218 和ser222突变为模拟磷酸化的谷氨酸(e),获得mek1ss2ee。构建了同时表达myriakt1和mek1ss2ee的载体(myriakt1
‑
ires
‑
mek1ss2ee),将该载体稳定导入人肝癌细胞系hepg2/c3a细胞中,获得稳定表达myriakt1和mek1ss2ee的细胞群c3a810。该细胞群可在无血清的化学培养基中悬浮生长,无需添加血清和任何细胞因子。利用细胞群c3a810在无血清培养条件下成功重组表达人血清白蛋白,表明该细胞群和培养体系能够作为人细胞表达体系(反应器)表达其它多种药用重组蛋白。采用该细胞群重组表达以血清白蛋白为代表的多种血浆蛋白并将其发展成为注射用药,将获得与血浆提取蛋白具有相同功效的重组蛋白药物,能极大缓解血浆蛋白药物短缺,极大减少对血浆的大量需求。
[0030]
本发明的技术方案之一为:一种载体,其包含表达框,所述表达框自5’端到3’端依次包含:表达含src蛋白的肉豆蔻基化细胞膜定位信号的激活型akt1基因、ires以及激活型
mek1变体基因;相比mek1,所述mek1变体的ser218和ser222突变为模拟磷酸化的氨基酸。
[0031]
其中,所述src蛋白的肉豆蔻基化细胞膜定位信号的肽段优选含有如seq id no: 2所示的氨基酸序列或所述src蛋白的肉豆蔻基化细胞膜定位信号的肽段氨基酸序列如seq id no: 2所示;较佳地,表达所述src蛋白的肉豆蔻基化细胞膜定位信号的基因含有如seq id no: 1所示的序列或表达所述src蛋白的肉豆蔻基化细胞膜定位信号的基因序列如seq id no: 1所示。
[0032]
所述含src蛋白的肉豆蔻基化细胞膜定位信号的akt1优选含有如seq id no: 4所示的氨基酸序列或所述含src蛋白的肉豆蔻基化细胞膜定位信号的akt1氨基酸序列优选如seq id no: 4所示;较佳地,表达所述含src蛋白的肉豆蔻基化细胞膜定位信号的akt1基因含有如seq id no: 3所示的序列或表达所述含src蛋白的肉豆蔻基化细胞膜定位信号的akt1基因序列如seq id no: 3所示。
[0033]
本发明中所述的ires优选含有如seq id no: 5所示的序列或所述的ires序列优选如seq id no: 5所示。
[0034]
本发明中所述mek1变体优选含有seq id no: 7所示的氨基酸序列或所述mek1变体的氨基酸序列优选如seq id no: 7所示;较佳地,所述mek1变体基因含有如seq id no: 6所示的序列或所述mek1变体基因的序列如seq id no: 6所示。
[0035]
本发明中所述载体的骨架可为本领域常规,较佳地为质粒pgk
‑
h2bmcherry。
[0036]
本发明的技术方案之二为:一种包含如技术方案之一所述的载体的转化体,所述转化体为人源细胞,优选的为人肝癌细胞hepg2/c3a。
[0037]
本发明的技术方案之三为:一种包含如技术方案之一所述的载体的慢病毒载体系统,其还包含包装辅助质粒pax2以及包装辅助质粒vsv
‑
g。
[0038]
本发明的技术方案之四为:一种利用如技术方案之三所述的慢病毒载体系统制备得到的病毒。
[0039]
本发明的技术方案之五为:利用如技术方案之四所述的病毒感染宿主细胞后得到的表达细胞,所述宿主细胞优选人肝癌细胞hepg2/c3a。
[0040]
本发明的技术方案之六为:利用编码人血白蛋白的慢病毒lenti802感染如技术方案之五所述的表达细胞后得到的细胞株。
[0041]
其中,所述慢病毒lenti802优选包含全合成表达框的核酸片段,所述核酸片段从5’端到3’端依次包含:人血清白蛋白启动子
‑
人血清白蛋白基因的第一个内含子
‑
人血清白蛋白基因
‑
ires
‑
绿色荧光蛋白基因;所述核酸片段优选通过重组连接到经xhoi和sali酶切的载体pgk
‑
h2bmcherry中,替换载体原有的pgk启动子、h2b基因和mcherry基因。
[0042]
以上所述人血清白蛋白启动子及第一个内含子较佳地含有如seq id no: 12所示的核苷酸序列。
[0043]
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0044]
本发明所用试剂和原料均市售可得。
[0045]
本发明的积极进步效果在于:首次选取人肝组织来源的细胞作为一种生物反应器来重组表达药用蛋白;首次提供了一种通过过表达二种激活型蛋白激酶让人细胞脱离血清生长的方法;首次用人的细胞
重组表达了人血浆白蛋白。
附图说明
[0046]
图1为载体lenti810表达框中myriakt1和mek1ss2ee连接顺序,m: src蛋白myristylation肽段的编码序列置于akt1基因的5’端。
[0047]
图2为利用pcr检测稳定插入在细胞c3a基因组中的akt1,mek1和myriakt1
‑
ires
‑
mek1ss2ee核酸片段。
[0048]
图3为hepg2/c3a810802细胞在无血清培养基中悬浮培养的生长曲线。
[0049]
图4为稳定表达人血白蛋白的hepg2/c3a810802细胞群培养在无血清培养基中培养时培养基中的人血白蛋白的跟踪检测。
具体实施方式
[0050]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0051]
实施例1构建表达含src蛋白膜定位信号的akt1基因(myriakt1)和激活型mek1s2e基因的载体pgk810myriakt1和mek1ss2ee基因中间以ires连接(myriakt1
‑
ires
‑
mek1ss2ee,参见图1)。全合成5’末端含有src蛋白myristylation肽段的编码序列及氨基酸序列(seq id no: 1、2)的akt1基因(seq id no: 3),表达所得氨基酸序列如seq id no: 4所示。全合成ires片段(seq id no: 5)。合成mek1ss2ee基因(seq id no: 6)以及mek1ss2ee的氨基酸序列(seq id no: 7)。以pgk
‑
h2bmcherry(addgene plasmid #21217)经限制性核酸内切酶bamhi和sali酶切后的载体部分为骨架,利用多片段重组拼接,将myriakt1、ires和mek1ss2ee拼接连接到pgk
‑
h2bmcherry载体的bamhi和sali位点之间,获得载体pgk810。
[0052]
实施例2制备pgk810病毒以六孔板中的1孔为例,每个样品需要1.3
×
106个293t细胞。
[0053]
1、第一天,于6
‑
well细胞培养孔中种1.3
×
106个293t细胞,细胞培养液为2ml dmem(gibco)+10%fbs(gibco)。置37℃,5%co2培养箱培养16小时。
[0054]
2、第二天,取1.5ml灭菌ep管,加入1.6μgpgk810质粒,1.2μg包装辅助质粒pax2和0.8μg包装辅助质粒vsv
‑
g,加入200μl的opti
‑
mem,静置5分钟,再加入10.8μl脂质体转染试剂fugene hd(roche),静置15分钟。
[0055]
3、将含dna和fugene hd脂质体的opti
‑
mem均匀地滴加到6
‑
well中的293t细胞中,稍加混匀,将细胞放回到37℃,5%co2细胞培养箱继续培养12小时。
[0056]
4、转染后12小时,用充分预热的2ml新鲜dmem+10%fbs替换6
‑
well中的培养基,置37℃,5%co2培养箱中继续培养36小时。
[0057]
5、转染后48h,收集含病毒的细胞培养液,用0.45μm滤器过滤去除细胞碎片。病毒上清置4
°
c冰箱保存,1周内使用。
[0058]
实施例3pgk810病毒感染c3a细胞和无血清筛选1、1.3
×
106个c3a细胞(atcc number: crl
‑
10741)用10ml含10%fbs 的dmem/f12
培养基种于10cm细胞培养皿中,37℃,5%co2培养箱培养12hr。
[0059]
2、向培养皿中加入12μl 8mg/ml polybrene混匀,加入pgk810病毒2ml,继续培养12hr后更换新鲜培养基。
[0060]
3、继续培养36小时后,用10ml新鲜培养基替换原培养基,继续培养24小时。
[0061]
4、用胰酶消化细胞,按1:5接种于新鲜培养基和新的培养皿中,24小时后,更换为不含血清的dmem/f12培养基,继续培养72小时。
[0062]
5、收集所有的悬浮细胞,未悬浮的贴壁细胞用胰酶消化,合并所有细胞,按1:5接种于新鲜的不含血清的dmem/f12培养基中,继续培养24小时。以后每隔24小时更换新鲜的无血清培养基,直至细胞全部长满培养皿。此为可在无血清培养基中贴壁生长的c3a810细胞群。
[0063]
实施例4细胞群c3a810细胞基因组中myriakt1和mek1的编码序列的检测通过本专利实施例3获得的细胞群c3a810的基因组dna的特征是:1、myriakt1和mek1的编码序列是以连续的cds形式整合于基因组,没有内含子将编码序列分隔;2、akt1基因和mek1基因由ires序列连接成为整体整合于基因组中;3、该akt1基因存在src蛋白的myristylation肽段的编码序列;4、mek1编码的蛋白序列为第218位丝氨酸和222位丝氨酸均突变为谷氨酸。
[0064]
以c3a810细胞群的基因组dna为模板,分别采用myriakt1基因和mek1基因的二端序列作为pcr引物可扩增完整的myriakt1和mek1序列,采用akt1基因的5’端序列和和mek1基因的3’序列作为引物可pcr扩增出同时包含akt1基因、ires元件和mek1基因的dna片段。具体操作如下:收集1
×
106个c3a810细胞,用1ml pbs 洗涤,按常规操作提取细胞基因组。
[0065]
采用分别以810f1和810r1,810f2和810r2,以及810f1和810r2为配对引物,对提取的基因组进行pcr扩增,将分别得到1443bp、1182bp以及3269bp的片段(参见图2)。
[0066]
扩增的片段可从dna琼脂糖凝胶电泳回收,采用扩增引物进行dna测序以确定获得的扩增产物为akt1基因和mek1基因。
[0067]
以下为引物名称及序列:表1810f15’atggggagtagcaagagcaagcctaaggac3’seqidno:8810r15’tcaggccgtgccgctggccgagtag3’seqidno:9810f25’atgcccaagaagaagccgacgcccatc3’seqidno:10810r25’ttagacgccagcagcatgggttggtg3’seqidno:11实施例5人血白蛋白表达载体lenti802病毒感染c3a810细胞1、1.3
×
106个c3a810细胞用10ml无血清dmem/f12培养基悬浮,种于10cm细胞培养皿中,37℃,5%co2培养箱培养12hr。
[0068]
2、向培养皿中加入6ul 8mg/ml polybrene混匀,加入参照实施例2操作步骤获得的编码人血白蛋白的慢病毒lenti802(halbpro
‑
alb
‑
ires
‑
gfp)2ml(参见中国专利cn201811433912),继续培养24hr后更换新鲜培养基。
[0069]
3、继续培养24小时后,用胰酶消化细胞,接种于新鲜培养基和新的培养皿中,常规培养扩增,获得c3a810802细胞群。
[0070]
实施例6c3a810802悬浮培养1、c3a810802细胞群在无血清的dmem/f12培养基中贴壁培养于10cm培养皿,用胰酶消化细胞,血清中和胰酶,pbs清洗1次后,按1.2
×
106个细胞/ml的密度重悬细胞于含30nmsodiumselenite,32μmethanolamine20μg/l,1mmn
‑
acetylcysteine,20μg/ml葡聚糖(mw=5000dalton)的dmem/f12培养基中,置于125ml三角玻璃摇瓶中,每瓶种20ml细胞悬液,于37℃,5%co2摇床中旋转培养,摇床转速100rpm。
[0071]
2、每隔24小时,取20μl进行台盼蓝染色和细胞计数并绘制生长曲线。另取50μl细胞悬液液1200转/分钟离心3分钟,将上清转移到新管中保存(上清含有细胞分泌的重组人血白蛋白rhsa)。
[0072]
3、每隔48小时为细胞更换相同体积的新鲜细胞培养基,继续培养。在此条件下连续培养12天(图3)。具体操作为:细胞以1.2
×
106/ml的细胞密度悬浮于10ml含30nmsodiumselenite、32μmethanolamine20μg/l、1mmn
‑
acetylcysteine以及20μg/ml葡聚糖硫酸钠(mw=5000dalton)的dmem/f12无血清培养基,置125ml三角玻璃摇瓶中,于37℃,5%co2摇床中培养,摇床转速100rpm。每隔48小时取20μl细胞进行台盼蓝染色并用countstar细胞计数仪进行活细胞计数,将摇瓶内细胞1200rpm离心3min去除培养基,重悬于相同体积的新鲜培养基,继续培养。
[0073]
实施例7在c3a810802悬浮培养液中rhsa含量和纯度的检测将实施例6步骤2所述获得的无血清培养上清(每24hr取培养物50μl,离心后取20μl培养上清)用sds
‑
page和考马斯亮蓝染色检测上清中的rhsa(图4)。以市售血浆来源的白蛋白(plasmaalbumin,纯度为96.6%)为阳性对照,以c3a细胞群贴壁无血清培养的上清为阴性对照。结果表明:1)在c3a细胞群的贴壁无血清培养的上清中不存在人血白蛋白,说明c3a不表达人血白蛋白,2)在c3a810802悬浮培养液中有人血白蛋白,说明在c3a810802成功重组表达人血白蛋白,重组人血白蛋白分泌于培养液中,3)c3a810802悬浮培养液中重组表达人血白蛋白的纯度非常接近市售血浆来源的白蛋白。
[0074]
参考文献:1.biaggio,r.t.,etal.,serum
‑
freesuspensionculturingofhumancells:adaptation,growth,andcryopreservation.bioprocessbiosysteng,2015.38(8):p.1495
‑
507.2.swiech,k.,v.picanco
‑
castro,andd.t.covas,humancells:newplatformforrecombinanttherapeuticproteinproduction.proteinexprpurif,2012.84(1):p.147
‑
53.3.dumont,j.,etal.,humancelllinesforbiopharmaceuticalmanufacturing:history,status,andfutureperspectives.critrevbiotechnol,2016.36(6):p.1110
‑
1122.4.brooks,s.a.,appropriateglycosylationofrecombinantproteinsforhumanuse:implicationsofchoiceofexpressionsystem.molbiotechnol,2004.28(3):p.241
‑
55.5.ghaderi,d.,etal.,productionplatformsforbiotherapeuticglycoproteins.occurrence,impact,andchallengesofnon
‑
humansialylation.
biotechnolgenetengrev,2012.28:p.147
‑
75.6.cruz,h.j.,etal.,adaptationofbhkcellsproducingarecombinantproteintoserum
‑
freemediaandprotein
‑
freemedium.cytotechnology,1998.26(1):p.59
‑
64.7.keen,m.j.andn.t.rapson,developmentofaserum
‑
freeculturemediumforthelargescaleproductionofrecombinantproteinfromachinesehamsterovarycellline.cytotechnology,1995.17(3):p.153
‑
63.8.chuang,v.t.andm.otagiri,recombinanthumanserumalbumin.drugstoday(barc),2007.43(8):p.547
‑
61.9.chen,z.,etal.,humanserumalbuminfromrecombinantdnatechnology:challengesandstrategies.biochimbiophysacta,2013.1830(12):p.5515
‑
25.10.hawe,a.andw.friess,stabilizationofahydrophobicrecombinantcytokinebyhumanserumalbumin.jpharmsci,2007.96(11):p.2987
‑
99.11.zhu,j.,etal.,recombinanthumanalbuminsupportssinglecellcloningofchocellsinchemicallydefinedmedia.biotechnolprog,2012.28(3):p.887
‑
91.12.rozga,j.,t.piatek,andp.malkowski,humanalbumin:old,new,andemergingapplications.anntransplant,2013.18:p.205
‑
17.13.bernardi,m.,c.maggioli,andg.zaccherini,humanalbumininthemanagementofcomplicationsoflivercirrhosis.critcare,2012.16(2):p.211.14.bernardi,m.,c.s.ricci,andg.zaccherini,roleofhumanalbumininthemanagementofcomplicationsoflivercirrhosis.jclinexphepatol,2014.4(4):p.302
‑
11.15.moujaess,e.,etal.,thetherapeuticuseofhumanalbuminincancerpatients'management.critrevoncolhematol,2017.120:p.203
‑
209.16.davis,c.h.,jr.,j.stoll,jr.,ande.alexander,jr.,theuseofconcentratedhumanserumalbumininthemanagementofincreasedintracranialpressure;apreliminaryreport.ncmedj,1953.14(11):p.569
‑
74.17.elliott,d.w.,etal.,theuseofhumanserumalbumininthemanagementofacutepancreatitis;experimentalandclinicalobservations.gastroenterology,1955.28(4):p.563
‑
87;discussion,588
‑
92.18.he,y.,etal.,large
‑
scaleproductionoffunctionalhumanserumalbuminfromtransgenicriceseeds.procnatlacadsciusa,2011.108(47):p.19078
‑
83.19.taghizadeh,s.m.,etal.,magneticimmobilizationofpichia
pastoriscellsfortheproductionofrecombinanthumanserumalbumin.nanomaterials(basel),2020.10(1).20.kobayashi,k.,summaryofrecombinanthumanserumalbumindevelopment.biologicals,2006.34(1):p.55
‑
9.21.nguyen,m.t.,etal.,bacterialoverexpressionandpurificationofsolublerecombinanthumanserumalbuminusingmaltose
‑
bindingproteinandproteindisulphideisomerase.proteinexprpurif,2020.167:p.105530.22.sun,q.y.,etal.,improvedexpressionandpurificationofrecombinanthumanserumalbuminfromtransgenictobaccosuspensionculture.jbiotechnol,2011.155(2):p.164
‑
72.23.manchu,r.,y.zhang,andy.zhang,[progressesinrecombinanthumanserumalbumin].shengwuyixuegongchengxuezazhi,2009.26(4):p.900
‑
3.24.guo,m.,etal.,[expressionofrecombinanthumanserumalbuminingeneticallyengineeredpichiapastorisinhigh
‑
densityfermentation].weishengwuxuebao,2002.42(1):p.62
‑
8.25.watanabe,h.,etal.,invitroandinvivopropertiesofrecombinanthumanserumalbuminfrompichiapastorispurifiedbyamethodofshortprocessingtime.pharmres,2001.18(12):p.1775
‑
81.26.li,s.,etal.,anovelpurificationprocedureforrecombinanthumanserumalbuminexpressedinpichiapastoris.proteinexprpurif,2018.149:p.37
‑
42.27.smith,d.g.,etal.,datasetformassspectrometricanalysisofrecombinanthumanserumalbuminfromvariousexpressionsystems.databrief,2015.4:p.583
‑
6.28.zhu,w.,etal.,highlevelexpressionandpurificationofrecombinanthumanserumalbumininpichiapastoris.proteinexprpurif,2018.147:p.61
‑
68.29.fu,k.,etal.,immunotoxicityassessmentofrice
‑
derivedrecombinanthumanserumalbuminusinghumanperipheralbloodmononuclearcells.plosone,2014.9(8):p.e104426.30.frahm,g.e.,etal.,determinationofsupplier
‑
to
‑
supplierandlot
‑
to
‑
lotvariabilityinglycationofrecombinanthumanserumalbuminexpressedinoryzasativa.plosone,2014.9(10):p.e109893.31.chen,z.,etal.,quantitationoftheresidualdnafromrice
‑
derivedrecombinanthumanserumalbumin.analbiochem,2014.450:p.4
‑
10.32.nakajou,k.,etal.,theeffectofglycationonthestructure,functionandbiologicalfateofhumanserumalbuminasrevealedbyrecombinantmutants.biochimbiophysacta,2003.1623(2
‑
3):p.88
‑
97.
requiredforp60srcmyristylationandmembraneassociationandforcelltransformation.molcellbiol,1984.4(9):p.1834
‑
42.48.kohn,a.d.,f.takeuchi,andr.a.roth,akt,apleckstrinhomologydomaincontainingkinase,isactivatedprimarilybyphosphorylation.jbiolchem,1996.271(36):p.21920
‑
6.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1