发酵生产肝素的酵母工程菌的构建及其应用
1.本发明涉及发酵生产肝素的酵母工程菌的构建及其应用,属于生物工程技术领域。
背景技术:
2.肝素(heparin)是一种酸性、带负电荷且具有一定生物活性的长链线性多糖,由糖醛酸(glcua)和d-氨基葡萄糖(glcnac)经α-1,4、β-1,4糖苷键连接并经变构化、磺酸化修饰而成,硫酸乙酰肝素(hs)和肝素的复杂结构决定着其复杂的生物学功能。1937年,肝素首次作为抗凝血药物应用于临床研究,是八十年以来使用最广泛最有效的抗凝抗血栓之一。由于hs和肝素参与多种生物学功能的调控,在正常的生理条件下,hs和肝素广泛存在于细胞表面和细胞外基质,在体内则主要是hs与多种蛋白配体相互作用并发挥相应的生物活性。hs和肝素不仅是反应中的催化剂,更是接触系统和补体系统的关键调节剂,hs和肝素通过介导细胞信号转导和细胞间通讯的关键过程发挥作用,进而调节包括细胞发育在内的不同生物学活动,如病原体感染、细胞增殖和炎症反应。
3.ndst1是一种兼具脱乙酰和磺酸化修饰活性的双功能酶,能够将肝素前体的n-乙酰氨基葡萄糖残基的乙酰基脱掉形成氨糖(glcnh2),并对其进行磺酸化修饰生成n-脱乙酰基-磺酸化氨糖(glcns)。c5差向异构酶(c5-epi)能够使n-磺酸化肝素前体糖链骨架的d-glca异构化转变成为idoa。c5的异构化在体内是不可逆反应,然而在体外酶法修饰中却是可逆反应。c5-epi转化glca为idoa的同时也逆向将idoa转化为glca。idoa在肝素的抗凝血活性中扮演着极为重要的角色。2-o-st是c5异构化后的磺酸化修饰酶,能够将多糖链的idoa2-oh进行磺酸化修饰为ido2s。值得注意的是,在人工构建的催化修饰体系中c5-epi和2-o-st展现了一种相辅相成的关系:c5-epi的修饰作用能够促进2-o-st的修饰,保证2-o-磺酸化程度的正常进行,同时2-ost也将转变c5-epi的可逆反应为不可逆。6-o-磺酸基团对抗凝血活性有重要修饰意义,含有6-o-磺酸基团、3-o-磺酸基团的产物仍对凝血酶和xa因子具有部分抑制作用,而缺失6-o-磺酸基团的产物则完全失去了抗凝血活性。虽然6-o磺酸化转移酶有3种同工酶,但它们底物选择性上存在的差异较小,虽然6-o-st-1更倾向选择修饰2-o-磺酸化的产物,但仅使用6-o-st-1则难以保证6-o-磺酸化的比例,因此常选择多种同工酶混合进行催化修饰。肝素糖链骨架的3-o-磺酸基团决定了肝素产物是否具有抗凝血活性,在肝素功能活性的赋予上发挥了重要作用。
4.目前商品化的肝素主要来自于猪、牛等哺乳动物,但由于牛源肝素的活性要低于猪源肝素、20世纪90年代的疯牛病爆发等原因,猪小肠粘膜仍然是天然肝素的主要提取来源。虽然其他哺乳动物如羊、骆驼等也被尝试用于提取天然肝素。动物源肝素的结构和磺酸化程度容易受到环境因素、动物品种的影响而产生变异性,难以保持不同批次产物的统一性。动物组织来源的肝素作为临床上广泛使用的药物一直面临结构不稳定、成分复杂的问题。为了得到结构均一性较好、生物安全的肝素,利用微生物进行肝素的合成可以有效避免上述问题。目前国内外虽然有以肝素前体为底物合成肝素寡糖,但没有在微生物细胞中直
接以葡萄糖、甘油、甲醇等碳源进行肝素合成的报道。
技术实现要素:
5.[技术问题]
[0006]
本发明要解决的技术问题是现有的肝素成分复杂、结构不均一,常规酶法催化合成肝素过程是以动物源肝素或肝素前体物质为底物进行磺酸化修饰,操作过程繁琐且低效。
[0007]
[技术方案]
[0008]
本发明是在毕赤酵母中以葡萄糖或甘油为碳源实现肝素的一步法发酵合成,实现胞内产量为1.8g/l。为实现上述发明目的,肝素生产的基因工程菌的构建方法,本发明所采用的技术方案如下:
[0009]
第一部分:毕赤酵母生产肝素基因工程菌的构建:
[0010]
本发明的第一个目的是提供一种产肝素的基因工程菌,所述基因工程以酵母为宿主,在基因组中整合表达或利用质粒表达编码(a)、(b)、(c)、(d)或(e)的核苷酸序列,其中:
[0011]
(a)肝素前体合酶(kfia、kfic)、dp-葡萄糖脱氢酶(tuad);
[0012]
(b)肝素前体合酶(kfia、kfic)、dp-葡萄糖脱氢酶(tuad)、n-脱乙酰/n-磺酸转移酶(ndst1)及atp磺酸化酶(met13);
[0013]
(c)肝素前体合酶(kfia、kfic)、dp-葡萄糖脱氢酶(tuad)、n-脱乙酰/n-磺酸转移酶(ndst1)、葡萄糖醛酸c5-变构酶(c5 epi)、磺酸乙酰肝素2-磺酸转移酶(2-ost)及atp磺酸化酶(met13);
[0014]
(d)肝素前体合酶(kfia、kfic)、dp-葡萄糖脱氢酶(tuad)、n-脱乙酰/n-磺酸转移酶(ndst1)、葡萄糖醛酸c5-变构酶(c5 epi)、磺酸乙酰肝素2-磺酸转移酶(2-ost)、磺酸乙酰肝素6-磺酸转移酶(6-ost)及atp磺酸化酶(met13);
[0015]
(e)肝素前体合酶(kfia、kfic)、dp-葡萄糖脱氢酶(tuad)、n-脱乙酰/n-磺酸转移酶(ndst1)、葡萄糖醛酸c5-变构酶(c5-epi)、磺酸乙酰肝素2-磺酸转移酶(2-ost)、磺酸乙酰肝素6-磺酸转移酶(6-ost)、磺酸乙酰肝素3-磺酸转移酶(3-ost)及atp磺酸化酶(met13)。
[0016]
在一种实施方式中,所述kfia、kfic分别是编码肝素前体合酶的基因,所述tuad是编码udp-葡萄糖脱氢酶(genbank登录号为np_391438.1)的基因。
[0017]
在一种实施方式中,外源基因kfia、kfic、tuad、ndst1、c5 epi、2-ost、6-ost、3-ost、met13的核苷酸序列来源及其genbank号如下表所示:
[0018]
表1肝素合成相关途径基因来源及其genbank号
[0019]
2ost-6ost和pao815-2ost-6ost-3ost质粒分别用快切酶sali线性化后分别整合到上述重组菌gs115/acdncm基因组中,用md平板筛选获得阳性克隆,将得到新的菌株命名为gs115/acdnc2m、gs115/acdnc26m、gs115/acdnc263m。
[0032]
(7)将所获得重组酵母菌株gs115/acd,gs115/acdnm,gs115/acdncm、gs115/acdnc2m、gs115/acdnc26m、gs115/acdnc263m分别在3-l发酵罐中发酵培养进行肝素的合成。
[0033]
第二部分:酿酒酵母生产肝素基因工程菌的构建:
[0034]
(1)以合成的基因tuad,kfia,kfic为模板,分别进行pcr扩增三个基因,利用gibson组装连接到prs305载体上,构建成prs305-kfia-t2a-kfic-t2a2-tuad质粒,其中,t2a和t2a2序列设计在引物上;
[0035]
(2)制备s.cerevisiae cen.pk2-1c单倍体酿酒酵母感受态细胞,将上述获得的质粒prs305-kfia-t2a-kfic-t2a2-tuad电转化到感受态细胞中,通过亮氨酸缺陷平板筛选阳性克隆,得到整合了基因tuad,kfia和kfic的菌株命名为s.c-acd;
[0036]
(3)扩增atp磺酸化酶met13,以在毕赤酵母中优化后的基因序列ndst1,c5 epi为模板,分别扩增ndst1、c5-epi,利用gibson组装将三个基因依次连接到prs303载体上,分别构建成prs303-ndst1-t2a-met13、prs303-ndst1-t2a-c5 epi-p2a-met13质粒;
[0037]
(4)制备酿酒酵母s.c-dac菌株感受态,将上述质粒rs303-ndst1-t2a-met13、prs303-ndst1-t2a-c5 epi-p2a-met13线性化后分别转入s.c-dac感受态细胞中,用色氨酸缺陷平板筛选获得阳性克隆,得到新的菌株分别命名为s.c-acdnm和s.c-acdncm;
[0038]
(5)以在毕赤酵母中优化后的基因序列2-ost、6-ost、3-ost为模板,分别组装到酿酒酵母游离表达载体prs304上,构建成prs304-2ost,prs304-2ost-t2a-6ost,prs304-2ost-t2a-6ost-t2a2-3ost质粒;
[0039]
(6)制备酿酒酵母s.c-acdncm菌株感受态,将上述质粒prs304-2ost,prs304-2ost-t2a-6ost,prs304-2ost-t2a-6ost-t2a2-3ost线性化后分别转入感受态细胞中,利用色氨酸缺陷平板筛选获得阳性克隆,得到新的菌株分别命名为s.c-acdnc2m、s.c-acdnc26m、s.c-acdnc263m;
[0040]
(7)将所获得酿酒酵母菌株s.c-dac、s.c-dacmnc、s.c-dacmnc2、s.c-dacmnc6、s.c-dacmnc3和s.c-dacnc263分别在3-l发酵罐中发酵培养进行肝素的合成。
[0041]
在一种实施方式中,所述缺陷型培养基平板(g/l):酵母无机氮源培养基6.7,葡萄糖20,根据需要添加组氨酸、色氨酸、亮氨酸及尿嘧啶,使其在培养基中终浓度为50mg/ml,准备固体培养基时添加琼脂粉20g/l。
[0042]
在一种实施方式中,所述发酵培养基组成为(g/l):酵母粉10,蛋白胨20,葡萄糖40,mnso
4 2;磷酸钾缓冲液100mmol/l,ph6.0,100
×
氨基酸混合液10ml/l。
[0043]
在一种实施方式中,所述发酵条件为:2vvm通气量、300-900rpm保证溶氧不低于30%,ph恒定维持在6,发酵48h后恒速流加无菌500g/l葡萄糖溶液,保证残糖维持在2-3g/l。
[0044]
本发明的第三个目的是提供所述菌株在生产肝素或其衍生产品方面的应用。
[0045]
本发明还要求保护含有所述基因工程菌的组合物。
[0046]
在一种实施方式中,所述组合物包括但不限于细胞保护剂。
[0047]
[有益效果]
[0048]
1、本发明首先将肝素(heparin)合成途径中的外源基因肝素前体合酶基因kfic,α4-n-乙酰氨基葡糖转移酶酶基因kfia和udp-葡萄糖脱氢酶编码基因tuad分别整合到毕赤酵母和酿酒酵母基因组中,初步构建了肝素前体(heparin precursor)合成途径,之后分别在毕赤酵母和酿酒酵母中表达筛选并优化n-脱乙酰磺酸转移酶(ndst)、葡萄糖醛酸c5-变构酶(c5 epi)、磺酸乙酰肝素2-磺酸转移酶(2-ost)、磺酸乙酰肝素6-磺酸转移酶(6-ost)、磺酸乙酰肝素3-磺酸转移酶(3-ost),将得到的高活性ndst1、c5 epi、2-ost、6-ost和3-ost序列分别或同时整合到上述产肝素菌株中得到合成不同磺酸化程度的磺酸乙酰肝素的生产菌株。本发明首次实现了利用微生物发酵碳源合成不同磺酸化程度的肝素。本发明的基因工程菌gs115/dac肝素前体产量1.5g/l,分子量300kda,gs115/dacnc脱乙酰肝素产量140mg/l,gs115/dacmnc2(2-ost)肝素产量50mg/l,gs115/dacmnc6(6-ost)肝素产量56mg/l,gs115/dacmnc3(3-ost)肝素产量60mg/l和gs115/dacmnc263肝素产量30mg/l,s.c-dacmnc肝素前体产量1.8g/l,s.c-dacmnc2(2-ost)肝素产量57mg/l,s.c-dacmnc6(6-ost)肝素产量59mg/l,s.c-dacmnc3(3-ost)肝素产量63mg/l和s.c-dacnc263肝素产量39mg/l。
[0049]
2、本发明的毕赤酵母和酿酒酵母基因工程菌通过代谢甘油,甲醇或者葡萄糖直接合成肝素,实现了特定结构的不同磺酸化程度的肝素在微生物中的合成,肝素分子量为12-60kda。所述不同磺酸化程度的肝素包含:30-80%未发生磺酸化(glca-glcnac)二糖基团,包含10-54%的n-磺酸化(glca-glcns),16-65%的2-磺酸化(idoa2s-glcns)二糖基团,12-84%的6-磺酸化(idoa2s-glcns6s)二糖基团,10-43%的(glca-glcns6s)二糖基团,9-37%的(idoa2s-glcnac6s),8-41%的(glca-glcns)二糖基团,6-35%的(idoa2s-glcnac)二糖基团。
[0050]
3、本发明利用微生物细胞直接合成肝素,与传统组织提取法获得的肝素相比,产品结构均一,无潜在致病因子,产品结构使用lc-ms鉴定二糖结构,产品的质量及安全性得以保证。
[0051]
4、本发明利用微生物直接合成肝素,与其他体外酶法催化合成肝素相比,简化了操作的繁琐性,避免了体外进行酶的提取纯化及后催化过程,显著的提高了生产效率,降低了成本。
附图说明
[0052]
图1是基因工程菌株酵母生产肝素的代谢网络示意图。
[0053]
图2是gs115/dac生产肝素前体的lc-ms图。
[0054]
图3是gs115/dacmnc263生产肝素的lc-ms图。
[0055]
图4是s.c-dac是生产肝素前体的lc-ms图
[0056]
图5是s.c-dacnc263生产肝素的lc-ms图。
[0057]
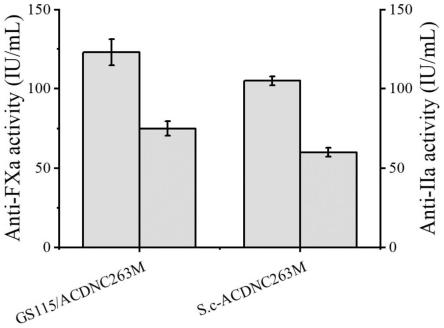
图6是gs115/acdnc263m和s.c-acdnc263m抗凝血活性图。
具体实施方式
[0058]
本发明利用合成生物学技术和基因工程手段,分别以毕赤酵母gs115和酿酒酵母s.cerevisiae cen.pk2-1c为出发菌株,在酵母细胞内异源表达了肝素合成途径相关基因。
[0059]
材料:
[0060]
1.毕赤酵母gs115和酿酒酵母s.cerevisiae cen.pk2-1c为实验室保存或购买。
[0061]
2.primestar dna聚合酶、磷酸化酶、dnamarker、solution i、avrii等酶类试剂购自takara(大连)。
[0062]
3.clonexpress一步法定向克隆试剂盒购自vazyme biotech(南京)。
[0063]
4.胶回收试剂盒,ecori,noti,kpni、sali、avrii等快切酶购自thermo fisher scientific公司。
[0064]
5.质粒抽提试剂盒购自生物工程(上海)有限公司。
[0065]
6.各种分析纯试剂购自国药集团。
[0066]
7.lb固体培养基(g/l):蛋白胨10,酵母粉5,氯化钠10,琼脂粉20。
[0067]
8.lb液体培养基(g/l):蛋白胨10,酵母粉5,氯化钠10。
[0068]
9.ypd培养基(g/l):蛋白胨20,酵母粉10,葡萄糖20。
[0069]
10.bmgy培养基(g/l):酵母粉10,蛋白胨20,k2hpo
4 3,kh2po
4 11.8,ynb 13.4,生物素4
×
10-4
,甘油10ml。
[0070]
11.bmmy培养基(g/l):酵母粉10,蛋白胨20,k2hpo
4 3,kh2po
4 11.8,ynb 13.4,生物素4
×
10-4
,甲醇5ml(用于重组毕赤酵母的诱导培养)。
[0071]
12.毕赤酵母基因工程菌的发酵培养基每升含有:甘油40g,k2so
4 18g,mgso4·
7h2o 14.9g,koh 4.13g,85%h3po
4 26.7ml,caso4·
2h2o 0.93g,4.35ml ptm1微量元素溶液;其中,ptm1微量元素溶液每升含有:cuso4·
5h2o 6g,ki 0.09g,mnso4·
h2o 3g,h3bo
3 0.02g,mona2o4·
2h2o 0.2g,cocl2·
6h2o 0.5g,zncl
2 20g,feso4·
7h2o 65g,生物素0.2g,h2so
4 5.0ml。
[0072]
13.酿酒酵母基因工程菌的发酵培养基每升含有:酵母粉10g;蛋白胨20g;葡萄糖40g;磷酸钾缓冲液100mmol,ph6.0,mnso
4 2g,100
×
氨基酸混合液10ml。其中,100
×
氨基酸混合液为:0.5g/l组氨酸、0.5g/l谷氨酸、0.5g/l谷氨酰胺、0.5g/l蛋氨酸、0.5g/l赖氨酸、0.5g/l亮氨酸和0.5g/l异亮氨酸溶于100ml水中,过滤除菌。
[0073]
14.实施例中设计的引物具体如表2所示。
[0074]
表2引物序列表
[0075][0076][0077]
实施例1:构建pgapzb-kfia-t2a-kfic-t2a2-tuad质粒和菌株gs115/acd
[0078]
(1)以酵母密码子优化的kfia(seq id no.1)、kfic(seq id no.2)、tuad(seq id no.3)序列为模板,使用引物ptuad-f/ptuad-r,pkfia-f/pkfia-r,pkfic-f/pkfic-r分别扩增三个基因,利用gibson组装连接到pgapzb载体上,构建成pgapzb-kfia-t2a-kfic-t2a2-tuad质粒,其中t2a序列为:gaaggtcgtggttctcttctgacttgtggtgatgttgaagaaaacccaggtcca,t2a2的序列为:ggatccggagaaggtcgtggatccctacttacttgcggtgacgtagaggaaaaccctggt
ccg。
[0079]
(2)将步骤(1)构建的pgapzb-kfia-t2a-kfic-t2a2-tuad使用快切酶avrii线性化后转化至毕赤酵母gs115感受态细胞,通过博来霉素抗性平板筛选阳性克隆,得到整合了基因kfic、kfia和tuad的菌株,命名为gs115/acd。
[0080]
实施例2:构建pgaphyg质粒
[0081]
使用引物hygr-f/hygr-r扩增潮霉素基因获得hyg片段,通过gibson组装将pgapzb质粒上的博来霉素抗性基因替换为潮霉素基因,将得到改造后的质粒命名为pgaphyg。
[0082]
实施例3:构建pgaphyg-ndst1-t2a-t2a2-met13、pgaphyg-ndst1-t2a-c5 epi-t2a2-met13质粒和菌株gs115/acdnm、gs115/acdncm
[0083]
(1)使用引物pmet13-f/pmet13-r从s.cerevisiae基因组上扩增met13基因,通过一步克隆组装连接到pgaphyg载体上,构建成pgaphyg-met13质粒;以引物pndst-f/pndst-r,pc5 epi-f/pc5 epi-r分别扩增优化后的基因序列ndst1(seq id no.4)、c5 epi(seq id no.5),将扩增产物利用gibson组装依次连接到pgaphyg-met13载体上得到重组质粒pgaphyg-ndst1-t2a-t2a2-met13和pgaphyg-ndst1-t2a-c5 epi-t2a2-met13:
[0084]
(2)将步骤(1)的质粒pgaphyg-ndst-t2a-t2a2-met13和pgaphyg-ndst1-t2a-c5 epi-t2a2-met13分别线性化后转化至gs115/acd的感受态细胞,通过潮霉素抗性平板筛选阳性克隆,菌株分别命名为gs115/acdnm、gs115/acdncm。
[0085]
实施例4:构建pao815-2ost,pao815-2ost-6ost和pao815-2ost-6ost-3ost质粒和菌株gs115/acdnc2m、gs115/acdnc26m、gs115/acdnc263m
[0086]
(1)分别以酵母优化后的基因序列2-ost(seq id no.6)、6-ost(seq id no.7)、3-ost(seq id no.8)为模板,以引物p2ost-f/p2ost-r,p6ost-f/p6ost-r,p3ost-f/p3ost-r,分别进行pcr扩增三个基因,利用gibson组装依次连接到pao815载体上,分别构建成pao815-2ost,pao815-2ost-6ost和pao815-2ost-6ost-3ost质粒;
[0087]
(2)制备重组菌株gs115/acdncm的感受态细胞,将获得的pao815-2ost,pao815-2ost-6ost和pao815-2ost-6ost-3ost质粒分别用快切酶sali线性化后整合到上述重组菌基因组中,用md平板筛选获得阳性克隆,将得到新的菌株命名为gs115/acdnc2m、gs115/acdnc26m、gs115/acdnc263m。
[0088]
实施例5:毕赤酵母工程菌发酵产肝素及肝素类似物
[0089]
将所获得重组酵母菌株gs115/acd,gs115/acdnm,gs115/acdnc2m,gs115/acdnc26m,gs115/acdnc263m在3-l发酵罐中发酵培养进行肝素的合成。首先分区划线得到单菌落,挑取单菌落接种于5ml ypd液体培养基中,在30℃220rpm条件下培养16-18h,然后按10%接种量转接至三瓶50mlypd液体培养基中,于30℃220rpm培养24h左右,然后按15%接种于含有1l发酵培养基的3-l发酵罐中,控制发酵温度为28℃,ph为5.5,通气量为4.0vvm,搅拌转速和溶氧相关联,控制溶氧在30%,搅拌转速在300-1000rpm。待发酵培养基中的甘油被消耗殆尽继续饥饿培养2-3h后,以恒速流加方式进行50%(v/v)甘油(含12ml/l ptm1)补料,补料速率为20ml
·
h-1
·
l-1
,补料结束后继续饥饿培养2h,进入甲醇诱导阶段,转速不变。含12ml
·
l-1
ptm1的甲醇用于流加诱导并且终浓度控制在18g/l,甲醇流加速率和培养基中甲醇终浓度由甲醇检测器实时在线控制。
[0090]
实施例6:使用lc-ms检测细胞中的肝素:
[0091]
(1)收集发酵结束后的菌体,使用去离子水洗涤菌体两遍后重悬菌体,采用高压匀浆破壁后离心得到胞内上清。将胞内上清置于65℃烘箱中加热沉淀部分蛋白,离心后去除沉淀,向上清中加入3倍预冷的无水乙醇沉淀肝素,搅拌均匀后离心得到沉淀。离心得到沉淀烘干后复溶于于20mm tris-hcl(ph8.0)中即为肝素样品。产物使用hiprep q hp 16/10柱纯化。柱体积(cv):20ml;流速:3ml
·
min-1
;检测波长:210nm;平衡液:超纯水;洗脱液:含1mol
·
l-1
nacl的水溶液液;洗脱梯度:0-100mmol
·
ml-1
nacl,3cv(柱体积);上样量:100mg肝素产物;分离程序:平衡-上样-清洗(冲洗样品中杂质)-洗脱-平衡,为一个循环。
[0092]
(2)取600μl肝素样品,加入5μl肝素裂解酶i和iii,置于37℃水浴锅中处理12h。将裂解后的溶液置于沸水加热10min使蛋白失活变性,离心后取上清进行lc-ms检测。
[0093]
(3)lc-ms检测使用acquity uplc beh amide色谱柱(1.7μm,2.1
×
100mm,waters,ma,usa)。洗脱液a为乙腈,洗脱液b为超纯水,使用氨水将ph值调节至10.4。所用的洗脱梯度设定如下:0-2分钟,5%b;2-3分钟,5-30%b;3-6分钟,30-60%b;6-8分钟,60%b。柱温保持在40℃,流速为0.2ml/min。在负离子模式下对m/z 100-800的质量范围进行扫描监测。肝素的二糖分子在负离子模式下质荷比应含有以下离子流:m/z:378.3,m/z:416.3,m/z:496.4,m/z:458.05,m/z:577.6。
[0094]
发酵结束后,将细胞使用高压匀浆仪破碎细胞,离心取上清使用乙醇沉淀法醇沉两次,之后使用50mm tris-hcl(ph7.4)重悬产物,使用硫酸咔唑法测得gs115/dac肝素前体产量4g/l。其余菌株产物使用lc-ms检测,结果见表3。
[0095]
表3毕赤酵母各个菌株不同位置磺酸化二糖组成
[0096][0097][0098]
实施例7:构建成prs305-kfia-t2a-kfic-t2a2-tuad及酿酒酵母s.c-acd的构建
[0099]
(1)以合成的基因tuad,kfia,kfic为模板,以引物sctuad-f/sctuad-r,sckfic-f/sckfic-r,sckfia-f/sckfia-r,分别进行pcr扩增三个基因,利用gibson组装连接到prs305载体上,构建成prs305-kfia-t2a-kfic-t2a2-tuad质粒,其中,t2a和t2a2序列设计在引物上;
[0100]
(2)制备s.cerevisiae cen.pk2-1c单倍体酿酒酵母感受态细胞,将上述获得的质粒prs305-kfia-t2a-kfic-t2a2-tuad电转化到感受态细胞中,通过亮氨酸缺陷平板筛选阳
性克隆,得到整合了基因tuad、kfia和kfic的菌株命名为s.c-acd。
[0101]
实施例8:构建成prs303-ndst1-t2a-met13、prs303-ndst1-t2a-c5 epi-p2a-met13及酿酒酵母s.c-acdnm、s.c-acdncm的构建
[0102]
(1)扩增atp磺酸化酶met13,以在酵母中优化后的基因序列ndst1,c5 epi为模板,分别以引物scndst-f/scndst-r,scc5epi-f/scc5epi-r,scmet13-f/scmet13-r进行pcr扩增两个基因,利用gibson组装依次连接到prs303载体上,分别构建成prs303-ndst1-t2a-met13、prs303-ndst1-t2a-c5 epi-p2a-met13质粒。
[0103]
(2)制备酿酒酵母s.c-dac菌株感受态,将上述质粒rs303-ndst1-t2a-met13、prs303-ndst1-t2a-c5 epi-p2a-met13线性化后分别转入s.c-dac感受态细胞中,用色氨酸缺陷平板筛选获得阳性克隆,得到新的菌株分别命名为s.c-acdnm和s.c-acdncm。
[0104]
实施例9:构建成prs304-2ost,prs304-2ost-t2a-6ost,prs304-2ost-t2a-6ost-t2a2-3ost及酿酒酵母s.c-dacmnc6,s.c-dacmnc3和s.c-dacnc263的构建
[0105]
(1)以在酵母中优化后的基因序列2-ost、6-ost、3-ost为模板,以引物sc2ost-f/sc2ost-r,sc6ost-f/sc6ost-r,sc3ost-f/sc3ost-r分别组装到酿酒酵母游离表达载体prs304上,构建成prs304-2ost,prs304-2ost-t2a-6ost,prs304-2ost-t2a-6ost-t2a2-3ost质粒。
[0106]
(2)制备酿酒酵母s.c-acdncm菌株感受态,将上述质粒prs304-2ost,prs304-2ost-t2a-6ost,prs304-2ost-t2a-6ost-t2a2-3ost线性化后分别转入感受态细胞中,色氨酸缺陷平板筛选获得阳性克隆,得到新的菌株分别命名为s.c-acdnc2m,s.c-acdnc26m,s.c-acdnc263m。
[0107]
实施例10:酿酒酵母工程菌发酵产肝素及肝素类似物
[0108]
将所获得酿酒酵母菌株s.c-acd,s.c-acdncm,s.c-acdnc2m,s.c-acdnc26m,s.c-acdnc263m在3-l发酵罐中发酵培养进行肝素及其类似物的合成。
[0109]
首先分区划线得到单菌落,挑取单菌落接种于50ml ypd液体培养基中,在30℃220rpm条件下培养16-18h至菌体od
600
达到6左右,以初始od
600
=0.4转接于新鲜的250mlypd液体培养基中,于30℃220rpm培养12h左右至菌体od
600
在12左右,然后按15%接种于含有1l发酵培养基的3-l发酵罐中,控制发酵温度为30℃,ph为6,通气量为2vvm,搅拌转速和溶氧相关联,控制溶氧在30%,搅拌转速在300-900rpm。每隔6h取样测定葡萄糖浓度,并根据葡萄糖的消耗速度及时调整葡萄糖的流加量,使葡萄糖浓度稳定在1-2g/l。发酵周期为96h。其中,调节ph的酸液为10%的磷酸,碱液为20%的氨水。
[0110]
发酵结束后,将细胞使用高压匀浆仪破碎细胞,离心取上清使用乙醇沉淀法醇沉两次,之后使用50mm tris-hcl(ph7.4)重悬产物,使用硫酸咔唑法测得s.c-acd肝素前体产量2.8g/l。根据实施例6中的方法使用lc-ms测定基因工程菌s.c-acd,s.c-acdncm,s.c-acdnc2m,s.c-acdnc26m,s.c-acdnc263m不同位置磺酸化所占比例,二糖组成如表4所示。
[0111]
表4酿酒酵母各个菌株不同位置磺酸化二糖组成
[0112]
[0113][0114][0115]
实施例11:酵母生产肝素抗凝血活性测定
[0116]
对实施例6和10中菌株gs115/acdnc263m和s.c-acdnc263m所获得的产物进行抗凝血活性测定,fxa因子和human atiii使用含有1mg/ml牛血清白蛋白(bsa)的pbs稀释至60nm和0.65pm。显色底物s-2765(对于fxa分析)和s-2238(对凝血酶测定)溶于水制备成1mg/ml原液。测试用的寡糖用pbs稀释成浓度为100nm。首先将60μl atiii和15μl寡糖溶液涡旋混匀,室温条件下孵肓2min后加入90μl fxa溶液,室温条件下孵育4min,最后分别加入30μl显色底物s-2765和s-2238。在405nm条件下测量反应混合物的吸光度,将不同的样品浓度对初始反应速率作图计算测试寡糖的ic50,结果如图6所示。抗xa/抗iia比率为0.70-2.56。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1