一种融合蛋白及其多核苷酸、碱基编辑器及其在药物制备中的应用
1.本发明属于生物技术领域,具体涉及一种融合蛋白及其多核苷酸、碱基编辑器和在制备治疗β
‑
血红蛋白病的药物中的应用。
背景技术:
2.crispr/cas9衍生的碱基编辑器可在目标基因组dna中将一个碱基对精确有效地转换为另一对碱基(c/g
→
t/a或a/t
→
g/c),而很少引起双链断裂(dsb)。碱基编辑器通常由具单链切割活性的cas9蛋白(ncas9)和对ssdna底物具有活性的胞苷或腺苷脱氨酶组成。cas9通过特定的引导rna(singleguide rna)引导与其靶dna结合,形成蛋白质
‑
rna
‑
dna三元“r环”复合物。与sgrna同义的dna链(也即非互补链,non
‑
target strand,nts)被解离形成相对游离的单链dna(single
‑
strand dna,ssdna),这为脱氨酶提供了ssdna底物。
3.传统的碱基编辑器中,胞苷或腺苷脱氨酶被直接融合到ncas9的n末端,这种融合方式造成脱氨酶对nts的编辑范围小且相对固定,使得脱氨酶只能在nts小窗口范围(称为编辑窗口)内转换碱基。例如,最广泛使用的spcas9衍生的胞嘧啶碱基编辑器之一,be3,通常催化4到8位内的碱基转化(将ngg pam计为21
‑
23)。如何进一步优化碱基编辑器以提高其编辑效率、或者扩大编辑窗口、或者提高特异性,是提高碱基编辑器效率、拓展其应用范围的关键。
技术实现要素:
4.针对现有技术中的上述不足,本发明提供一种融合蛋白及其多核苷酸、碱基编辑器及其在药物制备中的应用,本发明提供了sacas9的融合蛋白,它是将胞嘧啶脱氨酶和/或腺嘌呤脱氨酶插入到sacas9的第118~133位,和/或第685~702位氨基酸插入位点之间,具体可以是第125和126位氨基酸之间或者第693和694位氨基酸之间得到的。
5.本发明利用sacas9/sgrna/dna复合物的晶体结构设计了一系列碱基编辑器,其中将胞嘧啶或腺苷脱氨酶镶嵌在sacas9n内部的不同位置。对所得碱基编辑器的性能进行表征后发现,它们具有不同的编辑范围,且相较于n端融合胞嘧啶或腺苷脱氨酶的碱基编辑器,125位和693位融合的碱基编辑器在碱基编辑的效果上各有优势。上述内部镶嵌的sacas9碱基编辑器极大地改善了目标范围,为特定目的位点编辑方案的优化提供了更多选择。
6.为实现上述目的,本发明解决其技术问题所采用的技术方案是:
7.一种融合蛋白,该融合蛋白包括核酸酶,以及插入在其第118~133位,和/或第685~702位氨基酸插入位点之间的脱氨酶。
8.进一步地,该融合蛋白核酸酶,以及插入在其第125和126位,和/或插入在第693和694位氨基酸之间的脱氨酶。
9.进一步地,核酸酶为sacas9蛋白,或与其具有至少80%同源性的蛋白。
10.进一步地,sacas9蛋白含有d10a突变,其氨基酸序列如seq id no.1所示,所述sacas9蛋白的插入位点可以同时插入不同种类的脱氨酶。
11.进一步地,脱氨酶为胞嘧啶脱氨酶和腺嘌呤脱氨酶中的至少一种。
12.进一步地,胞嘧啶脱氨酶含有y130f突变,其氨基酸序列如seq di no.2所示。
13.进一步地,腺嘌呤脱氨酶为tada
‑
8e,其氨基酸序列如seq di no.3所示。
14.进一步地,脱氨酶通过接头与sacas9蛋白连接,所述接头为xten。
15.进一步地,该融合蛋白融合了1个胞嘧啶脱氨酶,且将胞嘧啶脱氨酶插入到所述sacas9的第125和126位氨基酸之间或者第693和694位氨基酸之间。
16.进一步地,该融合蛋白融合了1个腺嘌呤脱氨酶,且将腺嘌呤脱氨酶插入到所述sacas9的第125和126位氨基酸之间或者第693和694位氨基酸之间。
17.进一步地,该融合蛋白融合了1个胞嘧啶脱氨酶和1个腺嘌呤脱氨酶,且将胞嘧啶脱氨酶和腺嘌呤脱氨酶插入到所述sacas9的第693和694位氨基酸之间。
18.进一步地,腺嘌呤脱氨酶融合于胞嘧啶脱氨酶的n端。
19.进一步地,融合蛋白还包括嘧啶糖苷酶抑制蛋白和核定位信号,嘧啶糖苷酶抑制蛋白融合于sacas9蛋白的c端;核定位信号融合于融合蛋白的c端。
20.上述融合蛋白的氨基酸序列如seq id no.4、seq id no.5、seq id no.6中任意一项所示。
21.一种多核苷酸,多核苷酸能编码上述融合蛋白。
22.一种向导rna/核酸酶复合物,复合物包括至少一种向导rna以及上述融合蛋白;所述复合物能够识别、结合靶序列的全部或部分并任选地使靶序列的全部或部分产生切口、解旋或切割靶序列的全部或部分。
23.一种载体,其包括上述多核苷酸。
24.一种宿主细胞,其包括上述多核苷酸,或载体,并能表达上述融合蛋白。
[0025]“宿主细胞”通常是指生物学细胞。细胞可以是活的生物的基本结构、功能和/或生物学单元。细胞可源自具有一个或多个细胞的任何生物。宿主细胞的实例包括但不限于:原核细胞、真核细胞、细菌细胞、古细菌细胞、单细胞真核生物的细胞、原生动物细胞、来自植物的细胞、动物细胞、哺乳动物(例如,猪、牛、山羊、绵羊、啮齿动物、大鼠、小鼠、非人灵长类动物、人等)的细胞。此外,细胞可以是干细胞或祖细胞。
[0026]
一种碱基编辑器,碱基编辑器包括上述融合蛋白或多核苷酸,以及载体质粒。
[0027]
上述融合蛋白、多核苷酸或碱基编辑器在药物筛选及基因修饰中的应用。
[0028]
上述融合蛋白、多核苷酸、复合物、载体或碱基编辑器在制备基因治疗药物或细胞治疗药物中的应用。
[0029]
一种用于修饰宿主细胞基因组的方法,该方法包括:向包含有至少一个待修饰靶序列的宿主细胞提供至少一种向导rna和上述融合蛋白或碱基编辑器;所述向导rna和融合蛋白或碱基编辑器能够形成复合物;所述复合物能够识别、结合至少一个靶序列的全部或部分并任选地使所述至少一个靶序列的全部或部分产生切口、解旋或切割所述至少一个靶序列的全部或部分。
[0030]
一种药物组合物,包括上述多核苷酸、复合物、载体或碱基编辑器,以及药学上可接受的辅助成分。
[0031]
上述融合蛋白、多核苷酸、复合物或碱基编辑器在制备治疗β
‑
血红蛋白病的药物中的应用。
[0032]
一种用于治疗β
‑
血红蛋白病的药物,该药物包括靶向bcl11a基因+58位红系增强子中tgn 7
‑
9wgatar e
‑
box/gata结合基序的sgrna,以及上述融合蛋白或n端融合脱氨酶的碱基编辑器;
[0033]
sgrna间隔序列如seq id no.7所示;或在seq id no.7所示序列的基础上增加、删减或替换一个或多个碱基后,但同样具有相同功能的序列。
[0034]
进一步地,还包含引导sacas9识别目的基因的pam序列,其具体序列为aagggt。
[0035]
进一步地,脱氨酶为胞嘧啶脱氨酶和腺嘌呤脱氨酶中的至少一种。
[0036]
本发明实施案例中使用的sacas9为d10a突变的sacas9,氨基酸序列如seq id no.1所示。a3a为y130f突变的a3a,氨基酸序列如seq id no.2所示。使用的tada为tada
‑
8e,氨基酸序列如seq id no.3所示,接头为xten。
[0037]
基于sacas9的cbe融合蛋白:sacbe
‑
125的氨基酸序列如seq id no.4所示;sacbe
‑
693的氨基酸序列如seq id no.5所示。
[0038]
基于sacas9的cabe融合蛋白:sa
‑
cabe
‑
693的氨基酸序列如seq id no.6所示。
[0039]
此外,还可设计更多的融合蛋白,如sacbe
‑
269、sacbe
‑
593、n端融合胞嘧啶脱氨酶的编辑器sa
‑
cbe
‑
n、n端融合的双碱基编辑器sa
‑
cabe
‑
n、saabe
‑
125、saabe
‑
269、saabe
‑
593、saabe
‑
693、n端融合腺嘌呤脱氨酶的编辑器,即sa
‑
abe
‑
n等。
[0040]
本发明的有益效果:
[0041]
1、通过将胞嘧啶脱氨酶嵌入sacas9内部,本发明获得了一系列具有不同窗口范围的碱基编辑器。与n端融合的碱基编辑工具(sa
‑
cbe
‑
n)相比,sacbe
‑
125将编辑窗口由原来的3
‑
14缩小至8
‑
15,sacbe
‑
693将拓宽至3
‑
18;并且具有更低的dna脱靶编辑。
[0042]
2、对pku小鼠模型突变位点的体外验证,证明了本发明中具有狭窄窗口的sacbe
‑
125为苯丙酮尿症(pku)中pah突变热点h263y中c
→
t的突变提供了更加有效而精确的碱基编辑方案。并通过优化sgrna长度,进一步提高了功能性编辑的比例。
[0043]
3、通过将两种碱基脱氨酶嵌入sacas9内部693aa位置,开发了一种双功能的碱基编辑器sa
‑
cabe
‑
693。与单个碱基编辑工具相比,sa
‑
cabe
‑
693可纠正更多的突变组合,即对a&c同时编辑。与n端融合的双碱基编辑工具相比,其展现出c
‑
to
‑
t窗口进一步的拓宽,以及在某些靶点稍微提高了a
→
g的编辑。
[0044]
4、通过对bcl11a基因+58位红系增强子的编辑,证明了本发明开发的双碱基编辑工具,sa
‑
cabe
‑
693比传统的双碱基编辑工具更有效的引入治疗β
‑
血红蛋白病的突变。因此,sa
‑
cabe
‑
693不仅是一个单碱基编辑工具,也是一个两种碱基同时编辑的碱基编辑器。对于基因治疗而言,这种特性,为基因组多样化的需要提供了更多的选择。
附图说明
[0045]
图1为实施例1中sacas9域内嵌合a3a的sa
‑
cbes构建及活性验证图;
[0046]
图2为实施例2中sacas9域内嵌合tada
‑
8e的sa
‑
abes构建及活性验证图;
[0047]
图3为实施例3的脱靶检测结果图;
[0048]
图4为实施例4中sacbe
‑
125对pku靶点的编辑及优化图;
[0049]
图5为实施例5中sa
‑
cabe
‑
693设计及a&c的编辑窗口图;
[0050]
图6为实施例6中sa
‑
cabe
‑
693靶向bcl11a基因的+58位增强子的sgrna设计及结果图。
具体实施方式
[0051]
下面对本发明的具体实施方式进行描述,以便于本技术领域的技术人员理解本发明,但应该清楚,本发明不限于具体实施方式的范围,对本技术领域的普通技术人员来讲,只要各种变化在所附的权利要求限定和确定的本发明的精神和范围内,这些变化是显而易见的,一切利用本发明构思的发明创造均在保护之列。
[0052]
实施例1 sacas9域内嵌合a3a的sa
‑
cbes构建及活性验证
[0053]
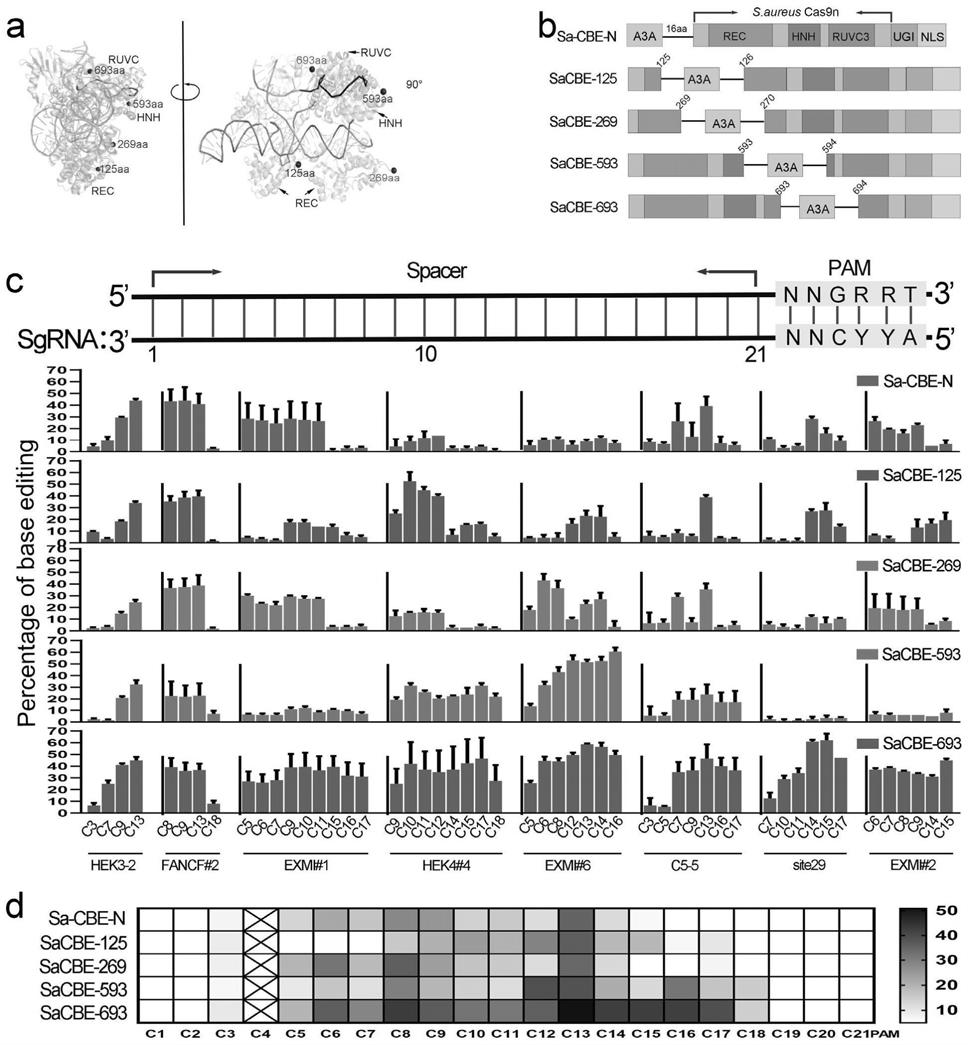
1、sacas9域内嵌入脱氨酶的cbe编辑器的设计与构建
[0054]
通过可视化分析sacas9/sgrna/dna复合物的晶体结构(其参考的pdb编号为:5xaw),在sacas9的rec结构域125aa、269aa位置和hnh结构域593aa位置以及ruvc结构域中693aa的位置设计插入位点,其相对于nts的位置如图1a所示,分别构建了sacbe
‑
125、sacbe
‑
269、sacbe
‑
593、sacbe
‑
693等内部嵌入脱氨酶的sa
‑
cbes编辑器,构建方案如图1b所示,xten为连接脱氨酶(a3a)与sacas9之间的接头序列,ugi为尿嘧啶糖苷酶抑制蛋白,nls为核定位信号。
[0055]
2、sacas9域内嵌入脱氨酶的cbe编辑器的活性窗口
[0056]
在8个内源性靶点中转染上述碱基编辑器,发现他们与sacas9的n端融合脱氨酶的编辑器(sa
‑
cbe
‑
n)相比,具有不同的编辑范围,如图1c所示。在大部分靶点中,sacbe
‑
125编辑窗口明显的有近pam端偏移并缩小趋势,sacbe
‑
693编辑窗口有拓宽倾向并且在所有靶点中编辑效率都比较高,sacbe
‑
593编辑窗口同样有拓宽倾向但在某些靶点上效率较低,sacbe
‑
269编辑窗口则没有明显变化。
[0057]
为了更直观具体的分析其编辑窗口,本发明汇总了所有sgrna上的编辑效率,总结了这些编辑器的窗口特点,如图1d所示。首先,sacbe
‑
693编辑效率最高,与sa
‑
cbe
‑
n相比,将窗口由原来的3
‑
14拓宽至3
‑
18,扩宽了约3~4位碱基。其次,sacbe
‑
125编辑窗口为8
‑
15,其编辑窗口明显缩小并且在c12和c13位的编辑有集中的趋势。此外,sacbe
‑
593虽然同样拓宽了编辑窗口(3
‑
18),但其编辑活性在某些靶点上很低,而sacbe
‑
269的编辑窗口(3
‑
14)未发生明显的变化。
[0058]
实施例2 sacas9域内嵌入腺嘌呤脱氨酶的abe编辑器的活性验证
[0059]
以上将胞嘧啶脱氨酶a3a嵌入sacas9,获得了一系列不同编辑窗口的sa
‑
cbes。但对于abe系统,尚未清楚是否具有同样的窗口特性。本发明选用tada
‑
8e嵌入sacas9同样的125aa、269aa、593aa、693aa位置,验证sa
‑
abe系统的窗口特性。
[0060]
如图2a所示,构建了saabe
‑
125、saabe
‑
269、saabe
‑
593、saabe
‑
693。接下来,在6个内源性靶点测试了编辑活性。如图2b所示,发现与n端融合的sa
‑
abe
‑
n编辑器相比,saabe
‑
125在大部分靶点(runx#14、exmi#6、site1、site6)上编辑更少的c或者近pam端的偏移,但在site11靶点两者窗口显示一致的范围。此前在cbe上验证的窗口拓宽的编辑器,sacbe
‑
693和sacbe
‑
593在abe系统中均未明显的扩宽编辑范围,除了在runx1#14、fancf#2上显示出近pam端的1
‑
2位碱基的扩宽。saabe
‑
269仍然与sa
‑
abe
‑
n显示出一致的窗口范围。因此,
尽管sacas9域内嵌合的abe编辑器与前面cbe系统有相似的窗口特性。即,与sa
‑
abe
‑
n相比,sa
‑
abe
‑
125编辑窗口更窄,saabe
‑
593、saabe
‑
693在某些靶点拓宽了近pam端1
‑
2位碱基的编辑,sa
‑
abe
‑
269则显示出一致的编辑窗口。但总体而言,sacas9域内嵌合脱氨酶的abe系统不如在cbe系统那样十分明显的扩大编辑范围。
[0061]
实施例3 sacas9域内嵌入脱氨酶的cbe编辑器的脱靶检测
[0062]
脱靶效应的测定是对一个新的碱基编辑工具的安全性评价的重要指标。r
‑
人工环正交法是一种测定非sgrna序列依赖性dna脱靶编辑的稳定而可靠的方法。但是,该技术中的已知人工r环结构由dsacas9和sacas9sgrna组成,用来测定spcas9非序列依赖性的脱靶编辑。为了测定sacas9派生的编辑器的非序列依赖性的脱靶编辑,本发明将该人工r环结构替换为dspcas9和spcas9 sgrna,用以测定sacas9派生的编辑器的dna脱靶编辑(图3a)。
[0063]
如图3b所示,在内源性靶点hek4中评估了上述编辑器的总脱靶编辑,即靶点上所有c的脱靶编辑总和的平均值。发现sa
‑
cbe
‑
n相比,在c3和c5位的脱靶效率为30%
‑
40%左右;而本发明域内嵌入的编辑器虽然在c5位显示出30%左右脱靶编辑,但大大降低了在c3位的脱靶编辑。可见,本发明设计的新型碱基编辑器的总脱靶编辑更低。
[0064]
实施例4 sacbe
‑
125编辑器应用于pku
[0065]
具有较窄窗口的sacbe
‑
125更有利于由单核苷酸变异引起的疾病位点的纠正,因此本实验以sacbe
‑
125为例验证本发明编辑器在基因治疗方面的潜力。苯丙酮尿症(pku)中pah突变热点h263y中c
→
t的突变,是已知的在小鼠模型中可通过碱基编辑恢复表型及血苯丙氨酸水平的非常有前景的治疗方案。本实验分析了pku位点中的c替换为t后,其氨基酸的编码情况,如图4a所示。c828的编辑会导致终止密码子(无义突变),c836的编辑会引起h
→
y的氨基酸突变(错义突变),其余的c对编码无影响。发明人前期研究已经证明,该错义突变不会影响pah酶的活性。
[0066]
为了比较sacbe
‑
125和sa
‑
cbe
‑
n在pku位点的编辑情况,我们首先构建了含有pah基因f263s突变的hek293细胞株。如图4b,转染细胞后发现,两者对c835的编辑一致(sa
‑
cbe和sa
‑
cbe
‑
125分别为33%和34%),sa
‑
cbe
‑
n对非目标c828有10%左右的编辑,而sacbe
‑
125则几乎不编辑c828。因此,与sa
‑
cbe
‑
n相比,我们的方案对pku位点的编辑不会导致终止密码子的产生,而集中编辑目标c835,从而更有效的引入治疗pku的pah的有益突变
[0067]
为了对pku靶点的编辑结果进一步优化,本实验构建了含18bp、19bp、20bp、21bp间隔序列(spacer)长度的pku
‑
sgrna,测试sgrna间隔序列(spacer)长度的改变对编辑器编辑窗口或编辑效率的影响。结果如图4c所示:间隔序列(spacer)长度的改变明显影响了sacbe
‑
125编辑效率,而编辑窗口影响较小,随着间隔序列(spacer)的缩短,目标c835编辑进一步提高,而仍不编辑非目标c828,从而提高了功能性编辑的比例;而对于sa
‑
cbe
‑
n,间隔序列(spacer)长度的改变既显著影响了编辑效率,也改变了其编辑窗口,对于18bp、19bppku
‑
sgrna而言,反而提高了非目标c828的编辑,从而降低功能性编辑的比例。可见,通过优化sgrna间隔序列(spacer)的长度为18bp、19bp,能够提高sacbe
‑
125对pku位点功能性编辑的比例。
[0068]
以上结果表明,本发明编辑器能够适用于窗口范围内有多个碱基c,即除了目标c,还有非目标c的复杂位点的编辑。
[0069]
实施例5 a&c双碱基编辑器sa
‑
cabe
‑
693的构建及活性验证
[0070]
前述实施例表明,本发明开发的sacbe
‑
693编辑器极大拓宽了编辑窗口,即可以编辑窗口内更多的碱基c。但是,该cbe系统也只能编辑单一的碱基类型,即对胞嘧啶进行脱氨。为了进一步扩宽编辑范围,本发明进一步优化该编辑器以编辑更多的碱基类型,实现同一间隔序列(spacer)内不同的碱基类型的同时编辑。
[0071]
因此,将两种脱氨酶tada
‑
8e和a3a嵌入该sacas9的693aa位置,构建了sa
‑
cabe
‑
693,如图5a。本实验进一步比较了sacas9域内嵌入脱氨酶的双碱基编辑方案(sa
‑
cabe
‑
693)和传统的n端融合的双碱基编辑方案(sa
‑
cabe
‑
n)。如图5b所示,在hek4
‑
4、c5
‑
5等内源性靶点中:与sa
‑
cabe
‑
n相比,本发明sa
‑
cabe
‑
693具有更广的c
→
t编辑范围。除了在exm1
‑
2靶点中,sa
‑
cabe
‑
693略微提高了对a
→
g编辑比例,而对a
→
g的编辑几乎在所有靶点中都保持一致。
[0072]
以上结果表明,本发明sa
‑
cabe
‑
693相比传统的n端融合双碱基编辑方案(sa
‑
cabe
‑
n),具有更广的c
→
t编辑范围,并且在某些靶点上略微提高了a
→
g转换比例,可产生更多突变组合。
[0073]
实施例6本发明sa
‑
cabe
‑
693靶向blc11a基因的+58位增强子能更有效的引入治疗β
‑
血红蛋白病的突变
[0074]
本实施例进一步验证了sa
‑
cabe
‑
693在基因治疗方面的潜力。在β
‑
血红蛋白病人中,抑制bcl11a的表达是已知的治疗该疾病的非常有前景的治疗方法。突变+58位bcl11a红系增强子上的tgn 7
‑
9wgatar e
‑
box/gata结合基序会导致bcl11a表达下降,从而诱导胎儿血红蛋白上调。
[0075]
首先,本发明设计bcl11a sgrna以靶向tgn 7
‑
9wgatar e
‑
box/gata结合基序,如图6a。接下来,比较了sa
‑
cabe
‑
693和sa
‑
cabe
‑
n对bcl11a sgrna靶向位点的编辑能力。结果如图6b所示,图示为sa
‑
cabe
‑
693和sa
‑
cabe
‑
n转染hek293t细胞72小时后在bcl11a基因+58位增强子处碱基编辑效率的对比,其中横坐标为不同as或cs的靶点位中的位置,纵坐标为a到g或c到t编辑效率,数据和误差线代表三次独立实验的平均值和标准差。
[0076]
从图6b可以看出,与sa
‑
cabe
‑
n相比,本发明sa
‑
cabe
‑
693对c
→
t具有更广的编辑窗口:sa
‑
cabe
‑
693能高效编辑到c17,而sa
‑
cabe
‑
n对c17几乎无编辑效果。另外,两者对a
→
g编辑显示出一致结果。
[0077]
以上结果表明,与n端融合脱氨酶的sa
‑
cabe
‑
n相比,本发明的方案靶向blc11a基因+58位增强子能更有效的引入治疗β
‑
血红蛋白病的突变。
[0078]
需要说明的是,本说明书中描述的具体特征、结构、材料或者特点可以在任一个或多个实施例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例以及不同实施例的特征进行结合和组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1