异源染色体定向转移的方法
1.本发明属于基因工程技术领域,具体地说,涉及一种异源染色体定向转移的方法。
背景技术:
2.转基因技术是指将外源dna转入动物基因组并产生可遗传修饰的技术,通过该技术产生的稳定携带外源dna的动物即为转基因动物。当外源dna包含人类基因组信息时,获得的转基因动物即称为人源化动物。随着基因工程技术的不断发展,人源化动物模型已经逐步实现了从个别碱基或氨基酸到庞大基因簇乃至染色体的人源化。迄今为止,已获得多种可以表达人源基因的人源化动物,这些动物模型被广泛应用于基因功能的研究、人类疾病模型的构建、治疗性抗体的开发、药理药效的测试等方面,强有力地推动了对人类疾病和健康的深入研究(devoy et al.,2011; moriwaki et al.,2020;scheer and wilson,2016;zhu et al.,2019)。
3.在这些人源化动物模型中,人源化小鼠模型已成为研究人类疾病越来越重要的工具,主要的应用包括免疫球蛋白人源化小鼠模型和唐氏综合症小鼠模型。
4.目前较为成熟的免疫球蛋白人源化小鼠模型有humab小鼠(lonberg et al., 1994)、xeno小鼠(green et al.,1994)、tc小鼠(tomizuka et al.,2000)、velocimmune 小鼠及ky小鼠(lee et al.,2014;macdonald et al.,2014;murphy et al.,2014)。相较于鼠源抗体、人鼠嵌合抗体及人源化抗体,由这些免疫球蛋白人源化小鼠模型产生的全人源抗体免疫原性低且临床应用转化成功率高(carter,2006;hwang and foote,2005; lonberg,2005),为筛选获得更多治疗性抗体提供了可能。
5.唐氏综合症即21三体综合症,又称先天愚型,是由于人21号染色体异常导致的疾病,新生儿中发病率为1/800(driscoll and gross,2009),60%在胎儿时期流产,存活患儿存在面容特殊、智力低下、生长发育畸形的症状(korenberg et al.,1994)。因唐氏综合症的高致死率和强发育缺陷,构建能够模拟人类疾病的动物模型用于研究疾病发病原因并探究疾病治疗方法势在必行。
6.ts65dn(davisson et al.,1990)和ts1cje(sago et al.,1998)均为唐氏小鼠模型,已广泛应用于唐氏综合症发病机制和药物研究,是通过辐射诱导或从自发染色体异常的小鼠中获得的唐氏模型。tc1模型则是通过辐照微细胞介导的染色体转移法向小鼠胚胎干细胞中转入人源21号染色体获得的,转入的人源染色体游离在小鼠基因组外,但在小鼠体细胞中随机丢失概率为25%(hernandez et al.,1999)。tcmac21模型则是将人源21号染色体长臂拼接至小鼠着丝粒,构建成在小鼠细胞中更稳定的人工染色体,再通过微细胞介导的染色体转移法转入小鼠胚胎干细胞,该模型未出现体细胞外源染色体丢失的现象(kazuki et al.,2020)。
7.大量研究结果表明,基因组人源化小鼠中人源dna信息在小鼠转录体系中能够正确地转录表达,但在实现mb级别基因组人源化的过程中,转基因载体的承载量和基因转移技术受到了极大的挑战(br
ü
ggemann et al.,1989)。目前常用的基因组人源化技术手段包
括:重组酵母人工染色体(yac)介导法、细菌人工染色体(bac)介导连续同源重组法、重组酶介导的基因组置换法(rmgr)和微细胞介导的染色体转移法(mmct)。
8.yac外源基因的承载量一般为1-2mb,但其进入受体细胞后是以随机整合的形式整合入受体基因组的,整合位置不仅对小鼠内源基因有着不能提前预测的影响,也可能影响人源基因的表达情况,且yac构建过程中容易发生载体自身重组事件,其转入外源基因的大小及类别均受到很大的限制(bellis et al.,1991)。
9.mac对外源基因的承载量符合超大dna的要求,若要获得包含目标人源dna的 mac,需要在目标基因附近进行多次loxp位点的敲入,通过多次cre/loxp重组最终获得目标mac。常规的基因转移技术不能实现mac向受体细胞的转入,最常用的mac 转移方法是借助微细胞与受体细胞的融合法也就是mmct技术,但多数人源细胞并不能有效产生微细胞。包含mac微细胞的产生一般都要借助人源细胞与a9细胞或 cho细胞融合产生的杂交细胞,mmct过程涉及一次细胞-细胞融合和一次微细胞
‑ꢀ
细胞融合实验,该过程效率通常为10-7-10-4
,且获得的转基因动物中游离于受体基因组的mac稳定性较差,在人源化小鼠部分组织和器官存在丢失的现象(kazuki et al., 2004)。
10.bac外源基因的承载量只有300kb,将其与同源重组技术、cre/loxp重组系统或 piggybac转座子系统结合可以实现人源基因向特定位点的多次转入,该技术需要进行多次嵌合体及纯合体的制备,非常耗时(lee et al.,2014;macdonald et al.,2014)。
11.在人鼠异种细胞融合后获得的杂交细胞中人源染色体大量丢失而鼠源染色体倾向于全部保留(weiss and green,1967)。已有课题组通过mmct实验手段将天然人源染色体转移至小鼠胚胎干细胞中,获得免疫球蛋白人源化以及唐氏综合症模型小鼠,但不同人源染色体在小鼠细胞中稳定性不同,存在转染色体小鼠部分组织器官丢失人源染色体的现象。
12.现有的基因组人源化技术的操作过程费时费力且效率极低,因此,简化超大人源转基因载体构建过程、提高超大dna转移效率并保证人源基因转入小鼠细胞和组织后的稳定性,对获得更多基因组人源化动物模型进而筛选更多人类疾病治疗性药物、揭示人类疾病致病机理、研究非编码区功能均具有重要的意义。
技术实现要素:
13.本发明的目的是提供一种异源染色体定向转移的方法。
14.为了实现本发明目的,第一方面,本发明提供一种介导异源染色体定向转移的重组易位筛选系统,包括受体细胞基因编辑载体和供体细胞基因编辑载体。
15.其中,所述受体细胞基因编辑载体包含靶向受体细胞染色体近端粒位置的基因编辑器1和donor dna 1;所述donor dna 1由以下元件组成:启动子-5'抗药性基因
‑ꢀ
包含loxp序列的功能性内含子。
16.所述供体细胞基因编辑载体包含靶向供体细胞染色体近着丝粒位置的基因编辑器2和donor dna 2;所述donor dna 2由以下元件组成:包含loxp序列的功能性内含子-3'抗药性基因-polya序列。
17.所述5'抗药性基因和3'抗药性基因是将完整的抗药性基因人为拆分成两部分,拆分后的5'抗药性基因和3'抗药性基因可在cre重组酶的作用下发生cre/loxp位点特异性重
组,从而回复抗药功能。
18.进一步地,抗药性基因被拆分的位置,遵循rna剪接原则并参考剪接位点附近的保守序列信息,选择碱基序列为aagg或cagg的位点。
19.rna剪接是指dna在rna聚合酶的存在下,先转录为前信使rna,剪切去除内含子并将外显子连接进而转变为成熟mrna的过程。位于内含子5'端的剪接供体位点 (sd)、位于内含子3'端的剪接受体位点(sa)以及位于内含子3'端附近的分支位点是 rna剪接体识别并发挥功能的基本元件。真核生物内含子5'端序列以gt开始,3'端以 ag结尾,外显子靠近sd的序列多数为a/cag(约60%),而靠近sa的序列多数为g(60%)。本发明中抗药性基因的拆分位置是利用相关保守序列以及该碱基在真核生物中的出现频率确定的。
20.所述抗药性基因为neo或puro,也可以选择其它抗药性基因。
21.所述功能性内含子可以是sv40lt内含子,序列如seq id no:1所示,其是经序列优化改造后的sv40lt内含子。
22.优选地,所述启动子为polⅱ启动子,也可以使用常见的其它通用型启动子。
23.优选地,所述基因编辑器是基于crispr-cas9技术的打靶载体,基因编辑器1包含靶向受体细胞染色体近端粒位置的sgrna,基因编辑器2包含靶向供体细胞染色体近着丝粒位置的sgrna。
24.本发明中的受体细胞、供体细胞可以是来自不同物种的细胞。
25.优选地,所述受体细胞来自小鼠或猪,所述供体细胞来自人。
26.更优选地,所述受体细胞、供体细胞为包含诱导多能性干细胞在内的相应物种来源的干细胞系。
27.本发明中,loxp序列的参考序列为5'-ataacttcgtatagcatacattatacgaa gttat-3';cre重组酶在ncbi上的参考序列编号为2777477。
28.理论上,本发明提供的染色体定向转移方法能够完成mbp级别的染色体转移如整条染色体臂,所以供体染色体上外源抗药性基因的插入位置应尽可能靠近着丝粒位置,以保证整条染色体臂的完整转移。另外,为了保证受体染色体的完整性,外源抗药性基因的插入位置应尽可能靠近受体染色体的端粒位置。
29.第二方面,本发明提供一种异源染色体定向转移的方法,包括以下步骤:
30.1)将受体细胞基因编辑载体导入受体细胞中,得到细胞i;
31.2)将供体细胞基因编辑载体导入供体细胞中,得到细胞ii;
32.3)将细胞i与细胞ii融合,实现异源染色体的定向转移(从供体向受体的转移)。
33.优选地,细胞融合的方法为电脉冲介导的物理融合。
34.优化条件为:交流参数80vrms-30s,支流参数1250v-30μs。融合起始细胞总量约6
×
108个。
35.更优选地,在进行细胞融合前,对供体细胞进行钴源照射。
36.钴源照射平均剂量为10gy/分钟,供体人诱导多能性干细胞的最优钴源照射剂量为120gy(照射12分钟,针对受体小鼠受精卵)和120-180gy(照射12-18分钟,针对受体猪卵母细胞),供体a9h14细胞的最优钴源照射剂量为60gy(照射6分钟,针对受体小鼠受精卵或猪卵母细胞)。
37.第三方面,本发明提供所述介导异源染色体定向转移的重组易位筛选系统或所述
异源染色体定向转移的方法在基因功能研究、人类疾病模型构建、治疗性抗体开发及药理药效测试等方面中的应用。
38.借由上述技术方案,本发明至少具有下列优点及有益效果:
39.(一)本发明提供的异源染色体定向转移的方法是采用重组易位筛选系统,将完整的抗药性基因人为拆分成两部分,并分别定点插入至需发生转移的目标染色体上,拆分后的5'抗药性基因和3'抗药性基因可在cre重组酶的作用下发生cre/loxp位点特异性重组,从而回复抗药功能,含有重组染色体的细胞即具有抗药性,易通过相应药物将成功发生染色体定向转移的阳性细胞筛选出来。
40.(二)本发明利用crispr-cas9基因编辑技术实现重组易位筛选系统的定点插入,相比于传统的同源重组介导的基因敲入,crispr/cas9技术具有sgrna设计简单,基因敲入效率高等优势。理论上可利用规模化的crispr/cas9技术配合本发明提供的染色体定向转移方法,进行全基因范围内的染色体操作。
41.(三)本发明提供的异源染色体定向转移技术能够用于21三体综合症动物模型构建、人源化抗体的制备、t细胞受体(tcr)的人源化及主要组织相容性复合体 (mhc)的人源化等,有助于人类疾病模型构建、治疗性抗体开发及药理药效测试等方面的研究。
42.(四)本发明提供的异源染色体定向转移技术也适用于除小鼠和人外其他物种同源或异源染色体的定向转移,可广泛应用于动物模型构建及基因功能研究等。如合成生物学中所需的哺乳动物细胞染色体转移、利用基因信息对古生物进行恢复以及将蝙蝠细胞染色体转移至其他物种,探究调控其寿命及抗病毒的基因。
43.(五)本发明提供的异源染色体定向转移技术,是利用电脉冲介导的物理融合实现的,融合后的细胞中,除成功定向转移至受体染色体的供体染色体片段,其他供体染色体会发生自然丢失,以保证融合细胞的核型正常。
44.(五)本发明提供的异源染色体定向转移技术,是利用电脉冲介导的物理融合实现的,用于融合的供体与受体细胞均为相应物种来源的干细胞系,以保证发生染色体定向转移后的融合细胞可以用于动物模型的制备。
45.(六)本发明提供的异源染色体定向转移技术,是利用电脉冲介导的物理融合实现的,且在融合前对供体干细胞进行了钴源照射处理,可保证在融合后的细胞中,除成功定向转移至受体染色体的供体染色体片段,其他供体染色体会发生自然丢失,以保证融合细胞的核型正常。
附图说明
46.图1为本发明较佳实施例中重组易位筛选t-puro系统介导hek293t细胞中5号和6 号染色体易位的示意图,a为人源5号和6号染色体的外源dna插入位置及外源dna 片段示意图,b为在hek293t中表达cre重组酶后发生cre/loxp重组的示意图,重组后在染色体上形成t-puro元件并实现了cd74-ros1基因融合。
47.图2为本发明较佳实施例中cd74-ros1融合基因的dna水平检测结果,对照组分别为hek293t-cd74单克隆(cd47-ct45)、hek293t-ros1单克隆(ros1-ct46),hek293t-cre单克隆(cre),hek293t细胞(293t),水;实验组为hek293tcd74-ros1单克隆(ct45-ct46-cre)。检测引物为zlj822/zlj823,pcr产物大小为 549bp(a),测序结果(b)也显示cd74-ros1融合
基因的形成。
48.图3为本发明较佳实施例中细胞电融合直流电压对细胞融合的影响。各组融合直流参数依次为500v-30μs、500v-60μs、750v-30μs、750v-60μs、1000v-30μs、1000 v-60μs、1250v-30μs、1250v-60μs、1500v-30μs、1500v-60μs,a中流式分析结果中红绿双荧光阳性细胞占比依次为0.40%、0.38%、083%、0.98%、1.40%、2.65%、 5.44%、5.26%、5.68%、5.52%。b中横坐标为融合直流参数,纵坐标为电融合效率(%)或红绿荧光双阳性细胞占比(%)。黄色折线代表各融合直流参数条件下三次独立电融合实验流式分析结果中红绿荧光双阳性细胞占比,蓝色折线代表利用计算公式“双标记细胞融合效率=红绿双阳细胞数量/红绿细胞中较小的细胞数量”计算出的细胞电融合效率,依次为1.11%、1.10%、2.40%、2.94%、4.39%、8.41%、17.49%、 16.86%、19.45%、17.58%。
49.图4为本发明较佳实施例中细胞电融合交流电压对细胞融合的影响。各组融合直流参数依次为30vrms-60s、60vrms-30s、60vrms-60s、80vrms-30s、80vrms-60s、 80vrms-60s,a中流式分析结果中红绿荧光双阳性细胞占比依次为2.11%、1.88%、 2.27%、3.57%、4.17%、6.35%。b中横坐标为融合交流参数,纵坐标为电融合效率(%) 或荧光双阳性细胞占比(%)。纵坐标为电融合效率(%)或红绿荧光双阳性细胞占比 (%)。黄色折线代表各融合直流参数条件下三次独立电融合实验流式分析结果中红绿荧光双阳性细胞占比,蓝色折线代表利用计算公式“双标记细胞融合效率=红绿双阳细胞数量/红绿细胞中较小的细胞数量”计算出的细胞电融合效率,依次为2.11%、 1.88%、2.27%、3.57%、4.17%、6.35%。
50.图5为本发明较佳实施例中细胞总量和融合前静置时间对融合效率的影响。a表示电融合起始细胞量为6
×
106融合静置分别为时间0分钟、3分钟、5分钟时,融合后单核细胞、双核细胞、多核细胞在每个实验组中数量;b表示电融合起始细胞量为6
×
107融合静置分别为时间0分钟、3分钟、5分钟时,融合后单核细胞、双核细胞、多核细胞在每个实验组中数量;c表示电融合起始细胞量为6
×
108融合静置分别为时间0分钟、3分钟、5分钟时,融合后单核细胞、双核细胞、多核细胞在每个实验组中数量。图中白色表示单核细胞,黄色代表双核细胞,灰色代表多核细胞。
51.图6为本发明较佳实施例中小鼠胚胎干细胞与人源诱导多能性干细胞融合细胞内染色体重组易位示意图。a为小鼠10号染色体及人源21号染色体的外源dna插入位置及外源dna片段示意图,b为在hek293t中表达cre重组酶后发生cre/loxp重组的示意图,重组后在染色体上形成t-puro元件并实现了染色体的易位重组。
52.图7为本发明较佳实施例中本发明较佳实施例中具有puromycin抗药性的融合单克隆细胞系的荧光表达情况,观察日期为培养的第17天和第23天,可同时观察到红绿荧光,比例尺为500μm。
53.图8为融合细胞单克隆重组易位dna水平检测结果。对融合单克隆细胞进行 t-puro pcr检测,pcr检测引物为zlj850/zlj851,目标条带大小为526bp。
54.图9为本发明较佳实施例中具有puromycin抗药性的融合单克隆细胞系的荧光原位杂交结果。红色荧光为人源cot-1 dna阳性,紫色荧光信号为dapi染色的中期染色体dna,比例尺为20μm。
具体实施方式
55.本发明的目的是提供一种染色体定向转移的技术,包括以下步骤:
56.1、建立重组易位筛选系统,并利用定点敲入策略将元件整合至目标染色体;
57.2、优化细胞融合条件;
58.3、实现染色体的定向移动并对其进行检测。
59.步骤1中重组易位系统的建立通过以下方法实现:
60.1)向抗药性基因中人为添加包含loxp序列的功能性内含子,并将其拆分为带有包含loxp序列的重叠区域的两部分;
61.2)将重组易位筛选系统中拆分的两部分抗药性基因分别插入供体物种及受体物种的目标染色体中;
62.3)拆分后的抗药性基因在cre重组酶的作用下发生cre/loxp位点特异性重组,并回复抗药功能。
63.步骤1)所述抗药性基因的拆分通过以下方法实现:遵循rna剪接原则并参考剪接位点附近的保守序列信息,选择碱基序列为aagg或cagg的位点,向该位点人为添加包含loxp序列的sv40lt功能性内含子,并将其拆分为带有包含loxp序列的重叠区域的两部分。
64.步骤2)所述拆分的抗药性基因插入通过以下方法实现:利用crispr/cas9系统介导的非同源末端连接将拆分后的两部分抗药性基因分别定点插入至受体染色体近端粒位置,供体染色体近着丝粒位置。
65.步骤3)所述抗药功能回复通过以下方法实现:拆分后的抗药性基因在cre重组酶的作用下发生cre/loxp位点特异性重组,在需要转移的供体和受体染色体之间再次形成完整的抗药性基因,使完成目标染色体定向转移的细胞具有相应抗药性。
66.步骤2中细胞融合条件的优化通过以下方法实现:
67.a.检测直流电压对细胞融合的影响,优化细胞融合直流参数;
68.b.检测交流电压对细胞融合的影响,优化细胞融合交流参数;
69.c.检测细胞密度对细胞融合的影响,确定最合适的融合起始细胞量。
70.步骤a所述直流电压对细胞融合的影响通过以下方法检测:设置交流参数及细胞密度固定,直流电压及持续时间不同的实验组,利用红色荧光和绿色荧光分别标记融合前细胞,完成细胞融合后,进行流式分析,统计双荧光阳性细胞的比例,计算细胞电融合效率。细胞电融合效率可通过如下公式计算:
71.双标记细胞融合效率=红绿双阳细胞数量/红绿细胞中较小的细胞数量
72.步骤2)所述直流电压对细胞融合的影响通过以下方法检测:设置直流参数及细胞密度固定,交流电压及持续时间不同的实验组,利用红色荧光和绿色荧光分别标记融合前细胞,完成细胞融合后,进行流式分析,统计双荧光阳性细胞的比例,计算细胞电融合效率。细胞电融合效率可通过如下公式计算:
73.双标记细胞融合效率=红绿双阳细胞数量/红绿细胞中较小的细胞数量
74.步骤3)所述细胞密度对细胞融合的影响通过以下方法检测:设置直流参数及交流参数固定,融合起始细胞密度不同的实验组,利用红色荧光和绿色荧光分别标记融合前细胞,完成细胞融合后,进行流式分析,统计双荧光阳性细胞的比例,计算细胞电融合效率。细胞电融合效率可通过如下公式计算:
2.13
×
10-3
。对具有puromycin抗药性的hek293t细胞阳性克隆进行 cd74-ros1融合基因的pcr检测,检测引物为zlj822和zlj823,pcr产物大小为549 bp,阳性克隆标记为ct45-ct46-cre,可观察到片段大小正确的pcr产物,且sanger 测序结果也证明了cd74-ros1融合基因的形成,表明在hek293t阳性克隆细胞中表达cre重组蛋白可以介导chr.5和chr.6之间的染色体易位。
94.引物zlj822:5'-ccaagagagccttgggcgtt-3'
95.引物zlj823:5'-aagacctcacatgccacaaagaag-3'
96.图2中完整的测序序列如下:
97.taatccagcctgtgt(ros1)ccaggcagtgtgagggcctatctagaggtaccttaa(pct44 sequence)
←ꢀ
gagtgtgcaaagcccctgtctgctaactgcataacttcgtatagcatacattatacgaagttat(loxp) gcttgctgtgcttactgaggataaagcatg(94bp overlap)
→
(pct43 sequence) ggcgcgccggtatgtcgggaaccttctacttcaggac(cd74)
98.测序峰图下方数字为:10,300,290,280,270,260,250,240,230,220,210,200,190,180, 170,160,150,140,130。
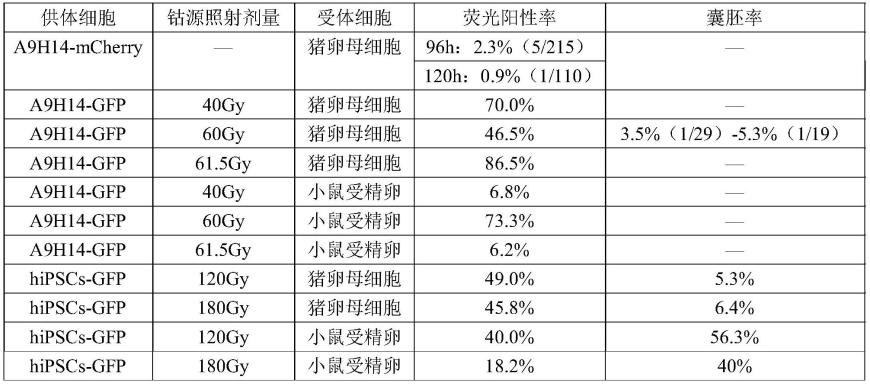
99.实施例2 细胞电融合条件的优化
100.本实施例中细胞电融合条件的优化主要包括以下四个方面:
101.第一,直流电压对细胞融合的影响(图3)
102.首先对细胞电融合直流电压大小和持续时间进行优化。设10个实验组,互为对照,每组实验融合细胞总量均为6
×
106,红色荧光和绿色荧光标记的小鼠胚胎干细胞比例为1:1,融合前细胞悬液在融合槽中静置5分钟,电融合交流参数均为80vrms-60 s,融合直流参数分别为500v-30μs、500v-60μs、750v-30μs、750v-60μs、1000v-30 μs、1000v-60μs、1250v-30μs、1250v-60μs、1500v-30μs、1500v-60μs。融合后的细胞在融合槽中静置10分钟,充分完成细胞膜的融合,随后重悬细胞,离心去除 ecf缓冲液,最终用3i培养基重悬,进行流式分析。
103.流式分析结果表明,当交流电参数均为80vrms-60s时,随着直流电压或直流处理时间的延长,融合后双荧光标记的小鼠胚胎干细胞数量总体呈现增多的趋势,实验组双阳细胞占比依次为0.40%、0.38%、083%、0.98%、1.40%、2.65%、5.44%、5.26%、 5.68%、5.52%,其中1000v-60μs和1250v-30μs两组荧光双阳细胞占比差值最大,但当直流电压参数大于1250v-30μs后双阳细胞占比基本无明显增加。
104.利用计算公式“双标记细胞融合效率=红绿双阳细胞数量/红绿细胞中较小的细胞数量”对流式分析所得数据进行进一步分析。10个实验组电融合效率依次为1.11%、 1.10%、2.40%、2.94%、4.39%、8.41%、17.49%、16.86%、19.45%、17.58%,当直流电压达到1250v-30μs后随着直流参数的增大融合效率基本保持相对稳定。通过公式计算出的融合效率避免了实验误差导致的绿色荧光单阳性或红色荧光单阳性细胞变化以及无荧光的饲养层细胞在总细胞占比对电融合最优结果的判定。考虑到较高的直流电压或较长时间的直流作用时间会对细胞造成较大的损伤,导致细胞存活率下降,最终确定电融合直流电压参数为1250v-30μs。
105.第二,交流电压对细胞融合的影响(图4)
106.设置6个实验组,互为对照,每组实验融合细胞总量均为6
×
106个,红色荧光和绿
色荧光标记的小鼠胚胎干细胞比例为1:1,融合前细胞悬液在融合槽中静置5分钟,电融合直流参数均为1250v-30μs,融合交流参数分别为30vrms-60s、60vrms-30s、 60vrms-60s、80vrms-30s、80vrms-60s、80vrms-60s。融合后的细胞在电极槽中静置10分钟,充分完成融合时间,随后重悬细胞,离心去除ecf缓冲液,最终用3i 培养基重悬,进行流式分析。
107.流式分析结果表明,当直流参数均为1250v-30μs时,随着交流电压增大或交流持续时间的延长,融合后双荧光标记的小鼠胚胎干细胞数量总体呈现增多的趋势,实验组双阳细胞占比依次为2.11%、1.88%、2.27%、3.57%、4.17%、6.35%。
108.利用融合效率计算公式对流式分析所得数据进行进一步分析,6个实验组电融合效率依次为6.37%、5.10%、5.99%、10.26%、11.00%、19.90%。通过对融合后静置细胞状态的观察,过度排列会导致形成较多的多核细胞,不利于后期杂交细胞单克隆的形成,经过综合分析最终确定电融合交流电压参数为80vrms-30s。
109.第三,细胞密度对细胞融合的影响(图5)
110.利用已优化的电融合条件交流参数80vrms-30s,直流参数1250v-30μs,设9个实验组,融合细胞总量分别为6
×
106个、6
×
107个、6
×
108个,融合前静置时间分别为0 分钟、3分钟、5分钟。在电融合完成后3分钟拍照,于20倍显微镜下统计每个实验组视野中600个融合后细胞中单核细胞个数、双核细胞个数以及多核细胞个数。当细胞量为6
×
106个时,5分钟的融合前静置时间获得的双核细胞数量最多,该细胞量若融合前不静置处理融合效率极低(《1%);细胞量为6
×
107个时,3分钟的融合前静置时间获得的双核细胞数量最多,当融合前静置时间延长至5分钟时多核细胞数量有明显的增多;细胞量为6
×
108个时,不进行融合前静置获得的双核细胞数量最多,静置时间为3 分钟和5分钟时,整体融合效率提高但其中多核细胞数量增大,双核细胞数量占比反而减少。最终确定当融合细胞起始量充足时,取6
×
108个细胞不静置直接进行电融合所获得的双核细胞的数量和比例都是最优的,而当细胞量较少时,则需要不同的融合前静置时间以提高电融合效率。
111.第四,融合前供体细胞钴源照射处理对细胞融合的影响(表1)
112.设11个实验组,供体细胞包括人诱导多能性干细胞和a9h14细胞(含有人14号染色体的小鼠a9细胞),受体细胞为未去核的猪卵母细胞或小鼠受精卵,人诱导多能性干细胞的钴源照射剂量为120gy(照射时间12分钟)和180gy(照射时间18分钟), a9h14细胞的照射剂量为40gy(照射时间4分钟)、60gy(照射时间6分钟)和61.5gy (照射时间6分9秒)。
113.将供体细胞直接注射至受体细胞内,并利用上述已优化的电融合条件对注射后的细胞进行电融合处理,供体细胞带有红色或绿色荧光标记,通过统计注射融合后细胞的荧光阳性率,可反映供体细胞染色体成功转移至受体细胞内的比例。另外,注射融合后细胞的囊胚率,可反映融合细胞是否能继续正常发育,即本发明提供的染色体定向转移方法是否可以最终用于制备动物模型。
114.供体a9h14细胞经钴源照射后,注射至猪卵母细胞或小鼠受精卵的融合细胞的荧光阳性率能够显著提高,且照射剂量为60gy时,a9h14细胞与猪卵母细胞的融合细胞可以成功发育至囊胚期。
115.将供体细胞由a9h14细胞替换为人诱导多能干细胞后,注射至猪卵母细胞或小鼠受精卵的融合细胞的囊胚率显著提高,最高可达到50%以上。
116.最终确定,供体细胞为干细胞且经钴源照射后,可以显著提高供体细胞染色体转
移至受体细胞的效率,且保证融合后细胞可继续正常发育并用于制备后续动物模型。
117.实验结果见表1。a9h14细胞为含有一条人源14号染色体的小鼠a9细胞,hipscs 为人源诱导多能性干细胞,mcherry表示红色荧光,gfp表示绿色荧光,gy为钴源照射剂量单位。
118.表1
[0119][0120]
实施例3 人源染色体片段向鼠源染色体的定向转移
[0121]
本实施例中人源染色体片段向鼠源染色体的定向转移主要包括以下两个方面:
[0122]
第一,重组易位筛选系统转染人源多能干细胞及小鼠胚胎干细胞(图6)
[0123]
利用crispr/cas9介导的依赖于非同源末端连接的dna定点敲入策略,将t-puro 系统(出发载体为puc57)的外源dna片段分别定点整合至小鼠10号染色体末端近端粒位置与人源21号染色体长臂近着丝粒位置。
[0124]
用于细胞电融合的小鼠细胞为小鼠胚胎干细胞,利用ncbi数据库确定小鼠10号染色体最后一个基因为vmn2r86(基因vmn2r86在ncbi上的编号为625109),外源 dna片段的插入位置在vmn2r86基因下游且尽量靠近染色体端粒的位置,靶位点 sgrna序列为:5'-ggctccggctctaaatcggtagg-3'。该外源dna片段包含由 ef1α启动子调控表达的绿色荧光蛋白和blasticidin s抗药性基因,以及由polⅱ启动子调控表达的5'-puro和带有loxp序列的sv40lt功能性内含子。所述外源dna片段的序列如seq id no:2所示。
[0125]
用于细胞电融合的人源细胞为人源诱导多能性干细胞,外源dna片段在人源21 号染色体的插入位置在其长臂近着丝粒位置(插入位点位于chm13装配体上),靶位点sgrna序列为:5'-gtgcagaacggtgatgctcagagg-3'。该外源dna片段包含带有loxp序列的sv40lt功能性内含子和由polⅱ启动子调控表达的3'-puro,以及由 ef1α启动子调控表达的红色荧光蛋白和hygromycin b抗药性基因。所述外源dna片段的序列如seq id no:3所示。
[0126]
随后通过cre重组酶的表达,在实现cre/loxp位点特异性重组t-puro元件的同时实现人与小鼠的染色体易位。
[0127]
融合前人源诱导多能性干细胞与小鼠胚胎干细胞的起始细胞总量为107个,经 blasticidin s和hygromycin b药物筛选后获得红绿双荧光阳性的单克隆细胞(图7)。挑取单克隆细胞进行扩大培养,取部分细胞进行puromycin药物筛选验证。
[0128]
第二,异源染色体易位的检测
[0129]
提取红绿双荧光阳性且具有puromycin抗药性的单克隆细胞基因组,对其进行t-puro易位pcr检测。pcr检测引物为zlj850和zlj851,目标条带大小为526bp。结果显示在10个单克隆细胞(#1-1,#1-2,#1-3,#1-4,#2-1,#2-2,#2-3,#2-4,#3-1,#3-2)中,除单克隆#3-1之外均为t-puropcr阳性,且野生型小鼠胚胎干细胞和未转染cre重组酶的细胞t-puro检测均为阴性(图8)。
[0130]
引物zlj850:5'-tcgggctcgacatcggcaaggtaagtgcttcttccttaaatc-3'
[0131]
引物zlj851:5'-gccgtcgtccgcgacccacacctaaaatacacaaacaattagg-3'
[0132]
为进一步证明具有puromycin抗药性的单克隆细胞中人源染色体片段的存在,对puromycin抗药性单克隆细胞进行荧光原位杂交。结果显示单克隆细胞有明显红色荧光信号(图9)。
[0133]
在小鼠10号染色体上敲入的人dna片段为人源21号染色体长臂,理论长度约为33.5mbp;融合细胞可稳定传代,且插入基因可在传代后细胞中检测到。
[0134]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
[0135]
参考文献:
[0136]
1、bellis,m.,g
é
rard,a.,charlieu,j.p.,b.,brun,m.e.,viegas-p
é
quignot,e.,carter,d.a.,androiz
è
s,g.(1991).constructionandcharacterizationofapartiallibraryofyeastartificialchromosomesfromhumanchromosome21.dnacellbiol.10,301-310.
[0137]
2、br
ü
ggemann,m.,caskey,h.m.,teale,c.,waldmann,h.,williams,g.t.,surani,m.a.,andneuberger,m.s.(1989).arepertoireofmonoclonalantibodieswithhumanheavychainsfromtransgenicmice.proc.natl.acad.sci.u.s.a.86,6709-6713.
[0138]
3、carter,p.j.(2006).potentantibodytherapeuticsbydesign.nat.rev.immunol.6,343-357.
[0139]
4、davisson,m.t.,schmidt,c.,andakeson,e.c.(1990).segmentaltrisomyofmurinechromosome16:anewmodelsystemforstudyingdownsyndrome.prog.clinbiol.res.360,263-280.
[0140]
5、devoy,a.,bunton-stasyshyn,r.k.,tybulewicz,v.l.,smith,a.j.,andfisher,e.m.(2011).genomicallyhumanizedmice:technologiesandpromises.nat.rev.genet.13,14-20.
[0141]
6、driscoll,d.a.,andgross,s.(2009).clinicalpractice.prenatalscreeningforaneuploidy.n.engl.j.med.360,2556-2562.
[0142]
7、green,l.l.,hardy,m.c.,maynard-currie,c.e.,tsuda,h.,louie,d.m.,mendez,m.j.,abderrahim,h.,noguchi,m.,smith,d.h.,zeng,y.,etal.(1994).antigen-specifichumanmonoclonalantibodiesfrommiceengineeredwithhumanigheavyandlightchainyacs.nat.genet.7,13-21.
[0143]
8、hernandez,d.,mee,p.j.,martin,j.e.,tybulewicz,v.l.,andfisher,e.m.
(1999).transchromosomalmouseembryonicstemcelllinesandchimericmicethatcontainfreelysegregatingsegmentsofhumanchromosome21.hum.mol.genet.8,923-933.
[0144]
9、hwang,w.y.,andfoote,j.(2005).immunogenicityofengineeredantibodies.methods36,3-10.
[0145]
10、kazuki,y.,gao,f.j.,li,y.,moyer,a.j.,devenney,b.,hiramatsu,k.,miyagawa-tomita,s.,abe,s.,kazuki,k.,kajitani,n.,etal.(2020).anon-mosaictranschromosomicmousemodelofdownsyndromecarryingthelongarmofhumanchromosome21.elife9,e56223.
[0146]
11、kazuki,y.,kimura,m.,nishigaki,r.,kai,y.,abe,s.,okita,c.,shirayoshi,y.,schulz,t.c.,tomizuka,k.,hanaoka,k.,etal.(2004).humanchromosome21q22.2-qtercarriesagene(s)responsiblefordownregulationofmlc2aandpebpindownsyndromemodelmice.biochem.biophys.res.commun.317,491-499.
[0147]
12、korenberg,j.r.,chen,x.n.,schipper,r.,sun,z.,gonsky,r.,gerwehr,s.,carpenter,n.,daumer,c.,dignan,p.,disteche,c.,etal.(1994).downsyndromephenotypes:theconsequencesofchromosomalimbalance.proc.natl.acad.sci.u.s.a.91,4997-5001.
[0148]
13、lee,e.c.,liang,q.,ali,h.,bayliss,l.,beasley,a.,bloomfield-gerdes,t.,bonoli,l.,brown,r.,campbell,j.,carpenter,a.,etal.(2014).completehumanizationofthemouseimmunoglobulinlocienablesefficienttherapeuticantibodydiscovery.nat.biotechnol.32,356-363.
[0149]
14、lonberg,n.(2005).humanantibodiesfromtransgenicanimals.nat.biotechnol.23,1117-1125.
[0150]
15、lonberg,n.,taylor,l.d.,harding,f.a.,trounstine,m.,higgins,k.m.,schramm,s.r.,kuo,c.c.,mashayekh,r.,wymore,k.,mccabe,j.g.,etal.(1994).antigen-specifichumanantibodiesfrommicecomprisingfourdistinctgeneticmodifications.nature368,856-859.
[0151]
16、macdonald,l.e.,karow,m.,stevens,s.,auerbach,w.,poueymirou,w.t.,yasenchak,j.,frendewey,d.,valenzuela,d.m.,giallourakis,c.c.,alt,f.w.,etal.(2014).preciseandinsitugenetichumanizationof6mbofmouseimmunoglobulingenes.proc.natl.acad.sci.u.s.a.111,5147-5152.
[0152]
17、moriwaki,t.,abe,s.,oshimura,m.,andkazuki,y.(2020).transchromosomictechnologyforgenomicallyhumanizedanimals.exp.cellres.390,111914.
[0153]
18、murphy,a.j.,macdonald,l.e.,stevens,s.,karow,m.,dore,a.t.,pobursky,k.,huang,t.t.,poueymirou,w.t.,esau,l.,meola,m.,etal.(2014).micewithmegabasehumanizationoftheirimmunoglobulingenesgenerateantibodiesasefficientlyasnormalmice.proc.natl.acad.sci.u.s.a.111,5153-5158.
[0154]
19、sago,h.,carlson,e.j.,smith,d.j.,kilbridge,j.,rubin,e.m.,mobley,w.c.,epstein,c.j.,andhuang,t.t.(1998).ts1cje,apartialtrisomy16mousemodelfordownsyndrome,exhibitslearningandbehavioralabnormalities.proc.natl.acad.sci.u.s.a.95,6256-6261.
[0155]
20、scheer,n.,andwilson,i.d.(2016).acomparisonbetweengeneticallyhumanizedandchimericliverhumanizedmousemodelsforstudiesindrugmetabolismandtoxicity.drugdiscov.today21,250-263.
[0156]
21、tomizuka,k.,shinohara,t.,yoshida,h.,uejima,h.,ohguma,a.,tanaka,s.,sato,k.,oshimura,m.,andishida,i.(2000).doubletrans-chromosomicmice:maintenanceoftwoindividualhumanchromosomefragmentscontainingigheavyandkappalociandexpressionoffullyhumanantibodies.proc.natl.acad.sci.u.s.a.97,722-727.
[0157]
22、weiss,m.c.,andgreen,h.(1967).human-mousehybridcelllinescontainingpartialcomplementsofhumanchromosomesandfunctioninghumangenes.proc.natl.acad.sci.u.s.a.58,1104-1111.
[0158]
23、zhu,f.,nair,r.r.,fisher,e.m.c.,andcunningham,t.j.(2019).humanisingthemousegenomepiecebypiece.nat.commun.10,1845。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1