漆黄素衍生物及其在制备抗炎药物中的应用
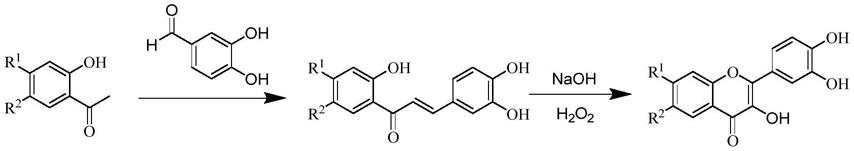
1.本发明涉及新的漆黄素衍生物及其药学上可接受的盐、水合物、溶剂化物或其前药的制备方法以及含有所述化合物的药物组合物,及其在制备治疗和/或预防炎症疾病的药物中的用途。
背景技术:
2.炎症作为一种十分常见却极为重要的病理过程,是人类机体对于外来的或者异体的刺激的一种自身免疫应答。通常情况下,炎症是有益的。而当这种应答失调或者过分应答从而导致机体自损伤时,炎症就对人体产生了危害,会造成各种疾病。炎症按照持续时间不同可分为急性炎症和慢性炎症。急性炎症中以急性肺损伤(acute lung inflammation,ali)为例,该疾病的死亡率可以超过30%。慢性炎症则包括高血压,糖尿病等等。长期的炎症反应刺激还会诱发机体的癌变,这些都严重威胁着人们的身心健康。但这些在临床上非常常见的疾病的药物治疗手段却很匮乏。因此,开发新的抗炎药物仍然是一项重要的挑战。
3.研究表明,上述疾病中的炎症反应虽然所表现的症状不同,但是介导这些炎症反应的因子或介质是相同的。如肿瘤坏死因子-α(tumornecrosis factor alpha,tnf-α)、白细胞介素-1β(interleukin-1beta,il-1β)、白细胞介素-6(il-6)等。一氧化氮(no)、自由基(free radicals)等毒性分子在炎症反应中可被诱导表达,从而加剧机体的炎症程度。在炎症发生过程中,炎症因子会直接或间接造成组织和细胞的破坏。多项临床研究表明,由炎症因子和趋化因子形成的复杂的网络在介导、放大和延续炎症的过程中起重要作用。因此抑制炎症因子的释放成为了治疗炎症的重要手段。
4.漆黄素是一种黄酮类天然产物,具有抗氧化,抗癌及抗炎等作用。但因其生物利用度低,药代动力学差等特性阻碍了其临床应用。虽然漆黄素有较好的抑制il-6和tnf-α的作用,但实验表明漆黄素衍生物具有比漆黄素更强的抗炎活性,因此开发活性更好的化合物仍是我们的追求。
技术实现要素:
5.本发明提供了一种漆黄素衍生物,该化合物同现有化合物相比,抗炎活性明显改善,可以作为一种更有潜力的抗炎药物。
6.本发明涉及通式ⅰ所示的漆黄素衍生物,及其药学上可接受的盐、水合物、溶剂化物或前药,
[0007][0008]
式(i)中,r1、r2为氢、卤原子、以及柔性片段,r3为氢或者羟基,x为氧或者羟基。且
当x为羟基时,r3为氢,x与2号碳原子之间碳氧键不存在;当x为氧时,r3为羟基,x与2号碳原子之间碳氧键存在而生成一个含氧六元环;
[0009]
所述柔性片段具有以下结构:
[0010][0011]
其中,n为1~4,r4为二烷基胺基或5~6元含n杂环基;
[0012]
~~~~表示取代位置。
[0013]
本发明人在多年的工作基础上,发现了新的漆黄素衍生物能治疗炎症引起的急性肺损伤,后续生物实验发现该化合物具有抗炎活性,尤其是能用于治疗由tnf-α和/或il-6超出正常量表达和释放而导致的急性肺损伤。
[0014]
本发明优选还涉及定义如下的通式ⅰ化合物,
[0015]
其中,
[0016]
当x为羟基时,r3为氢,r1为溴、氟、为溴、氟、为溴、氟、r2为氢;或者r1为氢,r2为溴、为溴、为溴、当x为氧时,r3为羟基,r1为溴,r2为氢。
[0017]
试验结果初步说明,当上述取代基进一步选择上述基团时,对于抗炎活性的提高是有积极效果的。
[0018]
本发明非常特别优选的下列具体化合物,及其药学上可接受的盐和/或水合物,但这些化合物并不意味着对本发明的任何限制:
[0019]
(e)-1-(4-溴-2-羟基苯基)-3-(3,4-二羟基苯基)丙-2-烯-1-酮;
[0020]
(e)-3-(3,4-二羟基苯基)-1-(4-氟-2-羟基苯基)丙-2-烯-1-酮;
[0021]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-4,5-二甲氧基苯基)丙-2-烯-1-酮;
[0022]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-4-(3-吗啉丙氧基)苯基)丙-2-烯-1-酮;
[0023]
(e)-3-(3,4-二羟基苯基)-1-(4-(3-(二甲氨基)丙氧基)-2-羟基苯基)丙-2-烯-1-酮;
[0024]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-4-(2-吗啉乙氧基)苯基)丙-2-烯-1-酮;
[0025]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-4-(3-(吡咯烷-1-基)丙氧基)苯基)丙-2-烯-1-酮;
[0026]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-4-(2-(吡咯烷-1-基)乙氧基)苯基)丙-2-烯-1-酮;
[0027]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-4-(3-(哌啶-1-基)丙氧基)苯基)丙-2-烯-1-酮;
[0028]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-4-(吡啶-4-基甲氧基)苯基)丙-2-烯-1-酮;
[0029]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-5-(3-吗啉丙氧基)苯基)丙-2-烯-1-酮;
[0030]
(e)-3-(3,4-二羟基苯基)-1-(5-(3-(二甲氨基)丙氧基)-2-羟基苯基)丙-2-烯-1-酮;
[0031]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-5-(2-吗啉乙氧基)苯基)丙-2-烯-1-酮;
[0032]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-5-(3-(吡咯烷-1-基)丙氧基)苯基)丙-2-烯-1-酮;
[0033]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-5-(2-(吡咯烷-1-基)乙氧基)苯基)丙-2-烯-1-酮;
[0034]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-5-(3-(4-甲基哌嗪-1-基)丙氧基)苯基)丙-2-烯-1-酮;
[0035]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-5-(3-(哌啶-1-基)丙氧基)苯基)丙-2-烯-1-酮
[0036]
7-溴-2-(3,4-二羟基苯基)-3-羟基-4h-烯-4-酮。
[0037]
而且,按照本发明所属领域的一些通常方法,本发明通式i的漆黄素衍生物可以与酸生成它的药学上可接受的盐。酸可以包括无机酸或有机酸,与下列酸形成的盐是特别优选的:盐酸、氢溴酸、硫酸、磷酸、甲磺酸、乙磺酸、甲苯磺酸、苯磺酸、萘二磺酸、乙酸、丙酸、乳酸、三氟乙酸、马来酸、柠檬酸、富马酸、酒石酸、苯磺酸、苯甲酸或对甲苯磺酸等。
[0038]
此外,本发明还包括本发明化合物的前药。依据本发明,前药是通式i化合物的衍生物,它们自身可能具有较弱的活性或甚至没有活性,但是在给药后,在生理条件下(例如通过代谢、溶剂分解或另外的方式)被转化成相应的生物活性形式
[0039]
下面的合成路线描述了本发明的通式ⅰ化合物的制备,所有的原料都是通过这些化学式中描述的方法、通过有机化学领域普通技术人员熟知的方法制备的或者可商购。本发明的全部最终化合物都是通过这些化学式中描述的方法或通过与其类似的方法制备的,这些方法是有机化学领域普通技术人员熟知的。这些化学式中应用的全部可变因数如下文的定义或如前述内容中的定义。
[0040]
按照本发明的通式i化合物,r1,r2,r3,x如前述内容部分所定义,均可按以下路线的方法制备而成。
[0041][0042]
抑或:
[0043][0044]
抑或:
[0045][0046]
本发明可以含有上述通式i含有漆黄素衍生物,及其药学上可接受的盐、水合物或溶剂化物作为活性成份,与药学上可接受的载体或赋型剂混合制备成组合物,并制备成临床上可接受的剂型,上述药学上可接受的赋型剂是指任何可用于药学领域的稀释剂、辅助剂和/或载体。本发明的衍生物可以与其他活性成份组合使用,只要它们不产生其他不利的作用,例如过敏反应。
[0047]
本发明的药用组合物可配制成若干种剂型,其中含有药物领域中一些常用的赋形剂。如上所述的若干种剂型可以采用注射剂、片剂、胶囊剂、气雾剂、栓剂、膜剂、滴丸剂、外用搽剂、软膏剂等剂型药物。
[0048]
用于本发明药物组合物的载体是药物领域中可得到的常见类型,包括:粘合剂、润滑剂、崩解剂、助溶剂、稀释剂、稳定剂、悬浮剂、无色素、矫味剂、防腐剂、加溶剂和基质等。药物制剂可以经口服或胃肠外方式(例如静脉内、皮下、腹膜内或局部)给药,如果某些药物在胃部条件下不稳定的,可将其配制成肠衣片剂。
[0049]
本发明涉及一类漆黄素衍生物及与炎症相关疾病的治疗药物,所述疾病的病因至少部分地是由炎症引起,所述疾病包括但不限于以下疾病:脓毒血症、急性肺损伤、关节炎、结直肠炎和各类因素引起的肝炎,以及以慢性炎症为重要病理通路的慢性疾病,包括糖尿病并发症、动脉粥样硬化、肥胖并发症和高血压并发症。
附图说明
[0050]
图1为部分实施例化合物抑制lps刺激j774a.1细胞释放il-6的量效关系;
[0051]
图2为部分实施例化合物抑制lps刺激j774a.1细胞释放tnf-α的量效关系;
[0052]
图3为以急性肺损伤为例,部分实施例化合物缓解炎症引起的小鼠生理学变化效果。a湿重/干重比(w/d);b肺泡灌洗液中细胞总数;c肺泡灌洗液中il-6表达量;d肺泡灌洗液中tnf-α表达量;e血清中il-6表达量;f血清tnf-α表达量;
[0053]
图4为以急性肺损伤中肺组织为例,部分实施例化合物缓解炎症引起的病理学变化。
具体实施方式
[0054]
为了更好地解释本发明,以下结合具体实施例对本发明作进一步的详细说明,但它们不对本发明构成限定。
[0055]
本发明按照制备通式i的方法,分别制得实施例1~18化合物,结构式如下表1所示。
[0056]
表1实施例1~18的结构式
[0057][0058][0059]
实施例1
[0060]
(e)-1-(4-溴-2-羟基苯基)-3-(3,4-二羟基苯基)丙-2-烯-1-酮
[0061]
在50ml圆底烧瓶中将4-溴-2-羟基苯乙酮(215mg,1mmol),3,4-二羟基苯甲醛(138mg,1mmol),二氯亚砜(206μl,2.84mmol)依次加入无水乙醇(5ml)中,室温反应过夜。反应液加入饱和氯化铵溶液淬灭,减压蒸干乙醇,用ea萃取,有机层用饱和碳酸氢钠溶液洗涤
三次,无水硫酸镁干燥。减压蒸干ea,柱层析分离(pe:ea=4:1)得,即为(e)-1-(4-溴-2-羟基苯基)-3-(3,4-二羟基苯基)丙-2-烯-1-酮,收率为32.5%。
[0062]
esi-ms m/z:335.85.1h nmr(400mhz,dmso-d6)δppm 12.85(s,1h,oh),9.88(s,1h,oh),9.17(s,1h,oh),8.13(d,j=8.6hz,1h,ch),7.69(dd,j=8.0,4.4hz,2h,ar-h),7.29(s,1h,ar-h),7.24-7.19(m,2h,ar-h),7.17(dd,j=8.5,1.4hz,1h,ar-h),6.82(d,j=8.2hz,1h,ch).
[0063]
按照实施例1的方法,分别制得实施例2~3化合物
[0064]
实施例2
[0065]
(e)-3-(3,4-二羟基苯基)-1-(4-氟-2-羟基苯基)丙-2-烯-1-酮
[0066]
esi-ms m/z:275.10.1h nmr(400mhz,dmso-d6)δppm 13.28(s,1h,oh),9.86(s,1h,oh),9.14(s,1h,oh),8.39-8.32(m,1h,ch),7.73(s,2h,ar-h),7.31(s,1h,ar-h),7.23(d,j=8.2hz,1h,ar-h),6.83(d,j=8.5hz,3h,ar-h ch).
[0067]
实施例3
[0068]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-4,5-二甲氧基苯基)丙-2-烯-1-酮
[0069]
esi-ms m/z:317.10.1h nmr(400mhz,dmso-d6)δppm 13.64(s,1h,oh),9.78(s,1h,oh),9.14(s,1h,oh),7.71(s,2h,ar-h),7.60(s,1h,ar-h),7.34(d,j=1.7hz,1h,ch),7.25(dd,j=8.2,1.8hz,1h,ar-h),6.83(d,j=8.2hz,1h,ch),6.57(s,1h),3.84(d,j=4.1hz,6h,ch3).
[0070]
实施例4
[0071]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-4-(3-吗啉丙氧基)苯基)丙-2-烯-1-酮
[0072]
步骤一:1-(2-甲氧基-5-(3-吗啉丙氧基)苯基)乙烷-1-酮
[0073]
在50ml的圆底烧瓶中依次将5-羟基-2-甲氧基苯乙酮(500mg,3mmol),n-(3-氯丙基)吗啉(736.43mg,4.5mmol),碳酸铯(2.93g,9mmol)依次加入dmf(5ml)中,在100℃下搅拌4h,有机层用ea萃取三次,再用饱和食盐水洗涤,无水硫酸镁干燥。加压蒸干ea,柱层析分离(dcm:meoh=10:1)得,即为1-(2-甲氧基-5-(3-吗啉丙氧基)苯基)乙烷-1-酮,收率为90.4%。
[0074]
步骤二:1-(2-羟基-5-(3-吗啉丙氧基)苯基)乙烷-1-酮
[0075]
在25ml的圆底烧瓶中依次将步骤一中所合成的1-(2-甲氧基-5-(3-吗啉丙氧基)苯基)乙烷-1-酮(500mg,1.70mmol),三溴化硼(491μl,5.1mmol),加入无水二氯甲烷(5ml)中,并在0℃条件下搅拌1h,在室温下搅拌2h。反应液使用甲醇淬灭,减压蒸干二氯甲烷以及甲醇,用二氯甲烷萃取,有机层用饱和碳酸氢;钠溶液洗涤三次,无水硫酸镁干燥,减压蒸干二氯甲烷,柱层析分离(dcm:meoh=10:1)得,即为1-(2-羟基-5-(3-吗啉丙氧基)苯基)乙烷-1-酮,收率为25.6%。
[0076]
步骤三:(e)-3-(3,4-二羟基苯基)-1-(2-羟基-4-(3-吗啉丙氧基)苯基)丙-2-烯-1-酮
[0077]
在25ml的圆底烧瓶中将步骤二所得的1-(2-羟基-5-(3-吗啉丙氧基)苯基)乙烷-1-酮(100mg,0.358mmol),3,4-二羟基苯甲醛(49.44mg,0.358mmol),二氯亚砜(73.76μl,1.02mmol)加入无水乙醇(2ml)中,反应液在室温下搅拌过夜。用饱和氯化铵溶液进行淬灭,减压蒸干乙醇。ea萃取,有机层用饱和食盐水洗涤三次,无水硫酸镁干燥,柱层析分离(dcm:
meoh=10:1)得,即为(e)-3-(3,4-二羟基苯基)-1-(2-羟基-4-(3-吗啉丙氧基)苯基)丙-2-烯-1-酮,收率为15.2%。
[0078]
esi-ms m/z:400.20.1h nmr(400mhz,dmso-d6)δppm 13.63(s,1h,oh),9.81(s,1h,oh),9.09(d,j=15.0hz,1h,oh),8.23(d,j=9.0hz,1h,ch),7.69(s,1h,ar-h),7.29(s,1h,ar-h),7.26-7.19(m,1h,ar-h),6.92-6.79(m,1h,ar-h),6.77-6.61(m,1h,ar-h),6.59-6.51(m,1h,ar-h),6.48(d,j=2.2hz,1h,ch),4.15-4.06(m,2h,ch2),3.60(s,4h,ch2×
2),2.54(s,2h,ch2),2.48-2.31(m,4h,ch2×
2),2.03-1.91(m,2h,ch2).
[0079]
按照实施例4的方法,分别制得实施例5~17化合物
[0080]
实施例5
[0081]
(e)-3-(3,4-二羟基苯基)-1-(4-(3-(二甲氨基)丙氧基)-2-羟基苯基)丙-2-烯-1-酮
[0082]
esi-ms m/z:358.20.1h nmr(400mhz,dmso-d6)δppm 13.62(s,1h,oh),9.70(s,1h,oh),9.05(s,1h,oh),8.23(d,j=9.0hz,1h,ch),7.69(d,j=2.4hz,1h,ar-h),7.30(d,j=1.8hz,1h,ar-h),7.22(dd,j=8.3,1.9hz,1h,ar-h),6.82(d,j=8.2hz,1h,ar-h),6.76(s,1h,ar-h),6.59-6.51(m,1h,ar-h),6.49(d,j=2.4hz,1h,ch),4.14-4.07(m,2h,ch2),2.68(s,2h,ch2),2.39(d,j=6.4hz,6h,ch3),2.00-1.93(m,2h,ch2).
[0083]
实施例6
[0084]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-4-(2-吗啉乙氧基)苯基)丙-2-烯-1-酮
[0085]
esi-ms m/z:386.10.1h nmr(400mhz,dmso-d6)δppm 13.63(s,1h,oh),9.79(s,1h,oh),9.04(s,1h,oh),8.22(d,j=9.0hz,1h,ch),7.69(s,1h,ar-h),7.29(d,j=1.6hz,1h,ar-h),7.22(dd,j=8.2,1.8hz,1h,ar-h),6.81(d,j=8.2hz,1h,ch),6.74(t,j=5.9hz,1h,ar-h),6.66-6.57(m,1h,ar-h),6.57-6.48(m,1h,ar-h),4.20-4.12(m,2h,ch2),3.57(dd,j=9.7,5.3hz,4h,ch2×
2),2.69(dd,j=12.5,4.6hz,2h,ch2),2.46(s,4h,ch2×
2).
[0086]
实施例7
[0087]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-4-(3-(吡咯烷-1-基)丙氧基)苯基)丙-2-烯-1-酮
[0088]
esi-ms m/z:384.20.1h nmr(400mhz,dmso-d6)δppm 13.65(s,1h,oh),9.70(s,1h,oh),9.11(s,1h,oh),8.26(d,j=9.0hz,1h,ch),7.71(s,2h,ar-h),7.30(d,j=1.9hz,1h,ar-h),7.23(dd,j=8.3,1.9hz,1h,ar-h),6.82(d,j=8.2hz,1h,ar-h),6.55(dd,j=8.9,2.4hz,1h,ar-h),6.51(d,j=2.4hz,1h,ch),4.17(t,j=6.0hz,2h,ch2),3.23(s,4h,ch2×
2),2.11(s,2h,ch2),1.93(s,6h,ch2×
3).
[0089]
实施例8
[0090]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-4-(2-(吡咯烷-1-基)乙氧基)苯基)丙-2-烯-1-酮
[0091]
esi-ms m/z:370.20.1h nmr(400mhz,dmso-d6)δppm 13.56(s,1h,oh),9.11(s,2h,oh
×
2),8.22(d,j=9.0hz,1h,ch),7.69-7.65(m,1h,ar-h),7.30-7.16(m,1h,ar-h),6.89-6.77(m,1h,ar-h),6.74(d,j=14.0hz,1h,ch),6.69-6.64(m,1h,ar-h),6.63-6.57(m,1h,ar-h),6.57-6.47(m,1h,ar-h),4.41(dd,j=11.5,6.4hz,2h,ch2),3.53-3.41(m,4h,ch2×
2),2.46(s,2h,ch2),1.88(s,4h,ch2×
2).
烯-1-酮
[0109]
esi-ms m/z:384.20.1h nmr(400mhz,dmso-d6)δppm 12.20(s,1h,oh),9.89(s,1h,oh),9.61(s,1h,oh),9.19-8.98(m,1h,ar-h),7.70(s,1h,ar-h),7.62(d,j=2.8hz,1h,ch),7.32-7.17(m,2h,ar-h),7.03(d,j=8.8hz,1h,ch),6.96-6.88(m,1h,ar-h),6.84-6.73(m,1h,ar-h),4.04(t,j=6.3hz,2h,ch2),3.09-2.94(m,4h,ch2×
2),2.18-2.08(m,2h,ch2),2.05-1.93(m,6h,ch2×
3).
[0110]
实施例15
[0111]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-5-(2-(吡咯烷-1-基)乙氧基)苯基)丙-2-烯-1-酮
[0112]
esi-ms m/z:370.20.1h nmr(400mhz,dmso-d6)δppm 9.04(s,2h,oh
×
2),7.21(s,2h,ar-h),7.19(d,j=3.1hz,1h,ch),7.01(d,j=9.3hz,1h,ch),6.89(s,1h,ar-h),6.78-6.71(m,3h,ar-h),4.07(t,j=5.7hz,2h,ch2),2.82(t,j=5.4hz,2h,ch2),2.56(s,4h,ch2×
2),1.69(s,4h,ch2×
2).
[0113]
实施例16
[0114]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-5-(3-(4-甲基哌嗪-1-基)丙氧基)苯基)丙-2-烯-1-酮
[0115]
esi-ms m/z:413.30.1h nmr(400mhz,dmso-d6)δppm 12.29(s,1h,oh),9.08(s,1h,oh),7.73-7.60(m,1h,ch),7.25-7.15(m,2h,ar-h),7.13-7.05(m,1h,ar-h),7.03-6.96(m,1h,ar-h),6.91(d,j=9.2hz,1h,ch),6.80-6.72(m,2h,ar-h),3.98(t,j=6.2hz,2h,ch2),2.47-2.35(m,8h,piperazin h),2.17(d,j=3.6hz,3h,ch3),2.03-1.87(m,2h,ch2),1.84(dd,j=12.3,5.8hz,2h,ch2).
[0116]
实施例17
[0117]
(e)-3-(3,4-二羟基苯基)-1-(2-羟基-5-(3-(哌啶-1-基)丙氧基)苯基)丙-2-烯-1-酮
[0118]
esi-ms m/z:398.30.1h nmr(400mhz,dmso-d6)δppm 12.27(s,1h,oh),9.05(s,2h,oh
×
2),7.73-7.60(m,1h,ar-h),7.19(s,1h,ar-h),7.17(d,j=3.1hz,1h,ch),7.00(d,j=9.2hz,1h,ar-h),6.91(d,j=12.7hz,1h,ch),6.84-6.76(m,1h,ar-h),6.75(s,2h,ar-h),3.99(t,j=6.3hz,2h,ch2),2.46-2.37(m,2h,ch2),2.03-1.84(m,4h,ch2×
2),1.53(d,j=5.1hz,6h,ch2×
3),1.40(d,j=4.3hz,2h,ch2)。
[0119]
实施例18
[0120]
7-溴-2-(3,4-二羟基苯基)-3-羟基-4h-烯-4-酮
[0121]
步骤一:按照实施例1方法制得(e)-1-(4-溴-2-羟基苯基)-3-(3,4-二羟基苯基)丙-2-烯-1-酮。
[0122]
步骤二:在25ml圆底烧瓶中依次加入步骤一得到的(e)-1-(4-溴-2-羟基苯基)-3-(3,4-二羟基苯基)丙-2-烯-1-酮(86mg),30%双氧水溶液(62μl),5.4%氢氧化钠水溶液(0.95ml)于甲醇(2ml)中。反应液在0℃搅拌1h,室温搅拌过夜。随后用2m盐酸将反应液ph调至中性,过滤收集滤渣,用饱和食盐水洗涤三次滤渣,用二氯甲烷重结晶得,即为7-溴-2-(3,4-二羟基苯基)-3-羟基-4h-烯-4-酮,收率为11.3%。
[0123]
本发明产物的药理研究
[0124]
实施例化合物抑制lps刺激巨噬细胞释放炎症因子的量效关系
[0125]
本实施例测试了部分活性实施例化合物抑制lps刺激j774a.1巨噬细胞释放il-6和tnf-α的量效关系。具体方法如下:1.2
×
106个原代巨噬细胞用dmem培养液培养于37℃,24小时后更新培养液,并加入受测化合物(终浓度为10μm)预处理2h,再用0.5μg/ml的lps继续处理22小时,收集培养液用elisa法检测il-6和tnf-α含量;收集细胞检测总蛋白浓度,elisa结果用相应的总蛋白浓度相除较准,以lps对照组的il-6和tnf-α含量定标为100,计算平均值和误差值。实验结果如图1、图2所示,由图1可知,所测试的实施例化合物3、4、5、8、9、13、14、15、17对于il-6释放的抑制,效果都优于漆黄素,由图2可知,所测试的实施例化合物3、4、5、8、9、13、14、15、17对于tnf-α释放的抑制,效果都优于漆黄素,这些实施例化合物具有的共同特点是引入了一些水溶性的片段,可提高化合物的水溶性,改善水溶性差的缺点,可大大提高化合物的成药性,这突出表明了本发明通式结构相对于漆黄素的创新性所在。
[0126]
实施例化合物缓解由炎症引起的小鼠生理学变化
[0127]
以缓解急性肺损伤所引起的生理学变化为例。用0.5%羧甲基纤维素钠与实施例化合物制成混悬液用于腹腔给药。各组小鼠乙醚麻醉后暴露气管,除对照组外,其余各组气管内缓慢滴入50μl 5mg/kg lps,造成小鼠急性肺损伤,对照组以相同的方式滴入等量生理盐水,缝合伤口,建立急性肺损伤模型。动物造模24h后,按照5ml/kg的剂量腹腔注射10%的水合氯醛麻醉老鼠,开胸结扎左肺,右肺用1ml生理盐水进行支气管肺泡灌洗,收集灌洗液,相同操作重复3次。
[0128]
肺泡灌洗液收集后,4℃1000rpm离心5分钟,取上清液,测肺泡灌洗液的蛋白浓度。肺泡灌洗液离心后,用50μl生理盐水重悬沉淀,混匀后取20μl用细胞计数仪standard计数肺泡灌洗液中的总细胞数。此外,取右肺上叶,滤纸吸去组织上的水分后称取湿重,放入60℃烘烤48h以上,直到其重量不再发生变化为止,称取干重,计算肺组织湿重/干重比(w/d),判断肺水肿程度。以漆黄素、实施例5化合物为例,实验数据见图3,其中fisetin、5b分别代表漆黄素、实施例5化合物,结果表明实施例化合物在生理学上可有效缓解小鼠急性肺损伤。
[0129]
实施例化合物缓解炎症引起的小鼠病理学变化试验
[0130]
以缓解由急性肺损伤引起的小鼠肺组织病理学变化为例。实验数据见图4,正常对照组小鼠肺泡腔清晰,结构完整,壁光滑;气管滴注lps造成急性肺损伤模型后,肺泡壁明显水肿、增厚,炎症细胞浸润增加;给予漆黄素、实施例5化合物治疗后细胞水肿、增厚显著减弱,且炎症细胞浸润明显减少,与正常组差别不大,实施例5化合物的效果优于漆黄素,说明实施例5化合物可有效缓解急性肺损伤中肺组织损伤。
[0131]
从上述试验结果可以清楚地看出,本发明所要保护的通式ⅰ的化合物,具有良好的抗炎活性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1