抗菌肽Mel-d1、所得水凝胶及其应用的制作方法
抗菌肽mel-d1、所得水凝胶及其应用
技术领域
1.本发明属于生物肽技术领域,尤其涉及一种抗菌肽mel-d1、所得水凝胶及其应用。
背景技术:
2.由细菌感染引起的慢性伤口感染已成为世界范围内的重大医学挑战。特别是新兴的革兰氏阴性多药耐药(mdr)细菌引起了过度关注,因为目前还没有商业抗生素可以对抗它们。迫切需要开发一种新药来消除革兰氏阴性 mdr细菌,但这是一项艰巨的挑战。
3.环丙沙星是第一个表现出有效全身活性的喹诺酮类药物,已被证明对肠杆菌科细菌引起的骨髓炎、前列腺炎和败血症有效。它针对细菌dna聚合酶和dna拓扑异构酶iv。在全球范围内,大肠杆菌等肠杆菌对喹诺酮类抗生素耐药,耐药率差异很大,在亚洲可高达近100%。因此,需要开发新的抗革兰氏阴性菌方法,抗生素与抗菌肽的结合成为一个很有前景的方向。
4.抗菌肽(amp)是一类通常是短的带正电荷的肽,是不同生物体先天免疫系统的重要组成部分,因为它们对细菌、真菌、寄生虫和病毒具有广泛的抑制作用。耐药微生物的出现和对抗生素使用的日益重视,催生了amp的发展,在医药、食品、畜牧、农业和水产养殖等领域具有良好的应用前景。蜂毒肽melittin作为膜活性肽具有良好的应用前景。然而,高毒性和低稳定性限制了其应用。有必要合理设计保留或提高蜂毒肽的抗菌活性,降低蜂毒肽的溶血活性和细胞毒性以进一步应用。
5.amp的生物膜破坏机制使得抗菌肽与抗生素的结合成为一种很有前景的抗菌方法,壳聚糖作为甲壳素(第二普遍存在的天然聚合物)的n-脱乙酰衍生物,已广泛应用于各种工业领域。o-cmcs是cmcs的-nh2基团在羧甲基化后保留,-oh基团被-ch3cooh基团取代,使其比壳聚糖更易溶于水,但它们作为生物材料的力学性能有限,需要进一步设计以增强其作为生物材料的机械性能和其他功能。
6.自组装肽由于其固有的生物相容性、生物降解性和柔韧性而受到越来越多的关注,由于能够形成通过自组装制备均质纤维和纳米管。淀粉样蛋白β(a β)肽的中心疏水氨基酸序列lvff是自组装成淀粉样蛋白原纤维的关键序列,在阿尔茨海默病(ad)中起关键作用。ff是lvff的关键基序,具有优异的压电、机械、电学和光学特性,已在淀粉样蛋白自组装和抗菌材料(已证明是低毒性的)方面进行了研究,可作为一种有前途的功能性生物材料。而且,合理的分子设计可以使它们的自组装具有对体外或体内酶刺激作出反应的能力。
7.水凝胶提供的潮湿环境促进生长因子、细胞因子和趋化因子的作用,以加速伤口愈合,并且水凝胶可以显著促进伤口愈合,因为固有的互连多孔结构允许血液和组织渗出液被吸收到水凝胶中。因此,如何在合理设计高活性、低毒、低溶血的新型抗菌肽的基础上,赋予其与自组装肽相互作用的能力,并有效提高水凝胶的机械性能,这对于本领域而言将是一个挑战。
技术实现要素:
8.本发明提供了一种抗菌肽mel-d1、所得水凝胶及其应用,所得抗菌肽具有良好的抗菌活性以及低细胞毒性和低溶血活性,基于该抗菌肽进一步获得了水凝胶,不但有效提到了水凝胶的机械性能,还赋予了生物材料良好的药物滞留和缓释能力,使其具有良好的生物相容性和加速伤口愈合和组织再生的能力,可有效应用于革兰氏阴性菌引起的医学伤口感染中。
9.为了达到上述目的,本发明提供了一种抗菌肽mel-d1,其特征在于,具有如seq id no.1所示氨基酸序列。
10.作为优选,所述抗菌肽mel-d1的最小抑菌浓度为16μg/ml。
11.作为优选,所述抗菌肽mel-d1在最小抑菌浓度下的溶血活性od450为 0.284
±
0.002;所述抗菌肽mel-d1在最小抑菌浓度下的细胞毒性od450为 1.3404
±
0.1799。
12.本发明还提供了一种抗菌肽mel-d1/环丙沙星负载o-羧甲基壳聚糖/自组装肽水凝胶,通过edc/nhs反应接枝o-羧甲基壳聚糖和自组装肽,获得o
‑ꢀ
羧甲基壳聚糖/自组装肽水凝胶,然后通过引入环丙沙星和抗菌肽mel-d1制备得到。
13.作为优选,其具体通过以下方法制备得到:
14.将o-羧甲基壳聚糖溶解在蒸馏水中至2%w/v,随后将自组装肽以o-羧甲基壳聚糖:自组装肽重量比10:1的比例添加到溶液中;
15.将o-羧甲基壳聚糖溶解在蒸馏水中至2%w/v,然后将自组装肽以o-羧甲基壳聚糖:自组装肽重量比10:1的比例添加到溶液中;
16.将0.5mm 1-乙基-3-(3-二甲基氨基丙基)碳二亚胺和0.25mm磺基-n
‑ꢀ
羟基磺基琥珀酰亚胺缓慢加入上述溶液中,超声充分溶解,然后将溶液置于 4℃下过夜;
17.将结合的o-羧甲基壳聚糖/自组装肽用透析膜截留分子量为12-14kda的 mill-q水透析,每2小时等量更换一次直到24小时,获得干燥的水凝胶海绵,冷冻干燥,得到干水凝胶海绵;
18.将环丙沙星和上述任一项技术方案所述的抗菌肽mel-d1分别稀释至终浓度10μg/ml和32μg/ml,根据溶胀率滴入在干水凝胶海绵上,于4℃下凝胶化2-3小时,得到水凝胶。
19.上述步骤中,o-cmcs/sap的溶胀率为1645.22
±
186.821%,即所加入的水与干水凝胶海绵的质量比为16:1。
20.作为优选,所述自组装肽为lvff-conh2。
21.作为优选,所述水凝胶在od540值为0.167
±
0.02的条件下并未观察到溶血活性。
22.本发明还提供了一种医用敷料,采用根据上述任一项技术方案所述的抗菌肽mel-d1/环丙沙星负载o-羧甲基壳聚糖/自组装肽水凝胶制备得到。
23.本发明还提供了一种根据上述技术方案所述的抗菌肽mel-d1/环丙沙星负载o-羧甲基壳聚糖/自组装肽水凝胶作为敷料在缓释用于增强抗菌感染和伤口愈合中的应用。
24.作为优选,尤其缓释用于革兰氏阴性菌引起的抗菌感染和伤口愈合。
25.与现有技术相比,本发明的优点和积极效果在于:
26.本发明通过合理设计了基于蜂毒肽的抗菌肽,通过替换三个氨基酸为其进一步应用创造了条件,既保持了蜂毒肽良好的抗菌活性,又降低了细胞毒性和溶血活性。新抗菌肽mel-d1的作用机制被证明破坏膜结构并诱导ros 产生。
27.本发明进一步通过edc/nhs反应接枝o-cmcs和sap获得 o-cmcs/sap水凝胶,并通过引入cip以增强水凝胶的机械性能以及与mel-d1 获得更好的协同作用。更重要的是,合理的设计使mel-d1与sap之间产生更多的疏水相互作用和π-π堆积,赋予生物材料良好的药物滞留和缓释能力,使其具有更长的有效作用时间。
28.本发明最后通过体内试验,证实该材料具有良好的生物相容性和加速伤口愈合和组织再生的能力,在革兰氏阴性菌引起的医学伤口感染中显示出良好的应用前景。
附图说明
29.图1为本发明实施例提供的抗菌肽mel-d1的设计和表征,其中a) i-tasser预测的肽的二级结构,b)cd谱验证的肽的二级结构,c)抗菌肽 mel-d1的细胞毒性和溶血性;
30.图2为本发明实施例提供的抗菌肽mel-d1的作用机制,其中a)抗菌肽对大肠杆菌内膜的影响;b)通过onpg测试,诱导ros产生的能力;c)通过 npn测试,抗菌肽对大肠杆菌外膜的影响;d)膜用肽处理30分钟的大肠杆菌细胞的透化,如通过pi荧光强度的增加所测量的;e)用肽处理的大肠杆菌的 sem显微照片;
31.图3为本发明实施例提供的o-cmcs与sap共轭的ftir光谱;
32.图4为本发明实施例提供的o-cmcs和o-cmcs/sap冻干水凝胶的 sem图像和照片、溶胀率和持水能力;
33.图5为本发明实施例提供的水凝胶的流变行为;
34.图6为本发明实施例提供的cip和mel-d1的释放动力学曲线;
35.图7为本发明实施例提供的水凝胶的细胞相容性和溶血活性,其中a)水凝胶的溶血活性;b)水凝胶处理的nih-3t3细胞的相对细胞活力c)水凝胶处理的nih-3t3细胞的显微照片;d)活/死染色荧光图像;
36.图8为本发明实施例提供的水凝胶的体内伤口愈合评估;其中,第2、4、 6、8、10、12和14天不同组的大肠杆菌感染伤口的照片;
37.图9为本发明实施例提供的第2、4和14天不同组的h&e染色组织切片的显微照片(比例尺:200μm);
38.图10为本发明实施例提供的第2、4、8和14天不同组的马森毛状体染色组织切片的显微照片(比例尺:200μm);
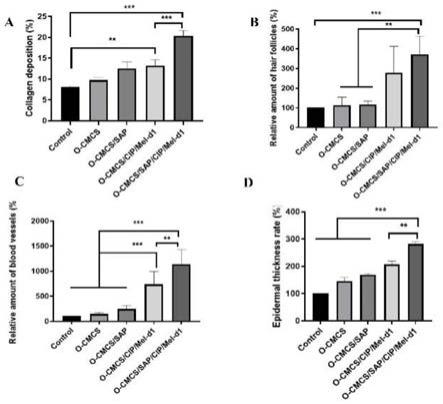
39.图11为本发明实施例提供的治疗14d后各组伤口愈合统计数据;其中, a)胶原沉积;b)毛囊的相对量;c)血管的相对量;d)表皮厚度率(实验组/对照)**p《0.05和***p《0.01;
40.图12为本发明实施例提供的治疗14天后不同组的主要器官组织切片 h&e染色的显微照片。
具体实施方式
41.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
42.实施例1抗菌肽mel-d1的设计及相关试验
43.1.1材料
44.肽(蜂毒肽、mel-d1和自组装肽lvff-conh2)由gl biochem(98%,中国上海)合成和纯化。n-苯基-1-萘胺(npn)、邻硝基苯基-β-d-吡喃半乳糖苷(onpg)、hepes缓冲液(1m ph7.4)购自macklin(中国上海)。碘化丙啶(pi)购自g-clone(中国北京)。dcfh-da购自元野(中国上海)。乳糖和蔗糖购自hushi(中国上海))。cell counting kit-8(cck-8)购自biosharp (中国北京)。十二烷基硫酸钠(sds)购自a&b(中国上海)。酵母提取物购自mdbio(中国台湾)。o-cmcs、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc)、磺基-n-羟基磺基琥珀酰亚胺(磺基-nhs)和环丙沙星(cip)购自麦克林(中国上海)。live/dead cell imaging kit购自bestbio(中国上海)。苏木精-伊红/he染色试剂盒、戊二醛和磷酸盐缓冲盐水(pbs)购自 solarbio science&technology co.,ltd.(中国上海)。masson染料溶液套装购自servicebio(中国武汉)。mtt细胞增殖和细胞毒性检测试剂盒购自太阳生物科技有限公司(中国北京)。
45.1.2抗菌肽的设计、表征和作用机制
46.使用expasy(https://web.expasy.org/protparam/)和phyre2 (http://www.sbg.bio.ic.ac.uk/phyre2/htmlx)在线进行中心对称肽的一级序列分析。每个残基的二级结构采用下述方式在线预测:
47.i-tasser(https://zhanglab.ccmb.med.umich.edu/i-tasser/)。
48.1.3cd光谱
49.采用j-815cd光谱仪(jasco,tokyo,japan)在25℃下记录肽的cd光谱,该光谱仪配备了光程长度为0.1cm的矩形石英池。光谱在25℃下测量,并以20nm/min的扫描速度从190到250nm记录,数据表示为平均残留椭圆率。在10mm pbs(模拟水性环境)、30mm sds(模拟带负电荷的原核膜可比环境)中使用最终浓度为150μm的肽测量光谱。
50.本实施例通过合理替换了蜂毒肽的三个氨基酸,获得了新抗菌肽mel-d1,其氨基酸序列如seq id no.1所示,通过调整其理化参数(表1)发现,较低的疏水性导致较低的细胞毒性但不影响通过适当增加蜂毒肽的净电荷来提高抗菌活性。i-tasser服务器的结构预测显示蜂毒肽(melittin)和抗菌肽mel-d1 为α-螺旋结构(图1a),并通过cd谱验证(图1b),但需要指出的是蜂毒肽和抗菌肽mel-d1均显示pbs缓冲液中的无序结构,而在sds(模拟带负电荷的原核膜可比环境)中,在大约208和222nm处出现两个负二向色带,显示出清晰的α-螺旋构象。
51.表1合成肽的设计和表征
[0052][0053]
1.4抗微生物活性测试
[0054]
该测试是指美国国家临床实验室标准委员会(nccls)推荐的确定最小抑制浓度(mic)的方法,该浓度被确定为未观察到细菌生长的最低抑制浓度。
[0055]
简而言之,将50μl细菌培养物(~104cfu/ml,对数中期)添加到无菌96孔板的每个孔中的50μl两倍连续稀释的肽中,并在37℃下孵育18小时。使用不含微生物细胞的培养基作为阴性对照,每个试验至少重复3次,重复6次。
[0056]
1.5溶血活性试验
[0057]
通过红细胞(rbc)评估溶血活性。简而言之,将含有抗凝剂(0.25%柠檬酸钠溶液)的小鼠新鲜血液以1000g离心5分钟以收集红细胞。rbc用 pbs洗涤三次并稀释至1%。随后,在96孔板中加入50μl不同浓度的肽和 50μl细胞溶液,37℃孵育1小时。将混合物离心(1000
×
g,5min),将上清液转移到96孔板中,在570nm处测量光密度(od)。阴性和阳性对照分别与未处理的血细胞和0.1%tritonx-100处理的血细胞一起孵育。对应于10%溶血活性的最小肽浓度定义为最小溶血浓度(mhc)。每个测定独立进行3次。
[0058]
1.6细胞增殖和细胞毒性检测
[0059]
cck-8试剂盒是一种基于wst-8的快速高灵敏度检测试剂盒,广泛应用于细胞增殖和细胞毒性检测。简而言之,将细胞接种到培养基中,在37℃、 5%co2条件下培养。培养的细胞用0.25%胰蛋白酶消化,并用培养基调整至 2~4
×
103个细胞/ml。随后,将50μl细胞悬液和50μl不同浓度的肽混合在96 孔板中,使肽的终浓度为8、16、32μg/ml,并在5%下37℃孵育4h二氧化碳。阳性和阴性对照是在无肽培养基和全培养基中未经处理的细胞。之后,每孔加入10μl cck-8,孵育4小时,用elisa酶标仪(teca nspark 10m,瑞士) 在450nm处测定各孔吸光度。进行了三个独立的实验。
[0060]
结合上述1.4-1.6测试的结果可见,设计的抗菌肽mel-d1对常见的革兰氏阴性菌和革兰氏阳性菌表现出与蜂毒肽相同的活性(表2)。此外,测试和比较了mel-d1和蜂毒肽在最低抑制浓度16μg/ml条件下的溶血活性和细胞毒性,如图1c所示,melittin和mel-d1的溶血活性od450分别为0.461
±
0.09 和0.284
±
0.002,细胞毒性的od450分别为0.9906
±
0.1383和1.3404
±
0.1799 (cck-8试剂盒的od值结果与细胞毒性呈反比)。结果表明,在与蜂毒肽活性相同的前提下,mel-d1的溶血活性和细胞毒性均显著降低,具有更好的应用前景。
[0061]
表2合成肽的最低抑菌浓度
[0062][0063]
实施例2抗菌肽mel-d1的膜通透性及活性氧测试
[0064]
2.1外膜通透性
[0065]
如前所述,荧光染料n-苯基-1-萘胺(npn)测定用于确定肽的外膜渗透性。简而言之,将大肠杆菌在lb中37℃温育至对数中期,然后以1,000
×
g离心 10分钟收获,洗涤三次
并用5mm hepes缓冲液(ph 7.4,含有5mm葡萄糖)。将npn加入无菌96孔板的细胞悬液中,使其终浓度为10μm,并测量背景荧光(激发波长=350nm,发射波长=420nm)。加入不同浓度的肽后,用荧光分光光度计测量荧光直至不再增加。
[0066]
2.2细胞质膜通透性
[0067]
使用ο-硝基苯基-β-d-吡喃半乳糖苷(onpg),一种细胞质β-半乳糖苷酶的底物,通过测量大肠杆菌中的β-半乳糖苷酶活性来评估在肽存在下细胞质膜透化的程度。简而言之,在含有2%乳糖的mhb中孵育过夜后,用10mm pbs (ph7.4,含有1.5mm onpg)将中期大肠杆菌细胞稀释至0.05的od600。在96孔中加入50μl菌液和50μl不同浓度的amps,在420nm条件下,每 3min测量一次uv吸光度值,持续60min。
[0068]
2.3活性氧
[0069]
使用荧光染料dcfh-da(一种细胞内ros指示剂)测定经大肠杆菌处理的肽中细胞内活性氧(ros)的产生。简而言之,大肠杆菌在lb中于37℃下生长至对数中期,然后用pbs洗涤三次并稀释至od600为0.6。将等体积的细菌溶液与不同浓度的肽混合在96孔板中,在37℃下与10μm dcfh-da孵育1小时。在激发波长为488nm,发射波长为525nm的条件下,用荧光分光光度计测定荧光强度。
[0070]
抗菌肽的作用机制主要包括破坏细胞膜和诱导ros产生。本实施例通过上述onpg、npn和ros测试,评估了抗菌肽对大肠杆菌内膜、外膜的影响,以及诱导ros产生的能力,并通过facs和sem进一步表征。
[0071]
其中,对于内膜穿透能力,在mic条件下,蜂毒肽在48分钟前比mel-d1 更快地破坏大肠杆菌内膜,但在2个肽段之间48分钟后破坏程度趋于相同(图2a)。这两种肽均表现出相同的外膜穿透和ros诱导作用,并且它们的诱导作用与剂量呈正相关(图2b、2c)。
[0072]
facs(bd facsverse,usa)和sem进一步表征了作用机制。用蜂毒肽和 mel-d1处理后,大肠杆菌中pi的荧光强度接近(49.09%和44.51%),表明具有相似的细胞膜破坏能力(图2d)。对于sem,明显地,与对照组中大肠杆菌完整光滑的细胞膜相比,用mic浓度的肽处理1小时的大肠杆菌表面出现波纹和孔隙。可能是大肠杆菌在膜表面产生lps。此外,还观察到膜变形以防止amp、内容泄漏,并且细菌细胞已经破裂,表明主要机制是膜的破坏(图2e)。
[0073]
实施例3抗菌肽mel-d1/环丙沙星负载o-羧甲基壳聚糖/自组装肽水凝胶 (o-cmcs/sap/cip/mel-d1水凝胶)的制备及鉴定
[0074]
3.1 o-cmcs/sap水凝胶的制备
[0075]
o-cmcs溶解在蒸馏水中至2%(w/v),并将自组装肽添加到溶液中 (o-cmcs:sap比率=10:1,w/w)。然后,将1-乙基-3-(3-二甲基氨基丙基) 碳二亚胺(edc;0.5mm)和磺基-n-羟基磺基琥珀酰亚胺(磺基-nhs;0.25mm) 缓慢加入混合物中并通过超声溶解5分钟治疗。然后,将溶液置于4℃冰箱中过夜。结合的o-cmcs/sap用mill-q水(透析膜截留分子量12-14kda)透析,每2小时更换一次等量直到24小时。最后,获得干燥的水凝胶海绵,冷冻干燥24小时。
[0076]
3.2 cip/mel-d1负载水凝胶的制备
[0077]
将cip和mel-d1分别稀释至终浓度10μg/ml和32μg/ml,根据溶胀率滴入干水凝胶海绵上。在4℃的冰箱中凝胶化2小时,之后可能存在的任何上清液残留物。
[0078]
3.3傅里叶变换红外(ft-ir)光谱
[0079]
在测试之前,将冻干的海绵样品与溴化钾(1%w/w与kbr)以颗粒形式混合。进行ftir(thermo scientific nicolet 6700,美国)以研究样品的结合效率。400到4000cm-1
之间的光谱是使用64次扫描以4cm-1
的分辨率获得的。
[0080]
为了确认结合,本实施例通过傅立叶变换红外(ftir;nicoletis10)分析所制备得到的水凝胶样品。其中,在3310-3350cm-1
处对应于仲胺nh伸缩振动以较高强度达到峰值,酰胺伸缩-c=o伸缩振动在1630-1690cm-1
处达到峰值,轻微的在1670处出现苯环特征峰,表明o-cmcs/sap成功共轭(图3)。
[0081]
实施例4形态观察、溶胀率和持水量评估
[0082]
4.1形态观察
[0083]
为了确定水凝胶(o-cmcs和o-cmcs/sap)的形态,将它们冻干并使用溅射涂布机喷涂金膜。用扫描电子显微镜(hitachis-4800,日本)在5kv下操作观察水凝胶的形态。
[0084]
4.2溶胀率(sr)评估
[0085]
将冻干海绵准确称重,然后浸入蒸馏水中10分钟。用滤纸从样品表面吸出残留水分,测定湿样品的质量。每组样品平行测试3次。使用下述公式计算溶胀率(sr):
[0086][0087]
结果表明,o-cmcs的溶胀率为1007.56
±
178.884%,o-cmcs/sap的溶胀率为1645.22
±
186.821%。
[0088]
4.3持水能力(whc)评估
[0089]
o-cmcs、o-cmcs/sap水凝胶的初始重量(ma)在37℃下溶胀平衡24h 后通过用滤纸擦拭去除多余的水来测定。然后,将样品置于60℃的烘箱中,每5分钟记录一次样品的重量,以mb为单位。每个样品测量3次。使用下述公式计算持水能力:
[0090][0091]
结果表明,o-cmcs的30min保水率为60.98%,o-cmcs/sap的30min 保水率为69.59%。
[0092]
理想的水凝胶伤口敷料应具有良好的吸附性,以确保及时吸收伤口表面多余的液体,并创造一个潮湿的环境,避免水凝胶粘附在伤口上,但又不能太湿。o-cmcs和o-cmcs/sap冷冻干燥得到海绵状材料(图4a),其中 o-cmcs呈现层状结构,层状结构表现出更好的弹性性能,o-cmcs/sap呈现出更好的弹性。无序的蜂窝状微孔,这可能是由sap的自组装产生的纤维结构以及o-cmcs和sap之间的氢键和酰胺键的相互作用引起的。 o-cmcs/sap的结构有利于氧气和营养物质的有效运输和渗透以及伤口废物的交换。
[0093]
o-cmcs水凝胶的溶胀率为1007.56
±
178.88%,o-cmcs/sap水凝胶的溶胀率1645.22
±
523.53%,与医用纱布相比,溶胀率均显著增加(图4c)。这可能与o-cmcs/sap更紧密的空间结构有关,但有趣的是持水能力的影响相反(图4b)。这是因为引入了带有疏水性氨基酸的sap,增加了材料的疏水性,导致材料与水的结合作用降低。在实际应用中,应用部位的病理情况需要无创去除,较低的保水能力使得基质在接触大量水后容易被冲洗掉。此外,较低的持水量对药物治疗后保持伤口干燥有一定的好处,有利于伤口恢复。
[0094]
实施例5流变测试
[0095]
使用流变仪(rhemeter mcr 301,奥地利)测试水凝胶(o-cmcs、 o-cmcs/sap、o-cmcs/sap/cip)的流变特性。简而言之,将600μl水凝胶放置在25毫米平行板之间,间隙为0.75毫米。使用一定的应变(通过应变扫描获得最佳应变)进行测量,频率范围为0.1-10hz,25℃。分析了水凝胶的储能模量(g')和损耗模量(g”)。
[0096]
良好的机械性能是保证凝胶敷料长期使用的关键,从而保护伤口免受二次伤害。对o-cmcs、o-cmcs/sap水凝胶,以及以抗生素作为溶剂的 o-cmcs/sap/cip、o-cmcs/cip水凝胶进行应变扫描,结果如图5,可得知其应力在0.1-100%之间的粘弹性区间,在曲线平稳区域内可取到合适的频率扫描应变值。由o-cmcs水凝胶的应变扫描图其应变在0.1-1%区间内的存储模量和弹性模量变化都较为稳定,故选取其应变值为0.5%用于频率扫描。同理,o-cmcs/sap水凝胶频率扫描应变值取为1%,o-cmcs/sap/cip水凝胶应变值取为0.5%、o-cmcs/cip水凝胶应变值取为0.4%。
[0097]
从o-cmcs水凝胶和o-cmcs/sap水凝胶的频率扫描图可看出,在频率扫描范围内的粘弹性曲线在一定程度上趋于平稳,该水凝胶样品的存储模量(g’)大于耗损模量(g”),表现为其弹力特性显著优于粘力特性,呈现出弱凝胶的特性,符合水凝胶具有片层状微观结构、多孔隙结构等特点。但是明显的,o-cmcs/sap的g’和g”都明显低于o-cmcs组,并且在8hz出开始出现相变,这体现了o-cmcs/sap作为凝胶具有较差的机械性能。
[0098]
但是不管o-cmcs组还是o-cmcs/sap组都体现了凝胶的机械性能,这是由于水凝胶网络之间存在间隙,间隙中充满了水。由于空隙较大(交联度低),水凝胶网络能够更自由地移动,因此可以承受更高的伸长率 (stretchability)。但是交联密度的增加限制了聚合物网络的运动,最轻微的拉伸都会破坏网络,从而大大降低水凝胶的拉伸性能,这与sem图片的结果可以互相印证。除此之外,交联sap后,引入了疏水氨基酸,降低了材料的保水性,这可能也是导致o-cmcs/sap机械性能较差的原因之一。
[0099]
cip的引入解决了这一问题,溶于抗生素环丙沙星(cip)的水凝胶 o-cmcs/sap/cip与用水溶解的水凝胶o-cmcs/sap相比,机械性能提升明显,与o-cmcs/cip显示出了相近的机械性能。这可能与o-cmcs/sap三维结构内部的疏水基团有关,cip的引入增加了疏水相互作用和π-π堆积,进一步增加了凝胶材料的机械性能。
[0100]
实施例6体外药物释放试验
[0101]
将加载有cip(10μg/ml)/mel-d1(32μg/ml)的100μl o-cmcs和 o-cmcs/sap水凝胶浸入1.5ml pbs(ph=7.4)中并放入37℃的培养箱中。以预定的时间间隔(前8小时内每2小时一次,随后时间段内每8小时一次),抽取1ml释放介质并补充1ml新鲜缓冲液。释放培养基与浓度为104cfu/ml 的大肠杆菌以1:1的比例混合,然后在37℃培养箱中孵育1小时。将混合物接种在lb培养基上并置于37℃培养箱中24小时。记录每个平板中的菌落数。
[0102]
上述释放实验评估了mel-d1/cip在水凝胶中的保留和持续释放能力,如图6所示,o-cmcs在32h检测出活菌,o-cmcs/sap在第40h检测出活菌,并且在104h时对应的菌落总数为156.67
±
15.01个以及114
±
5.10个,与对照组相比,o-cmcs和o-cmcs/sap在4天内均保持良好的抗菌活性,菌落总数明显低于对照组。o-cmcs/sap显示出更好的cip/mel-d1保留能力,表明自组装肽的引入可以进一步增强药物的缓释效果,提高药物的有效作用时间。这与由于sap的苯丙氨酸-苯丙氨酸(phe-phe)结构以及在mel链中引入色氨酸作为色氨酸标签
(w-tag)导致材料和药物之间增强的疏水相互作用和π-π堆积有关。同时,cip也是一种典型的疏水性抗生素。
[0103]
实施例7溶血试验及细胞相容性
[0104]
7.1溶血试验
[0105]
通过红细胞(rbc)评估溶血活性。简而言之,将含有抗凝剂(0.25%柠檬酸钠溶液)的小鼠新鲜血液以1000g离心5分钟以收集rbc。用pbs洗涤3次后,将分离的rbc以8%(v/v)的浓度悬浮于pbs中。然后,将100ml rbc 悬液与无菌96孔tcps板中的不同样品以1:1的体积比混合。37℃孵育1小时后,将tcps板以1000g离心5分钟,然后将100μl上清液转移到新的96 孔tcps板中。最后,通过测量540nm处的吸光度获得血红蛋白释放量。0.1% tritonx-100和pbs中的血红蛋白释放分别用作阳性和阴性对照。
[0106]
7.2细胞相容性
[0107]
冻干的水凝胶样品经紫外光照射30分钟灭菌,溶解于各液体中(pbs、 mel-d1、cip用0.22μm滤膜过滤,mel-d1、cip为最低抑菌浓度),然后孵育在12孔板上37℃培养24小时。将2.0ml dmem细胞培养基覆盖在水凝胶上,孵育24小时,然后收集备用。
[0108]
使用100μl已用于孵育水凝胶的培养基代替原始培养基进行细胞毒性测试。每组由六个平行重复组成。培养24小时后,加入10μlmtt,浓度为 5mg/ml,再培养4小时,然后用150μl二甲亚砜置换培养基溶解沉淀。通过elisa读数器在490nm处测量吸光度。接下来,为了进行生死分析,将它们的等分试样(100μl)加入到96孔tcps板的孔中,然后在37℃下孵育 24小时。然后,将nih-3t3细胞(4
×
104个细胞/ml,100μl)加入到24孔板中。在37℃和5%co2下孵育24小时后,去除过量溶液并用pbs洗涤孔3 次。然后,将细胞用1μg/ml钙黄绿素-am和5μg/ml碘化丙啶(pi)在室温下染色15分钟。除去染料溶液后,接种的细胞用pbs洗涤3次,立即用激光共聚焦显微镜(fv1200,olympus,japan)观察。
[0109]
生物相容性是水凝胶体内生物医学应用的主要问题。为了初步研究水凝胶的生物相容性,测试了水凝胶的细胞相容性和血液相容性。
[0110]
通过标准的3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑(mtt)测定进一步评估水凝胶的细胞相容性,并通过活/死分析(calcein-cm/pi)进一步表征。对于细胞毒性,mtt结果显示各实验组相对细胞存活率都接近100%,未观察到对水凝胶提取物的显著细胞毒性(图7b、7c、7d)。细菌在各组水凝胶提取的缓冲液中培养24小时后,均呈绿色荧光,未观察到明显的红色荧光,与 mtt结果一致。表明本实验中的水凝胶样品具有良好的细胞相容性,表明该水凝胶可用于生物应用,而不会对生物生长产生负面影响。通过溶血试验进一步研究了水凝胶的血液相容性,其溶血活性显示o-cmcs/cip/mel-d1和 o-cmcs/sap/cip/mel-d1的od540值分别为0.139
±
0.01和0.167
±
0.02,相比于阴性对照组并未观察到明显的溶血活性(图7a)。
[0111]
实施例8体内伤口愈合试验
[0112]
8.1体内伤口愈合试验
[0113]
雄性balb/c小鼠随机分为5组:对照组(不进一步治疗)、o-cmcs组、 o-cmcs/sap组、o-cmcs/mel-d1/cip组和o-cmcs/sap/mel-d1/cip组(分别覆盖o-cmcs、o-cmcs/sap、o-cmcs/mel-d1/cip、 o-cmcs/sap/mel-d1/cip水凝胶敷料)。在麻醉下对小鼠的背表面进行脱毛。在每只小鼠的背部制作两个直径为5mm的部分厚度伤口。将含有对数中期大肠杆菌
(108cfu/ml)的50μl悬浮液接种在小鼠的每个伤口上,并使其吸收到组织中10分钟。制备的水凝胶直接应用于伤口。
[0114]
手术后,o-cmcs、o-cmcs/sap、o-cmcs/mel-d1/cip、 o-cmcs/sap/mel-d1/cip组的伤口区域被水凝胶敷料完全覆盖并使用 tegaderm固定(3m)。前4天每2天换一次敷料,以后4天换一次敷料,第2、 4、8、10、12、14天用数码相机拍摄创面照片。皮肤组织标本用10%福尔马林溶液固定,石蜡包埋,制备病理切片。样品经苏木精伊红(h&e)和masson 三色染色后,用光学显微镜(nikon/ni-e,日本)观察组织学图像。收集主要器官,包括心脏、肝脏、脾脏、肺和肾脏,并用h&e染色进行组织学分析。所有动物护理和实验均经中国海洋大学动物调查伦理委员会审查批准(编号: spxy2017050402)。
[0115]
8.2统计分析
[0116]
所有数据均表示为平均值
±
标准偏差,基于一式三份或更多次进行的实验。通过spss18.0统计软件(spssinc.,chicago,il,usa)使用单因素方差分析(anova)确定统计显著性,统计显著性差异显示为**p《0.05, ***p《0.01,****p《0.001。
[0117]
本实施例采用皮肤伤口模型来评估水凝胶的伤口修复功效,并进一步评估了组织学检查,包括h&e和马森三色染色。h&e显示,未使用抗菌剂(cip 和mel-d1)的第二天伤口因炎症反应有大量中性粒细胞,证明大肠杆菌感染成功(图10)。治疗后,拍摄照片以监测伤口愈合过程(图8)。与对照组和其他实验组相比,o-cmcs/sap/cip/mel-d1水凝胶显著加速伤口闭合(图8),尤其是在治疗早期。并且o-cmcs/sap/cip/mel-d1组显示出更快的结痂形成。 o-cmcs/sap/cip/mel-d1组第10天和o-cmcs/cip/mel-d1组第12天观察到明显的伤口闭合。治疗14天后,o-cmcs/cip/mel-d1、 o-cmcs/sap/cip/mel-d1水凝胶处理的创面无开放性创面,新生表皮组织变得光滑,而对照创面,o-cmcs和o-cmcs/sap组未完全闭合,疤痕不均匀。结果表明,o-cmcs/sap/cip/mel-d1水凝胶加速了伤口闭合和皮肤再生。
[0118]
h&e和masson染色用于进一步评估上皮再生、血管和毛囊再生以及胶原蛋白沉积(图9、10)。o-cmcs/sap/cip/mel-d1组观察到肉芽组织形成并被表皮覆盖并形成新的真皮层。此外,伤口处出现毛囊,胶原纤维更丰富。其中,o-cmcs/sap/cip/mel-d1组胶原沉积比例最高(21.271%),明显低于对照组(8.331%),显示出丰富、致密、排列整齐的胶原在14天内(图11a)。
[0119]
此外,沉积的胶原蛋白呈线状、篮状编织结构,表明o-cmcs/sap/cip/mel-d1处理14天后皮肤几乎完全再生,证明了sap对皮肤加速愈合的独特作用。o-cmcs/cip/mel-d1和o-cmcs/sap/cip/mel-d1组均显著促进新毛囊的形成(图11b)。
[0120]
对于血管生成(图11c),与对照组相比,o-cmcs/cip/mel-d1和 o-cmcs/sap/cip/mel-d1组在o-cmcs/sap/cip/mel-d1组(毛囊相对量 371.1%)高于o-cmcs/cip/mel-d1组(277.7%)。这可能是由于引入了自组装肽,产生了更密集的空间结构并有利于血管生成,但在o-cmcs、 o-cmcs/sap组之间没有观察到显著差异。这可能是皮肤恢复较差的情况,因为更严重的感染和炎症会支持氧气和营养物质的运输以及皮肤附着物。再生。然而,在实际应用中,o-cmcs和o-cmcs/sap之间没有明显的不同效果。这可能表明在伤口感染中,消除炎症的优先级高于组织修复,突出了材料和药物协同作用的重要性,有助于放大各自的优势。在第14天,所有治疗组都形成了新表皮,而o-cmcs/sap/cip/mel-d1的治疗产生了最厚的表皮(图 11d)。
[0121]
此外,各组主要器官(心、肝、脾、肺、肾)的组织学分析显示,治疗 14天后组织结构完好,无异常缺陷或损伤(图12),表明 o-cmcs/sap/cip/mel-d1水凝胶是一种安全伤口愈合治疗材料。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1