使用发卡寡核苷酸扩增核酸的方法与流程
使用发卡寡核苷酸扩增核酸的方法
1.本技术是申请日为2014年3月14日申请号为2014800274090、发明创造名称为“使用发卡寡核苷酸扩增核酸的方法”的专利申请的分案申请。
技术领域
2.本发明与核酸扩增的方法有关,具体地,使用发夹寡核苷酸扩增核酸。
背景技术:
3.对本领域技术人员而言有许多已知的扩增核酸的方法。提供从一样本中特异性地捕获一目标核酸的方法,有助于纯化、扩增和/或检测该特异性目标。本发明提供了捕获特异性核酸以进行包括扩增和测序在内的进一步操作的方法。
技术实现要素:
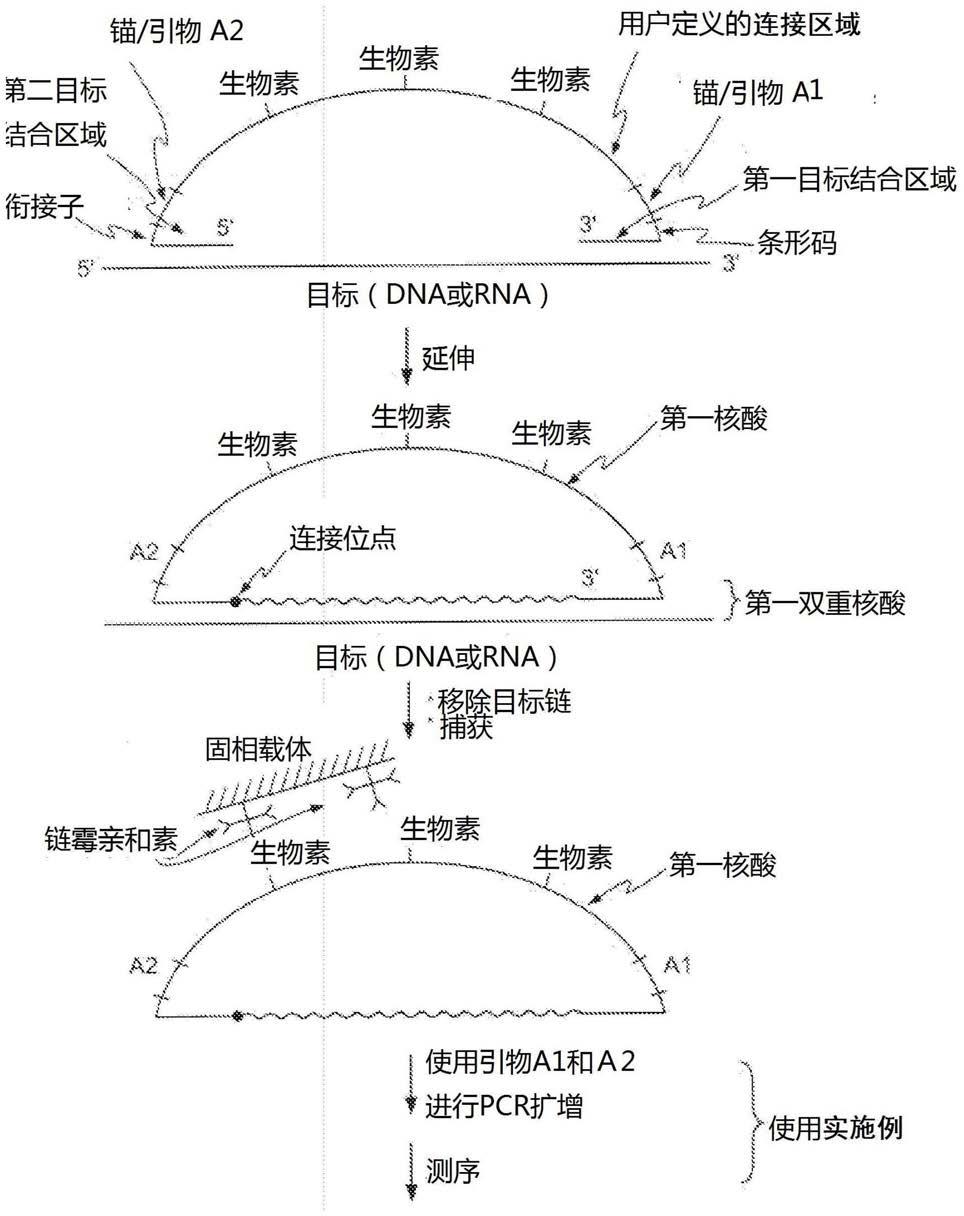
4.本发明提供了固定和扩增一目标核酸的方法。在一方法中,一发夹寡核苷酸与一目标核酸混合。所述发卡寡核苷酸含有在所述3’端的一第一目标结合区域和在所述5’端的一第二目标结合区域和两者之间的用户定义的连接区域。所述连接区域可包括多种的用户定义的序列或原件,譬如,所述连接区域可包括一个或多个下列原件或其任意的组合:一引物位点、一锚位点和/或一条形码序列。优选的,所述连接区域包括至少一个捕获原件和至少一个引物结合位点。
5.所述发夹寡核苷酸的所述第一和第二目标结合区域退火后与所述目标核酸结合,所述发夹寡核苷酸通过聚合酶从其3’端向5’端延伸以产生一第一双重核酸。所述第一双重核酸包括一第一核酸和所述目标核酸。所述第一核酸的末端由连接酶连接以产生一环状核酸。所述环状核酸从所述目标核酸移除,然后通过由一固相载体所提供的一捕获手段捕获。捕获也可由本领域已知的多种方法所实现。优选的,所述捕获手段与所述连接区域的所述捕获原件结合。可选择地,所述环状第一核酸/目标复合物可被捕获至一固相载体上,然后所述第一核酸与所述目标核酸分离。
6.能够与所述连接区域的至少一个引物结合位点结合的一引物与所述环状核酸混合,通过聚合酶延伸一产生一含有一第二核酸和一第一核酸的第二双重核酸。所述第二核酸,或所述扩增的目标核酸,从所述第一核酸移除,现在可进行后续操作步骤,包括使用pcr扩增、捕获、检测和/或包括第二代测序的测序。
7.本发明的其他方面参见于所述说明书的全文中。
附图说明
8.图1是本发明中一个方法的示意图。
具体实施方式
9.除非特别说明,此处所用的所有术语都与本发明所属的本领域技术人员所通常理
解的含义相同。此处公开全文所引用的所有专利、专利申请和出版物都以它们全文的形式被引用。若此处的某一术语含有多重的定义,则以本部分最通常的定义为准。
10.此处所用术语“寡核苷酸”指核苷酸的一聚合物形式,核糖核苷酸或脱氧核糖核酸,含有天然或非天然的核苷酸,长度至少为2,通常在约5至约200,或者更常见地至约100。因此,该术语包含双链和单链dna和rna。此外,寡核苷酸可抗核酸酶,包括但不限于2
’‑
o
‑
甲基核糖核苷酸、硫代核苷酸、二硫代核苷酸、磷酰胺核苷酸和甲基膦酸酯核苷酸。
11.此处所用术语“目标”、“目标序列”或者“目标核苷酸”指一含有一所关注的多聚核苷酸的核酸,需要对其进行纯化、分离、捕获、固定、扩增、鉴定、检测、定量、质量测定和/或测序以及类似操作。所述目标序列就其实际序列而言可已知或未知。
12.此处所用术语“引物”或“引物序列”是指含有挑选到的与将扩增的每一特定序列基本上互补的序列的核酸。更具体地,引物是与它们相应的目标杂交充分互补的。因此,所述引物序列不需要准确地反映所述目标的精确的序列。所述引物中可散布非互补碱基或更长的序列,只要所述引物序列与所述目标核酸的序列具有足够的互补性以允许杂交和延伸。
13.此外,引物可抗核酸酶并包括经过修饰以阻止核酸外切酶降解的引物。在一些实施方案中,所述引物已经过修饰以保护不被3’或5’端核酸外切酶的活性所降解。这些修饰包括但不限于2
’‑
o
‑
甲基核糖核苷酸修饰、硫代骨架修饰、二硫代骨架修饰、磷酰胺骨架修饰、甲基膦酸酯骨架修饰、3’端磷酸修饰和3’烷基取代。在一些实施方案中,在一扩增反应中施用的所述引物和/或探针通过一种或多种修饰保护不被3’或5’端核酸外切酶的活性所降解。
14.技术人员能够设计和准备适于延伸一目标序列的引物。此处提供的应用于所述方法和组分的引物的长度取决于多种因素,包括鉴定所述核苷酸序列特性及这些核酸在杂交或在体外核酸延伸时的温度。对具备通常手段的人员而言,其知晓决定上述针对具有一特定序列特性的所述引物的优选长度所要考虑的事宜。
15.术语“载体”或“固相载体”指传统的载体,其包括,如微量滴定孔、玻璃粉、微粒或纤维的聚合物,和诸如载玻片、试管等捕获分子与之共价键或非共价键结合的硅烷或硅酸盐载体。
16.此处所用术语“样本”指本质上任何含有所期望的目标核酸的样本,包括但不限于分离自一人或一动物的组织或体液,包括但不限于,譬如,血液、血浆、血清、脊髓液、淋巴液、眼泪或唾液、尿液、精子、粪便、痰液、呕吐物、胃吸出物、支气管吸出物、棉签拭样(鼻咽的、直肠的、眼的、泌尿生殖器的等)、器官、肌肉、骨髓、石蜡包埋组织、皮肤、肿瘤和/或获取自所述生物体任何部分的细胞;植物材料、细胞、液体等;一单独的细菌、菌群及其培养物、食物、化妆品、药品/药物、通过生物工艺准备的材料(终产品和中间材料)、水、环境样品,包括但不限于,譬如,土壤、水和空气;从以上所列所述来源中获得的半纯化或纯化的核酸,诸如,作为一过程的结果的核酸,如测序的模板形成,包括下一代测序、样本处理、核酸酶消化、限制酶消化、复制或类似。
17.此处所用术语“扩增”指产生与一完整的目标核酸序列或其一部分或作为所述目标核酸序列的一替代物的通用序列的相同或互补的核酸链的过程。
18.此处所用术语“固定”指一分子,诸如所述第一和第二寡核苷酸与一固相载体相连
protocols in molecular biology,john wiley&sons,secaucus,n.j.(1994)。此处所用术语“基本上互补”指与所结合的核酸完全互补,在某些情况下指一条相同的序列,以及互补性足够达到与所期望的核酸结合。相应地,术语“互补杂交”包括基本上互补杂交。
26.此处所用术语“锚定序列”或“锚”指一用户定义的、通常通过一标签序列融合增加到一核酸目标序列的序列。所述锚可被用于促进后续处理,如测序,譬如纯化、捕获、固定或通过其他方法分离具有所述锚的所述目标核酸。
27.通常的扩增核酸序列的方法已在本领域被充分描述并且众所周知。任何这样的方法都可以与本发明所述的方法一起施用。在一些实施方案中,用数字pcr方法进行所述扩增,如文献中所描述,譬如,vogelstein和kinzler(“digital pcr,”pnas,96:9236
‑
9241(1999),此处引用其全文作为参考)。这些方法包括在扩增所述目标区域前,稀释含有所述目标区域的所述样本。稀释可包括稀释到传统的平板、多孔板和纳孔中,以及稀释到微板和微滴上。(参见,如,beer nr,et al“on
‑
chip,real time,single copy polymerase chain reaction in picoliter droplets,”anal.chem.79(22):8471
‑
8475(2007);vogelstein and kinzler,“digital pcr,”pnas,96:9236
‑
9241(1999);和pohl and shih,"principle and applications of digital pcr,”expert review of molecular diagnostics,4(1):41
‑
47(2004),此处引用其全文作为参考)。在一些实施方案中,所述扩增通过数字pcr进行。
28.在一些实例中,用本发明所示方法扩增所述目标区域的所述酶包括但不限于高保真dna聚合酶,譬如有3
’‑5’
端核酸外切酶校正能力的dna聚合酶。能够用于所述方法的酶包括但不限于amplitaq、phusion hs ii、deep vent和kapa hifi dna聚合酶。
29.高保真酶能够使一目标序列高保真(高精确)扩增。在一些实施例中,所用的酶包括高保真dna聚合酶,譬如有3
’‑5’
端核酸外切酶校正能力的dna聚合酶。能够用于所述方法的酶包括但不限于amplitaq、phusion hs ii、deep vent和kapa hifi dna聚合酶。
30.所述扩增产物能通过使用一些本领域技术人员知晓的方法进行检测或分析,这些方法包括但不限于,荧光、电化学检测、凝胶分析和测序。进一步地,所述产物能使用本领域技术人员知晓的一些方法如实时扩增进行定量。定量能够通过与所谓管家基因,如肌动蛋白、gapdh或与在可以所述反应中加入的已知量的一内参相比较进行标准化。这些方法是已知的,并且在sambrook和russell的molecular cloning:a laboratory manual(3rd ed.)(2001)中描述。
31.用仪器来实施此处所述的方法可以随时进行。这些仪器可包括进行实时和终点pcr试验、乳剂pcr、固相pcr、熔解曲线分析和测序分析的仪器。这些仪器包括7500fast dx实时仪器(其还能够进行高分辨熔解曲线分析)(life technologies,carlsbad,usa)和所述3500xl毛细管凝胶仪。其他本领域所已知的将有益于本发明所述方法的仪器也应被本领域技术人员在实施本发明的所述方法时考虑在内加以使用。
32.本发明是使用一发夹寡核苷酸选择性地捕获所关注的一目标核酸并为进一步操作准备一目标模板的方法。譬如,一发夹寡核苷酸与所述目标核酸的复合物可被用于产生一环状的模板。然后该模板可被分离进行后续操作,譬如,扩增、检测、定量和包括第二代测序的测序。
33.在一实施方案中,所述发夹寡核苷酸包括两个目标核酸结合区域,每端一个,由一连接区域分开。该连接区域可包括多种功能序列,包括,譬如一个或多个引物位点(如,位于
所述连接区域相反的末端但是在所述目标结合区域中的引物位点)、一个或多个锚定位点、一个或多个衔接子位点、一个或多个检测位点、一个或多个测序引物结合位点和/或一个或多个条形码序列。所述连接区域也提供所需的长度,该长度能够使得所述连个目标结合区域在所述目标的所期望的位置上结合。
34.在另一实施例中,所述连接区域为实现所期望的特定功能可进一步包括其他化学分子,譬如能够被用于影响目标捕获的分子可被定位于沿所述连接区域上的一个或多个位点。譬如,生物素融合于所述发夹寡核苷酸的一个或多个位点上促进所述发夹寡核苷酸/目标核酸复合物固定到一链霉亲和素修饰的固相载体上。同样地,地高辛融合于所述发夹寡核苷酸的一个或多个位点上促进所述发夹寡核苷酸/目标核酸复合物固定到抗地高辛抗体修饰的固相载体上。可替换地,一包括于所述发夹寡核苷酸的所述连接区域中的特异性的、用户定义的捕获序列促进所述发夹寡核苷酸/目标核酸复合物固定到固相载体上,该载体上结合有与所述特异性捕获序列互补的序列。
35.在一个方面,所述目标结合区域含有与所关注的所述目标核酸互补的序列,因此促进特异性结合。在本发明的一方法中,所述发夹寡核苷酸与一含有所关注的目标结合或混合。在这一例子中,所述发夹寡核苷酸经修饰沿所述连接区域含有生物素。所述发夹寡核苷酸的两个目标结合区域退火后与所述目标核酸结合。对这些区域进行选择,以使其相互之间在所述目标核酸序列中为期望的距离。所述发夹寡核苷酸从3’端至5’端延伸,所述末端通过连接酶连接以产生一环状核酸,其含有与所述目标序列的一部分互补的序列和所述发夹寡核苷酸。所述环状核酸从所述目标核酸中移除并使用,譬如,一链霉亲和素修饰的(或者其他合适的结合伙伴)固相载体从溶液中捕获,该载体将与一生物素化的发卡寡核苷酸紧密结合。
36.所述捕获的环状核酸现在进行后续操作。譬如,所述环状核酸能使用本领域已知的方法扩增,包括pcr和滚环扩增。引物位点可被选择位于与所述原始目标核酸结合的序列中,或者位于所述用户定义的连接区域中,或者是上述两者的结合。如果引物在所述连接区域中,所述相同的引物能被用于从多重目标核酸产生不同的发夹寡核苷酸,从而以一多样形式进行普遍扩增。进一步地,譬如衔接子、条形码序列和测序引物位点,能被用于简单地产生包括第二代测序的测序用的模板。同样,在所述发夹寡核苷酸产生的环状模板中的目标核酸可直接进行测序。也可以进行本领域技术人员已知的其他功能。
37.在该实施方案的另一方面,所述发夹寡核苷酸的所述目标结合区域可以是随机的,使其在诸如全基因组或全转录组扩增的应用中与所述基因组或转录组中的所有序列结合。可选择地,所述目标结合区域可以是半随机的,其被设计包括部分所述目标核酸的特异性序列,譬如所述基因组的特定区域,也包括部分随机区域,可与许多不同的所述目标区域中的潜在区域结合。所述目标结合区域随机化程度也可更低,譬如,其被设计与特定的核酸类型,如非核糖体rna转录本结合。
38.上述的信息为本领域技术人员提供一完整的披露,并描述了如何制造和使用所述仪器和方法的实施方案,且其意图并不限于发明人在其发明中提及的范围。对于上述模式的修改(对本领域技术人员而言实施所述发明是显而易见的)被确定为在下述权利要求的范围内。在本说明书中所引用的所有的出版物、专利和专利申请均被包含作为参考。譬如,在所述不同的方法中所引用的许多所述清洗的步骤是可选择的,就如一些将两条核酸链相
互去除和/或分开的步骤。不实施所述清洗和/或分离步骤的至少一些步骤会使得工作流程更快速、更简单和更经济,并且也能达到所期望的结果。在另一实例中,在所述已例证的方法中逐步地增加/结合某些寡核苷酸和/或目标核酸也能被结合。进一步地,多种聚合酶、延伸条件和其他本领域技术人员已知的扩增方法能在上述方法中的不同的步骤或步骤组合中来使用。其他对本领域技术人员而言对所公开的方法明显的改进也包括在本发明中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1