一种核素标记的配合物及其制备方法和应用
1.本发明涉及疾病诊疗技术领域,尤其涉及一种核素标记的配合物及其制备方法和应用。
背景技术:
2.肿瘤相关成纤维细胞(cancer associated fibroblasts,cafs)是肿瘤微环境中的主要细胞类型,几乎存在于所有实体瘤中,占到肿瘤组织细胞总数的50%左右。成纤维细胞活化蛋白(fibroblast activation protein,fap)是一种可以促进cafs的募集、分化和增殖的丝氨酸蛋白酶。其主要存在于肿瘤相关成纤维细胞、间充质细胞和肿瘤细胞表面,是ii型跨膜丝氨酸蛋白酶家族的一员,具有二肽酶和胶原酶活性。fap选择性地上调于90%以上的上皮恶性肿瘤的基质成纤维细胞表面,包括乳腺癌、卵巢癌、肺癌、结直肠癌、胃癌、胰腺癌、皮肤黑色素瘤等。除肿瘤之外,在一些炎性部位也有表达,如创面愈合、瘢痕组织、骨关节炎、类风湿关节炎、心肌炎、肝纤维化、肺纤维化、肝硬化等。而在正常的组织中表达很低,仅存在于宫颈和子宫内膜,并在胚胎发育过程中短暂表达。因此,将其作为疾病核素成像及治疗的关键靶点是一种有前途的策略。
3.在本领域中,fap抑制剂(fapi)作为应用于肿瘤治疗的方案受到广泛关注。与fdg显像相比,fapi显像在脑、肝脏等器官具有更低本底,对于肿瘤病灶有更高的检出率。但到目前为止,fapi类探针在治疗方面还没有表现出特别好的效果,其生物活性往往比较低,在病灶部位的摄取较低。此外,从配体的选择来看,单体与受体的结合呈现一一对应的关系,与受体结合的稳固性较差,偏低的病灶摄取极大限制了诊疗效果。
技术实现要素:
4.本发明的目的在于解决现有技术中的上述问题,提供一种核素标记的配合物及其制备方法和应用,具有制备简单、稳定性好、肿瘤摄取高滞留久等优点,适于临床推广。
5.为达到上述目的,本发明采用如下技术方案:
6.一种核素标记的配合物,配体化合物的结构式如下:
7.8.其中:r1为核素标记基团;l为
‑
och2ch2‑
,并通过化学键连接喹啉酸衍生的成纤维细胞活化蛋白抑制剂结构;r1与两个l结构通过谷氨酸连接剂进行连接;n取0
‑
10的整数;
9.核素包括
177
lu、
90
y、
18
f、
64
cu、
68
ga、
62
cu、
67
cu、
64
gd、
86
y、
89
zr、
99m
tc、
89
sr,
153
sm、
149
tb、
161
tb、
186
re、
188
re、
212
pb、
213
bi、
223
ra、
225
ac、
226
th、
227
th、
123/124/125/131
i、
211
at或
111
in中的至少一种,优选
177
lu、
99m
tc、
18
f、
68
ga、
90
y及
225
ac中的至少一种。
10.所述核素通过配体化合物结构中的核素标记基团r1进行螯合。
11.所述核素采用
123/124/125/131
i、
18
f,其可通过如下带核素结构与配体化合物置换引入:
[0012][0013]
所述核素标记基团r1选自以下任意一种结构:
[0014][0015][0016]
本发明中,当所述
‑
(l)
n
‑
采用
‑
(och2ch2)3‑
,r1采用
时,所述配体化合物分别为(fp3)2ed、(fp3)2en或(fp3)2eh,其结构分别如下所示:
[0017]
[0018][0019]
所述核素标记的配合物的制备方法,采用湿法或冻干法进行制备。
[0020]
所述湿法步骤如下:将所述配体化合物溶于缓冲溶液或去离子水中,然后加入含放射性核素的溶液,室温至100℃反应10~30min,然后用生理盐水或注射用水稀释,进无菌滤膜过滤即生成放射性核素标记的配合物注射液。
[0021]
所述冻干法步骤如下:将所述配体化合物溶于缓冲溶液或去离子水中,分装于冻干容器中,经冷冻干燥后密封成冻干药盒,可根据需要在冻干药盒加入相关赋形剂、抗氧化剂或酸碱调节剂;在冻干药盒中加入去离子水或缓冲液溶解,再加入含放射性核素的溶液,室温至100℃反应10~30min,用生理盐水或注射用水稀释,进无菌滤膜过滤即生成放射性核素标记的配合物注射液。
[0022]
所述核素标记的配合物的应用,应用于制备检测与成纤维细胞活化蛋白相关的疾病或病症的产品中的应用。
[0023]
所述核素标记的配合物被制备成注射剂,通过静脉注射给药;所述的病症包括肿瘤或炎症;所述肿瘤包括但不限于卵巢癌、肺癌、结直肠癌、前列腺癌、肺癌、纤维肉瘤、骨骼
及结缔组织肉瘤、肾细胞癌、胃癌、胰腺癌或皮肤黑色素瘤;所述炎症包括但不限于、类风湿关节炎、肉芽组织、肝纤维化、肺纤维化或肝硬化;显像方式包括单光子发射计算机断层成像术(spect)和正电子发射断层成像术(pet)。
[0024]
相对于现有技术,本发明技术方案取得的有益效果是:
[0025]
本发明通过两个fap抑制剂单体和配位基团以特定的化学形式相连接形成二聚体,二聚体靶向基团的引入及不同连接剂的合理组合,可增强配体与受体之间的亲和力。相较于单体配合物,本发明二聚体中两个fapi单元之间的距离及连接基团可以显著影响探针的活性,生物性能得到有效提高。
[0026]
本发明通过引入二聚体结构增加探针与受体之间的靶向性及亲和力,进而显示出优秀的生物体内分布性质。此外,由于靶向基团和双功能螯合基团之间的分子骨架具有高度可修饰性、可改造性,因此可以根据实际需要调节两个靶向单元之间的距离,增强配体化合物的稳定性。
[0027]
相比于现有技术,本发明具有适宜的代谢动力学性质及较高的病灶摄取和滞留时间,靶/非靶比值高,可以达到更好的诊断及治疗效果,是目前其它fapi显像剂所不具备的,更加有利于该类探针的商业化应用与临床推广。
附图说明
[0028]
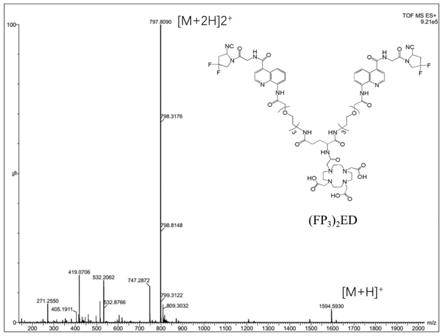
图1为化合物(fp3)2ed的质谱图。
[0029]
图2为化合物(fp3)2en的质谱图。
[0030]
图3为化合物(fp3)2eh的质谱图。
[0031]
图4为化合物(fp3)2ed的hplc谱图。
[0032]
图5为化合物(fp3)2en的hplc谱图。
[0033]
图6为化合物(fp3)2eh的hplc谱图。
[0034]
图7为化合物
68
ga
‑
(fp3)2en的hplc谱图。
[0035]
图8为化合物
18
f
‑
(fp3)2en的hplc谱图。
[0036]
图9为化合物
99m
tc
‑
(fp3)2eh的hplc谱图。
[0037]
图10为化合物
99m
tc
‑
(fp3)2eh在生理盐水中的稳定性hplc鉴定图。
[0038]
图11为化合物
18
f
‑
(fp3)2en在体外生理盐水稳定性hplc鉴定图。
[0039]
图12为化合物
18
f
‑
(fp3)2en在血清稳定性hplc鉴定图。
[0040]
图13为
99m
tc
‑
(fp3)2eh在fap高表达的荷瘤小鼠中0.5、1、2、4h的小动物spect显像。
具体实施方式
[0041]
下文将结合具体实施例对本发明的化合物及其制备方法和应用做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
[0042]
一种基于喹啉酸衍生的fapi二聚体配体化合物的结构式如下:
[0043][0044]
其中:r1为核素标记基团;l为
‑
och2ch2‑
,并通过化学键连接喹啉酸衍生的成纤维细胞活化蛋白抑制剂结构;r1与两个l结构通过谷氨酸连接剂进行连接;n取0 10的整数。
[0045]
在以上基于喹啉酸衍生的fapi二聚体配体基础上,进一步提供一种放射性核素标记的fap靶向配合物,其可以作为fap高表达的肿瘤诊断及核素靶向治疗探针。所述核素可以选择
177
lu、
90
y、
18
f、
64
cu、
68
ga、
62
cu、
67
cu、
64
gd、
86
y、
89
zr、
99m
tc、
89
sr,
153
sm、
149
tb、
161
tb、
186
re、
188
re、
212
pb、
213
bi、
223
ra、
225
ac、
226
th、
227
th、
123/124/125/131
i、
211
at或
111
in中的至少一种,优选
177
lu、
18
f、
68
ga、
90
y及
225
ac。所述核素可以通过所述的双功能螯合基团进行螯合,也可以通过如下带核素结构引入:
[0046][0047][0048]
对于金属离子,所述放射性标记探针可以通过含放射性核素的化合物与式(i)化合物按照现有的多种标记方法制备得到;本发明优选的标记方法为湿法或冻干法。
[0049]
所述湿法步骤如下:将所述配体化合物溶于缓冲溶液或去离子水中,然后加入含放射性核素的溶液,室温至100℃反应10~30min,然后用生理盐水或注射用水稀释,进无菌滤膜过滤即生成放射性核素标记的配合物注射液。
[0050]
所述冻干法步骤如下:将所述配体化合物溶于缓冲溶液或去离子水中,分装于冻干容器中,经冷冻干燥后密封成冻干药盒,可根据需要在冻干药盒加入相关赋形剂、抗氧化剂或酸碱调节剂;在冻干药盒中加入去离子水或缓冲液溶解,再加入含放射性核素的溶液,室温至100℃反应10~30min,用生理盐水或注射用水稀释,进无菌滤膜过滤即生成放射性核素标记的配合物注射液。
[0051]
具体的,冻干法中分装用容器优选为冻存管或管制抗生素瓶,还可根据药盒冻干粉成型情况选择在药盒中增加赋形剂或抗氧化剂,比如甘露醇、抗坏血酸等,并通过调节式
(i)化合物及赋形剂的用量,使药盒成型达到最佳。所述缓冲溶液为稳定反应液ph值的物质,可以为醋酸盐、乳酸盐、酒石酸盐、苹果酸盐、马来酸盐、琥珀酸盐、抗坏血酸盐、碳酸盐和磷酸盐,以及它们的混合物等。
[0052]
如标记率及放射化学纯度较低,本发明提供一种优选纯化方式为:取一sep
‑
pak c18分离小柱,先后通过10ml无水乙醇及10ml水进行活化淋洗。加水稀释反应液后经sep
‑
pak c18色谱柱分离纯化,以缓冲液或水冲洗色谱柱以除去未反应的放射性离子,以乙醇溶液淋洗得到放射性核素标记的配合物,通过氮吹除去有机溶剂,再经生理盐水或注射用水稀释后无菌过滤,即得到放射化学纯度较高的放射性标记配合物的注射液。
[0053]
实施例1:
[0054]
1、fapi
‑
p3的制备
[0055]
将化合物1与化合物2溶解于二甲基甲酰胺dmf中,加入适量hatu及dipea反应1小时,浓缩除去溶剂并通过柱纯化得喹啉酸衍生的fapi化合物3。将化合物3与boc(t
‑
butyl carbamate,叔丁氧羰基)保护的peg3(化合物4)溶于二甲基甲酰胺(dmf)中,加入适量hatu及dipea反应4h,浓缩除去溶剂。随后加入三氟乙酸(tfa)并于室温下反应30min,脱去boc保护基。反应结束后倒入冰乙醚中析出固体,通用过半制备高效液相色谱法分离,收集目标产物峰并冻干保存,得到fapi
‑
p3。
[0056]
2、(fp3)2e的制备
[0057]
将化合物5与fapi
‑
p3溶于二甲基甲酰胺(dmf)中,加入适量hatu及dipea反应1小时,浓缩除去溶剂。随后加入三氟乙酸(tfa)并于室温下反应30min,脱去boc保护基。反应结束后倒入冰乙醚中析出固体,通用过半制备高效液相色谱法分离,收集目标产物峰并冻干保存,得到(fp3)2e。
[0058]
3、(fp3)2ed的制备
[0059]
将dota
‑
nhs和(fp3)2e溶于dmso溶液中,加入适量dipea,室温反应8~12h。产品经用半制备高效液相色谱法分离,收集目标物馏分并冻干,得到配体(fp3)2ed。如图1所示经质谱分析确认为目标产物,如图4所示为hplc图。
[0060]
4、(fp3)2en及(fp3)2eh的制备
[0061]
带有nota基团的前体化合物(fp3)2en及带有hynic基团的前体化合物(fp3)2eh合成步骤与(fp3)2ed类似。(fp3)2en及(fp3)2eh的质谱分析图谱如图2~3所示。(fp3)2en及(fp3)2eh的hplc图分别如图5~6所示。
[0062]
其余基于(i)结构的前体的制备方法均可参考f2p3eh、f2p3ed及f2p3en的合成过程,其区别在于将核素标记基团进行相应替换,即可得到相应的前体化合物结构。
[0063]
以上以式(i)结构为基础的前体化合物(fp3)2eh、(fp3)2ed及(fp3)2en的合成路线如下:
[0064][0065][0066]
实施例2:
[0067]
68
ga核素标记过程如下:
[0068]
湿法:将37~3700mbq 68
gacl3盐酸溶液(淋洗自锗镓发生器)加入到含0.5~2ml实施例1制备的(fp3)2en(20~200μg)的醋酸
‑
醋酸盐溶液的离心管中,置于室温至100℃下反应20min后冷却至室温,用生理盐水或注射用水稀释,并经无菌过滤即得标记化合物注射液。
[0069]
冻干法:将一定量缓冲液及37~3700mbq 68
gacl3盐酸溶液(淋洗自锗镓发生器)加入到含实施例1制备的(fp3)2en(20~200μg)的冻干药盒中,混匀溶解后置于室温至100℃下反应20min后冷却至室温,用生理盐水或注射用水稀释,经无菌过滤即得标记化合物注射液。
[0070]
如放射化学纯度低于95%,则需进行纯化,纯化步骤为:取一sep
‑
pak c18分离小柱,先后通过10ml无水乙醇及10ml水进行活化淋洗。用10ml水将标记液稀释后,上样到分离柱上。用水冲洗分离柱除去未反应的
68
ga离子,再用乙醇溶液淋洗得到
68
ga标记的配合物。通过氮吹除去有机溶剂,经生理盐水稀释后无菌过滤即得标记化合物注射液。
[0071]
如图7所示,对所标记化合物
68
ga
‑
(fp3)2en取样进行hplc分析鉴定。hplc体系如下:反相c18分析柱(4.6
×
250mm),淋洗梯度:0~15min:20%乙腈(0.1%tfa)和80%水(0.1%tfa)增加到85%乙腈(0.1%tfa)和15%水(0.1%tfa),16~20min:95%乙腈(0.1%tfa)和5%水(0.1%tfa),流速为1ml/min,放射性标记目标配合物保留时间约为10.93min,并以此计算放射化学纯度大于99%。
[0072]
实施例3:
[0073]
18
f核素标记:采用氟铝标记法。
[0074]
湿法:将实施例1制备的(fp3)2en(20
‑
200μg)溶解于0.5ml 0.5mol/l的醋酸
‑
醋酸盐缓冲液(ph 4.2),再加入8μg/ml的氯化铝
‑
醋酸
‑
醋酸钠溶液,全部溶解后加入约37~3700兆贝可(mbq)
18
f(通过加速器生产获得),密闭60~100℃反应15min,冷却。用生理盐水或注射用水稀释,并经无菌过滤即得标记化合物注射液。
[0075]
冻干法:取实施例1制备的(fp3)2en(20~200μg)的冻干药盒(含氯化铝5~40μg),加入1ml 0.5mol/l的醋酸
‑
醋酸盐缓冲液(ph 4.2),全部溶解后加入约37~3700兆贝可(mbq)
18
f(通过加速器生产获得),密闭60~100℃反应15min,冷却。用生理盐水或注射用水稀释,并经无菌过滤即得标记化合物注射液。
[0076]
如放射化学纯度低于95%,则需进行纯化,纯化步骤为:取一sep
‑
pak c18分离小柱,先后通过10ml无水乙醇及10ml水进行活化淋洗。用10ml水将标记液稀释后,上样到分离柱上。用水冲洗分离柱除去未反应的
18
f离子,再用乙醇溶液淋洗得到
18
f标记的配合物。通过氮吹除去有机溶剂,经生理盐水稀释后无菌过滤即得标记化合物注射液。
[0077]
如图8所示,对所标记化合物
18
f
‑
(fp3)2en取样进行hplc分析鉴定。hplc体系如下:反相c18分析柱(4.6
×
250mm),淋洗梯度:0~15min:20%乙腈(0.1%tfa)和80%水(0.1%tfa)增加到85%乙腈(0.1%tfa)和15%水(0.1%tfa),16~20min:95%乙腈(0.1%tfa)和5%水(0.1%tfa),流速为1ml/min,放射性标记目标配合物保留时间约为10.51min,并以此计算放射化学纯度大于99%。
[0078]
实施例4:
[0079]
99m
tc核素标记:采用sncl2作为还原剂,n
‑
三(羟甲基)甲基甘氨酸(tricine)和三苯基膦三间磺酸钠盐(tppts)作为协同配体进行
99m
tc的标记。
[0080]
湿法:将新鲜配制sncl2溶液(sncl2的盐酸溶液)20μl加入到含有20~200μg(fp3)2eh化合物、1~50mg tricine及1~10mg tppts的溶液中,随后立即加入37~7400mbq新鲜淋洗的na
99m
tco4洗脱液(淋洗自钼锝发生器),混匀后压盖密封,室温至100℃下反应30min后冷却至室温,用生理盐水或注射用水稀释,并经无菌过滤即得标记化合物注射液。
[0081]
冻干法:将约37~3700兆贝可(mbq)新鲜的na
99m
tco4洗脱液(淋洗自钼锝发生器)加入到含有20~200μg(fp3)2eh化合物,1~50mg tricine及1~10mg tppts的冻干药盒中(含甘露醇及抗坏血酸),混匀后压盖密封,室温至100℃下反应30min后冷却至室温,用生理盐水或注射用水稀释,并经无菌过滤即得标记化合物注射液。
[0082]
如放射化学纯度低于95%,则需进行纯化,纯化步骤为:取一sep
‑
pak c18分离小柱,先后通过10ml无水乙醇及10ml水进行活化淋洗。用10ml水将标记液稀释后,上样到分离柱上。用水冲洗分离柱除去未反应的
99m
tco4‑
,再用乙醇溶液淋洗得到
99m
tc标记的配合物。通过氮吹除去有机溶剂,经生理盐水稀释后无菌过滤即得标记化合物
99m
tc
‑
(fp3)2eh注射液。hplc体系如下:反相c18分析柱(4.6
×
250mm),淋洗梯度:0~15min:20%乙腈(0.1%tfa)和80%水(0.1%tfa)增加到85%乙腈(0.1%tfa)和15%水(0.1%tfa),16~20min:95%乙腈(0.1%tfa)和5%水(0.1%tfa),流速为1ml/min,放射性标记目标配合物
99m
tc
‑
(fp3)2eh保留时间约为10.95min,并以此计算放射化学纯度大于95%。(结果如图9所示)。
[0083]
实施例5:
[0084]
1、体外稳定性测试
[0085]
将用生理盐水溶解的标记化合物在室温下放置不同时间,取样用hplc进行分析。在所测试时间点,各探针依旧保持放射化学纯>90%,表明其在指定溶液中性质稳定,不易分解。
99m
tc
‑
(fp3)2eh体外生理盐水稳定性hplc鉴定结果如图10所示,表明其在生理盐水体系中至4h依旧保持较高的稳定性(>90%)。
[0086]
将标记化合物与血清在室温下共孵育不同时间,加入乙腈除蛋白,离心取上清溶液,取样用hplc进行分析。在所测试时间点,各探针依旧保持放射化学纯>90%,表明其在指定溶液中性质稳定不易分解。
18
f
‑
(fp3)2en体外生理盐水即血清稳定性hplc鉴定结果如图11~12所示,表明其在生理盐水即血清体系中至4h依旧保持较高的稳定性(>95%)。
[0087]
2、肿瘤模型鼠nanospect显像
[0088]
spect显像选用
99m
tc核素。小鼠通过尾静脉注射约18.5~37mbq实施例4制备的
99m
tc
‑
(fp3)2eh,于注射后不同时间点进行用异氟烷进行吸入式麻醉,俯卧固定后进行静态扫描成像。并以ct扫描辅助定位。对小鼠的spect显像结果的感兴趣区(roi)进行勾画,经计算获得探针分布及靶/非靶比值。
99m
tc
‑
(fp3)2eh在fap表达的荷瘤小鼠spect成像结果如图13所示,在监测的时间范围内,肿瘤部位有明显的放射性浓集,轮廓清晰,证明标记化合物具有特异性亲和力和良好的滞留效果。在包括肝、肺、肠、肌肉等主要器官或组织中均呈现低摄取或滞留,因而有非常好的靶与非靶比值。以上数据表明,此类探针在以fap表达肿瘤spect成像中具有极大的应用潜力。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1