活性海星肽的分离纯化方法、活性海星肽及应用
1.本发明涉及海星肽分离纯化技术领域,尤其是涉及一种活性海星肽的分离纯化方法、活性海星肽及应用。
背景技术:
2.罗氏海盘车(asterias rollestoni),别名海星,属棘皮动物门海星纲钳棘目海盘车科动物。我国威海地区水产资源丰富,沿海地区海星产量大,但对海星资源并无有效的开发利用。海星中的主要活性物质包括海星多肽、海星多糖和海星皂苷等,药用价值丰富。海星中有一些多糖有较强的抗菌抗病毒作用,海星总皂苷具有溶血作用。面包海星皂苷
‑
l(astemsaponins
‑
1)对体外恶性胶质细胞瘤细胞u87mg的生长有明显的抑制作用,并能促其凋亡。而目前对于海星的研究主要集中在海星多糖、海星皂苷等方面,对海星多肽的研究较少。
3.乳腺癌是乳腺上皮细胞在多种致癌因子的作用下,发生增殖失控的现象。乳腺癌常被称为“粉红杀手”,其发病率位居女性恶性肿瘤的首位,男性乳腺癌较为少见。在我国,乳腺癌的发病率呈逐年上升趋势,每年有30余万女性被诊断出乳腺癌。在东部沿海地区及经济发达的大城市,乳腺癌发病率上升尤其明显。据 2020 年世界卫生组织国际癌症研究机构(iarc)发布全球近 190 个国家最新癌症负担数据显示,乳腺癌发病率位居全球第一。
4.临床治疗乳腺癌的主要方法是手术联合放疗和化疗,然而手术治疗容易复发,放、化疗具有很强的毒副作用,而化疗药物虽对大多数肿瘤有一定的疗效,但选择性差、毒副反应大、耐药性等问题依然非常明显。因此,寻找高效、低毒、特异强的抗肿瘤药物仍势在必行。
5.有鉴于此,特提出本发明。
技术实现要素:
6.本发明的第一目的在于提供一种活性海星肽的分离纯化方法。
7.本发明的第二目的在于提供一种活性海星肽,采用上述分离纯化方法制得。
8.本发明的第三目的在于提供上述活性海星肽的应用。
9.为了实现上述目的,本发明的技术方案如下:本发明提供了一种活性海星肽的分离纯化方法,包括以下步骤:(1)提供海星经仿生酶解得到的海星肽粗品;(2)将海星肽粗品采用凝胶色谱柱层析的方法进行纯化,包括:(a)将海星肽粗品和纯水混合后,分离,得到海星肽样品;(b)将已溶胀好的层析填料装柱,采用流动相进行压柱,至柱均匀性达到要求;(c)将海星肽样品进样,洗脱,收集洗脱液,并于280nm下测量紫外吸光度,收集海星肽样品峰;(d)将洗脱液进行干燥,得到活性海星肽。
10.进一步的,在本发明上述技术方案的基础之上,步骤(a)中,分离所采用的过滤膜孔径为0.45μm。
11.进一步的,在本发明上述技术方案的基础之上,步骤(b)中,层析填料包括superdex 30,柱体积为60ml。
12.进一步的,在本发明上述技术方案的基础之上,步骤(b)中,流动相为双蒸水。
13.进一步的,在本发明上述技术方案的基础之上,步骤(c)中,所述洗脱采用蒸馏水进行等度洗脱,洗脱1.5个柱体积。
14.进一步的,在本发明上述技术方案的基础之上,步骤(d)中,所述干燥为真空冷冻干燥。
15.本发明还提供了一种活性海星肽,采用上述活性海星肽的分离纯化方法制得。
16.本发明还提供了采用上述活性海星肽的分离纯化方法制得的活性海星肽在制备抑制乳腺癌细胞mcf
‑
7增殖药物中的应用。
17.本发明还提供了采用上述活性海星肽的分离纯化方法制得的活性海星肽在制备用于抗乳腺癌药物中的应用。
18.与现有技术相比,本发明具有以下技术效果:(1)本发明提供了一种活性海星肽的分离纯化方法,通过将海星肽粗品采用凝胶色谱柱层析的方法进行纯化分离,得到活性海星肽;该分离纯化方法简单、易操作,制备过程安全、环保,且所制得的海星肽具有纯度高、活性高、生物相容性好、安全无副作用等优点。
19.另外,该分离纯化方法丰富了对海星中活性物质的研究,为促进海星资源应用提供了理论基础和实验依据。
20.(2)本发明提供了一种活性海星肽,采用上述活性海星肽的分离纯化方法制得。该活性海星肽具有纯度高、活性高、生物相容性好、安全无副作用等优点,具有广阔的应用前景。
21.(3)本发明提供了一种活性海星肽的应用,实验发现,活性海星肽可抑制乳腺癌细胞mcf
‑
7的增殖生长,且由于其具有活性高、生物相容性好、安全无副作用、靶向性强等优势,因此,可将其用于制备抑制乳腺癌细胞mcf
‑
7的增殖药物或制备抗乳腺癌药物,故活性海星肽在乳腺癌的治疗和诊断方面具有广阔的应用前景。
附图说明
22.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
23.图1为本发明实施例1采用superdex30凝胶色谱柱层析的洗脱图谱;图2为本发明实施例1得到的活性海星肽a1的质谱图;图3为本发明实施例1中的海星肽粗品对于乳腺癌细胞mcf
‑
7存活率影响的效果图;图4为本发明实施例1提供的活性海星肽对于乳腺癌细胞mcf
‑
7存活率影响的效果
图。
具体实施方式
24.下面将结合实施方式和实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施方式和实施例仅用于说明本发明,而不应视为限制本发明的范围。未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
25.根据本发明的第一方面,提供了一种活性海星肽的分离纯化方法,包括以下步骤:(1)提供海星经仿生酶解得到的海星肽粗品;(2)将海星肽粗品采用凝胶色谱柱层析的方法进行纯化,包括:(a)将海星肽粗品和纯水混合后,分离,得到海星肽样品;(b)将已溶胀好的层析填料装柱,采用流动相进行压柱,至柱均匀性达到要求;(c)将海星肽样品进样,洗脱,收集洗脱液,并于280nm下测量紫外吸光度,收集海星肽样品峰;(d)将洗脱液进行干燥,得到活性海星肽。
26.在本发明中,海星肽粗品是指海星经仿生酶解后所得到的酶解产物。海星肽粗品中主要含有多种海星多肽,为海星多肽的混合物。
27.仿生酶解是指通过对各种生物系统所具有的功能原理和作用机理作为生物模型进行研究,利用活性酶来水解特定的某种物质。本发明中海星仿生酶解所用的酶为复合酶。该复合酶是碱性蛋白酶、木瓜蛋白酶和胰蛋白酶按活力单位比为3:3:4的混合物。此为本领域的现有技术,海星仿生酶解的具体方法可参考专利(申请号:201510120730.x),此处不再赘述。
28.对海星肽粗品进行凝胶色谱柱层析,可实现海星肽粗品的纯化分离。
29.本发明中,步骤(a)中,将海星肽粗品和纯水混合后,采用分离的方法(例如,过滤)以除去大颗粒杂质以防止后续影响海星肽粗品的进一步纯化。
30.步骤(b)中,装柱过程中需要确保层析填料均匀。
31.步骤(c)中,由于海星肽样品峰可能会出现多个,故合并相同样品峰的洗脱液,不同样品峰的洗脱液可分开收集。
32.本发明提供了一种活性海星肽的分离纯化方法,通过采用凝胶色谱柱层析的方法实现活性海星肽的精细分离纯化,该分离纯化方法简单、易操作,制备过程安全、环保,且所制得的海星肽具有纯度高、活性高、生物相容性好、安全无副作用等优点。该分离纯化方法丰富了对海星中活性物质的研究,为促进海星资源应用提供了理论基础和实验依据。
33.作为本发明一种优选实施方式,活性海星肽的分离纯化方法包括以下步骤:(a)将海星肽粗品用纯水溶解后,过滤,得到海星肽样品,
‑
4℃冷藏备用;(b)将已溶胀好的层析填料(包含保存液体中的无水乙醇),静置沉降后弃去上层液体和漂浮的层析填料,重新加入适量超纯水,重复冲洗,直至乙醇完全去除;连接akta仪器、柱子以及装柱器,将层析填料摇晃均匀后迅速倒入装柱器中,自然沉降24h后,以一定流速的流动相进行压柱,直至柱内填料的界面不再下移,用bsa检测柱效以检查装填效果;
(c)将海星肽样品进样,采用蒸馏水进行洗脱,采用自动收样器收集洗脱液,并采用紫外检测器于280nm波长处测量紫外吸光度,收集海星肽样品峰,合并相同样品峰的洗脱液;(d)将洗脱液进行真空冷冻干燥,得到活性海星肽。
34.通过对分离纯化方法的进一步限定,使得对于活性海星肽具有良好的分离纯化效果。
35.为获得更好得分离纯化效果,对分离纯化过程中各参数的选择有一定的限定。
36.作为本发明一种可选实施方式,步骤(a)中,分离所采用的过滤膜孔径为0.45μm。
37.由于本发明是对海星肽粗品进行纯化,故层析填料选用superdex。superdex是由高度交联的结合有葡萄糖的琼脂糖形成的多孔结构。
38.作为本发明一种可选实施方式,步骤(b)中,层析填料包括superdex 30,柱体积为60ml。
39.作为本发明一种可选实施方式,步骤(b)中,流动相为双蒸水。
40.作为本发明一种可选实施方式,步骤(b)中,流动相流速为2ml/min。
41.作为本发明一种可选实施方式,步骤(c)中,洗脱采用蒸馏水进行等度洗脱,洗脱1.5个柱体积。
42.作为本发明一种可选实施方式,步骤(d)中,干燥为真空冷冻干燥。
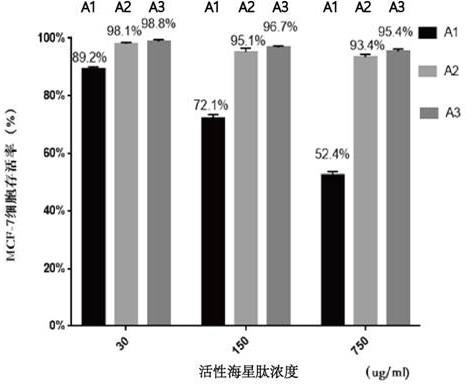
43.采用真空冷冻干燥,可保持海星肽的活性。
44.作为本发明一种可选实施方式,步骤(d)中,真空冷冻干燥的真空度为:10
‑
200pa,真空冷冻干燥的温度为
‑
20至
‑
50℃,真空冷冻干燥的时间为12
‑
24h。
45.典型但非限制性的真空度为10pa、50pa、100pa、120pa、150pa、180pa或200pa,典型但非限制性的真空冷冻干燥的温度为
‑
20℃、
‑
25℃、
‑
30℃、
‑
35℃、
‑
40℃、
‑
45℃或
‑
50℃,典型但非限制性的真空冷冻干燥的时间为12h、16h、18h、20h、22h或24h。
46.根据本发明的第二个方面,还提供了一种活性海星肽,采用上述活性海星肽的分离纯化方法制得。
47.鉴于上述分离纯化方法所具有的优势,使得分离纯化得到的活性海星肽具有纯度高、活性高、生物相容性好、安全无副作用等优点,从而使得其具有广阔的应用前景。
48.根据本发明的第三个方面,还提供了采用上述活性海星肽的分离纯化方法制得的活性海星肽在制备抑制乳腺癌细胞mcf
‑
7增殖药物方面的应用。
49.根据本发明的第四个方面,还提供了采用上述活性海星肽的分离纯化方法制得的活性海星肽在制备用于抗乳腺癌药物中的应用。
50.实验发现,活性海星肽可抑制乳腺癌细胞mcf
‑
7的增殖生长,且由于活性海星肽具有活性高、生物相容性好、安全无副作用、靶向性强等优势,因此,可将其用于制备抑制乳腺癌细胞mcf
‑
7增殖药物或制备抗乳腺癌药物,故该活性海星肽在乳腺癌相关领域的治疗和诊断方面具有广阔的应用前景。
51.下面结合具体实施例和对比例,对本发明作进一步说明。
52.实施例1本实施例提供了一种活性海星肽的分离纯化方法,包括以下步骤:(a)取海星用清水洗净、除去内脏后剪碎,尽量将水分弃去,称重。向剪碎的海星体
壁加入其质量两倍的超纯水。用组织匀浆机匀浆(22000rpm,10min),得到海星匀浆液。加入匀浆液2倍体积的pbs以及海星质量1%的复合酶(该复合酶为碱性蛋白酶、木瓜蛋白酶、胰蛋白酶按活力单位比3:4:4配制),将上述匀浆液放入50℃恒温水浴中酶解10小时,持续搅拌,并保持ph在6.8~7.2之间。
53.酶解结束后,加入酶解液三倍体积的95%乙醇,置于4℃冰箱中静置6小时。静置后的液体离心(5000rpm,10min),取上清液。然后在恒流泵的作用下将上清液通过截留分子量为6000的中空纤维膜组件,收集透过液。取上述透过液用真空旋转蒸发仪浓缩后,冷冻干燥(真空冷冻干燥的真空度为:10pa温度为
‑
50℃,真空冷冻干燥的时间为12h),得到海星肽粗品。
54.上样前,将海星肽粗品0.5g用超纯水10ml溶解并过0.45μm滤器,得到海星肽样品,于
‑
4℃冷藏备用。
55.(b)取已溶胀好的supedex 30填料60ml(包含保存液体中的无水乙醇),静置沉降后弃去上层液体和漂浮的填料,重新加入适量超纯水,重复冲洗,直至乙醇完全去除。连接akta仪器、柱子以及装柱器,将填料摇晃均匀后迅速倒入装柱器中,自然沉降24h后,以2ml/min的流速、双蒸水为流动相进行压柱,直至柱内填料的界面不再下移。用bsa检测柱效。
56.(c)采用手动进样环进样,每次进样量为1ml。采用蒸馏水进行等度洗脱,洗脱1.5个柱体积(90ml),于280nm波长下紫外检测器检测多肽,采用自动收样器收集样品峰。
57.(d)将各段收集液真空冷冻干燥,得到活性海星肽,并将活性海星肽置于干燥器中保存备用。
58.实施例1采用superdex30凝胶色谱柱层析的洗脱图谱如图1所示。从图1中可以看出,共有3组较明显峰,得到a1、a2、a3三种纯化物。且从图1中电导率可以看出,本流动相为蒸馏水,样品含有部分盐,采用superdex 30凝胶过滤色谱可以有效分离海星肽并去除其中的盐。
59.同时,将分离得到的活性海星肽a1送至北京欧米科斯生物科技有限公司进行分子量检测,质谱检测仪器为ultrafle xtreme maldi tof/tof。具体检测步骤为:将海星肽a1样品用10 μl超纯水溶解,nano定量为0.05 μg/ml,取1 μl溶液滴加于maldi靶上,室温晾干后用基质辅助激光解析串联飞行时间质谱进行检测。具体检测结果如图2所示。
60.从图2中可以看出,活性海星肽a1为混合物,其分子量范围在1100
‑
1700 da之间,其中大部分集中在1400
‑
1500 da之间。
61.与活性海星肽a1一样,活性海星肽a2、活性海星肽a3也均为混合物,只是分子量更小,故未将质谱图一一列出。
62.为了说明上述实施例和对比例的技术效果,特设以下实验例。
63.实验例1 抑制乳腺癌细胞mcf
‑
7的增殖实验(1)海星肽粗品精确称量实施例1的海星肽粗品 5mg,将其溶于5ml含10%fbs(胎牛血清)的dmem培养基中,其中海星肽粗品终浓度为1mg/ml。经 0.22μm 微孔滤膜过滤除菌后,作为抗肿瘤活性测试母液,其余所用浓度均由此浓度稀释。乳腺癌细胞mcf
‑
7经铺板后培养24h至贴壁,将海星肽抗肿瘤活性测试母液用培养基分别稀释至100μg/ml、200μg/ml、300μg/ml、400μg/ml、500μg/ml,每个浓度设立6个复孔平行实验。加药前吸净孔内的培养基,每孔加各浓度海
星肽粗品溶液100μl。培养 48h 后按mtt比色法测定海星肽粗品对mcf
‑
7增殖的抑制作用。
64.具体结果如图3所示,从图中我们可以看到海星肽粗品浓度为300μg/ml时即可显著的抑制mcf
‑
7细胞生长,抑制率为20.9%。且随浓度增大,抑制作用逐步增强,呈剂量依赖性。
65.(2)活性海星肽精确称取实施例1中经superdex 30凝胶过滤色谱纯化获得的活性海星肽的三种组分各2mg,取2ml含10%fbs的dmem培养基将其溶解,获得终浓度为1mg/ml的活性海星肽溶液。细胞加药操作前经0.2μm微孔滤膜除菌备用。乳腺癌细胞mcf
‑
7铺板后培养24h至贴壁,各组分分别设30μg/ml、150μg/ml、750μg/ml三个浓度梯度,吸净旧培养基,每孔加各浓度活性海星肽溶液100μl,培养48h后按mtt比色法测定活性海星肽对mcf
‑
7细胞增殖的抑制作用。
66.具体结果如图4所示,从图中我们可以看到纯化物a1为150μg/ml时即可非常显著的抑制mcf
‑
7细胞生长,抑制率为27.9%,且随浓度增大,抑制作用逐步增强,呈剂量依赖性。
67.最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1