热稳定的逆转录酶突变体的制作方法
1.本发明涉及生物技术领域,具体而言,涉及一种热稳定的逆转录酶突变体。
背景技术:
2.逆转录酶(ec 2.7.7.49)最初被发现为负责rna病毒基因组复制的酶。它可以使用rna或单链dna(ssdna)作为模板,同时具有rnase h活性和dna聚合酶活性。莫洛尼鼠白血病病毒逆转录酶(m-mlv rt),因为其高催化活性和保真度,是目前互补dna(cdna)合成中使用最广泛的逆转录酶。m-mlv逆转录酶活性蛋白是一个75kda大小的单体,其具有两个活性位点,其中一个位于n端结构域中以进行dna聚合,另一个位于c端域中以实现rnase h活性。
3.m-mlv逆转录酶是不耐热的,在没有模板引物(t/p)的情况下,在44℃下孵育10分钟,其活性下降至50%(t(50))。即使在模板和引物t/p(28μm)存在的情况下,在47℃孵育10分钟后,野生型m-mlv rt的活性也会下降到50%。
4.通过消除rnase h活性的同时保留完整的rna指导的dna聚合酶活性的方法,m-mlv rt的热稳定性得到了一定的提高。比如,rnase h-m-mlv rt(d524n)显示出更高的热稳定性,与m-mlv rt相比,其在50℃下的半衰期延长了4倍。通常,m-mlv rt的最佳应用温度在37℃,而rnase h-m-mlv rt建议在42℃下使用。
5.然而,分子生物学领域的应用仍然需要更进一步提高逆转录的反应温度以打开rna二级结构,从而减少非特异性引物结合并通过降低错配的稳定性来提高m-mlv rt保真度。
6.有鉴于此,特提出本发明。
技术实现要素:
7.本发明的目的在于提供一种逆转录酶突变体,其氨基酸序列在seq id no:1所示的莫洛尼鼠白血病病毒(m-mlv)逆转录酶的基础上具有如下突变中的一种或多种:
8.k15e、d235r、e441k和k445e。
9.上述逆转录酶突变体相对于未发生相应突变的m-mlv逆转录酶,具有显著提高的热稳定性,因而可以无需过多顾虑逆转录过程中的温度波动情况,并且能够减少非特异性引物结合并通过降低错配的稳定性来提高m-mlv rt保真度,具有更广阔的应用前景。
10.本发明还涉及分离的核酸,其编码如上所述的逆转录酶突变体,以及包含如上所述核酸的载体。
11.本发明还涉及宿主细胞,其基因组中掺有如上所述的核酸,或被如上所述的载体所转化。
12.本发明还涉及生产逆转录酶突变体的方法,包括:
13.a)培养如上所述的宿主细胞;
14.b)表达所述逆转录酶突变体;并
15.c)由所述宿主细胞分离所述逆转录酶突变体。
16.本发明还涉及试剂盒,其包含如上所述的逆转录酶突变体。
17.本发明还涉及组合物,其由如上所述的试剂盒中的各成分混合得到。
18.本发明还涉及用于逆转录一种或多种核酸分子的方法,包括:
19.i)使用如上所述的逆转录酶突变体与模板rna接触,并且
20.ii)在足以生产与所述模板rna互补的dna的反应体系下保温。
21.本发明还涉及用于检测样品中rna标记物的方法,包括:
22.i)使用如上所述的逆转录酶突变体与rna标记物接触;
23.ii)在足以生产与所述rna标记物互补的dna的反应体系下保温;和
24.iii)检测步骤ii)中合成的dna的存在,从而检测所述样品中的rna标记物。
25.本发明还涉及用于产生热稳定性增强的逆转录酶的方法,包括:
26.在编码m-mlv逆转录酶的核酸中引入突变,以使得所述核酸的表达产物具有如下突变中的至少一种:
27.k15e、d235r、e441k和k445e;
28.上述突变的位置以seq id no:1所示的m-mlv逆转录酶的氨基酸为参考。
附图说明
29.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
30.图1为本发明一个实施例中所采用的逆转录反应示意图;
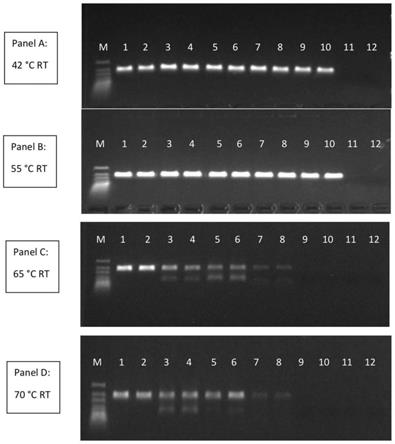
31.图2为本发明一个实施例所提供的野生型逆转录酶与k15e、d235r、e441k、k445e的热稳定性比较结果;panel a:反应为42℃ 5min,95℃ 3min,然后95℃ 30s,60℃ 1min,共35个循环;泳道m:generuler超低范围dna阶梯(thermo scientific),泳道1-2:k15e,泳道3-4:d235r,泳道5-6:e441k,泳道7-8:k445e,泳道9-10:野生型逆转录酶,泳道11-12:无模板对照;panel b:反应为55℃ 5min,95℃ 3min,然后95℃ 30s,60℃ 1min,共35个循环;样品设置与panel a相同;panel c:反应为65℃ 5min,95℃ 3min,然后95℃ 30s,60℃ 1min,共35个循环;样品设置与panel a相同;panel d:反应为70℃ 5min,95℃ 3min,然后95℃ 30s,60℃ 1min,共35个循环;样品设置与panel a相同。
具体实施方式
32.现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
33.除非另有说明,用于披露本发明的所有术语(包括技术和科学术语)的意义与本发明所属领域普通技术人员所通常理解的相同。通过进一步的指导,随后的定义用于更好地理解本发明的教导。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
34.本发明中所使用的术语“含有”、“包含”和“包括”是同义词,其是包容性或开放式的,不排除额外的、未被引述的成员、元素或方法步骤。
35.本发明中用端点表示的数值范围包括该范围内所包含的所有数值及分数,以及所引述的端点。
36.本发明中涉及浓度数值,其含义包括在一定范围内的波动。比如,可以在相应的精度范围内波动。比如2%,可以允许
±
0.1%范围内波动。对于数值较大或无需过于精细控制的数值,还允许其含义包括更大波动。比如100mm,可以允许
±
1%、
±
2%、
±
5%等范围内的波动。涉及分子量,允许其含义包括
±
10%的波动。
37.本发明中,涉及“多个”、“多种”等描述,如无特别限定,指在数量上指大于等于2。
38.本发明中,以开放式描述的技术特征中,包括所列举特征组成的封闭式技术方案,也包括包含所列举特征的开放式技术方案。
39.本发明中,“优选”、“更好”、“更佳”、“为宜”仅为描述效果更好的实施方式或实施例,应当理解,并不构成对本发明保护范围的限制。
40.在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。除非和本技术的发明目的和/或技术方案相冲突,否则,本发明涉及的引用文献以全部内容、全部目的被引用。本发明中涉及引用文献时,相关技术特征、术语、名词、短语等在引用文献中的定义也一并被引用。本发明中涉及引用文献时,被引用的相关技术特征的举例、优选方式也可作为参考纳入本技术中,但以能够实施本发明为限。应当理解,当引用内容与本技术中的描述相冲突时,以本技术为准或者适应性地根据本技术的描述进行修正。
41.本发明中,“热稳定性”或“热稳定”,是指m-mlv逆转录酶在适于逆转录反应发生、但较高的反应温度的条件仍然具有逆转录活性的能力。反应温度约为30℃~70℃,例如35℃、37℃、39℃、40℃、42℃、45℃、50℃、55℃、60℃、65℃,优选65℃~70℃。
42.本发明涉及一种逆转录酶突变体,其氨基酸序列在seq id no:1所示的m-mlv逆转录酶的基础上具有如下突变中的一种或多种:
43.k15e、d235r、e441k和k445e。
44.对应上述单个突变位点,逆转录酶突变体的氨基酸序列是示例依次如seq id no:2~5所示。
45.上述逆转录酶突变体相对于未发生相应突变的m-mlv逆转录酶,具有显著提高的热稳定性,且在m-mlv逆转录酶的逆转录效率、逆转录模板灵敏度以及保真度等方面未产生明显的不利影响。
46.逆转录酶突变体并不排除在除seq id no:1以外的m-mlv逆转录酶进行突变的可能,亦即,本技术所请求保护的逆转录酶突变体可以为与所述逆转录酶突变体(特别是seq id no:2~5所示的逆转录酶突变体)实质上相似的酶。
[0047]“实质上相似”意指给定核酸或氨基酸序列与参比序列共有至少约80%同一性、至少约90%同一性、至少约95%同一性、至少约96%同一性、至少约97%同一性、至少约98%同一性、至少约99%同一性或至少约99.5%同一性的序列的酶,且保留k15e、d235r、e441k和k445e中至少一种突变位点,保留逆转录酶活性,并保留更强的热稳定性(其热稳定性与seq id no:2~5所示的酶相仿,例如不低于它们的至少一个)。
[0048]
实质上相似的酶通常较参比序列发生保守性的氨基酸置换,通常视为保守置换的置换是在脂肪族氨基酸ala、val、leu和ile中的彼此置换、羟基残基ser和thr的互换、酸性残基asp和glu的交换、酰胺残基asn和gln之间的置换、碱性残基lys和arg的交换以及芳香残基phe、tyr间的置换。
[0049]
另外,实质上相似的酶还包括通过天然过程(诸如加工和其他翻译后修饰),或通过化学修饰技术所得到衍生物,例如通过添加一个或多个聚乙二醇分子、糖、磷酸酯和/或其他这样的分子来进行化学修饰,其中一个或多个分子不是天然地附着到蛋白质。衍生物包括盐。这样的化学修饰在基础教科书和更详细的专论中以及在大量研究文献中有详细描述,并且它们是本领域技术人员熟知的。应当理解,相同类型的修饰可以以相同或不同程度存在于给定蛋白质或多肽中的几个位点。此外,给定的蛋白质或多肽可以含有许多类型的修饰。修饰可发生在蛋白质或多肽中的任何位置,包括肽骨架,氨基酸侧链以及氨基或羧基末端。修饰包括例如乙酰化、酰化、adp-核糖基化、酰胺化、共价连接黄素、共价连接血红素部分、共价连接核苷酸或核苷酸衍生物、共价连接脂质或脂质衍生物、共价连接磷脂酰肌醇、交联、环化、形成二硫键、脱甲基化、形成共价交联、形成半胱氨酸、形成焦谷氨酸、甲基化、γ-羧化、糖基化、形成gpi锚接、羟基化、碘化、甲基化、肉豆蔻酰化、氧化、蛋白质酶解加工、磷酸化、异戊二烯化、外消旋化、糖基化、脂质连接、硫酸化、谷氨酸残基的γ-羧化、烃基化和adp-核糖基化、硒化、硫酸化、蛋白质的氨基酸的传递rna介导加成(诸如精氨酰化)以及泛素化。它们还可以结合至维生素,例如生物素、叶酸或维生素b12。参见例如proteins
‑‑
structure and molecular properties,2nd ed.,t.e.creighton,w.h.freeman and company,new york(1993)和wold,f.,“posttranslational protein modifications:perspectives and prospects,”pgs.1-12in posttranslational covalent modification of proteins,b.c.johnson,ed.,academic press,new york(1983);seifter等人.,meth.enzymol.182:626-646(1990)和rattan等人,“protein synthesis:posttranslational modifications and aging,”ann.n.y.acad.sci.663:48-62 1992)。术语“衍生物”包括导致蛋白质或多肽在支链化或不支链化的情况下变成支链的或环状的化学修饰。环状、支链和支链圆形蛋白质或多肽可以从翻译后自然加工得来并且还可以完全由合成方法制成。在一些实施方式中,化合物可以共价连接至载体蛋白质,诸如血清白蛋白或其他血浆蛋白质。
[0050]
实质上相似的酶可以不具有rnase h活性,或者具有减弱的rnase h活性。
[0051]
实质上相似的酶可以包含本领域公知的其他有利于m-mlv逆转录酶功能实现的突变为点,例如,其可以具有包含至少一个位于选自下组的氨基酸位置处的突变:
[0052]
q19,y64,r116,d124,h126,y133,k152,t197,v223,l435,d524;
[0053]
可用于替代tyr的氨基酸包括lys、arg、his、asp、glu、ala、val、leu、ile、pro、met、trp、gly、ser、thr、cys、asn或gln。可用于替代arg的氨基酸包括tyr、his、asp、glu、ala、val、leu、ile、pro、met、trp、gly、ser、thr、cys、phe、asn、或gln。可用于替代lys的氨基酸包括tyr、arg、his、asp、glu、ala、val、leu、ile、pro、met、trp、gly、ser、thr、cys、asn、或gln。可用于替代glu的氨基酸包括lys、arg、his、asp、tyr、ala、val、leu、ile、pro、met、trp、gly、ser、thr、cys、asn、或gln。可用于替代thr的氨基酸包括lys、arg、his、asp、glu、ala、val、leu、ile、pro、met、trp、gly、ser、tyr、cys、asn、或gln。可用于替代val的氨基酸包括lys、
arg、his、asp、glu、ala、tyr、leu、ile、pro、met、trp、gly、ser、thr、cys、asn、或gln。可用于替代leu的氨基酸包括lys、arg、his、asp、glu、ala、val、tyr、ile、pro、met、trp、gly、ser、thr、cys、asn或gln。可用于替代asp的氨基酸包括lys、arg、his、leu、glu、ala、val、tyr、ile、pro、met、trp、gly、ser、thr、cys、asn或gln。
[0054]
可以通过众所周知的方法例如定点诱变来制备这些突变体。
[0055]
本领域技术人员在本技术的基础上容易对上述效果进行验证,这不需要付出创造性劳动,因而在上述m-mlv逆转录酶基础上进行突变得到的逆转录酶突变体也在本技术的保护范围内。
[0056]
优选地,本发明所述的逆转录酶突变体包含标签。进一步优选的,标签融合于所述逆转录酶突变体的c端。标签出于各种目的而附着在蛋白质,例如以便容易纯化,帮助蛋白质的正确折叠,防止蛋白质沉淀,改变层析特性,修饰蛋白质或者标记蛋白质或给蛋白质贴标签。标签的实例包括arg标签、his标签、strep标签、flag标签、t7标签、v5-肽标签、gst标签和c-myc标签。本发明中的优选标签是由六个组氨酸残基组成的his标签。
[0057]
根据本发明的再一方面,还涉及分离的核酸,其编码如上所述的逆转录酶突变体。
[0058]
核酸通常是rna或dna。核酸可以是单链或双链的。当将核酸与另一个核酸序列置于功能关系中时,核酸是“有效连接的”。例如,如果启动子或增强子影响编码序列的转录,那么启动子或增强子有效地连接至所述编码序列。当其连入载体时优选采用dna核酸。核酸可以经过密码子优化以在期望的宿主细胞中获得更为高效的表达。
[0059]
根据本发明的再一方面,还涉及包含如上所述核酸的载体。
[0060]
术语“载体(vector)”是指,可将多聚核苷酸插入其中的一种核酸运载工具。当载体能使插入的多核苷酸编码的蛋白获得表达时,载体称为表达载体。载体可以通过转化,转导或者转染导入宿主细胞,使其携带的遗传物质元件在宿主细胞中获得表达。载体是本领域技术人员公知的,包括但不限于:质粒;噬菌粒;柯斯质粒;人工染色体,例如酵母人工染色体(yac)、细菌人工染色体(bac)或p1来源的人工染色体(pac);噬菌体如λ噬菌体或m13噬菌体及动物病毒等。可用作载体的动物病毒包括但不限于,逆转录酶病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤空泡病毒(如sv40)。在一些实施方式中,本发明所述载体中包含基因工程中常用的调控元件,例如增强子、启动子、内部核糖体进入位点(ires)和其他表达控制元件(例如转录终止信号,或者多腺苷酸化信号和多聚u序列等)。
[0061]
本发明还涉及宿主细胞,其基因组中如上所述的核酸,或被如上所述的载体所转化。
[0062]
术语“宿主细胞”是指,可用于导入载体的细胞,其包括但不限于,如大肠杆菌或枯草菌等的原核细胞,如酵母细胞或曲霉菌等的真菌细胞,如s2果蝇细胞或sf9等的昆虫细胞,或者如纤维原细胞,cho细胞,cos细胞,nso细胞,hela细胞,bhk细胞,hek 293细胞或人细胞等的动物细胞。宿主细胞优选为真核细胞,
[0063]
根据本发明的再一方面,还涉及一种生产逆转录酶突变体的方法,包括:
[0064]
a)培养如上所述的宿主细胞;
[0065]
b)表达所述逆转录酶突变体;并
[0066]
c)由所述宿主细胞分离所述逆转录酶突变体。
[0067]
分离所述逆转录酶突变体可以理解为将粗品分离,也可以理解为包括纯化和/或浓缩过程,例如可将目的产物根据本领域标准程序从细胞培养内容物纯化出,标准程序包括硫酸铵沉淀、亲和柱、柱层析、凝胶电泳等。这类技术在本领域技术范围内,不限定本发明。表达得到的蛋白可用常规方法进行过滤浓缩。可溶的混合物和多聚体,也可以用常规方法去除,比如分子筛、离子交换。得到的产物需立即冷冻,如-70℃~-80℃,或者冻干。
[0068]
根据本发明的再一方面,还涉及一种试剂盒,其包含如上所述的逆转录酶突变体。
[0069]
所述试剂盒优选用于执行逆转录。
[0070]
在一些实施方式中,其还包含rna提取试剂、逆转录反应液、dntps、水、双脱氧核苷酸以及逆转录引物中的一种或多种。
[0071]
根据需要,逆转录引物可以为oligo dt引物、随机引物或基因特异性引物。
[0072]
术语“试剂盒”是指包括至少一个设备的任何制品(例如,包装或容器),可进一步包括在本文中描述的方法或其步骤中使用的使用说明书、补充试剂和/或组分或组件。
[0073]
优选的,试剂盒中的核酸组分和蛋白组分,例如引物和逆转录酶突变体以干粉形式存放于试剂盒中。各组分也可以冻干形式,例如以一种或多种所谓的冻干珠的形式实现。冻干珠通常可以被理解为是指在制造后(在所述制造后物质通常作为粉末存在)被压制成球形的冻干物。
[0074]
根据本发明的再一方面,还涉及一种组合物,其包含如上所述的逆转录酶突变体。
[0075]
在一些实施方式中,所述组合物,其由如上所述的试剂盒中的各成分混合得到。
[0076]
根据本发明的再一方面,还涉及用于逆转录一种或多种核酸分子的方法,包括:
[0077]
i)使用如上所述的逆转录酶突变体与模板rna接触,并且
[0078]
ii)在足以生产与所述模板rna互补的dna的反应体系下保温。
[0079]
根据本发明的再一方面,还涉及用于检测样品中rna标记物的方法,包括:
[0080]
i)使用如上所述的逆转录酶突变体与rna标记物接触;
[0081]
ii)在足以生产与所述rna标记物互补的dna的反应体系下保温;和
[0082]
iii)检测步骤ii)中合成的dna的存在,从而检测所述样品中的rna标记物。
[0083]
在一些实施方式中,所述样品选自血液、血浆、血清、尿、胆汁、脑脊髓液、拭子、临床样本、器官样品和组织样品。
[0084]
在一些实施方式中,所述样品得自细胞培养物、怀疑被污染的来源或受试者。
[0085]
在一些实施方式中,所述受试者选自人、动物(如大鼠、小鼠、猫、犬、马、牛、羊、猪、鸡、鸭、鹅、鹌鹑、鸽子、线虫、斑马鱼)和植物(如水稻、拟南芥、小麦、玉米)。
[0086]
容易理解,上述方法为可应用于不同物种、不同目的的普适性方法。但在一些优选的实施方式中,上述方法用于疾病的检测。
[0087]
所述rna标记物可以用于指示微生物、细胞、病毒、细菌、真菌、寄生虫、哺乳动物物种、遗传状况或疾病。rna可以在各种应用中用作标记物。检测到的rna可以指示本身,或者它可以指示dna的存在或目标基因的表达,其继而指示疾病、病原体的存在等。rna本身可以指示病毒rna,特别是逆转录病毒rna的存在。逆转录病毒引起各种疾病,例如癌症、aids、自身免疫性以及中枢神经系统、骨骼和关节疾病,例如髓样白血病、红细胞系白血病、淋巴样白血病、淋巴瘤、肉瘤、乳腺癌、肾癌、再生障碍性贫血、溶血性贫血、自身免疫性疾病、免疫缺陷、骨硬化病、关节炎、周围神经病、脑病、神经变性、痴呆、肺炎和腺瘤病。诱导此类疾病
的病毒包括人类免疫缺陷病毒(hiv)、人t淋巴病毒(htlv)、劳斯肉瘤病毒(rsv)和鼠乳腺肿瘤病毒(mmtv)。然而,rna标记物可以指示基因表达。许多基因仅在特定条件(包括疾病条件)下或由特定物种表达。相应地,蛋白质(或相应mrna)的存在可以指示疾病状态、细胞或病原体。例如,癌细胞的特征在于特定标记物,其核酸可以用于其检测和定量。可以提及的实例(尤其是癌基因和肿瘤抑制基因)是:例如p53,ras家族的基因erb-b2、c-myc、mdm2、c-fos、dpc4、fap、nm23、ret、wt1等等,例如关于p53、dcc、apc、rb等等的loh,以及遗传性肿瘤中的brca1和brca2,msh2、mlh1、wt1等等的微卫星不稳定性;以及肿瘤rna,例如cea,细胞角蛋白例如ck20、bcl-2、muc1,特别是其肿瘤特异性剪接变体、mage3、muc18、酪氨酸酶、psa、psm、ba46、mage-1等等,或其它形态发生rna,例如乳腺丝抑蛋白、hcg、gip、胃动素、htg、scca-1、ar、er、pr、各种激素等等;此外,尤其是影响转移概况的rna和蛋白质,即涉及血管生成、运动、粘附和基质降解的分子的表达,例如bfgf、bfgf-r、vegf、vegf-rs例如vegf-r1或vegf-r2、e-钙粘蛋白、整联蛋白、选择素、mmp、timp、sf、sf-r等等、细胞周期概况或增殖概况例如细胞周期蛋白(例如,细胞周期蛋白d、e和b的表达比)、ki67、p120、p21、pcna等等,或凋亡概况例如fas(受体和/或配体)、tnf(受体和/或配体)、穿孔素、颗粒酶b、bax、bcl-2、半胱天冬酶3等等。可替代地,rna可以指示除逆转录病毒外的病原体的dna。
[0088]
示例性的病毒包括:腺病毒科(adenoviridae)、沙粒病毒科(arenaviridae)、星状病毒科(astroviridae)、本雅病毒科(bunyaviridae)、杯状病毒科(caliciviridae)、黄病毒科(flaviviridae)、肝炎病毒科(hepeviridae)、单分子负链rna病毒目(mononegavirales)、网巢病毒目(nidovirales)、小rna病毒科(picornaviridae)、正黏液病毒科(orthomyxoviridae)、乳头瘤病毒科(papillomaviridae)、细小病毒科(parvoviridae)、多瘤病毒科(polyomaviridae)、痘病毒科(poxviridae)、呼肠孤病毒科(reoviridae)、反转录病毒科(retroviridae)以及披膜病毒科(togaviridae)中的一种或多种。
[0089]
示例性的细菌包括:葡萄球菌属、链球菌属、李式杆菌属、丹毒丝菌属、肾杆菌属、芽孢杆菌属、梭菌属、分支杆菌属、放线菌属、奴卡菌属、棒状杆菌属、红球菌属中的一种或多种,和/或,炭疽杆菌、丹毒杆菌、破伤风杆菌、李氏杆菌、气肿疽杆菌结核杆菌、大肠杆菌外、变形杆菌、痢疾杆菌、肺炎杆菌、布氏杆菌、产气夹膜杆菌、流感嗜血杆菌、副流感嗜血杆菌、卡他摩拉克氏菌、不动杆菌属、耶尔森菌属、嗜肺军团菌、百日咳杆菌、副百日咳杆菌、志贺菌属、巴斯德菌属、霍乱弧菌以及副溶血性杆菌中的一种或多种。
[0090]
示例性的真菌包括:粗球孢子菌、普赛德斯球抱子菌、荚膜组织胞浆菌、杜氏组织胞浆菌、洛博芽生菌、巴西副球孢子菌、皮炎芽生菌、申克氏孢子丝菌、马尔尼菲青霉菌、白色念珠菌、光滑念珠菌、热带念珠菌、葡萄牙假丝酵母、曲霉菌、甄氏外瓶霉、裴氏着色霉、紧密着色霉、疣状着色霉、皮炎着色霉、白地霉、波氏足肿菌、新型隐球菌、丝孢酵母菌、米根霉、印度毛霉、伞枝犁头霉、总状共头霉、蛙粪霉、冠状耳霉、异孢耳霉、西伯鼻孢子菌、透明丝孢霉以及暗色丝孢霉中的一种或多种。
[0091]
示例性的寄生虫包括:消化道内寄生虫、肝内寄生虫、肺内寄生虫、脑组织寄生虫、血管内寄生虫、淋巴管内寄生虫、肌肉组织寄生虫、细胞内寄生虫、骨组织寄生虫以及眼内寄生虫中的一种或多种。
[0092]
根据本发明的再一方面,还涉及用于产生热稳定性增强的逆转录酶的方法(或称
之为提高逆转录酶热稳定性的方法),包括:
[0093]
在编码m-mlv逆转录酶的核酸中引入突变,以使得所述核酸的表达产物具有如下突变中的至少一种:
[0094]
k15e、d235r、e441k和k445e;
[0095]
上述突变的位置以seq id no:1所示的m-mlv逆转录酶的氨基酸为参考。
[0096]
由于已知k15e、d235r、e441k和k445e位点的突变可以用以提高热稳定性,那么适于产生突变或产生所需要的重组蛋白序列的任何方法均可应用。
[0097]
需要注意的是,上述m-mlv逆转录酶的参考序列不构成对本发明所产生的逆转录酶的限制,该方法除seq id no:1外,亦可用于其他已然发生其他突变的m-mlv逆转录酶的改进,只需要使得k15e、d235r、e441k和k445e的变异发生在相对于seq id no:1所示的m-mlv逆转录酶的相应位置上即可,本领域技术人员可通过常规的序列分析方法找到相应的位点。
[0098]
下面将结合实施例对本发明的实施方案进行详细描述。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,优先参考本发明中给出的指引,还可以按照本领域的实验手册或常规条件,还可以参考本领域已知的其它实验方法,或者按照制造厂商所建议的条件。
[0099]
下述的具体实施例中,涉及原料组分的量度参数,如无特别说明,可能存在称量精度范围内的细微偏差。涉及温度和时间参数,允许仪器测试精度或操作精度导致的可接受的偏差。
[0100]
实施例
[0101]
具有c末端his tag标记的m-mlv逆转录酶(序列如下所示)在c3019(new england biolabs,ma)中进行表达,质粒构建使用的是具有卡那霉素抗性的pbad载体。
[0102]
mlniedehrlhetskepdvslgstwlsdfpqawaetggmglavrqapliiplkatstpvsikqypmsqearlgikphiqrlldqgilvpcqspwntpllpvkkpgtndyrpvqdlrevnkrvedihptvpnpynllsglppshqwytvldlkdaffclrlhptsqplfafewrdpemgisgqltwtrlpqgfknsptlfdealhrdladfriqhpdlillqyvddlllaatseldcqqgtrallqtlgnlgyrasakkaqicqkqvkylgyllkegqrwltearketvmgqptpktprqlreflgtagfcrlwipgfaemaaplypltktgtlfnwgpdqqkayqeikqalltapalglpdltkpfelfvdekqgyakgvltqklgpwrrpvaylskkldpvaagwppclrmvaaiavltkdagkltmgqplvilaphavealvkqppdrwlsnarmthyqallldtdrvqfgpvvalnpatllplpeeglqhncldilaeahgtrpdltdqplpdadhtwytngssllqegqrkagaavtteteviwakalpagtsaqraelialtqalkmaegkklnvytdsryafatahihgeiyrrrglltsegkeiknkdeilallkalflpkrlsiihcpghqkghsaeargnrmadqaarkaaitetpdtstllgsgssg(seq id no:1)-hhhhhh(his tag)
[0103]
载体转化之后的细菌首先在37℃下培养5小时,以达到od600nm=0.5,之后向细菌培养液中加入0.2%阿拉伯糖以在25℃下诱导蛋白质表达。蛋白诱导表达过夜之后,先离心沉淀收集细菌,经超声破碎处理后上清液与his-琼脂糖珠一起孵育以纯化m-mlv逆转录酶。最后用200mm imidazole buffer将蛋白质从his-琼脂糖珠上洗脱下来,并标准化为10ng/μl,用于后续逆转录酶酶活的鉴定测试。
[0104]
逆转录酶的活性通过图1所示的一步法rt-pcr测试。
[0105]
rt-pcr反应制备为10μl混合物,其中含有10ng逆转录酶、1ng人293rna、1
×
mod缓
冲液(20mm tris-hcl,10mm(nh4)2so4)、10mm kcl、2mm mgso4、0.1%triton-x100、80mm tris-acetate、3mm mg-acetate,ph=8.8@25℃)、10mm dtt、0.2μm正向引物(cccatgttcgtcatgggtgt)、0.2μm反向引物(tggtcatgagtccttccacgata),0.2μl 10mm dntp,25ng taq聚合酶d578r(参考:用于更快扩增的taq聚合酶突变体,美国专利号:#10,865,441)。热稳定性测定是通过首先逆转录酶突变体在不同温度下的(42℃、55℃、65℃、70℃5分钟)进行逆转录反应,然后通过pcr步骤,程序设置为95℃3分钟,(95℃30秒,60℃1分钟)35个循环来测试rt-pcr的活性。
[0106]
与野生型逆转录酶相比,四种rt突变体k15e、d235r、e441k、k445e在65℃/70℃5分钟逆转录时显示出比野生型m-mlv rt更高的活性。42℃、55℃、65℃、70℃下rt-pcr活性的比较如图1所示。在相同的缓冲液和rt-pcr反应体系中,野生型逆转录酶在65℃和70℃失去可检测的rt-pcr活性,但k15e、d235r、e441k和k445e仍保留其活性,其中k15e在65℃明显具有相对于其他突变体更强的活性,同时在65℃和70℃下也具有更强的特异性。
[0107]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准,说明书及附图可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1