用于细胞缺氧和HIF1α蛋白活性指示剂的RCAN1.4启动子片段及其应用
用于细胞缺氧和hif1
α
蛋白活性指示剂的rcan1.4启动子片段及其应用
技术领域
1.本发明属于基因工程技术领域,具体涉及一种用于细胞缺氧和hif1α蛋白活性指示剂的rcan1.4-315-15启动子片段及其应用。
背景技术:
2.rcan1基因位于位于唐氏综合症关键区域(down syndrome critical region,dscr),包括7个外显子和6个内含子,其中前4个外显子为选择性外显子,不同的表达可以产生4种不同的蛋白亚型,其中最主要的是外显子1编码的rcanl.1和外显子4编码的rcanl.4。rcan1基因有两个转录起始位点,分别位于外显子1和外显子4前面,外显子5,6,7编码的168个氨基酸为高度保守区域,在所有rcan1亚型中均表达,并包含有钙调磷酸酶结合域。研究表明,rcan1对钙调磷酸酶的信号转导通路具有双重调控作用,并参与了核转录因子nf-kb信号通路的调控,在细胞凋亡、细胞分化和记忆等生理过程中都有非常重要的调节作用,被认为与多种疾病相关。研究发现在阿尔茨海默病(alzheimer’s disease,ad)患者中,rcan1高度过量表达且ad患者大脑中aβ的大量沉积直接引起rcan1的表达增加,上调的rcan1抑制了钙调磷酸酶的活性,使得去磷酸化作用减弱,高度磷酸化的tau蛋白累积,导致螺旋状的神经原纤维缠结,进一步导致神经元死亡,加重了ad的症状。另有研究发现在脑受缺血/再灌注损伤的早期,星形胶质细胞中,rcan1.4蛋白表达水平明显升高,在大脑缺血性损伤和神经炎性病变中起到一定的保护作用。众多的研究结果提示,rcan1对多种疾病的发生发展都具有重要作用。
3.哺乳动物和人体内细胞存在着一类介导低氧适应性反应的转录因子,能激活许多低氧反应性基因(hypoxia responsive genes,hrg)的表达,是在低氧条件下维持氧稳态的关键性物质,称低氧诱导因子1(hypoxia inducible factor,hif1)。hif1转录因子包括两个亚单位,即低氧调控的α亚单位(hif1α)和对氧不敏感的β亚基hif1β,其中hif1α是决定hif1功能的关键亚基。人hif1α的基因位于第14号染色体(14q21-4)上,属于hifs(hypoxia inducible factors,hifs)家族。研究表明,细胞低氧状态可诱导hif1α的表达,其在体内介导的生理或病理作用主要通过与目的基因的低氧反应元件(hypoxia response element,hre)结合而调节目的基因的表达来实现。现已发现受hif1α调控的下游目的基因包括促红细胞生成素(erythropoietin,epo)、血管内皮生长因子(vascular endothelial growth factor,vegf)、诱导性一氧化氮合酶(inducible nitric-oxide synthase,inos)、血红素氧合酶-1(heme oxygenase-1,ho-1)等五十多种基因的表达,进而来介导机体的一系列低氧适应性反应如红细胞生成,血管舒张,血管生成和糖酵解等等。因此,hif1α参与多种生理过程,对多种疾病均有调控作用,hif1α蛋白活性的检测意义重大。
4.目前的研究多是通过wb法检测hif1α蛋白表达水平进而指示细胞缺氧程度,通过与正常条件下的对照相比hif1α蛋白的表达量,确定细胞的缺氧状态。该方法的弊端在于,wb操作步骤较为繁琐复杂,细胞裂解时要在裂解液中及时添加足量的仍处于有效期内的蛋
白酶抑制剂和磷酸酶抑制剂以减缓蛋白的降解,从收集细胞、细胞裂解、离心至免疫沉淀反应等需要全程保持在0-4℃条件下操作,且反应用时长,通常需要四小时至过夜孵育,长时间暴露于4℃环境即使在有蛋白酶抑制剂的条件下仍易导致蛋白降解。另外,hif1α蛋白在常氧条件下极易迅速降解,要求操作过程必须熟练且快速,否则结果将会受到影响。再者,目前市面上hif1α的抗体与同规格其他普通蛋白抗体相比,价格高昂,活性不够稳定、存放时间短等缺点,对结果的准确性有一定的影响。
5.总体来说,这类方法检测起来费时费力,结果不稳定且检测成本较高。
技术实现要素:
6.本发明旨在提供一种能够被hif1α蛋白激活的rcan1.4启动子片段及其应用,本发明还提供了一种能够利用双荧光素酶报告基因指示细胞缺氧程度和hif1α蛋白活性的方法及其应用。
7.为了达到上述目的,本发明采用以下技术方案:
8.本发明的第一目的是提供一种rcan1.4启动子片段,所述rcan1.4启动子片段为rcan1.4-315-15启动子片段,该启动子片段为下列序列之一:
9.1)如seq id no.1所示的核苷酸序列;
[0010]5’‑
ctgttttttccattctccccaagcaaagttaattagcatagggaaaa tgactaaggtgttgacgtcacctctttccagtagaaacttacactttgtccctgtctgcctgcaagcatgcaggacttgactcaggaatttgctgtccaaacaggatgctgtggaagctgcactttttttttccccagggagtgggggctggcccttactgctttataagcaccagctcaagaaggaacctacagcctcttggaaaggaatctcactaggggcttgactgcgtgggtctgtagcgctttcac-3’(seq id no.1)
[0011]
2)seq id no.1所示的核苷酸序列在保留核心启动子序列的基础上经取代、缺失和/或添加一个或几个核苷酸且具有同等功能的由seq id no.1所示的核苷酸序列衍生的核苷酸序列。
[0012]
本发明的第二个目的是提供一种指示载体,该指示载体含有根据上述所述的rcan1.4-315-15启动子片段和含有报告基因的空白载体pgl3-basic。
[0013]
本发明的第三个目的是提供一种细胞,该细胞系含有上述所述的指示载体。
[0014]
本发明的又一个目的是提供一种工程菌,该工程菌含有上述所述的指示载体。
[0015]
本发明的又一个目的是提供一种利用双荧光素酶报告基因检测hif1α蛋白表达变化的方法,包括如下步骤:
[0016]
s1、将生长状态良好、处于对数生长期的hek293细胞接种到48孔培养板中,37℃、5%c02饱和湿度培养箱中贴壁培养;
[0017]
s2、构建如上述所述的指示载体;
[0018]
s3、将指示载体转染入48孔培养板的hek293细胞中,转染时细胞密度约为70-80%;
[0019]
s4、转染48小时后,将细胞进行或不进行缺氧(1%o2)处理,检测指示载体中报告基因的表达变化,进而判断指示载体中rcan1.4-315-15启动子片段的激活情况,从而判断hif1α蛋白表达变化。
[0020]
优选的,所述步骤s2构建如上述所述的指示载体的包括步骤:
[0021]
利用报告基因检测系统,将rcan1.4-315-15启动子片段插入带有报告基因的空白载体pgl3-basic中,构建表达报告基因的重组质粒;
[0022]
优选的,所述步骤s4中的报告基因为萤火虫荧光素酶报告基因,所述步骤s4中检测指示载体中报告基因的表达具体包括步骤:
[0023]
1)转染后48小时,将细胞进行或不进行缺氧(1%o2)处理后,立即弃去培养基,用预冷的pbs清洗细胞并加入1
×
passive lysis buffer细胞裂解液100μl,室温条件下放置在摇床上裂解20min至细胞完全裂解;
[0024]
2)将细胞裂解液收集转移到1.5ml的ep中,涡旋振荡器震荡混匀15秒,4℃条件下12000g离心5min后,取上清置于冰上待测;
[0025]
3)采用双荧光素酶报告基因检测试剂盒,在新的ep管中依次加入2μl细胞上清液,再加入10μl萤火虫荧光素酶分析试剂ii(fl)充分混匀,应用glomax tm bioluminimeter(单管分光光度计)检测荧光素酶活性;然后加入10μlstop&glo reagent(rl),读数10s检测海肾荧光素酶(内参)活性,两组数值比即为相对荧光素酶单位rlu。
[0026]
本发明的又一个目的是提供一种利用报告基因检测hif1α蛋白表达变化的试剂盒,所述试剂盒包括上述所述的指示载体或上述所述的细胞或上述所述的工程菌。
[0027]
我们研究发现,rcan1.4启动子片段可以被hif1α蛋白激活,且rcan1.4的mrna和蛋白表达量均显著上调。为了寻找rcan1.4启动子片段上具体的hif1α蛋白结合位点,我们扩增了rcan1.4启动子区-315bp-15bp的序列,并将其插入到空白载体pgl3-basic中,命名为rcan1.4-315-15-luc。我们发现rcan1.4-315-15-luc对细胞缺氧条件和hif1α蛋白十分敏感,细胞缺氧状态下hif1α表达增加,进而会显著增加rcan1.4-315-15-luc的荧光素酶活性。为进一步确定rcan1.4-315-15启动子片段对hif1α蛋白的敏感性,我们还构建了rcan1.4-315-15-gfp的载体,研究发现缺氧状态下hif1α蛋白过表达会显著增加rcan1.4-315-15-gfp的荧光亮度。因此,我们有理由认为rcan1.4-315-15启动子片段可以作为细胞缺氧和hif1α蛋白活性的指示剂。
[0028]
本发明进一步发现rcan1.4-315-15启动子片段应用广阔,采用双荧光素酶报告实验,细胞裂解后直接进行检测,简单快捷,省去了繁琐的wb方法。当需要检测细胞缺氧程度或hif1α蛋白活性时,只需要提前将rcan1.4-315-15-luc或rcan1.4-315-15-gfp质粒转染到对应的细胞中去,并在对细胞进行缺氧处理后通过检测rcan1.4-315-15-luc的荧光素酶活性和rcan1.4-315-15-gfp的表达量,即可反映细胞缺氧程度和hif1α蛋白活性,简单易行,并且效果直观,检测方便灵敏,检测时间短,同时可以对双荧光素酶报告实验的检测结果进行双重验证。
[0029]
与现有技术相比,本发明具有以下有益效果:
[0030]
1)本发明提供的能够被hif1α蛋白激活rcan1.4-315-15启动子片段,对hif1α蛋白具有高度的敏感性,可以作为细胞缺氧和hif1α蛋白活性指示剂;
[0031]
2)本发明提供的利用双荧光素酶报告基因检测hif1α蛋白活性的方法能够指示细胞缺氧程度,相比于传统的通过wb法检测hif1α蛋白表达水平进而指示细胞缺氧程度,本发明的免疫荧光法更加省时省力,结果稳定,大大降低了检测成本;
[0032]
3)采用本发明双荧光素酶报告实验,细胞裂解后直接进行检测,简单快捷,省去了繁琐的wb方法,hif1α蛋白极易降解,该方法避免了wb操作步骤繁琐导致的出错率和样品损
失,同时减少蛋白暴露在4℃环境中的时间,降低蛋白降解,检测结果更为准确;
[0033]
4)本发明的免疫荧光法检测相对于wb检测,效果更为直观,检测更为方便灵敏,检测时间短,同时对双荧光素酶报告实验的检测结果进行双重验证。
附图说明
[0034]
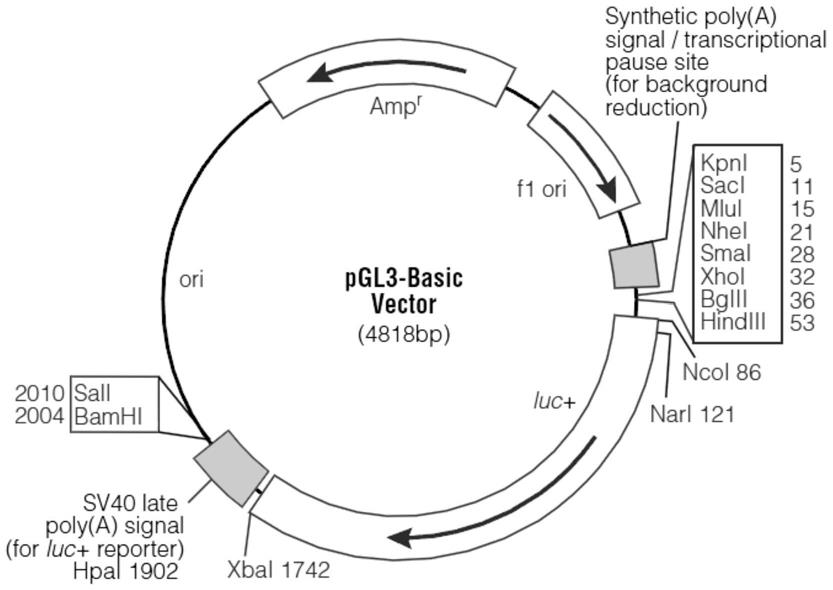
图1为pgl3-basic空白载体多克隆位点图;
[0035]
图2为缺氧条件下,wb法检测hif1α蛋白的变化图(a)和luciferase实验检测rcan1.4-315-15-luc的荧光素酶活性变化图(b);
[0036]
图3为敲低hif1α后,luciferase实验检测正常氧条件下和缺氧条件下rcan1.4-315-15-luc的荧光素酶活性变化图,其中(a)为wb法检测sihif1α的敲低效率,(b)为luciferase实验结果;
[0037]
图4为hek293细胞高表达hif1α蛋白后luciferase实验中rcan1.4-315-15-luc的荧光素酶活性图;
[0038]
图5为rcan1.4-315-15-gfp在缺氧0h和缺氧3h时的荧光强度变化结果图。
具体实施方式
[0039]
以下通过实施例形式的具体实施方式,对本发明的上述内容作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下实施例。
[0040]
所述lipo2000转染试剂购自thermo fisher公司,货号11668500;蛋白酶抑制剂和磷酸酶抑制剂均购自sigma公司,货号分别为s8830和4906845001;anti-hif1α抗体购自santa cruz公司,货号sc-13515;
[0041]
所述蛋白定量检测试剂盒:pierce
tm bca蛋白定量试剂盒,购自thermo fisher scientific公司,货号:23225;
[0042]
所述培养基:含有10%胎牛血清的dmem培养基。胎牛血清购自biological industries公司,货号04-002-1acs;培养基购自中科迈晨,货号cm15019;
[0043]
所述双荧光素酶报告基因检测系统dual-luciferase reporter assay system:购自promega公司,货号e1910,该试剂盒包括萤火虫荧光素酶分析试剂ii(fl)和stop&glo reagent(rl);
[0044]
所述hif1α的表达载体和空白载体pgl3-basic由加拿大健康科学院院士宋伟宏教授友情提供;所述hif1α的编码序列来源自ncbi的数据库,基因编号nm-001530.4;
[0045]
所述hek293细胞购自atcc;
[0046]
所述anti-hif1α抗体购自santa cruze公司,货号sc-13515;
[0047]
所述sihif1α、sicon于吉玛基因定制。
[0048]
实施例1质粒构建
[0049]
1.1构建rcan1.4启动子区rcan1.4-315-15-luc和rcan1.4-315-15-gfp质粒:
[0050]
rcan1.4第一个外显子的第一个atg命名为+1,将rcan1.4启动子区-315bp-15bp的序列插入到pgl3-basic的多克隆位点smai和hindiii中,得到rcan1.4-315-15-luc质粒。正常情况下,pgl3-basic载体上含有表达荧光素酶报告基因luc的编码序列且没有启动子元件,不能够启动luc基因的表达,如果插入的外源性序列具有启动子活性,为启动子元件,那
么报告载体的荧光素酶活性就会升高,因此该质粒的荧光素酶活性取决于插入片段的启动子活性。我们将rcan1.4-315-15-luc质粒中的luc编码序列切除,替换成gfp的编码序列,那么插入片段的启动子活性增加时,gfp的表达会增加,细胞荧光亮度会增加,其中pgl3-basic空白载体含有多个多克隆位点,如图1所示。
[0051]
1.1.1构建rcan1.4-315-15-luc质粒:
[0052]
a.设计扩增rcan1.4启动子区-315bp-15bp的引物,并在引物上加入酶切位点,上游酶切位点为smai,下游酶切位点为hindiii;
[0053]
b.从细胞中提取基因组dna,以基因组dna为模板,通过pcr获得rcan1.4启动子区-315bp-15bp的片段进行琼脂糖凝胶电泳,并进行核酸纯化;
[0054]
c.纯化产物与pgl3-basic载体分别进行双酶切反应(限制性内切酶为smai和hindiii,反应条件为37℃条件下15min),后进一步纯化酶切产物;
[0055]
d.将纯化后的酶切产物(载体和插入片段)做连接反应,16℃条件下连接1小时;
[0056]
e.将反应产物转化入感受态细菌dh5α,并与转化后16小时观察克隆生长情况;
[0057]
f.挑取克隆,37℃条件下氨苄青霉素抗性lb培养基中摇菌16小时,并纯化菌体质粒,并进行酶切验证;
[0058]
g.将验证阳性的质粒送测序。
[0059]
1.1.2构建rcan1.4-315-15-gfp质粒:
[0060]
a.通过直接合成的方法,合成gfp的编码序列,并在两端加上酶切位点,上游酶切位点为ncoi,下游酶切位点为xbai;
[0061]
b.将rcan1.4-315-15-luc质粒进行双酶切反应(限制性内切酶为ncoi和xbai,反应条件为37℃条件下15min),后进一步纯化酶切产物;
[0062]
c.将纯化后的酶切产物和第一步中合成序列做连接反应,16℃条件下连接1小时;
[0063]
d.将反应产物转化入感受态细菌dh5α,并与转化后16小时观察克隆生长情况;
[0064]
e.挑取克隆,37℃条件下氨苄青霉素抗性lb培养基中摇菌16小时,并纯化菌体质粒,并进行酶切验证;
[0065]
f.将验证阳性的质粒送测序。
[0066]
1.2构建hif1α的表达载体质粒:
[0067]
hif1α的表达载体由加拿大健康科学院院士宋伟宏教授友情提供,将hif1α的编码序列插入到pcdna3.1空白载体中并融合ha标签蛋白序列,其中,hif1α的编码序列来源自ncbi的数据库,基因编号nm-001530.4。
[0068]
实施例2缺氧条件下hif1α蛋白表达变化和rcan1.4-315-15-luc的荧光素酶活性变化
[0069]
2.1应用lipo3000转染试剂(或其他品牌转染试剂均可)将rcan1.4-315-15-luc转染入hek293细胞中,hek293细胞转染时密度约为75%。
[0070]
2.2转染后48小时,将细胞进行或不进行缺氧(1%o2)处理后,立即弃去培养基,用预冷的pbs清洗细胞并加入1
×
passive lysis buffer细胞裂解液100μl,室温条件下放置在摇床上裂解20min至细胞完全裂解,将细胞裂解液收集转移到1.5ml的ep中,涡旋振荡器震荡混匀15秒,4℃条件下12000g离心5min后,取上清置于冰上待测。
[0071]
2.3采用双荧光素酶报告基因检测试剂盒,在新的ep管中依次加入2μl细胞上清
液,再加入10μl萤火虫荧光素酶分析试剂ii(fl)充分混匀,应用glomax
tm bioluminimeter(单管分光光度计)检测荧光素酶活性;然后加入10μlstop&glo reagent(rl),读数10s检测海肾荧光素酶(内参)活性。两组数值比即为相对荧光素酶单位(rlu)。
[0072]
2.4采用蛋白定量检测试剂盒将剩余的样品应用bca法进行蛋白定量,取每个样品50μg总蛋白量,加入上样缓冲液混匀并于95℃加热变性5min并冷却至室温,样品进行wb电泳,应用anti-hif1α抗体及一抗结合对应种属的荧光二抗进行检测。
[0073]
实验结果:图2(a)为wb法检测缺氧条件下hif1α蛋白的变化图,可见缺氧条件下hif1α蛋白表达较对照明显增加;图2(b)为luciferase实验结果,可见缺氧条件下rcan1.4-315-15-luc的荧光素酶活性较对照明显增加;缺氧条件下rcan1.4-315-15-luc的荧光素酶活性变化趋势与hif1α蛋白的变化趋势一致,提示rcan1.4-315-15-luc可用于指示细胞缺氧状态和hif1α蛋白活性。
[0074]
实施例3缺氧条件下敲低hif1α蛋白后rcan1.4-315-15-luc的荧光素酶活性变化
[0075]
3.1应用lipo3000转染试剂(或其他品牌转染试剂均可)将构建好的rcan1.4-315-15-luc质粒与sihif1α或sicon共转染入48孔培养板的hek293细胞中,转染时细胞密度为75%。
[0076]
3.2转染后48小时,将细胞进行或不进行缺氧(1%o2)处理后,立即弃去培养基,用预冷的pbs清洗细胞并加入1
×
passive lysis buffer细胞裂解液100μl,室温条件下放置在摇床上裂解20min至细胞完全裂解,将细胞裂解液收集转移到1.5ml的ep中,涡旋振荡器震荡混匀15秒,4℃条件下12000g离心5min后,取上清置于冰上待测。
[0077]
3.3采用双荧光素酶报告基因检测试剂盒,在新的ep管中依次加入2μl细胞上清液,再加入10μl萤火虫荧光素酶分析试剂ii(fl)充分混匀,应用glomax
tm bioluminimeter(单管分光光度计)检测荧光素酶活性;然后加入10μlstop&glo reagent(rl),读数10s检测海肾荧光素酶(内参)活性。两组数值比即为相对荧光素酶单位(rlu)。
[0078]
3.4采用蛋白定量检测试剂盒将剩余的样品应用bca法进行蛋白定量,取每个样品50μg总蛋白量,加入上样缓冲液混匀并于95℃加热变性5min并冷却至室温,样品进行wb电泳,应用anti-ha/hif1α抗体及一抗结合对应种属的荧光二抗进行检测。
[0079]
实验结果:图3(a)为wb法检测sihif1α的敲低效率,可见加入sihif1α后,细胞中hif1α蛋白表达较对照sicon明显降低;图3(b)为敲低hif1α蛋白后的luciferase实验结果,luciferase实验证实了敲低hif1α后,rcan1.4-315-15-luc的荧光素酶活性在正常条件下和缺氧条件下均较对照明显降低,与hif1α蛋白的变化趋势一致,进一步提示rcan1.4-315-15-luc可用于指示细胞缺氧状态和hif1α蛋白活性。
[0080]
实施例4luciferase实验检测hif1α诱导的rcan1.4-315-15-luc的荧光素酶活性变化
[0081]
4.1应用lipo2000转染试剂(或其他品牌转染试剂均可)将构建好的rcan1.4-315-15-luc质粒分别与hif1α表达质粒及空白对照质粒共转染入48孔培养板的hek293细胞中,转染时细胞密度为75%。
[0082]
4.2转染后48小时,将细胞进行或不进行缺氧(1%o2)处理后,立即弃去培养基,用预冷的pbs清洗细胞并加入1
×
passive lysis buffer细胞裂解液100μl,室温条件下放置在摇床上裂解20min至细胞完全裂解,将细胞裂解液收集转移到1.5ml的ep中,涡旋振荡器
震荡混匀15秒,4℃条件下12000g离心5min后,取上清置于冰上待测。
[0083]
4.3采用双荧光素酶报告基因检测试剂盒,在新的ep管中依次加入2μl细胞上清液,再加入10μl萤火虫荧光素酶分析试剂ii(fl)充分混匀,应用glomax
tm bioluminimeter(单管分光光度计)检测荧光素酶活性;然后加入10μlstop&glo reagent(rl),读数10s检测海肾荧光素酶(内参)活性。两组数值比即为相对荧光素酶单位(rlu)。
[0084]
实验结果:图4为高表达hif1α蛋白后luciferase实验结果,可见高表达hif1α蛋白后,rcan1.4-315-15-luc的荧光素酶活性明显增加,进一步验证了rcan1.4-315-15-luc可作为细胞缺氧状态和hif1α蛋白活性的指示剂。
[0085]
实施例5免疫荧光法检测
[0086]
5.1应用lipo2000转染试剂将带有gfp蛋白的rcan1.4-315-15-gfp质粒转染入35mm培养皿的hek293细胞中。
[0087]
5.2转染后24-48小时,将细胞进行缺氧处理,对照细胞不进行缺氧处理,固定细胞后可直接进行活细胞的荧光拍照及并进行定量分析。
[0088]
实验结果:如图5所示,荧光显微镜的结果更加直观的检测到缺氧条件下,rcan1.4-315-15-gfp表达量显著增加。
[0089]
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1