纤维特异性启动子proGhROP6及其应用
纤维特异性启动子proghrop6及其应用
技术领域
1.本发明属于植物基因工程技术领域,具体涉及纤维特异性启动子proghrop6及其应用。
背景技术:
2.棉花是一种重要经济作物,是全球纺织工业中提供天然的纤维原料。为应对棉花生产的需求,基因工程已成为一种快速而有效的手段用于棉花遗传改良。目前,转基因棉花的使用在全球的棉花生产中已经超过70%(zhang et al.,2015)。但在改善纤维性状方面,这一尝试仍极具挑战。其中最主要的问题是如何在特定时期和组织中表达需要的目的基因。因为一些能够促进纤维发育的基因会影响植物组织的生长和发育。例如,生长素是一种重要的植物激素促进纤维发育(seagull and giavalis,2004)。不恰当的操纵植物体内生长素的生物合成常常导致转基因棉花出现异常(zhang et al.,2011)。此外,控制目的基因在纤维中的精准表达也可避免产生任何系统性的不利影响。因此,分离和鉴定棉花纤维特发育相关启动子显得尤为重要。
3.棉纤维由胚珠表达细胞分化而来。棉纤维的发育分为五个连续的阶段:起始、伸长、转变、次生细胞壁合成和成熟(haigler et al.,2012)。目前,一系列与纤维相关的启动子已经被发现。大多数在伸长到次生细胞壁合成阶段在纤维中具有活性。e6和fbl2a就是因其在棉纤维cdna文库中大量转录而分离得到的两个启动子,在此阶段具有明显活性(john and crow,1992;rinehart et al.,1996)。e6和fbl2a在表现出很好的纤维特异性,其活性强度大约为组成型启动子camv35s的九分之一和三分之一(rinehart et al.,1996)。脂肪酶/水解酶基因(ghgdsl)的启动子在次生细胞壁合成阶段的纤维中具有活性(yadav et al.,2017)。类似的活性也在类几丁质酶蛋白(ghctl)和tcp转录因子(gbtcp)的启动子上观察到。但是这两个启动子在花药、木质部或年轻子叶和根中的也具有一定的活性(zhang et al.,2004;hao et al.,2012)。
4.另一部分棉纤维相关启动子主要活跃在纤维的起始和伸长阶段。扩张蛋白gbexp2de的启动子主要在伸长纤维中而不是在起始纤维中具有活性,并且在其他膨大的组织中也具有活性,如种皮、幼子叶和下胚轴(li et al.,2015)。微管和微丝与棉纤维的发育密切相关。β
‑
微管蛋白ghtub1的启动子同样在发育的纤维中有活性,但在花粉、子房、花柱和子叶等组织也能检测到表达(li et al.,2002)。肌动蛋白actin基因(ghact1)的启动子的特点也与之十分类似(li et al.,2005)。棉花纤维的起始和伸长和其它毛状体细胞相似,也存在很多转录因子的参与。一些转录因子的调控序列也相应的得以鉴定。rd22
‑
like1(rdl1)、r2r3 myb因子(ghmyb25、ghmyb25
‑
like)和hd
‑
zip因子(ghhd
‑
1)的启动子不仅在发育的纤维而且在其他毛状体细胞中表现出典型的具有毛状体特异性的表达活性(wang et al.,2004;machado et al.,2009;walford et al.,2011,2012)。而且ghmyb25、ghmyb25
‑
like和ghhd
‑
1的启动子在花药、花粉粒、木质部血管或根等组织中也观察到一些的活性泄露(machado et al.,2009;walford et al.,2011,2012)。此外,另一个myb转录因子
(ghmyb109)的启动子具有很好的纤维特异性,在纤维起始阶段尤其是开花后5天的纤维中活性较强(pu et al.,2008)。这种较好的特异性也出现在一个纤维特异性的蛋白酶(ghscfp)的启动子上,其活性从开花当天持续到次生壁合成时期(hou et al.,2008),活性强度也较高(zhang et al.,2011)。gbpdf1是一种调节棉花纤维起始的protodermal factor1,其启动子主要在胚珠表皮和发育中的纤维中有活性,但也在一些生殖组织和幼苗中也十分活跃(deng et al.,2012)。除了棉花内源启动子,一些异源启动子也表现出了纤维相关的活性。来源于矮牵牛的fbp7启动子和来源于拟南芥的ban启动子均在纤维起始阶段的胚珠表皮细胞中表现出较强的活性(zhang et al.,2011)。随着高通量技术的应用,已经鉴定出大量在纤维中优势表达的基因。然而,能够在纤维中特异控制基因转录的调控序列仍然十分有限,尤其是那些具有详细活性鉴定的启动子。这阻碍了在理解纤维发育机制以及改善棉纤维特性方面的进展。
技术实现要素:
5.本发明的目的在于提供一种启动子可用于棉花纤维性状的遗传改良。
6.本发明的技术方案是纤维特异性启动子proghrop6,其核苷酸序列如seq id no.1所示。
7.本发明还提供了含有所述启动子的重组载体、表达盒、转基因细胞系或重组菌。
8.本发明还提供了所述纤维特异性启动子proghrop6及含有所述启动子的重组载体、表达盒、转基因细胞系或重组菌在调控棉花纤维生长发育中的用途,proghrop6的核苷酸序列如seq id no.1所示。
9.进一步的,本发明还提供了所述纤维特异性启动子proghrop6及含有所述启动子的重组载体、表达盒、转基因细胞系或重组菌在纤维起始阶段调控棉花纤维生长发育中的用途。
10.本发明的有益效果:本发明克隆了棉花纤维发育过程特异表达的ghrop6调控序列,经试验验证是一个强度温和,在纤维中特异性较高,主要在纤维起始阶段活跃的启动子。本发明为棉花纤维研究和纤维性状改良的所需要的基因表达精细控制提供了新的元件。
附图说明
11.图1:proghrop6::gus转基因植株鉴定。n代表阴性对照,p代表阳性对照,m2000代表marker 2000,1
‑
100代表不同的转基因株系。
12.图2:proghrop6::gus在陆地棉不同组织中的gus染色结果。编号#1、5、19和21代表不同的转基因株系;ovule代表胚珠,leaf代表叶片,stem代表茎,petal代表花瓣,stamen+pistil代表雄蕊和雌蕊。
13.图3:proghrop6::gus在陆地棉纤维不同发育时期gus染色结果。编号#1、19和21代表不同转基因株系;dpa为day(s)post anthesis缩写,代表(棉花花朵)开花后的天数。
14.图4:proghrop6::gus转基因植株纤维发育不同时期的gus酶活。横坐标代表代表(棉花)开花天数;纵坐标代表gus酶活,用每毫克蛋白每分钟产生的4
‑
mu的量(皮摩尔,pmol)表示。每个实验设置3个生物学重复。
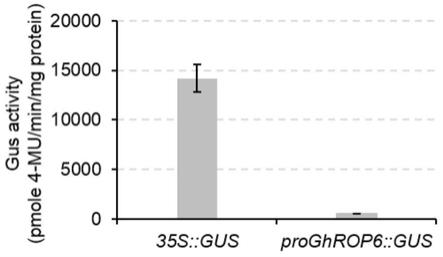
15.图5:camv35s::gus和proghrop6::gus开花当天胚珠中的gus酶活。横坐标代表代表(棉花)开花天数;纵坐标代表gus酶活,用每毫克蛋白每分钟产生的4
‑
mu的量(皮摩尔,pmol)表示。每个实验设置3个生物学重复。
具体实施方式
16.以下结合附图对本发明进行进一步的详细说明,但以下说明并不对本发明进行限定,任何对本发明的变形和改变,只要不脱离本发明的精神,均应属于本发明所附权利要求所定义的范围。
17.本发明实例中的试剂药品未做具体说明的均为普通市售。材料方法未做具体说明的均参考《分子克隆实验指南》(sambrook和russell,2001)。
18.实施例1载体的构建
19.1.1植物rna提取
20.选取约1g新鲜的棉花材料在研钵中加入液氮充分碾磨成细粉,用艾德莱生物公司的easyspin plant rna kit提取rna,提取步骤按照内附说明书进行。提取完成后取2μl进行琼脂糖凝胶电泳,以检测所提取rna的质量。
21.1.2cdna合成
22.rna提取完成后,用takara公司的primescript rt reagent kit with gdna eraser进行cdna合成,操作步骤按照说明书进行。
23.1.3棉花基因ghrop6启动子的获得
24.申请人基于研究经验,根据ghrop6(jgi登录号:gohir.d01g159200)上游序列设计引物(seq id no.2和seq id no.3),以陆地棉gdna为模板,扩增得到1240bp的核苷酸序列(seq id no.1),为启动子proghrop6。
25.seq id no.1:基因,来源于陆地棉
26.[0027][0028]
seq id no.2:proghrop6扩增上游引物,5
’‑
attaagcttcagaactttcttatttcactg
‑3’
[0029]
seq id no.3:proghrop6扩增下游引物,5
’‑
attggatcc acccaagattcgcagtaatgaaagc
‑3’
[0030]
1.4proghrop6::gus植物超量表达载体的构建
[0031]
本发明优选的用于构建植物表达载体的骨架载体为pbi121(genebank登录号af485783),是常用的植物表达双元载体,具有camv 35s启动子调控下的gus基因。
[0032]
将pbi121植物表达载体用bamhⅰ和hindⅲ进行酶切线性化。各种限制性内切酶为thermo scientific公司产品,按照说明书进行酶切。将用带酶切位点的引物(seq id no.2和seq id no.3)扩增获得的proghrop6序列,以及植物表达载体pbi121用bamhⅰ和hindⅲ进行酶切后连接在一起。将获得的proghrop6::gus的植物表达载体中用于棉花遗传转化,所用的棉花实验材料为陆地棉(gossypium hirsutum l)。
[0033]
实施例2转化棉花
[0034]
2.1用电激法将构建的植物表达载体质粒导入农杆菌gv3101
[0035]
参考bio
‑
rad micropulser用户说明书,将上述载体通过电激转化法导入农杆菌gv3101。
[0036]
农杆菌电击转化步骤为:取出农杆菌感受态细胞置于冰上融化,电击转化所用的
电击杯用无菌水清洗5~6次,置于冰上备用。吸取20~50ng质粒与感受态细胞混匀后加入电击杯中。打开bio
‑
rad公司的电击转化仪,选择agr/bacteria模式进行电击。电击后立即加入800μl yeb液体培养基,28℃,200rpm振荡培养3h。10000rpm离心1min,弃上清,留下约100μl培养基重悬菌体,菌液均匀涂布在加有相应抗生素(如50μg/ml kan)的yeb平板上,28℃恒温倒置培养48h。
[0037]
2.2组成型表达gus结合proghrop6的载体整合到棉花基因组
[0038]
通过根癌农杆菌介导的方法进行棉花的遗传转化(转化过程中所用的培养基见表1),上述植物表达载体的t
‑
dna区段通过农杆菌介导胚性愈伤的方法导入棉花。具体方法如下:
[0039]
(1)棉花种子萌发:陆地棉栽培种柯字棉种子剥去外壳,选取大而饱满的子仁置于三角瓶中,先用75%酒精灭菌1~2min,用无菌水漂洗2次;再用0.1%升汞(hgcl2)灭菌10min,无菌水漂洗6次。用无菌水于常温,120rpm摇床上振荡培养12h。将露白的子仁胚根朝下接种入萌发培养基中,并置于28℃黑暗条件下萌发2~3d,以获得无菌棉花幼苗。
[0040]
(2)转化农杆菌的培养:将含有上述植物表达载体的农杆菌菌种,接种于含50mg/l卡那霉素和125mg/l链霉素的yeb固体培养基(0.5%蔗糖(w/v),0.1%细菌用酵母提取物(w/v),1%细菌用胰化蛋白胨(w/v),0.05%mgso4·
7h2o(w/v),1.5%的琼脂粉(w/v)ph7.0)上划线培养。接种新划板活化的农杆菌单菌落于5ml含相同抗生素的yeb液体培养基中,28℃、,200rpm振荡培养过夜。取1ml菌液于20~25ml含相同抗生素的yeb液体培养基中进行二次活化,28℃,200rpm振荡培养至od600为0.8~1.0左右。10000rpm室温离心1min,收集菌体,用等体积的液体共培养基(含as)重悬菌体,作为侵染液备用。
[0041]
(3)浸染和共培养:将棉花无菌下胚轴切成0.5cm左右的小段,置于含侵染液的三角瓶内,28℃、100rpm摇床侵染45min。弃去菌液,将侵染过的下胚段接种入固体共培养基上(含as),28℃黑暗培养2d。
[0042]
(4)转化子的筛选:共培养完成后将下胚段转移到筛选培养基上进行脱菌和选择培养,28℃,16h光照下培养,每2周继代一次。1
‑
2个月后大部分愈伤组织褐化死亡,少部分表现出卡那霉素抗性,生长出新鲜的胚性愈伤组织。将愈伤组织块进行继代,每块组织增殖到2.0
‑
3.0g时接入液体悬浮培养基中,在摇床上120rpm振荡悬浮培养以获得大量体胚。悬浮2周后用30目筛网过滤悬浮培养组织,网下沉淀物转接入体胚成熟培养基。萌发的成熟胚转入体胚伸长诱导培养基上,于28℃黑暗条件下培养2周以诱导体胚伸长、萌发。取较大的萌发胚(>0.5cm)转接入sh培养基成苗,28℃,16h光照下培养。待幼苗长到约2cm高时,剪取幼苗嫁接到有3~4片真叶的棉花幼苗上。
[0043]
表3根癌农杆菌介导的棉花遗传转化用培养基
[0044][0045]
gelrite:sigma,货号:g1910;sh:schenk&hildebrandt,1972。
[0046]
2.3获得转基因棉花
[0047]
获得t1代的转基因棉花在温室中培养,常规管理。收集成熟后的纤维进行性状分析。获得的转基因棉花在表型和生长发育上与野生型的对照没有明显区别。
[0048]
实施例3ghrop6::gus转基因棉花转基因植株筛选
[0049]
植物表达载体骨架pbi121为双元载体,t
‑
dna区域中含有一个用于抗性筛选的nptii表达盒。因此可以扩增基因nptii(seq id no.4)来鉴定proghrop6::gus转基因棉花。分别棉花叶片的gdna,以之为模板用nptii特异引物(seq id no.5和seq id no.6)扩增目标序列对proghrop6::gus转基因植株进行筛选。
[0050]
seq id no.4:nptii基因序列
[0051]
[0052][0053]
seq id no.5:nptii基因扩增引物1,5
’‑
atgattgaacaagatggattgcacg
‑3’
[0054]
seq id no.6:nptii基因扩增引物2,5
’‑
tcagaagaactcgtcaagaaggcga
‑3’
[0055]
具体操作步骤为:
[0056]
转基因植株dna进行pcr体外扩增验证的条件:反应总体积为25μl,包括10μla taq buffer 2.5μl、每种dntp 100μmol/l、1.5mmol/l mgcl2、模板dna 10ng、上下游引物各400nmol/l、1单位la taq dna聚合酶(takara公司)。
[0057]
扩增条件:94℃变性4min,继以94℃变性30s、55℃退火30s、72℃延伸1min,共35个循环,最后72℃延伸10min。扩增产物在含溴乙锭的1%琼脂糖凝胶上以5v/cm的电压电泳后,紫外灯下成像记录。转基因拟南芥的pcr验证结果见图1。转基因棉花dna(泳道1
‑
100)中均能和阳性质粒d(泳道p)一样检测到nptii基因的存在,而野生型棉花dna(泳道n)检测结果为阴性。这表明所获得的转基因棉花均已经整合上目标转基因序列到基因组上。
[0058]
实施例4gus的组织化学染色及观察
[0059]
取新鲜的转基因棉花胚珠,置1.5ml离心管中,加入gus染色液(10mmol/l edta,100mmol/l磷酸缓冲液(ph7.0),0.5mol/l k3[fe(cn)6],0.5mol/l k4[fe(cn)6],0.1%(v/v)triton x
‑
100,1.0mmol/l x
‑
gluc)。将含有植物材料和gus染液的离心管,放入37.0℃恒温箱中,过夜染色。最后倾去染色液,通过70%乙醇脱色后,观察照相。
[0060]
转proghrop6::gus基因棉花的gus染色结果见图2和3。转基因棉花不同组织的染色结果显示多个转基因株系中proghrop6启动子均表现出一致的特异性,只在胚珠表皮有表达活性,而在叶片、花瓣、柱头、茎等组织均不表达(图2)。不同纤维发育时期的胚珠染色结果进一步表明,proghrop6在胚珠外表皮和纤维中表达,且在纤维中的表达具有明显优势(图3中0dpa胚珠)。表达时期主要集中在纤维起始阶段和伸长阶段。这表明ghrop6启动子具有较好的纤维表达特异性(图3)。
[0061]
实施例5gus酶活测定
[0062]
gus酶活测定的方法参考hou等人描述的方法进行(2008),并做部分修改。
[0063]
(1)用bradford法(1976)对蛋白浓度进行检测,具体步骤如下:
[0064]
①
每个样品取50个新鲜的胚珠(0dpa的胚珠)分别用液氮研磨至粉末,按样品/提取液(m/v)=1:2的比例加入gus提取缓冲液,冰上浸提1h。
②
13000rpm室温离心10min,上清即为gus提取液。
③
取3μl gus提取液用900μl bradford工作液稀释,再取200μl稀释后的gus提取液用酶标仪varioskan lux(thermo fisher公司)测定od595时的吸光度值。
④
根据bsa标准曲线计算总蛋白浓度。
[0065]
(2)gus酶活测定具体步骤如下:
[0066]
①
在96孔空白酶标板中按实验需要每孔加入195μl gus反应液,37℃预热待用。
②
重新取96孔空白酶标板按实验需要在每孔中加入180μl gus反应终止液待用。
③
预热的gus反应液中每孔加入5μl gus提取液,混匀后立即取20μl反应液加入到180μl gus反应终止液中,用酶标仪varioskan lux(thermo fisher公司)测定0min时的4
‑
mu荧光值。测定的激发光波长为360nm,发射光波长为460nm,gain值为63(与标曲使用值一致)。
④
在30min时取20μl反应液加入到180μl gus反应终止液中,测定30min的4
‑
mu荧光值。
⑤
根据4
‑
mu荧光值标准曲线计算gus酶活。gus酶活用nmol 4
‑
mu
·
minute
‑1·
mg
‑1total protein表示。每个实验设置3个生物学重复。
[0067]
结果显示,proghrop6在纤维起始阶段的活性强度最高,开花5天后处于较低水平(图4)。同时该启动子强度温和,约为组成型启动子35s的二十五分之一(图5)。
[0068]
上述实施例表明,本发明克隆的proghrop6启动子核苷酸长度为1240bp,当该启动子与报告基因融合后,在棉花中能指导gus报告基因在起始阶段的纤维中特异表达,强度温和,在棉花纤维性状的遗传改良中具有巨大的应用价值。
[0069]
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1