一种鼠抗猴IgG种属特异性抗体及其应用和基于此的抗药抗体的通用型检测方法与流程
一种鼠抗猴igg种属特异性抗体及其应用和基于此的抗药抗体的通用型检测方法
技术领域
1.本发明涉及生物技术领域,特别是涉及一种鼠抗猴igg种属特异性抗体和基于此抗体试剂构建的通用型猴抗人抗药抗体检测方法。
背景技术:
2.单克隆抗体药物(以下简称单抗药)在申请临床使用时需提供相关免疫原性的数据(如使用单抗药后产生的抗药抗体),用于分析临床前的药代及药效研究、安全性等结果。免疫原性通常是指治疗性蛋白产品(如单抗药)诱发的对自身的免疫应答或免疫相关反应的能力。
3.治疗类蛋白产品的药品会被识别为外来物质(抗原)从而产生免疫应答。非预期的免疫应答会破坏药物安全并降低预期的疗效,主要原因为产生的抗药抗体(anti-drug antibodies,ada)具有潜在的副作用,可能影响药物的生物学活性及药代动力学参数进而降低药物的药效,更为严重的具有用药方面的安全隐患。
4.在临床前研究中,抗药抗体的分析可以通过一定的检测数据来描述给予药物后产生免疫反应的抗药抗体出现的时间点,并为药代、毒代、药效、毒理学结果提供相应的析因分析。
5.但是现有技术对于获得抗药抗体检测数据的检测方法的开发费时耗力,在实际应用中往往由于制备阳性对照抗体的时间过长和缺乏平台型的检测技术而难以开发相应的方法、导致药物的开发时间跟着延迟。
技术实现要素:
6.为了解决上述问题,本发明提供了一种鼠抗猴igg种属特异性抗体及其基于此的猴抗人抗药抗体的通用型检测方法。本发明提供的鼠抗猴igg种属特异性抗体及以之构建的检测技术,弥补了现有技术中针对于少量样本的检测还需特定开发一套检测方法的缺陷,简化了检测步骤并缩短了检测时间,极大的降低了开发时间以及开发成本,为更快速的获取数据申报临床提供有力的保障。目前业界没有抗药抗体通用型分析方法,本发明还填补了该领域的空白。
7.本发明提供了一种鼠抗猴igg种属特异性抗体,所述鼠抗猴igg种属特异性抗体的制备方法包括以下步骤:
8.利用单抗药免疫食蟹猴,得到猴来源的抗药抗体(ada);
9.利用猴来源的抗药抗体免疫小鼠,得到鼠抗猴抗体;
10.筛选鼠抗猴抗体得到鼠抗猴igg种属特异性抗体。
11.本发明还提供了上述鼠抗猴igg种属特异性抗体在检测抗药抗体中的应用。
12.本发明还提供了上述鼠抗猴igg种属特异性抗体在制备检测抗药抗体试剂盒中的应用。
13.本发明提供了一种猴抗人抗药抗体的通用型检测试剂盒,所述猴抗人抗药抗体的通用型检测试剂盒包括以下组分:上述鼠抗猴igg种属特异性抗体、ada阳性对照、抗体药物、磁珠和缓冲液;
14.所述ada阳性对照包括食蟹猴来源的抗药抗体。
15.本发明提供了一种临床前研究中猴抗人抗药抗体的通用型检测方法,所述通用型检测方法包括亲和素-生物素法和抗体法。
16.优选的,所述亲和素-生物素法包括以下步骤:
17.(1)将标记有亲和素的磁珠与标记有生物素的单抗药混合,得到结合有单抗药的磁珠;
18.(2)将结合有单抗药的磁珠置于酶标板的板孔中,得到含有磁珠的酶标板;
19.(3)向含有磁珠的酶标板中添加样本,得到含有样本的酶标板;
20.(4)使用缓冲液对含有样本的酶标板进行吹吸混匀;
21.(5)所述吹吸混匀结束后,进行结合反应得到结合有鼠抗猴igg种属特异性抗体的链霉亲和素磁珠复合物;
22.所述结合反应包括:将带有显色标记物的权利要求1所述的鼠抗猴igg种属特异性抗体加入含有链霉亲和素磁珠与样本复合物的酶标板中并进行孵育处理;
23.(6)向结合有鼠抗猴igg种属特异性抗体的磁珠复合物中加入显色底物进行显色反应,得到显色反应磁珠复合物;
24.(7)将磁板置于显色反应磁珠复合物所在的底部,将磁珠吸引到微孔边缘,再加入终止液;
25.(8)使用酶标仪进行检测,并与空白对照组进行对比得到检测结果。
26.优选的,所述标记有亲和素的磁珠包括链霉亲和素磁珠。
27.优选的,所述抗体法包括以下步骤:
28.(1)将标记有鼠抗人igg的磁珠与单克隆抗体混合,得到结合有单克隆抗体的磁珠;
29.(2)将结合有单克隆抗体的磁珠置于酶标板的板孔中,得到含有磁珠的酶标板;
30.(3)向含有磁珠的酶标板中添加样本,得到含有样本的酶标板;
31.(4)使用缓冲液对含有样本的酶标板进行吹吸混匀;
32.(5)所述吹吸混匀结束后,进行结合反应得到结合有鼠抗猴igg种属特异性抗体的磁珠复合物;
33.所述结合反应包括:将带有显色标记物的权利要求1所述的鼠抗猴igg种属特异性抗体加入含有磁珠与样本复合物的酶标板中并进行孵育处理;
34.(6)向结合有鼠抗猴igg种属特异性抗体的磁珠复合物中加入显色底物进行显色反应,得到显色反应磁珠复合物;
35.(7)将磁板置于显色反应磁珠复合物所在的底部,将磁珠吸引到微孔边缘,再加入终止液;
36.(8)使用酶标仪进行检测,并与空白对照组进行对比得到检测结果。
37.本发明提供了一种鼠抗猴igg种属特异性抗体,所述鼠抗猴igg种属特异性抗体的制备方法包括以下步骤:利用单抗药免疫食蟹猴,得到猴来源的抗药抗体;利用猴来源的抗
药抗体免疫小鼠,得到鼠抗猴抗体;进一步筛选鼠抗猴抗体得到鼠抗猴igg种属特异性抗体。本发明通过使用通用型的试剂(鼠抗猴igg种属特异性抗体作为检测试剂,猴来源的抗药抗体作为ada阳性对照)达到了对不同单抗药分子的ada的检测,因而实现了方法的通用性。同时,本发明提供的检测方法由于采用磁珠技术,简化了ada检测步骤,使得原本需要酸化、包被、检测流程简化为清洗后即可检测,还降低了操作时间以及操作难度,提高了抗药抗体检测的成功率,解决了该领域的难点,填充了技术方面的空白。
38.实施例结果表明,本发明提供的鼠抗猴igg种属特异性抗体具备与猴源的igg结合但不受人源抗体(例如单抗药)干扰的特性,还能够通过酸化操作去除干扰物信号既简化了检测步骤,还不影响检测结果,同时还具有极高的准确性和可行性。
39.本发明的优势
40.(1)采用特制的抗体试剂和磁珠技术,实现了通用型的猴抗人抗药抗体的检测;
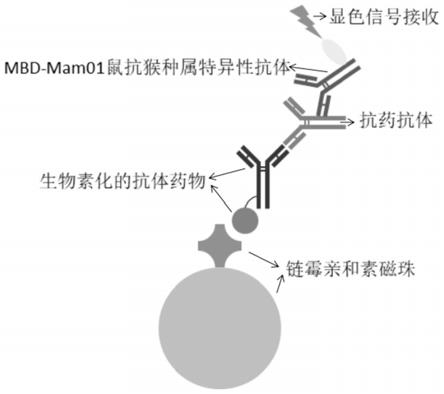
41.(2)本发明采用特定的比例的亲和素的磁珠和标记有生物素的单抗药,能够有效提高抓取结果,提高检测质量;
42.(3)通过试剂盒提供通用型阳性对照ada,极大简化了实验人员的调研以及采购等物资时间成本,无需进行过多试剂操作,是一种通用型ada检测方法;
43.(4)采用磁珠富集ada能够有效地去除干扰物,为接下来的检测提供了稳定性保障。大大降低了操作时间,使原本需要酸化分离检测的步骤简化为只需清洗检测即可。
44.(5)采用磁珠富集方法,使后期操作实现自动化成为可能。
45.抗药抗体检测在大分子药物的开发中为必检测项目,而由于临床前项目量较多,且每个项目涉及到的检测样本量较少,因此针对于各自项目进行的方法开发难免会造成大量人员物资以及时间上的成本浪费。本发明提供的检测方法巧妙运用了磁珠的理化特性以及特制抗体和通用型阳性对照ada,开发出了一种通用型猴抗人ada分析检测方法,不仅解决了上述问题,且该方法将ada分离富集以及后期检测合为一体,无需进行分离后再检测,极大的简化了试验的操作流程,是一种非常具有创新性的ada分析平台技术。
附图说明
46.图1为亲和素-生物素法的操作原理图;
47.图2为抗体法的操作原理图;
48.图3为鼠抗猴igg种属特异性抗体的抗干扰的特异性检测结果;
49.图4为鼠抗猴igg种属特异性抗体的特异性和可行性的检测结果。
具体实施方式
50.为了进一步说明本发明,下面结合附图和实施例对本发明提供的鼠抗猴igg种属特异性抗体及其应用和基于此的猴抗人抗药抗体的通用型检测方法进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
51.实施例1
52.鼠抗猴igg种属特异性抗体的制备
53.将单抗药(包括igg1亚型抗体药物、igg2亚型抗体药物和igg4亚型抗体药物以1:1:1的质量比混合,即每种亚型抗体2mg。)注射进入食蟹猴体内引起免疫反应产生抗药抗
体,纯化猴血后得到相应的猴来源的抗药抗体;将猴来源的抗药抗体(约2mg)注射进入小鼠腹腔中,使小鼠产生鼠抗猴特异性抗体;通过筛选去除鼠抗猴特异性抗体中与人源igg反应的鼠单抗的杂交瘤细胞株,得到只表达鼠抗猴igg种属特异性抗体(下文简称mbd-mam01)的杂交瘤细胞株。由这个杂交瘤细胞株生产鼠抗猴igg种属特异性抗体。
54.实施例2
55.检测方法流程
56.1、亲和素-生物素法
57.(1)将链霉亲和素磁珠与标记生物素的单抗药(biotin-drug)按50:1的质量比混合,恒温震荡仪室温孵育1h,用0.05%吐温20磷酸盐缓冲液(pbst)洗涤三次。
58.(2)磁珠结合单抗药后用pbst清洗,将结合有单抗药的磁珠按180μl/孔加入酶标板的板孔中,用磁板吸附去除液体。
59.(3)向酶标板的板孔中加入样本(含ada样本的猴血,用1%casein稀释),100μl/孔,置于恒温震荡仪室温孵育1h,pbst洗涤三次。
60.(4)加入ph为3.0的甘氨酸缓冲液并吹吸混匀,100μl/孔,室温孵育1h,pbst洗涤三次。
61.(5)加入一定浓度的鼠抗猴igg-hrp(即连接有辣根过氧化物酶的mbd-mam01,下同),使终浓度约为250ng/ml,100μl/孔,置于恒温震荡仪室温孵育1h,pbst洗涤三次。
62.(6)加入显色底物3,3',5,5'-四甲基联苯胺(tmb)并吹吸混匀,100μl/孔,室温孵育10min。
63.(7)将环形磁板放于酶标板底部(将磁珠吸引到微孔边缘),加入终止液静置1~3min。
64.(8)酶标仪检测,得出结果。
65.亲和素-生物素法的操作原理示意图如图1所示。
66.2、抗体法
67.(1)将鼠抗人igg磁珠与单克隆抗体100:1的质量比混合,恒温震荡仪室温孵育1h,pbst洗涤三次。
68.(2)将结合有单克隆抗体的磁珠用pbst清洗,清洗后,将结合有单克隆抗体的磁珠按180μl/孔加入酶标板的板孔中,用磁板吸附去除液体。
69.(3)向酶标板的板孔中加入样本(含ada样本的猴血,用1%casein稀释),100μl/孔,置于恒温震荡仪室温孵育1h,pbst洗涤三次。
70.(4)加入ph值为3.0的甘氨酸缓冲液并吹吸混匀,100μl/孔,室温孵育1h,pbst洗涤三次。
71.(5)加入一定浓度的鼠抗猴igg-hrp,,使终浓度约为250ng/ml,100μl/孔,置于恒温震荡仪室温孵育1h,pbst洗涤三次。
72.(6)加入tmb并吹吸混匀,100μl/孔,室温孵育10min。
73.(7)将环形磁板放于酶标板底部(将磁珠吸引到微孔边缘),加入终止液静置1~3min。
74.(8)酶标仪检测,得出结果。
75.抗体法的操作原理示意图如图2所示。
76.应用例1
77.鼠抗猴igg种属特异性抗体的检测
78.检测实施例1提供的mbd-mam01与猴源的igg结合但不受人源抗体(例如单抗药)干扰的特性,检测数据如图3和表1所示。
79.表1
[0080][0081]
由图3和表1可知,mbd-mam01抗体在1%bsa(pbst缓冲液)中与人源抗体(igg1亚型抗体药物、igg2亚型抗体药物和igg4亚型抗体药物)和猴来源ada进行孵育,但是图3中只有猴来源ada的检测信号呈现s型曲线,人源抗体的检测信号在底部呈直线,表明本发明提供的mbd-mam01与人源抗体未发生非特异性反应,与猴来源的ada存在明显的特异性反应,表明mbd-mam01抗体具备特异性识别猴源ada且不受人源化抗体药物的干扰的特异性性能。
[0082]
应用例2
[0083]
验证甘氨酸酸化对试验效果影响
[0084]
根据实施例2提供的两个检测方法,对比检测方法中进行了甘氨酸酸化和未进行酸化进行实验数据,以及甘氨酸酸洗后对待测物ada的后期检测影响,从而确认试剂可行性。检测结果如表2所示。
[0085]
表2
[0086][0087]
由表2可知,甘氨酸酸化后相对于未酸化组,各浓度信号值与空白组之间信噪比(s/n)显著提高,且对清洗的上清液进行了通用性抗体和特异性抗体两种方法的检测发现,甘氨酸酸化后对待测物ada未产生影响,说明甘氨酸酸化起到了极佳的去除干扰物但不影响检测物的效果。
[0088]
应用例3
[0089]
流程验证:对比试验可靠性
[0090]
取实施例2中亲和素-生物素法中步骤(3)含有样本的酶标板中结合有样品的磁珠,利用本发明提供的检测方法和现有技术提供的分子特异型检测方法分别对(drug a,双特异性抗体药物,靶向cd3&bcma)进行ada检测,对比两组数据差别,以及验证通用型方法的准确性以及可行性。检测结果如图4和表3所示。
[0091]
表3
[0092][0093][0094]
由图4和表3可知,本发明提供的通用型ada检测方法与传统的ada分析方法的检测结果存在一致性,且s/n值更高,因此可以判断本发明提供的通用型ada检测方法不仅能够很取代传统的ada分析方法,同时还有一定的进步性。
[0095]
应用例4
[0096]
1、定性检测及定量检测
[0097]
对注射了单克隆抗体药物修美乐(drug b)的不同取样时间点的试验猴血清样本进行实施例2提供的亲和素-生物素法通用型抗药抗体的分析(由于抗体药的药物注射量以及注射频率与实验结果关系很小,且本发明的分析方法采用本领域技术人员公知的方法,因此这里本发明对具体内容不做赘述)。分析结果如表4所示。
[0098]
表4
[0099]
[0100]
由表4可知,安慰剂组的ada检测结果均为阴性,实验组则均为阳性,因此本发明提供的通用型检测方法完全可以特异性的区分安慰剂组(安慰剂组未使用单克隆抗体药物注射,不会产生ada)与试验组,且试验组产生ada趋势符合单克隆抗体药物在猴样本体内的变化规律,表明本发明提供的通用型检测方法不仅能够定性检测ada,还能够在一定程度呈现定量检测的效果。
[0101]
2、不同媒介检测样本的通用性检测
[0102]
为了验证该方法在其他介质中(如血浆)的检测效果,本发明针对上述猴血清样本所对应的猴血浆样本进行与上述相同的试验流程,验证不同介质样本的通用性能。检测结果如表5所示。
[0103]
表5
[0104][0105]
由上表5可知,安慰剂组均表现为ada阴性,即猴血浆样本中未检测出ada;试验组的ada信号值均为高信号值,表现为阳性。即在猴血样本中,无论样本来源于血浆还是血清样本,血浆与血清样本中ada检测的结果均保持一致,证明我们开发的通用型方法在猴血样本中检测ada的可行性。
[0106]
3、不同药物的通用性检测
[0107]
对双特异性抗体(drug c,靶向pdl1&tigit抗体药物)以及融合抗体(drug d,靶点为治疗新冠病毒的中和抗体)的猴血清样本进行同样的ada检测,验证本发明实施例2提供的通用型检测方法适用于不同项目,证明该检测方法在不同抗体药物中的通用性能。检测结果如表6和表7所示。
[0108]
表6
[0109]
[0110][0111]
表7
[0112][0113]
由表6和表7可知,无论是drug c(双特异性抗体)还是drug d(融合抗体),本发明提供的通用型ada检测方法均可以得到很好的ada检测效果,即安慰剂组均表现为ada阴性,而试验组均表现未ada阳性,充分证明了该通用型方法可以应用于不同的生物抗体药物的ada检测中,方法具有通用性。
[0114]
综上所述:本发明针对于猴血样本开发的通用型ada检测方法完全满足试验需求,方法不仅适用于猴血清以及猴血浆样本,而且针对于不同的抗体药物项目检测结果均不受影响,数据具有一定的可靠性,方法具有很好的通用性,不仅解决了临床前抗体药ada检测方法开发的难题,也将实验操作流程大大简化,是一种极具创新性的ada检测方法。
[0115]
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可以做各种改动和修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1