一种游动放线菌靶向分离方法
1.本发明属于药用微生物资源领域,具体涉及一种游动放线菌的靶向分离方法。
背景技术:
2.放线菌是抗生素及其它生物活性物质的主要生产者,作为一类重要的药用微生物资源,日益受到科研工作者的关注。
3.为了获得新的物种并从中分离得到新的活性代谢产物,人们逐渐将研究对象转为稀有放线菌。稀有放线菌通常指非链霉菌,采用常规分离手段进行分离,其分离频率远低于链霉菌。近年来,随着新的选择性分离方法及基因技术的开发,稀有放线菌的分离数量不断增加。稀有放线菌的靶向分离,不仅可以减少对菌株的重复分离,还可以发现更多生物活性物质,为新药研发奠定基础。
4.游动放线菌属于稀有放线菌。游动放线菌是放线菌目小单孢菌科的第二大属,dna中的g+c含量为70.6%-76%。其典型特征是:基内菌丝顶端形成孢子囊,孢子囊壁破裂或部分溶解释放出游动孢子。游动放线菌是产糖肽类抗生素的重要菌种资源,糖肽类抗生素如替考拉宁、万古霉素等是临床治疗耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,mrsa)等多重耐药的革兰阳性菌感染的有效药物和“最后一道防线”,对人类抗感染疾病的治疗具有重要意义。
5.目前有效发表的游动放线菌属仅有53种,但分离比较困难。对稀有放线菌资源进行勘探,并设计特定的稀有放线菌分离方法对发现药用放线菌新资源至关重要。
技术实现要素:
6.为了解决稀有放线菌,尤其是游动放线菌定向分离的困难。本发明提供一种靶向分离游动放线菌的方法。
7.具体的,本发明公开了一种靶向分离游动放线菌的方法,包括如下步骤:(1)通过添加聚天冬氨酸保水剂(pasp)的土壤恒温培养并原位富集游动放线菌;(2)取原位富集培养的土样,风干后干热处理,采用离心法利用花粉或牛角粉靶向诱捕游动放线菌孢子囊释放的游动孢子;(3)采用选择性培养基分离培养步骤(2)中诱捕的游动孢子,挑取橘黄色、有褶皱、具土腥味的单菌落。
8.优选地,所述步骤(1)中保水剂的用量相对于土壤的重量比1:500-1000;培养条件为25-32℃恒温培养3-5周。
9.优选地,所述步骤(2)中风干后干热处理具体为:自然风干后于100-120℃干热处理20-40min;进一步地,所述步骤(2)中诱捕游动放线菌孢子囊释放的游动孢子的具体步骤为:称取土样,加入生理盐水以及花粉或牛角粉,恒温振荡培养,离心后,取花粉或牛角粉于另一离心管中,用生理盐水依次稀释,获得靶向诱捕的游动孢子。
10.优选的,所述选择性培养基选自添加抗生素的isp 2培养基、添加抗生素的hv培养基或添加抗生素的高氏i号培养中的一种或几种。
11.优选的,所述抗生素选自制霉菌素、萘啶酮酸、环丙沙星、红霉素、庆大霉素、新生霉素、苯唑西林、链霉素和妥布霉素中的一种或几种。
12.本发明公开了一种靶向分离游动放线菌的试剂盒,所述试剂盒包括:聚天冬氨酸保水剂(pasp),花粉或牛角粉,引物对如seq id no:1和seq id no:2所示,放线菌dna提取试剂。
13.本发明公开了所述的试剂盒在靶向分离游动放线菌中的应用。
14.优选的,所述分离方法包括:(1)聚天冬氨酸保水剂(pasp)土壤原位富集;(2)花粉和牛角粉离心法诱捕;(3)设计特定的选择性培养基分离培养,挑取橘黄色、有褶皱、具土腥味的单菌落。
15.优选的,所述分离方法包括:(4)提取单菌落基因组dna,用放线菌16s r rna基因引物进行扩增测序。
16.优选的,所述引物的序列分别如seq id no:1和seq id no:2所示。
17.优选的,所述pasp土壤原位富集的应用包括:采集于河底淤泥、溪流河岸土以及富含腐殖质的枯枝落叶土样自然风干,研钵研磨成细土,过200目筛,混合拌匀。通过pasp保水剂混土原位富集,按照质量比为保水剂:水:土=1:200~300:600~900的比例混合拌匀,其最优配比为保水剂:水:土=1:240:720,装于有孔的塑料瓶中,28℃恒温培养4周。
18.优选的,花粉和牛角粉离心法诱捕的具体应用包括:原位富集的土样自然风干,110℃干热处理30min。按1g土样:9ml水:0.1g花粉加入10ml离心管,28℃振荡孵化2小时,5000rpm离心20min,取有花粉和牛角粉的部分稀释涂板。
19.优选的,设计特定的选择性培养基分离培养,挑取橘黄色、有褶皱、具土腥味的单菌落。
20.优选的,所述方法所选用的培养基具体配方如下:1.稀释10倍的加药的isp 2培养基:葡萄糖0.4g/l,酵母提取物0.4g/l,麦芽浸粉1g/l,琼脂16g/l,微量元素液1ml/l,抗生素20~100mg/l;2.加药的hv培养基:腐殖酸1.0g/l,na2hpo
4 0.5g/l,kcl 1.71g/l,mgso4·
7h2o 0.05g/l,feso4·
7h2o 0.05g/l,caco
3 0.02g/l,琼脂16.0g/l,微量元素液1ml/l,抗生素20~100mg/l;3.加药的高氏i号培养基:可溶性淀粉20g/l,kno
3 1g/l,k2hpo
4 0.5g/l,mgso4·
7h2o 0.5g/l,琼脂15g/l,微量元素液1ml/l,抗生素20~100mg/l。
21.优选的,抗生素为制霉菌素、萘啶酮酸、环丙沙星、红霉素、庆大霉素、新生霉素、苯唑西林、链霉素和妥布霉素中一种或多种。
22.优选的,平板或96孔板培养2周后挑取橘黄色、有褶皱、具土腥味的单菌落。
23.本发明具有以下有益效果:本方法通过聚天冬氨酸保水剂原位富集,花粉和牛角粉诱捕和设计选择性培养基,挑取橘黄色、有褶皱、具土腥味的单菌落,添加制霉菌素、萘啶酮酸、环丙沙星、红霉素、庆大霉素、新生霉素、苯唑西林、链霉素和妥布霉素等特殊的抗生素,具有靶向分离游动放线菌的作用。
24.应用本发明方法,游动放线菌的出菌率高,达67.9%,能够用于分离游动放线菌这一重要药用微生物资源,采用本发明的方法一次靶向分离的游动放线菌的统计结果如表1。
25.表1:一次靶向分离游动放线菌结果统计
[0026][0027][0028]
优选的,采用所述方法,分离到一株拮抗革兰阳性与革兰阴性菌的游动放线菌新物种actinoplanes polyasparticus trm66264-dlm
t
。该菌株对于多种常见菌种表现出拮抗活性。
[0029]
因此,本发明还提供本发明公开了一株游动放线菌actinoplanes polyasparticus trm66264-dlm
t
,所述菌株于2021年4月16日保藏于中国典型培养物保藏中心(cctcc),地址是中国武汉武汉大学,保藏编号为cctcc no:m 2021381。以及提供该菌在抑制大肠杆菌、金黄色葡萄球菌、肺炎克雷伯菌、志贺氏菌中的应用。
附图说明
[0030]
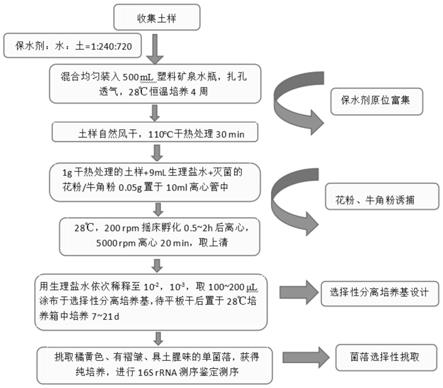
图1为游动放线菌靶向分离流程图。
[0031]
图2为游动放线菌actinoplanes polyasparticus trm66264-dlm
t
菌株扫描电镜图。
[0032]
图3为游动放线菌actinoplanes polyasparticus trm66264-dlm
t
与其相似菌株16sr rna基因构建的系统进化发育树(邻接法)。
[0033]
图4为游动放线菌actinoplanes polyasparticus trm66264-dlm
t
与其相似菌株16sr rna基因构建的系统进化发育树(最大似然法)。
[0034]
图5为游动放线菌actinoplanes polyasparticus trm66264-dlm
t
与其相似菌株16sr rna基因构建的系统进化发育树(最大简约法)。
[0035]
图6为菌株聚天冬氨酸游动放线菌actinoplanes polyasparticus trm66264-dlm
t
与其相似菌株全基因组系统进化发育树。
具体实施方式
[0036]
以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
[0037]
若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
[0038]
实施例1 9株游动放线菌的靶向分离与鉴定
[0039]
1、pasp土壤原位富集。
[0040]
土样采集于新疆地区塔里木河河底淤泥、塔里木河河岸土、柽柳林林下土、大豆根际土、塔里木大学梨园土。将采集的五种土样自然风干,等质量混合,研磨过筛。按质量比保水剂:水:混合土样=1:200-300:600-900,按最优比为保水剂:水:混合土样=1:240:720混合拌匀,装入500ml矿泉水塑料瓶中,扎孔透气,28℃恒温培养4周。
[0041]
2、花粉和牛角粉离心法诱捕。
[0042]
取原位培养4周的土样,自然风干,110℃干热处理30min。称取1g干热土样于10ml离心管中,加入9ml生理盐水及0.05-0.1g花粉或牛角粉,置于28℃摇床,200rpm恒温振荡0.5-2h,5000rpm离心20min,取含有花粉或牛角粉的上清于另一10ml离心管中,用生理盐水依次稀释至10-2
、10-3
、10-4
,分别取100μl涂板。
[0043]
3、设计特定的选择性培养基分离培养,挑取橘黄色、有褶皱、具土腥味的单菌落。
[0044]
选用的培养基具体配方如下:(ⅰ)稀释10倍的加药的isp 2培养基:葡萄糖0.4g/l,酵母提取物0.4g/l,麦芽浸粉1g/l,琼脂16g/l,微量元素液1ml/l,制霉菌素100mg/l,奈啶酮酸25mg/l,新生霉素20mg/l;(ⅱ)加药的hv培养基:腐殖酸1.0g/l,磷酸氢二钠0.5g/l,氯化钾1.71g/l,七水硫酸镁0.05g/l,七水硫酸亚铁0.05g/l,碳酸钙0.02g/l,琼脂16.0g/l,微量元素液1ml/l,制霉菌素100mg/l,奈啶酮酸25mg/l,新生霉素20mg/l;(ⅲ)加药的高氏i号培养基:可溶性淀粉20g/l,硝酸钾1g/l,磷酸氢二钾0.5g/l,七水硫酸镁0.5g/l,琼脂15g/l,微量元素液1ml/l,制霉菌素100mg/l,奈啶酮酸25mg/l,新生霉素20mg/l。平板或96孔板培养2周后挑取橘黄色、有褶皱、具土腥味的单菌落,于isp 2培养基上获得纯培养。
[0045]
4、9株游动放线菌的分子生物学鉴定。
[0046]
4.1、9株游动放线菌基因组dna的提取。
[0047]
收集培养平板上的橘黄色、有褶皱、具土腥味的单菌落菌体分别放入1.5ml的无菌离心管中,加入480μl的1
×
te缓冲液。加入20μl溶菌酶(50mg
·
m l-1
),放入37℃水浴过夜。每管加入50μl 20%的sds,加入5μl 20mg
·
m l-1
的蛋白酶k,60℃水浴2h。加入550μl的酚:氯仿:异戊醇(25:24:1),12000rpm离心5min,取上清移入另一离心管,反复抽提2次。取上清,加入300μl的95%异丙醇,70μl的乙酸钠(3mol
·
l-1
),12000rpm离心10min,弃上清。用500μl的70%乙醇清洗离心产物1次,12000rpm离心5min,弃上清,将乙醇挥发完全。用30μl无菌超纯水充分溶解底部的dna,1%的琼脂糖凝胶电泳检测dna提取质量,将提取的dna放
入-20℃冰箱中保存备用。
[0048]
4.2、9株游动放线菌16s rrna基因的扩增。
[0049]
用放线菌16s rrna基因通用引物27f(5
’‑
agagtttgatcctggctc-3’,seq id no:1)和1492r(5
’‑
cggctaccttgttacgactt-3’,seq id no:2)扩增放线菌基因组dna中的16sr rna基因片段。50μl的pcr反应体系为:dd h2o 34μl,10
×
buffer(缓冲液含mg
2+
)5μl,dntps 2.5μl,引物27f(10μmol
·
l-1
)2μl,引物1492r(10μmol
·
l-1
)2μl,50%dmso 2μl,taq dna聚合酶0.5μl,模板dna 2μl。
[0050]
pcr反应条件为:预变性94℃4min;变性94℃1min,退火56℃1min,延伸72℃2min,30次循环;总延伸72℃8min。反应完成后用1%琼脂糖凝胶电泳检测。符合条件的pcr产物进行序列测定。
[0051]
4.3、测序结果的比对分析。
[0052]
测序结果用seqman软件拼接,序列通过ezbiocloud数据库中的已有效发表的菌株序列进行比对,下载相似度较高的已有效发表菌株的16s rrna基因序列,用mega 5.0软件对序列进行系统发育树的构建,确定放线菌的分类学地位,结果见图3-6。全基因组拼接结果用ncbi中genbank数据库进行比对,进一步确定菌株的分类学地位,结果见图6。测序结果用seqman软件拼接,9种已知游动放线菌鉴定结果为actinoplanes abujensis a4029
t
(98.04%),其16s rrna序列如seq id no:3所示,actinoplanes nipponensis fh2241
t
(98.64%),其16s rrna序列如seq id no:4所示,actinoplanes nipponensis fh2241
t
(98.64%),其16s rrna序列如seq id no:5所示,actinoplanes hulinensis neau-m9
t
(99.08%),其16s rrna序列如seq id no:6所示,actinoplanes ferrugineus ifo 15555
t
(96.89%),其16s rrna序列如seq id no:7所示,actinoplanes rectilineatus nrrl b-16090
t
(98.66%),其16s rdna序列如seq id no:8所示,actinoplanes toevensis mn07-a0368 t
(97.38%),其16s rrna序列如seq id no:9所示,actinoplanes tereljensis mn07-a0371
t
(97.68%),其16s rdna序列如seq id no:10所示,actinoplanes brasiliensis dsm 43805
t
(99.78%),其16s rrna序列如seq id no:11所示,。通过该方法获得的游动放线菌中,有56%的来源于1/10稀释10倍的加药的isp 2培养基,37%来源于加药的hv培养基,9%来源于加药的高氏一号培养基。
[0053]
实施例2拮抗g+和g-菌的游动放线菌actinoplanes polyasparticus trm66264-dlm
t
的靶向分离与鉴定。
[0054]
1、游动放线菌actinoplanes polyasparticus trm66264-dlm
t
的靶向分离。
[0055]
1.1、聚天冬氨酸保水剂(pasp)土壤原位富集。采集棉花地的土样自然风干,研钵研磨成细土,过200目筛,混合拌匀。通过pasp保水剂混土原位富集,按照质量比为保水剂:水:土=1:240:720的比例混合拌匀,装于有孔的塑料瓶中,28℃恒温培养4周。(2)花粉和牛角粉离心法诱捕。原位富集的土样自然风干,110℃干热处理30min。按1g土样:9ml水:0.05g花粉加入10ml离心管,28℃振荡孵化2小时,5000rpm/min离心20min,取有花粉和牛角粉的部分稀释涂板于加药的高氏i号培养基:可溶性淀粉20g/l,硝酸钾1g/l,磷酸氢二钾0.5g/l,七硫酸镁水0.5g/l,琼脂15g/l,微量元素液1ml/l,制霉菌素100mg/l,奈啶酮酸25mg/l,新生霉素20mg/l。平板培养2周后挑取橘黄色、有褶皱、具土腥味的单菌落。
[0056]
2、游动放线菌actinoplanes polyasparticus trm66264-dlm
t
的形态观察。
[0057]
2.1形态观察用培养基(含pasp保水剂的高氏i号培养基):可溶性淀粉20g/l,硝酸钾1g/l,磷酸氢二钾0.5g/l,七水硫酸镁0.5g/l,液体保水剂30μl/l,调节ph为7.0-7.2,28℃培养21天。
[0058]
2.2扫描电子显微镜观察:平板划线法,28℃培养聚天冬氨酸游动放线菌actinoplanes polyasparticus trm66264-dlm
t
。用扫描电子显微镜观察记录菌丝形态、菌丝生长情况,菌丝体是否产生孢子丝及孢子丝的排列方式、形状;孢子形状和大小;孢子的有无、形状、大小及形成方式等。
[0059]
3、聚天冬氨酸游动放线菌actinoplanes polyasparticus trm66264-dlm
t
的测序结果的比对分析。测序结果用seqman软件拼接,序列通过ezbiocloud数据库中的已有效发表的菌株序列进行比对,下载相似度较高的已有效发表菌株的16s r rna基因序列,用mega 5.0软件对序列进行系统发育树的构建,确定放线菌的分类学地位。全基因组拼接结果用ncbi中genbank数据库进行比对,进一步确定菌株的分类学地位。
[0060]
4、实验结果
[0061]
4.1聚天冬氨酸游动放线菌actinoplanes polyasparticus trm66264-dlm
t
的形态学观察结果。聚天冬氨酸游动放线菌actinoplanes polyasparticus trm66264-dlm
t
在添加了保水剂的高氏i号培养基上生长良好,菌落表面圆形凸起,表面干燥,无气生菌丝,孢子囊堆起呈褶皱,基内菌丝黄色,有黄色色素产生。
[0062]
4.2聚天冬氨酸游动放线菌actinoplanes polyasparticus trm66264-dlm
t
的扫描电镜观察结果。聚天冬氨酸游动放线菌actinoplanes polyasparticus trm66264-dlm
t
革兰染色为阳性,在高氏i号培养基上28℃平板培养21d,通过扫描显微镜观察发现:聚天冬氨酸游动放线菌actinoplanes polyasparticus trm66264-dlm
t
的孢囊呈球状,见图2。根据聚天冬氨酸游动放线菌actinoplanes polyasparticus trm66264-dlm
t
菌落、菌体形态和生理特征测定,确定聚天冬氨酸游动放线菌actinoplanes polyasparticus trm66264-dlm
t
属于游动放线菌属(actinoplanes)。
[0063]
4.3聚天冬氨酸游动放线菌actinoplanes polyasparticus trm66264-dlm
t
基因序列测定结果。测序结果用seqman软件拼接,聚天冬氨酸游动放线菌actinoplanes polyasparticus trm66264-dlm
t
的16s rrna基因片段由1545个碱基组成,其基因序列如seq id no:12所示。
[0064]
4.4同源进化树构建。通过在ezbiocloud数据库中进行比对,与待测放线菌16s r rna基因序列相似度较近的序列,用mega软件对放线菌16s r rna基因序列进行多重序列比对,构建系统发育树。聚天冬氨酸游动放线菌actinoplanes polyasparticus trm66264-dlm
t
进化树见图3~5,聚天冬氨酸游动放线菌actinoplanes polyasparticus trm66264-dlm
t
的16s rrna基因序列聚与actinoplanes bogoriensis lipi11-2-ac043
t
在同一个系统进化分支上,且相似度较高(相似度:98.40%),根据菌株分离来源将该游动放线菌命名为聚天冬氨酸游动放线菌actinoplanes polyasparticus trm66264-dlm
t
。
[0065]
4.5聚天冬氨酸游动放线菌actinoplanes polyasparticus trm66264-dlm
t
新种多相分类实验结果发现,主要的甲醌类化合物为mk-8(h4)、mk-9(h2)和mk-6(h2),主要细胞脂肪酸(》5%)为iso-c
16:0
、anteiso-c
15:0
、iso-c
15:0
、c
17:1
ω8c、anteiso-c
17:0
和c
17:0
,主要极性脂质为磷脂酰肌醇二甘露糖苷、磷脂酰肌醇甘露糖苷、磷脂酰肌糖、磷脂酰甘油、磷脂酰
乙醇胺和双磷脂酰甘油。细胞水解糖为木糖、阿拉伯糖、葡萄糖和半乳糖。细胞壁氨基酸为meso-2,6-二氨基丙烯酸。
[0066]
菌株聚天冬氨酸游动放线菌actinoplanes polyasparticus trm66264-dlm
t
的g+c含量为70.48mol%。将聚天冬氨酸游动放线菌actinoplanes polyasparticus trm66264-dlm
t
与最近的放线菌actinoplanes bogorensis lipi11-2-ac043
t
进行比较,dddh值为27.00%,ani值为83.39%。dna-dna杂交和系统发育分析的结果,以及表型和生理生化数据,可以将菌株actinoplanes polyasparticus trm66264-dlm
t
鉴定为一个新物种,命名为actinoplanes polyasparticus trm66264-dlm
t
(=cctcc m 2021381)。
[0067]
实施例3 actinoplanes polyasparticus trm66264-dlm
t
的次级代谢产物挖掘。
[0068]
1、游动放线菌actinoplanes polyasparticus trm66264-dlm
t
的平板培养。培养基为tsa培养基:胰蛋白胨15g,大豆蛋白胨5g,氯化钠5g,琼脂17g,水1l,ph=9。28℃培养9d。
[0069]
2、游动放线菌actinoplanes polyasparticus trm66264-dlm
t
的种子液培养。培养基为燕麦-尿素:燕麦20g,硝酸钾1g,磷酸氢二钾0.5g,七水硫酸镁0.5g,微量元素液1ml,水1l。微量元素液:七水硫酸亚铁1g,七水硫酸锌1g,四水氯化锰1g,蒸馏水1l。种子液150ml分装于500ml锥形瓶,150rpm,28℃培养7d。
[0070]
3、游动放线菌actinoplanes polyasparticus trm66264-dlm
t
的发酵液培养。发酵培养基04配方:淀粉20g,糊精10g,葡萄糖5g,黄豆粉25g,棉籽饼粉12g,蛋白胨5g,缬氨酸0.6g,三水磷酸氢二钾0.2g,七水硫酸镁0.4g,硫酸铵0.2g,碳酸钙3g,水1l。发酵液150ml分装于500ml锥形瓶,150rpm,28℃培养10d。
[0071]
4、游动放线菌actinoplanes polyasparticus trm66264-dlm
t
的发酵产物提取。将发酵液四层纱布过滤,菌液过大孔树脂,菌体加甲醇超声提取30min,收集甲醇滤液,合并,旋干,即得发酵浸膏。
[0072]
5、对发酵浸膏进行活性研究,选取金黄色葡萄球菌(staphyloccocus aureus atcc25923)、大肠杆菌(escherichia coli atcc 25922)、肺炎克雷伯菌(klebsiella pneumonia atcc 10031)、欧文氏菌(erwinia amylovora)、铜绿假单胞菌(pseudomonas aeruginosa atcc 27853)、志贺氏菌(shigella castellani)、沙门氏菌(salmonella atcc 64550)作靶标菌,取浸膏用甲醇溶解,10μl加于滤纸片上,挥干,置于混有靶标菌的琼脂平面,24h后观察。
[0073]
6、实验结果如表2,结果显示actinoplanes polyasparticus trm66264-dlm
t
发酵浸膏对大肠杆菌(escherichia coli atcc 25922)、金黄色葡萄球菌(staphyloccocus aureus atcc 25923)、肺炎克雷伯菌(klebsiella pneumonia atcc 10031)、志贺氏菌(shigella castellani)具有活性,而对欧文氏菌(erwinia amylovora)、铜绿假单胞菌(pseudomonas aeruginosa atcc 27853)、沙门氏菌(salmonella atcc 64550)无活性。可见trm66264-dlm
t
发酵产物中具有拮抗活性的化合物。
[0074]
表2:trm66264-dlm
t
菌株的抑菌活性结果
[0075][0076][0077]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1