拟南芥AtSR33基因在抑制芜菁花叶病毒侵染中的应用
拟南芥atsr33基因在抑制芜菁花叶病毒侵染中的应用
技术领域
1.本发明涉及基因工程技术领域,特别是涉及一种拟南芥atsr33基因在抑制芜菁花叶病毒侵染中的应用及其侵染性克隆载体。
背景技术:
2.芜菁花叶病毒(tumv),属于马铃薯y病毒科、马铃薯y病毒属病毒,是农业生产中最重要的植物病毒之一。目前已知tumv能够侵染至少43科156属318种植物,在世界各地均有危害。tumv在我国大部分蔬菜种植地区均有分布。在蔬菜作物上,tumv能够危害葫芦科、茄科、豆科蔬菜,最主要危害十字花科蔬菜,包括油菜、甘蓝、白菜等,已成为危害我国十字花科蔬菜的重要病原,近年来在我国还发现了tumv的其他新寄主。tumv严重危害蔬菜的生长,造成植物矮化、黄萎、花叶等,在白菜上可以造成严重的产量损失甚至是绝产。除此之外tumv还能够通过蚜虫和汁叶摩擦接种的方式传播,在加上tumv在田间还存在不同变异的株系,给防治带来极大的困难。
3.目前,还没有能够有效抑制植物病毒的农药,植物病毒的防控最重要的还是抗病品种的选育,在植物中已经筛选出了一些的抗病毒基因,但大多数基因存在抗性不足的缺点,所以寻找抗病毒效果明显的基因在抗病育种中尤为重要。
技术实现要素:
4.本发明的目的在于提供拟南芥atsr33基因在抑制芜菁花叶病毒侵染中的应用。
5.为实现上述目的,本发明采用的技术方案具体如下:
6.发明人研究团队通过大量前期实验,发现tumv侵染可以诱导植物一类丝氨酸/精氨酸丰富的剪接因子(serine/arginine
‑
rich proteins,即sr蛋白)的高表达,在拟南芥中该类剪接因子有18个,选取了植物所特有的一类——atsr33,将其克隆出来构建了植物过表达载体,并进一步通过遗传转化方式转入到拟南芥中获得稳定遗传的过表达材料,获得的过表达材料接种tumv后对植物病毒症状、病毒核酸、蛋白积累量进行的分析,与野生型col
‑
0相比,发现atsr33的过表达能够显著抑制tumv的侵染。
7.拟南芥atsr33基因可以用于抑制芜菁花叶病毒侵染。另外,拟南芥atsr33基因在其他物种的同源基因也可以抑制芜菁花叶病毒侵染。
8.该基因将来可以应用到其他植物上,预期能够获得显著有效抗tumv的优良品种。
9.一种侵染性克隆载体,所述载体为过表达载体pearleygate 102
‑
atsr33
‑
cfp
‑
ha,载体中的atsr33序列如seq id no:1所示。
10.其中,atsr33的c端融合cfp青色荧光蛋白标签。
11.本发明的侵染性克隆载体的构建方法:通过gateway体系,pcr扩增拟南芥atsr33基因,通过bp反应连入pdonr221载体,然后通过lr反应连入pearleygate 102载体,从而获得含有atsr33的过表达载体pearleygate 102
‑
atsr33
‑
cfp
‑
ha。
12.具体包括以下步骤:
13.(1)pcr扩增拟南芥atsr33基因
14.①
提取拟南芥野v生型的总rna,并反转录为cdna并以该cdna为模板,用fastpfu dna polymerase聚合酶,以gw
‑
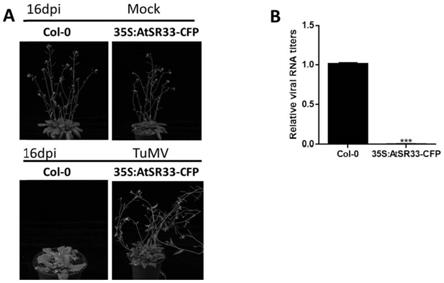
atsr33
‑
f、gw
‑
atsr33
‑
r为引物,如seq id no:3
‑
4所示,扩增带有gateway同源臂的atsr33基因序列;
15.②
将扩增的pcr产物经过电泳,割胶纯化回收;
16.(2)构建带有荧光标签的yfp
‑
atsr33
17.①
将纯化回收的产物用bp酶连接到pdonr221载体;
18.回收产物4μlpdonr 2210.5μlbp酶mix0.5μl总共5μl
19.在pcr管中混合上述反应体系,在pcr管中25℃孵育2h,然后将产物转化大肠杆菌,涂布于卡那霉素抗性的平板上培养,挑选单菌落进行pcr验证,引物为m13f和gw
‑
atsr33
‑
r;m13f序列如seq id no:5所示;
[0020]2×
taq mix10μlm13f,10μm0.5μlgw
‑
atsr33
‑
r,10μm0.5μlddh2o9μl
[0021]
用10μl灭菌枪头蘸取一点单菌落到上述体系中,移液器吸打混匀;
[0022]
将筛选的阳性克隆摇菌,提取质粒,经过测序验证后,获得构建成功的载体,命名为pdonr221
‑
atsr33;
[0023]
②
将pdonr221
‑
atsr33质粒用mlui酶切;
[0024]
③
将酶切产物跑胶,割取3000左右的条带,用胶回收试剂盒回收dna片段;
[0025]
④
将纯化回收的产物用lr酶(invitrogen)连接到pearleygate 102载体,该载体携带cfp标签;
[0026]
回收产物4μlpearleygate 1020.5μllr酶mix0.5μl总共5μl
[0027]
在pcr管中混合上述反应体系,在pcr中25℃孵育2h,然后将产物转化大肠杆菌,涂布于卡那霉素抗性的平板上培养,挑选单菌落进行pcr验证,引物为35s
‑
f和gw
‑
atsr33
‑
r,鉴定操作和步骤
③
相同。阳性克隆提取质粒后,经过跑胶验证大小正确。即为最终获得的pearleygate 102
‑
atsr33
‑
cfp
‑
ha载体,简称atsr33
‑
cfp载体。
[0028]
本发明上述的侵染性克隆载体可以用于抑制芜菁花叶病毒侵染,也可以用于抑制受atsr33调控的植物病毒侵染。
[0029]
同现有技术相比,本发明的突出效果在于:
[0030]
拟南芥atsr33基因及atsr33
‑
cfp侵染性克隆载体可以运用到农业作物抗病育种,提高作物的抗病性。本发明通过遗传转化的方式,将携带拟南芥atsr33
‑
cfp侵染性克隆载
体通过花序侵染转化法转入拟南芥,获得了稳定表达atsr33
‑
cfp的t2代拟南芥植物。获得的拟南芥达atsr33
‑
cfp过表达植物能够显著阻碍芜菁花叶病毒的侵染。
[0031]
下面结合附图说明和具体实施例对本发明所述的拟南芥atsr33基因在抑制芜菁花叶病毒侵染中的应用及其侵染性克隆载体作进一步说明。
附图说明
[0032]
图1为earleygate 102
‑
atsr33
‑
cfp
‑
ha载体构建示意图。从左到右依次是草甘膦筛选基因、甘露碱合成酶基因的启动子、花椰菜花叶病毒camv的35s启动子、atsr33基因、融合cfp蛋白基因。
[0033]
图2为atsr33
‑
cfp过表达拟南芥植株的确证。
[0034]
(a)野生型(col
‑
0)、atsr33
‑
cfp过表达拟南芥的表型,播种后14天拍摄。
[0035]
(b)atsr33
‑
cfp转基因植物的定位,共聚焦观察转基因拟南芥叶片确定atsr33
‑
cfp能够正常表达。
[0036]
(c)atsr33在转基因株系中的表达水平,提取野生型col、atsr33
‑
cfp过表达材料的rna,反转录cdna,rt
‑
qpcr检测atsr33的表达水平。**代表显著性水平p<0.01。
[0037]
图3中,(a)芜菁花叶病毒(tumv)接种拟南芥野生型col
‑
0,atsr33
‑
cfp过表达16天后(16dpi)的症状图,接种缓冲液(buffer)作为对照。
[0038]
(b)用qrt
‑
pcr定量检测tumv系统侵染拟南芥16天后的病毒rna的积累水平。从tumv系统感染叶片中提取rna,分析病毒rna的积累水平,atactin ii作为内参。星号表示显著差异(**p<0.01)。
[0039]
图4为瞬时过表达nbsr33抑制tumv侵染。
[0040]
其中,(a)western blot分析植物接种tumv+myc
‑
gus或tumv+myc
‑
nbsr33在接种叶片接种60小时后(60hpi)衣壳蛋白(cp)的积累量,使用myc抗体(α
‑
myc)确认目标蛋白表达,使用cp抗体(α
‑
cp)确认过表达的nbsr33能够显著抑制tumv cp的积累水平。丽春红染色的rubisco大亚基代表上样量(rbcl)。
[0041]
(b)用qrt
‑
pcr定量检测植物接种tumv+myc
‑
gus或tumv+myc
‑
nbsr33在接种7天后(7dpi)系统侵染的叶片上的病毒rna的积累水平。从图c系统感染叶片中提取rna,分析病毒rna的积累水平,atactin ii作为内参。星号表示显著差异(**p<0.01)。
[0042]
(c)瞬时过表达植物接种tumv+myc
‑
gus或tumv+myc
‑
nbsr33 7天后的症状。
[0043]
(d)western blot分析图c中tumv衣壳蛋白(cp)的积累量,使用cp抗体(α
‑
gfp)确认过表达的nbsr33能够显著抑制tumv cp在系统叶片上的积累水平。丽春红染色的rubisco大亚基代表上样量(rbcl)。
具体实施方式
[0044]
下列实验步骤是例示性的,旨在对atsr33
‑
cfp过表达载体的构建以及拟南芥过表达材料抑制tumv侵染的应用提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
[0045]
在对sr亚家族蛋白的功能进行深入分析,通过pcr方法克隆了col
‑
0拟南芥atsr33基因;基因的核酸序列如seq id no:1所示,氨基酸序列如seq id no:2所示。
[0046]
(1)克隆拟南芥中atsr33基因
[0047]
①
提取拟南芥col
‑
0野生型的总rna,并反转录为cdna并以该cdna为模板,用全式金公司的fastpfu dna polymerase(全式金)聚合酶,以gw
‑
atsr33
‑
f、gw
‑
atsr33
‑
r为引物,如seq id no:3
‑
4所示,扩增带有gateway同源臂的atsr33基因序列。
[0048]
体系如下:
[0049][0050]
pcr反应程序设定:
[0051][0052]
程序完成后取pcr产物3μl,电泳检测。
[0053]
②
将扩增的pcr产物经过电泳,割胶纯化回收,用omega公司的胶回收试剂盒。具体步骤参见试剂盒说明书,在此不一一赘述。
[0054]
(2)构建带有荧光标签的yfp
‑
atsr33
[0055]
①
将纯化回收的产物用bp酶(invitrogen)连接到pdonr221载体。
[0056]
回收产物4μlpdonr 2210.5μlbp酶mix0.5μl总共5μl
[0057]
在pcr管中混合上述反应体系,在pcr中25℃孵育2h,然后将产物转化大肠杆菌,涂布于卡那霉素抗性的平板上培养,挑选单菌落进行pcr验证,引物为m13f和gw
‑
atsr33
‑
r;m13f序列如seq id no:5所示;
[0058]2×
taq mix10μlm13f(10μm)0.5μlgw
‑
atsr33
‑
r(10μm)0.5μl
ddh2o9μl
[0059]
用10μl灭菌枪头蘸取一点单菌落到上述体系中,移液器吸打混匀;
[0060]
pcr程序如下
[0061][0062]
将筛选的阳性克隆摇菌,提取质粒,经过测序验证后,获得构建成功的载体,命名为pdonr221
‑
atsr33。
[0063]
②
将pdonr221
‑
atsr33质粒用mlui酶切。
[0064][0065]
将体系混匀后,放入37℃温育10
‑
20min。
[0066]
③
将酶切产物跑胶,割取3000左右的条带,用胶回收试剂盒回收dna片段。
[0067]
④
将纯化回收的产物用lr酶(invitrogen)连接到pearleygate 102载体,该载体携带了cfp标签。
[0068]
回收产物4μlpearleygate 1020.5μllr酶mix0.5μl总共5μl
[0069]
在pcr管中混合上述反应体系,在pcr中25℃孵育2h,然后将产物转化大肠杆菌,涂布于卡那霉素抗性的平板上培养,挑选单菌落进行pcr验证,引物为35s
‑
f和gw
‑
atsr33
‑
r,鉴定操作和步骤
③
相同。阳性克隆提取质粒后,经过跑胶验证大小正确。即为最终获得的pearleygate 102
‑
atsr33
‑
cfp
‑
ha载体(简称atsr33
‑
cfp载体),如图1所示。
[0070]
(3)将atsr33
‑
cfp载体转入农杆菌
[0071]
将atsr33
‑
cfp载体转化eha105农杆菌,取农杆菌eha105菌株50μl,质粒2μl,冻融法转化;卡那霉素+利福平抗平板筛选,挑选单菌落pcr鉴定阳性克隆,鉴定引物为m13f和gw
‑
atsr33
‑
r,将阳性农杆菌单菌落用卡那霉素+利福平lb液体培养基培养16
‑
18小时;
‑
80
℃保存菌株。
[0072]
(4)将带有atsr33
‑
cfp的农杆菌侵染拟南芥
[0073]
①
取atsr33
‑
cfp的农杆菌于3ml含有卡那霉素+利福平的lb液体培养基中,28℃,220rpm过夜培养。
[0074]
②
取1ml培养菌液,转接到新的100ml含有卡那霉素+利福平lb液体培养基中,28℃,220rpm培养12小时。
[0075]
③
将菌液分装到50ml离心管,3000g,4℃离心5分钟收集菌体。用1/2ms洗涤菌体,3000g 4℃离心5分钟收集菌体。用转基因缓冲液(5%蔗糖,10mm mgcl2,3
×
10
‑4silvet77)重悬菌体,调节菌悬液od600至0.8。
[0076]
④
挑选生长3
‑
4周的拟南芥,此时开花数较少,减掉已经开放的花,将剩下所有花序浸没在
③
中配好的菌液中30秒,然后将拟南芥转至黑暗中保湿培养24小时。再用吸水纸吸去表面多余的菌液,转移到正常光照条件下培养。5天后重复再侵染一次,等到植物成熟结种子,收取种子进行后续筛选。
[0077]
(5)筛选、获得转基因atsr33
‑
cfp的植物
[0078]
①
将种子消毒后,涂播于含有basta除草剂的1/2ms平板上进行阳性苗筛选。成功转入目的基因的幼苗能够正常生产,而未转入的幼苗则不能正常生长而,将长出健壮的、生长良好的拟南芥幼苗移栽至花盆中培养。光照条件16小时光照/8小时黑暗。温度条件22℃。
[0079]
②
当拟南芥开始结角果后,对每株t1代转基因植株分别编号,后续单株收取种子从而得到t2代转基因种子。
[0080]
③
对上述获得的种子分别选取100粒左右种子消毒后涂铺于1/2ms+basta平板上生长,依据孟德尔遗传定律统计性状分离比:幼苗生长全部正常的为纯合子株系,后续就选取这样的株系进行实验。
[0081]
④
对所获得的成功转入的atsr33
‑
cfp的株系进行鉴定,通过rt
‑
qpcr和confocal实验进行验证,如图2所示。
[0082]
(6)测试atsr33
‑
cfp转基因的植物对芜菁花叶病毒的抗性
[0083]
①
种植拟南芥col、atsr33
‑
cfp株系,待其生长到5
‑
6期状态时用于接种病毒。
[0084]
②
取活化好的tumv病毒侵染性克隆农杆菌在lb液体培养中培养,获得的培养物用植物浸润缓冲液重悬,调整od为1.2,室温静置2h后,用去掉针头的注射器将农杆菌接种到拟南芥。
[0085]
③
接种14天后,观察病毒症状和分析病毒积累量,通过rt
‑
qpcr检测tumv的rna水平,如图3所示。图中明显看出atsr33
‑
cfp过表达能够显著抑制tumv的症状。
[0086]
(7)测试atsr33在烟草中的同源基因nbsr33对芜菁花叶病毒的抗性
[0087]
①
种植本氏烟植物,待其生长到5
‑
6期状态时用于接种病毒,取活化好的tumv病毒侵染性克隆农杆菌、含有myc
‑
gus与含myc
‑
nbs33的农杆菌,在lb液体培养基中培养,获得的培养物用植物浸润缓冲液重悬,调整od为1.2,室温静置2h后,将含有myc
‑
gus与含myc
‑
nbs33的菌液与含有tumv病毒侵染性克隆的菌液以1:1的比例混合后,浸润野生型本氏烟叶片背面;
[0088]
②
浸润后的烟草植株放于温室培养,培养条件为:温度为25℃,相对湿度为60%,光照周期为16h光照/8h黑暗。接种60小时后(60hpi),取以上浸润的叶片,用尿素的方法提
取总蛋白,进行sds
‑
page凝胶电泳,再使用cp与myc抗体进行western blot分析,明确myc
‑
gus与含myc
‑
nbs33在浸润叶片中的表达以及myc
‑
nbs33对病毒蛋白积累量的抑制(图4a);
[0089]
③
接种7天后(7dpi),观察病毒症状,通过rt
‑
qpcr和western blot分析病毒积累量,图4b
‑
图4d中明显看出myc
‑
nbs33过表达能够显著抑制tumv的症状,降低病毒rna和蛋白的积累水平。以上说明atsr33在烟草中的同源基因nbsr33对芜菁花叶病毒具有较强的的抗性。
[0090]
通过上述实验结果可以看出,本发明构建的植物过表达载体atsr33
‑
cfp,通过遗传转化方式转入到拟南芥中获得稳定遗传的过表达材料,获得的过表达材料接种tumv后对植物病毒症状、病毒核酸、蛋白积累量进行的分析,与野生型col
‑
0相比,发现atsr33的过表达能够显著抑制tumv的侵染。
[0091]
此外,瞬时过表达烟草中的nbsr33能够传递对芜菁花叶病毒的抗性,表明不仅atsr33,它的同源基因也能用于抑制tumv的侵染。
[0092]
以上所述的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案作出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1