一种提高植酸酶热稳定性的方法及融合植酸酶
一种提高植酸酶热稳定性的方法及融合植酸酶
1.技术领域
2.本发明涉及农业生物技术领域,具体涉及一种提高植酸酶热稳定性的方法及融合植酸酶。
背景技术:
3.植酸酶(phytase),即肌醇六磷酸磷酸水解酶(myo
‑
inositol hexakisphosphate phosphohydrolases)是一类能够催化植酸盐水解为肌醇、肌醇磷酸酯和无机磷酸盐的磷酸酶。用植酸酶对动物饲料进行预处理,可以提高无机磷的利用率,去除植酸的抗营养作用,从而改善食品/饲料的营养质量,减少磷污染。具有高热稳定性的植酸酶有着巨大的市场需求和商业价值。
4.spytag是一个多肽段,spycatcher是与之相对应的一个蛋白质,它们之间能够重组,并自发形成异肽键偶联,这就将蛋白质组装和化学反应结合在一起,产生稳定的分子自组装体。
技术实现要素:
5.本发明的目的是提供一种热稳定性提高的融合植酸酶。
6.本发明的再一目的是提供一种提高植酸酶的热稳定的方法。
7.本发明的再一目的是提供上述融合植酸酶的编码基因。
8.本发明的再一目的是提供包含上述融合植酸酶编码基因的重组载体。
9.本发明的再一目的是提供包含上述融合植酸酶编码基因的重组菌株。
10.本发明的再一目的是提供制备热稳定性提高的植酸酶的方法。
11.根据本发明的具体实施方式,对来源于yersinia intermedia的氨基酸序列如seq id no:1所示的野生型植酸酶y4与肽标签spytag/spycatcher进行融合表达,从而获得所述植酸酶融合蛋白。
12.根据本发明的具体实施方式,将氨基酸序列如seq id no:1所示的野生型植酸酶通过linker(gsggsg)与肽标签spytag/spycatcher进行融合表达,从而获得所述融合植酸酶。
13.根据本发明的具体实施方式,热稳定性提高的融合植酸酶具有如seq id no:2所示的氨基酸序列,由560个氨基酸组成。
14.根据本发明的具体实施方式,还提供了编码上述热稳定性提高的融合植酸酶的基因,核苷酸序列如seq id no:3所示,共为1683 bp(包含终止密码子)。
15.根据本发明的具体实施方式,还提供了包含上述融合植酸酶编码基因的重组载体,所述重组表达载体的出发载体具体为ppiczαa,所述重组表达载体具体为ppiczαa
‑
y4
‑
spy。
16.根据本发明的具体实施方式,还提供了包含上述融合植酸酶编码基因的重组菌株,所述重组菌的出发菌株具体为毕赤酵母gs115(ppiczαa
‑
y4),所述重组菌株具体为gs115(ppiczαa
‑
y4
‑
spy)。
17.根据本发明的具体实施方式,制备热稳定性提高的植酸酶的方法,包括以下步骤:1)制备包含上述融合蛋白编码基因的重组载体;2)以所述重组载体转化宿主,获得重组菌株;3)发酵培养所述宿主,诱导表达并分离纯化植酸酶。
18.本发明的融合植酸酶与野生型植酸酶相比,融合植酸酶热稳定性增强,100℃处理5min仍保留42%左右的活性,而野生酶活性已基本消失。
19.本发明主要是通过将野生型植酸酶y4与肽标签spytag/spycatcher进行融合表达,从而获得所述环化融合蛋白y4
‑
spy,实现提高植酸酶热稳定性的目的。引入肽标签spytag/spycatcher后显著提高了植酸酶y4的热稳定性。本发明提供了一种热稳定性提高的适合于在能源、食品和饲料等领域中应用的融合植酸酶,有着非常广阔的应用前景。
附图说明
20.图1显示野生型与融合植酸酶的比活;图2显示野生型与融合植酸酶的最适温度;图3显示野生型与融合植酸酶在100℃下处理的热稳定性;图4显示木聚糖酶与融合木聚糖酶在60℃下处理10 min后的剩余酶活。
具体实施方式
21.试验材料和试剂1、菌株及载体:表达宿主为pichia pastoris gs115,表达质粒载体为ppiczαa。
22.2、酶类及其它生化试剂:限制性内切酶购自takara公司和new england biolabs (neb) 公司,t4 dna连接酶购自赛默飞世尔科技(中国)有限公司。其它都为国产试剂(均可从普通生化试剂公司购买得到)。
23.3、大肠杆菌培养基lb(1%蛋白胨、0.5%酵母提取物、1% nacl,ph自然)。毕赤酵母培养基ypd(1%酵母提取物,2%蛋白胨,2%葡萄糖,ph自然);bmgy (1%酵母提取物,2%蛋白胨,1%甘油,1.34% ynb,0.00004%生物素,ph自然);bmmy(1%酵母提取物,2%蛋白胨,0.5%甲醇,1.34% ynb,0.00004%生物素,ph自然)。
24.说明:以下实施例中未作具体说明的分子生物学实验方法,均参照《分子克隆实验指南》(第三版)j.萨姆布鲁克一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行。
25.实施例1、重组菌株gs115(ppiczαa
‑
y4
‑
spy)的制备首先通过ncbi网站获得肽标签spytag/spycatcher的氨基酸序列,之后由北京六合华大基因科技有限公司进行基因合成。对合成的基因spy和质粒ppiczαa使用限制性内切酶eco ri和not i进行双酶切,通过t4 dna连接酶将两者连接,获得重组质粒ppiczαa
‑
spy。
26.之后采用pcr的方式扩增植酸酶基因y4和ppiczαa
‑
spy,pcr所用引物如表1所示。
27.表1
其中,y4
‑
f及y4
‑
r用于扩增植酸酶野生型y4的基因编码序列;y4
‑
spycat
‑
f和spytag
‑
y4
‑
r用于扩增质粒ppiczαa
‑
spy。
28.扩增结束后,将pcr产物进行琼脂糖凝胶电泳检测,y4与ppiczαa
‑
spy条带的理论大小分别为1254 bp、4020 bp,对大小正确的条带进行回收。
29.回收产物y4与ppiczαa
‑
spy使用clonexpress ultra one step cloning kit(南京诺唯赞生物科技股份有限公司)进行重组以获得重组质粒ppiczαa
‑
y4
‑
spy,具体操作按说明书进行,重组产物转化大肠杆菌trans1
‑
t1感受态细胞并测序验证。
30.待测序正确后,提取重组质粒ppiczαa
‑
y4
‑
spy,利用限制性内切酶pme i进行线性化,产物纯化回收并电击转化毕赤酵母gs115感受态细胞,获得重组菌株毕赤酵母gs115(ppiczαa
‑
y4
‑
spy)。
31.实施例2、野生型植酸酶y4及融合蛋白y4
‑
spy的制备1.蛋白的诱导表达将得到的重组表达菌株接种至ypd培养基中进行种子培养,200 rpm,30℃培养48 h后,以1%接种量转接至bmgy培养基中,200 rpm,30℃培养48 h。之后4500 rpm离心5 min,弃上清,收集菌体并加入含有0.5%甲醇的bmmy培养基进行诱导表达,每12 h补加0.5%甲醇,共诱导48 h。
32.2.蛋白的纯化将诱导表达后的菌液12000 rpm离心10 min,收集上清进行浓缩,再用20 mm ph 8.0 tris
‑
hcl进行透析。然后将透析后的酶液进行阴离子交换层析,a液为20 mm ph 8.0 tris
‑
hcl,b液为a液加1 m nacl,纯化蛋白,收集洗脱液,进行sds
‑
page分析。
33.实施例3、野生型植酸酶y4及融合蛋白y4
‑
spy的性质测定1. 植酸酶活性测定将酶液用0.1 mol/l含有0.05% bsa和0.05% triton x
‑
100的ph 5.5 hac
‑
naac缓冲液进行稀释,将100
ꢀµ
l稀释后的酶液加入到900
ꢀµ
l植酸钠底物(用0.1 mol/l的ph 5.5 的hac
‑
naac缓冲液配制)中,在37度反应10 min,加入1 ml 10%(w/v)tca终止反应,最后加入1 ml显色液[1%(w/v)四水合钼酸铵,3.2%(v/v)浓硫酸,7.32%(w/v)硫酸亚铁]进行显色。对照则是在加酶液之前先加入tca混匀使酶变性,其他相同。显色后,在700 nm光吸收下测定od值,计算酶活。
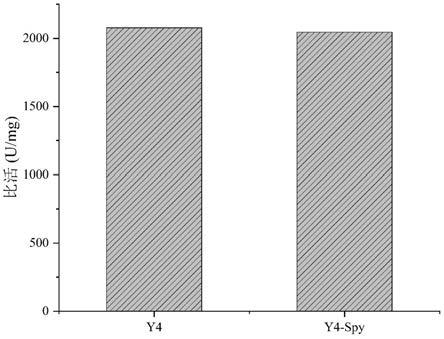
[0034]
将纯化后的野生型和融合蛋白在ph 5.5、37℃下进行酶促反应以测定其酶活性。如图1所示,野生型的酶比活为2077 u/mg,融合酶的酶比活为2045 u/mg,与野生型相当,表明对植酸酶y4的改造并未影响其活性。
[0035]
2. 最适温度测定
在0.1mol/l ph 5.5 hac
‑
naac缓冲液条件下,分别在不同温度(20、25、30、37、40、45、50、55、60、65和70℃)下对野生型和融合蛋白的酶活性进行测定来确定最适温度,最适温度对应活性定义为100%,依次计算其余温度下的剩余酶活。如图2所示,野生型和融合蛋白的最适温度都为55℃,肽标签spytag/spycatcher与植酸酶的融合表达并未影响植酸酶y4的最适温度。
[0036]
3. 热稳定性测定将纯化所得蛋白用0.1 mol/l含有0.05% bsa和0.05% triton x
‑
100的ph 5.5 hac
‑
naac缓冲液稀释至合适倍数后,取100 μl于1.5 ml ep管中,分别在100度下保温0、2、5、10、15和30 min,之后测定对应酶活,以保温0 min的活性为100%,计算不同保温时间下的剩余酶活。如图3所示,野生型在100℃下处理2 min后,酶活基本消失;而融合酶在100℃下处理2 min之后,剩余酶活相当于处理前的47%,处理5 min后,剩余酶活约为42%。
[0037]
实施例4、木聚糖酶xyna及融合蛋白xyna
‑
spy的性质测定根据本发明的具体实施方式,对从绵羊瘤胃中分离得到的氨基酸序列如seq id no:4所示的木聚糖酶xyna与肽标签spytag/spycatcher进行融合表达,从而获得所述融合木聚糖酶,氨基酸序列如seq id no:5所示。
[0038]
1. 木聚糖酶活性测定在0.9 ml ph 6.0的 1%(w/v)榉木木聚糖底物中加入100 μl适当稀释的酶液,50℃反应10 min后加入1.5 ml dns,煮5 min终止反应,冰上放置10 min后,室温下测定od
540
的吸光值,每个反应重复测定三次。酶活单位(u)的定义:在最适条件下每分钟释放1 μmol还原糖所需要的酶量。
[0039]
2. 热稳定性测定将纯化后的酶用最适ph缓冲液稀释后,在60℃处理下处理10 min,然后在最适温度和ph条件下测定剩余酶活。如图4所示,木聚糖酶xyna和xyna
‑
spy在60℃处理10 min后,剩余酶活分别为39.8%和41.2%,酶活损失情况基本一致,表明肽标签spytag/spycatcher与木聚糖酶的融合表达并未提高木聚糖酶xyna的热稳定性。
[0040]
以上实施例仅用于解释本技术的技术方案,不限定本技术的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1