一种诱导牙髓干细胞分化为成脂细胞的培养基、含有其的试剂盒及其应用的制作方法
1.本发明涉及干细胞技术领域,具体涉及一种诱导牙髓干细胞分化为成脂细胞的培养基、含有其的试剂盒及其应用。
背景技术:
2.牙髓干细胞(dental pulp stem cells,dpscs)是一种间充质干细胞(mesenchymal stem cells,mscs),其具有同其他间充质干细胞一样的良好增殖分化能力和多向分化潜能。
3.成脂细胞应用于美容修复软组织损伤具有可塑性强、可适应不同缺损形状的优势。脂肪组织再生技术是重建和修复由老化和病例因素等导致的脂肪组织丢失和损伤的重要技术手段,脂肪细胞作为脂肪再生工程的种子细胞来源,可大大地驱动新生组织的重建,因此成脂分化成为目前再生医学和组织工程领域的研究热点之一。
4.在特定的诱导条件下,牙髓干细胞能够分化为成脂细胞,牙髓干细胞的这种成脂诱导分化潜能,使其成为美容修复软组织缺损的干细胞来源。目前的成脂诱导培养基中含有血清,血清中含有的生长因子和细胞因子会影响干细胞分化进程,导致批次间的差异较大。同时,现有的成脂诱导分化培养基还存在诱导分化效率低(只有极少数的间充质干细胞能够分化为成脂细胞,形成脂滴,其余大部分细胞始终无法形成脂滴)、成脂诱导分化的专一性不强且诱导时间较长等问题。此外,干细胞领域普遍使用的细胞培养基地主要为聚苯乙烯材质的细胞培养板、培养瓶、培养皿等,基地的硬度对干细胞分化有着显著的影响,这些基地的硬度较大,力学性能与骨组织较为接近,使得间充质干细胞在这些基地表面容易发生成骨分化,使得成脂细胞的分化效率更低。
5.目前公开的研究多为诱导间充质干细胞向成脂细胞分化的方法,尚未见由专门针对人牙髓干细胞成脂分化的研究。虽然现有的诱导培养基都可以诱导间充质干细胞成脂分化,但是不同来源的干细胞之间由于微环境的差异,需要自己适宜的诱导分化环境。
技术实现要素:
6.本发明的目的在于提供一种诱导牙髓干细胞分化为成脂细胞的培养基、含有其的试剂盒及其应用,以降低成脂细胞诱导培养基的成本,并缩短诱导分化时间和提高诱导分化效率。
7.根据本发明的第一个方面,提供一种诱导牙髓干细胞分化为成脂细胞的培养基,该培养基包括基础培养基、胰岛素、血小板裂解液、吲哚美辛、地塞米松、3-异丁基-1-甲基黄嘌呤。
8.本发明提供的牙髓干细胞成脂诱导分化培养基为无血清培养基,该培养基是通过在基础培养基中添加胰岛素、血小板裂解液、吲哚美辛、地塞米松、3-异丁基-1-甲基黄嘌呤制备得到的。胰岛素能够促进成脂细胞分化以及细胞内脂肪的积累,缺乏胰岛素会导致正
在成脂分化的细胞表现出分化不再发展,出现逆分化,最终导致原有脂滴逐渐外排、消失。与胎牛血清相比,血小板裂解液中含有多种细胞因子,对细胞生长起支持作用,诱导牙髓干细胞分化为成脂细胞的效果更加优异。吲哚美辛可通过前列腺素非依赖的方式促进c/ebpβ和pparγ2表达,从而促进牙髓干细胞成脂分化。地塞米松可以通过抑制wnt/β-catenin信号通路从而促进环腺苷酸(camp)调控蛋白(crem)及与成脂功能密切相关pparγ2表达,从而加快细胞射能。3-异丁基-1-甲基黄嘌呤作为磷酸二酯酶非选择型抑制剂,上调环腺苷酸(camp)及环磷酸鸟苷(cgmp)活化代谢,进一步促进牙髓干细胞成脂分化过程中的能量摄取。本发明提供的培养基中含有基础培养基、胰岛素、血小板裂解液、吲哚美辛、地塞米松和3-异丁基-1-甲基黄嘌呤,这几种组分之间具有良好的协同作用,能够促进camp调控蛋白以及成脂分化相关基因和蛋白的表达,同时能够避免成脂分化的逆分化现象,使得牙髓干细胞能够高效、稳定地向成脂细胞分化,并为成脂分化过程中的细胞生长提供支持作用。此外,与常用的血清培养基(如胎牛血清)相比,本发明提供的培养基为无血清培养基,其诱导时间短,成本低。
9.优选地,上述诱导牙髓干细胞分化为成脂细胞的培养基包括基础培养基、10-30μg/ml胰岛素、5-20%(体积分数)血小板裂解液、0.1-1mm吲哚美辛、0.1-1mm地塞米松、0.1-1mm 3-异丁基-1-甲基黄嘌呤。
10.优选地,上述诱导牙髓干细胞分化为成脂细胞的培养基还包括0.5-2%(体积分数)青霉素-链霉素混合溶液。
11.本方案通过对培养基中各组分的含量进行限定,使得培养基之间各组分之间具有更好的协同作用,能够大大缩短牙髓干细胞成脂诱导分化时间,同时还能够提高成脂诱导分化效率。
12.同时,使用青霉素-链霉素混合溶液能够有效降低牙髓干细胞在分化为成脂细胞的过程中被污染的风险。
13.优选地,基础培养基为dmem/f12培养基。
14.本方案涉及的dmem/f12培养基为高糖型dnem培养基,其中的d-葡萄糖浓度为3151mg/l,有利于细胞的快速生长,降低细胞生长过程中贴壁困难的问题。
15.优选地,上述诱导牙髓干细胞分化为成脂细胞的培养基由以下方法制备得到:向基础培养基中添加胰岛素、血小板裂解液、吲哚美辛、地塞美松、3-异丁基-1-甲基黄嘌呤、青霉素-链霉素混合溶液,混合均匀,并用0.22μm滤膜过滤除菌,得到诱导牙髓干细胞分化为成脂细胞的培养基。
16.本方案涉及的牙髓干细胞成脂诱导分化培养基的制备方法简单,有利于降低生产成本。
17.根据本发明的第二个方面,提供上述诱导牙髓干细胞分化为成脂细胞的培养基在促进牙髓干细胞向成脂细胞分化中的应用。
18.根据本发明的第三个方面,提供一种诱导牙髓干细胞分化为成脂细胞的试剂盒,该试剂盒包括第一培养基,第一培养基为上述诱导牙髓干细胞分化为成脂细胞的培养基。
19.优选地,上述试剂盒还包括第二培养基,按照体积分数计算,第二培养基包括5-20%血小板裂解液(hpl)、0.05-0.3%表皮生长因子(egf)溶液、0.05-0.3%碱性成纤维细胞生长因子(bfgf)、0.1-1%含有l-丙氨酰-l-谷氨酰胺的添加剂(glutamax
tm
)、基础培养
基;
20.egf溶液浓度为100ng/ml;
21.bfgf溶液浓度为100ng/ml。
22.本方案提供的试剂盒中包括第二培养基,该培养基中含有hpl、egf、bfgf、glutamax
tm
和基础培养基。hpl含有多种生长因子,有利于促进牙髓干细胞的增殖;egf和bfgf则能够促进牙髓干细胞的增殖;glutamax
tm
被细胞释放的氨肽酶水解后,能够缓慢释放l-谷氨酰胺和l-丙氨酸至培养基中,随后被细胞吸收,使得培养基中的l-谷氨酰胺始终保持较低的浓度且不会生产过多的氨,避免氨的产生对细胞产生毒害作用。第二培养基中的各组分之间相互配合使用,有利于牙髓干细胞的快速生长和提高牙髓干细胞的活性,为成脂诱导分化诱导分化提供了更多的、活性更高的牙髓干细胞,以提高牙髓干细向成脂细胞分化的效率。
23.优选地,上述试剂盒中的第二培养基还包括0.5-2%(体积分数)psn抗生素组合物。
24.本方案涉及的psn抗生素组合物是一种由青霉素、链霉素和新霉素组成的抗生素组合物,这三种抗生素联合使用能够降低细胞被污染的风险。
25.优选地,上述试剂盒中第二培养基中的基础培养基为dmem/f12培养基。
26.根据本发明的第四个方面,提供上述诱导牙髓干细胞分化为成脂细胞的试剂盒在促进牙髓干细胞向成脂细胞分化中的应用。
27.根据本发明的第五个方面,提供一种诱导牙髓干细胞分化为成脂细胞的方法,包括以下步骤:利用上述诱导牙髓干细胞分化为成脂细胞的培养基或上述诱导牙髓干细胞分化为成脂细胞的试剂盒对牙髓干细胞进行诱导,获得成脂细胞。
28.本方案利用上述诱导牙髓干细胞分化为成脂细胞的培养基或上述诱导牙髓干细胞分化为成脂细胞的试剂盒对牙髓干细胞进行诱导分化,使得牙髓干细胞能够有效地、定向地分化为成脂细胞,分化效率高。
29.优选地,诱导的时间为25-35天。利用本发明提供的牙髓干细胞成脂诱导分化培养基对牙髓干细胞进行诱导,获得成脂细胞,能够有效缩短诱导时间。
30.优选地,牙髓干细胞为第3-5代的牙髓干细胞。
31.优选地,诱导的温度为36-38℃。本方案采用的诱导温度为36-37℃,诱导温度适中,有利于细胞的生长和成脂分化。
32.本发明的有益效果为:
33.1.本发明提供的诱导牙髓干细胞分化为成脂细胞的培养基中,各组分安全无细胞毒性、制备方法简单,能够高效诱导牙髓干细胞向成脂细胞定向分化,避免了向成骨细胞等其他组织细胞的分化,有效提高牙髓干细胞的成脂分化效率,缩短诱导分化时间,并且能够降低成本。
34.2.本发明提供的诱导牙髓干细胞分化为成脂细胞的培养基为无血清培养基,可避免批次间的差异和血清组分对细胞培养的影响,避免血清的外源性污染和对细胞的毒性作用,使得牙髓干细胞成脂分化的操作过程可重复性高,其成脂分化效果优于传统的血清培养基。
35.3.利用本发明提供的诱导牙髓干细胞分化为成脂细胞的培养基对牙髓干细胞进
行诱导分化,使得牙髓干细胞成脂分化的操作更加简便、可操作性强,为牙髓干细胞成脂分化提供了一定的理论基础。
36.4.本发明还提供了一种试剂盒,该试剂盒含有上述诱导牙髓干细胞分化为成脂细胞的培养基,可以用于诱导牙髓干细胞向成脂细胞定向分化,提高诱导分化效率。
37.5.本发明最后提供了一种诱导牙髓干细胞分化为成脂细胞的方法,该方法利用上述诱导牙髓干细胞分化为成脂细胞的培养基或试剂盒对牙髓干细胞进行诱导,得到成脂细胞,该诱导分化方法简单,使得牙髓干细胞能够有效地分化为成脂细胞。
附图说明
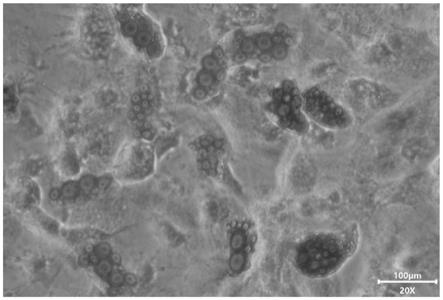
38.图1为牙髓干细胞在本发明实施例1的成脂诱导分化培养基中诱导30天时成骨诱导分化油红o染色结果图。
39.图2为牙髓干细胞在本发明实施例2的成脂诱导分化培养基中诱导25天时成骨诱导分化油红o染色结果图。
40.图3为牙髓干细胞在本发明实施例3的成脂诱导分化培养基中诱导35天时成骨诱导分化油红o染色结果图。
具体实施方式
41.下面结合具体实施方式对本发明提供的技术方案中的技术特征作进一步清楚、完整的描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
42.实施例1-3和对比例1-6
43.一种诱导牙髓干细胞分化为成脂细胞的培养基,成分如表1所示,制备方法具体包括以下步骤:向高糖型dmem培养基(葡萄糖浓度3151mg/l)中添加10-30μg/ml胰岛素、5-20%(体积分数)血小板裂解液、0.1-1mm吲哚美辛、0.1-1mm地塞米松、0.1-1mm 3-异丁基-1-甲基黄嘌呤、0.5-2%(体积分数)青霉素-链霉素混合溶液,混合均匀,并用0.22μm滤膜过滤除菌,得到诱导牙髓干细胞分化为成脂细胞的培养基。
44.表1牙髓干细胞成脂诱导分化培养基组分
[0045][0046]
实施例4
[0047]
一种诱导牙髓干细胞分化为成脂细胞的方法,具体包括以下步骤:
[0048]
(1)从-196℃液氮中取出装有处于对数生长期的牙髓干细胞的冻存管,立即放入37℃恒温水浴锅内,不断来回摇晃,直至所有冰块消融,从水浴锅中取出冻存管,用75%的酒精喷洒冻存管表面,放入生物安全柜内充分擦拭,将牙髓干细胞转移至装有10ml实施例1所得到的诱导牙髓干细胞分化为成脂细胞的培养基的15ml离心管中,于1000rpm下离心5min,舍弃上清,用实施例1所得到的诱导牙髓干细胞分化为成脂细胞的培养基重悬细胞;
[0049]
(2)将重悬液转移到12孔板中(2ml重悬液/孔),转移后每孔的细胞密度为3
×
103个/cm2,于37℃下孵育细胞,待细胞融合度约达90-100%时(需要大约1-7天),利用实施例1所得到的诱导牙髓干细胞分化为成脂细胞的培养基进行诱导分化,每3天以2ml/孔更换一次培养基,直到细胞成脂分化,并记录所需时间;
[0050]
(3)配制oil red o(油红o)染色液:将0.25mg oil red o母液与50ml异丙醇混合均匀,并用0.22μm滤膜过滤除菌,得到油红o染色液;
[0051]
(4)将细胞转移至24孔板铺爬片,吸弃分化培养基,并加入1ml生理盐水轻轻润洗24孔板底面,随后用vivacell的试剂盒固定液adipo-fixation 1ml进行室温固定30min,吸弃固定液,加入1ml adipo washⅰ,润洗底面,静置2min,吸弃上清,加入1ml油红o染色液,室温染色30min,吸弃染色液,然后加入1ml adipo washⅱ润洗底面;
[0052]
(5)从孔板中取出爬片,用中性树脂固定在载玻片上,向其中滴加1-2滴中性树脂,将铺有细胞的一面朝上,室温静置15min左右,随后用显微镜观察染色情况,并进行拍照,结果如图1所示。
[0053]
实施例5
[0054]
一种诱导牙髓干细胞分化为成脂细胞的方法,具体包括以下步骤:
[0055]
(1)从-196℃液氮中取出装有处于对数生长期的牙髓干细胞的冻存管,立即放入37℃恒温水浴锅内,不断来回摇晃,直至所有冰块消融,从水浴锅中取出冻存管,用75%的酒精喷洒冻存管表面,放入生物安全柜内充分擦拭,将牙髓干细胞转移至装有10ml实施例2所得到的诱导牙髓干细胞分化为成脂细胞的培养基的15ml离心管中,于1000rpm下离心
5min,舍弃上清,用实施例2所得到的诱导牙髓干细胞分化为成脂细胞的培养基重悬细胞;
[0056]
(2)将重悬液转移到12孔板中(2ml重悬液/孔),转移后每孔的细胞密度为3
×
103个/cm2,于37℃下孵育细胞,待细胞融合度约达90-100%时(需要大约1-7天),利用实施例2所得到的诱导牙髓干细胞分化为成脂细胞的培养基进行诱导分化,每3天以2ml/孔更换一次培养基,直到细胞成脂分化,并记录所需时间;
[0057]
(3)配制oil red o(油红o)染色液:将0.25mg oil red o母液与50ml异丙醇混合均匀,并用0.22μm滤膜过滤除菌,得到油红o染色液;
[0058]
(4)将细胞转移至24孔板铺爬片,吸弃分化培养基,并加入1ml生理盐水轻轻润洗24孔板底面,随后用vivacell的试剂盒固定液adipo-fixation 1ml进行室温固定30min,吸弃固定液,加入1ml adipo washⅰ,润洗底面,静置2min,吸弃上清,加入1ml油红o染色液,室温染色30min,吸弃染色液,然后加入1ml adipo washⅱ润洗底面;
[0059]
(5)从孔板中取出爬片,用中性树脂固定在载玻片上,向其中滴加1-2滴中性树脂,将铺有细胞的一面朝上,室温静置15min左右,随后用显微镜观察染色情况,并进行拍照,结果如图2所示。
[0060]
实施例6
[0061]
一种诱导牙髓干细胞分化为成脂细胞的方法,具体包括以下步骤:
[0062]
(1)从-196℃液氮中取出装有处于对数生长期的牙髓干细胞的冻存管,立即放入37℃恒温水浴锅内,不断来回摇晃,直至所有冰块消融,从水浴锅中取出冻存管,用75%的酒精喷洒冻存管表面,放入生物安全柜内充分擦拭,将牙髓干细胞转移至装有10ml实施例3所得到的诱导牙髓干细胞分化为成脂细胞的培养基的15ml离心管中,于1000rpm下离心5min,舍弃上清,用实施例3所得到的诱导牙髓干细胞分化为成脂细胞的培养基重悬细胞;
[0063]
(2)将重悬液转移到12孔板中(2ml重悬液/孔),转移后每孔的细胞密度为3
×
103个/cm2,于37℃下孵育细胞,待细胞融合度约达90-100%时(需要大约1-7天),利用实施例3所得到的诱导牙髓干细胞分化为成脂细胞的培养基进行诱导分化,每3天以2ml/孔更换一次培养基,直到细胞成脂分化,并记录所需时间;
[0064]
(3)配制oil red o(油红o)染色液:将0.25mg oil red o母液与50ml异丙醇混合均匀,并用0.22μm滤膜过滤除菌,得到油红o染色液;
[0065]
(4)将细胞转移至24孔板铺爬片,吸弃分化培养基,并加入1ml生理盐水轻轻润洗24孔板底面,随后用vivacell的试剂盒固定液adipo-fixation 1ml进行室温固定30min,吸弃固定液,加入1ml adipo washⅰ,润洗底面,静置2min,吸弃上清,加入1ml油红o染色液,室温染色30min,吸弃染色液,然后加入1ml adipo washⅱ润洗底面;
[0066]
(5)从孔板中取出爬片,用中性树脂固定在载玻片上,向其中滴加1-2滴中性树脂,将铺有细胞的一面朝上,室温静置15min左右,随后用显微镜观察染色情况,并进行拍照,结果如图3所示。
[0067]
对比例7
[0068]
一种诱导牙髓干细胞分化为成脂细胞的方法,具体包括以下步骤:
[0069]
(1)从-196℃液氮中取出装有处于对数生长期的牙髓干细胞的冻存管,立即放入37℃恒温水浴锅内,不断来回摇晃,直至所有冰块消融,从水浴锅中取出冻存管,用75%的酒精喷洒冻存管表面,放入生物安全柜内充分擦拭,将牙髓干细胞转移至装有10ml对比例1
所得到的诱导牙髓干细胞分化为成脂细胞的培养基的15ml离心管中,于1000rpm下离心5min,舍弃上清,用对比例1所得到的诱导牙髓干细胞分化为成脂细胞的培养基重悬细胞;
[0070]
(2)将重悬液转移到12孔板中(2ml重悬液/孔),转移后每孔的细胞密度为3
×
103个/cm2,于37℃下孵育细胞,待细胞融合度约达90-100%时(需要大约1-7天),利用对比例1所得到的诱导牙髓干细胞分化为成脂细胞的培养基进行诱导分化,每3天以2ml/孔更换一次培养基,直到细胞成脂分化;
[0071]
(3)配制oil red o(油红o)染色液:将0.25mg oil red o母液与50ml异丙醇混合均匀,并用0.22μm滤膜过滤除菌,得到油红o染色液;
[0072]
(4)将细胞转移至24孔板铺爬片,吸弃分化培养基,并加入1ml生理盐水轻轻润洗24孔板底面,随后用vivacell的试剂盒固定液adipo-fixation 1ml进行室温固定30min,吸弃固定液,加入1ml adipo washⅰ,润洗底面,静置2min,吸弃上清,加入1ml油红o染色液,室温染色30min,吸弃染色液,然后加入1ml adipo washⅱ润洗底面;
[0073]
(5)从孔板中取出爬片,用中性树脂固定在载玻片上,向其中滴加1-2滴中性树脂,将铺有细胞的一面朝上,室温静置15min左右,随后用显微镜观察染色情况。
[0074]
对比例8
[0075]
对比例8提供一种诱导牙髓干细胞分化为成脂细胞的方法,与对比例7的区别在于,步骤(1)、(2)中采用对比例2所得到的诱导牙髓干细胞分化为成脂细胞的培养基代替对比例1所得到的诱导牙髓干细胞分化为成脂细胞的培养基。
[0076]
对比例9
[0077]
对比例9提供一种诱导牙髓干细胞分化为成脂细胞的方法,与对比例7的区别在于,步骤(1)、(2)中采用对比例3所得到的诱导牙髓干细胞分化为成脂细胞的培养基代替对比例1所得到的诱导牙髓干细胞分化为成脂细胞的培养基。
[0078]
对比例10
[0079]
对比例10提供一种诱导牙髓干细胞分化为成脂细胞的方法,与对比例7的区别在于,步骤(1)、(2)中采用对比例4所得到的诱导牙髓干细胞分化为成脂细胞的培养基代替对比例1所得到的诱导牙髓干细胞分化为成脂细胞的培养基。
[0080]
对比例11
[0081]
对比例11提供一种诱导牙髓干细胞分化为成脂细胞的方法,与对比例7的区别在于,步骤(1)、(2)中采用对比例5所得到的诱导牙髓干细胞分化为成脂细胞的培养基代替对比例1所得到的诱导牙髓干细胞分化为成脂细胞的培养基。
[0082]
对比例12
[0083]
对比例12提供一种诱导牙髓干细胞分化为成脂细胞的方法,与对比例7的区别在于,步骤(1)、(2)中采用对比例6所得到的诱导牙髓干细胞分化为成脂细胞的培养基代替对比例1所得到的诱导牙髓干细胞分化为成脂细胞的培养基。
[0084]
测试例
[0085]
1.实验构建方式
[0086]
用油红o对细胞进行染色,观察染色情况,并对油红o染色的细胞进行计数,计算牙髓干细胞成脂诱导分化率,具体操作为:在倒置显微镜100倍放大视野下,每孔随机记数3个视野,计算分化细胞占细胞总数的比例,每次平行计数3个孔,计算平均值。诱导分化率按照
下式计算:诱导分化率=染色阳性细胞数/细胞总数
×
100%。
[0087]
2.实验结果
[0088]
表2各组诱导分化率
[0089][0090]
用油红o对细胞进行染色,结果显示,实施例4-6中利用本发明提供的诱导牙髓干细胞分化为成脂细胞的培养基对牙髓干细胞进行诱导之后,细胞的胞浆中都是油滴,经染色后,细胞质被油红o试剂染色为红色脂滴,证明牙髓干细胞定向分化为成脂细胞(实施例4-6的细胞染色图分别对应图1-3)。其次,本发明提供的牙髓干细胞成脂诱导分化培养基为无血清培养基,利用其对牙髓干细胞进行诱导分化,虽然培养基中添加的是不同浓度的成分,对其成脂诱导形成的脂滴的数量和大小存在一定的影响,但是都比对比例7利用血清培养基进行牙髓干细胞成脂诱导形成的脂滴的数量多且形成的脂滴都比较大。此外,实施例4-6中脂滴的形成时间分别为30、25、35天,而对比例7中脂滴的形成时间为38天,这说明利用本发明提供的无血清培养基诱导牙髓干细胞向成脂细胞分化的效果比对比例1中含有血清的培养基的诱导分化效果更好,能够缩短诱导分化时间,提高牙髓干细胞的成脂诱导分化效率,在更短的时间内形成更多的脂滴。
[0091]
各组诱导分化率结果如表2所示。由表2可知,实施例4-6的成脂诱导分化效率显著高于对比例7-12的成脂诱导分化效率,说明本发明提供的培养基中含有的胰岛素、血小板裂解液、吲哚美辛、地塞米松、3-异丁基-1-甲基黄嘌呤这几种组分之间具有良好的协同作用,正是由于这几种组分之间的协同作用才使得牙髓干细胞能够定向分化为成脂细胞,并提高成脂诱导分化效率。
[0092]
以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照上述实施例对本发明进行了详细的说明,所属领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,但这些修改或替换均在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1