结核分枝杆菌链霉素耐药突变检测方法及检测试剂盒与流程
1.本发明涉及生物技术领域,特别涉及结核分枝杆菌链霉素耐药突变检测方法及检测试剂盒。
背景技术:
2.结核病为结核分枝杆菌(mycobacterium tuberculosis,mtb)引起的慢性传染性疾病。结核病主要通过飞沫传播,可侵犯人体全身多个脏器,其中以肺结核(pulmonary tuberculosis,ptb)最多见,具有高感染率、高发病率和高致死率。在20世纪40年代至60年代,链霉素(streptomycin,sm)、异烟肼(isoniazid,inh)、吡嗪酰胺(pyrazinamide,pza)、乙胺丁醇(ethambutol,emb)、利福平(rifampicin,rif)等抗结核药物的问世给结核病的治疗带来了希望,并使结核病疫情在很大程度得到控制,抗结核化疗药物成为人们抵抗结核病的重要武器。然而,由于抗结核治疗的不规范以及免疫抑制剂的滥用,使得耐药结核病频繁发生。
3.耐药性结核病指结核病患者感染的mtb经体外药物敏感试验(drug susceptibility test,dst)证实对一种或多种抗结核药物产生耐药,尤其是耐多药结核病(multidrug resistance tuberculosis,mdr-tb,指mtb至少对inh和rif同时耐药)和广泛耐药结核病(extensively drug resistant tuberculosis,xdr-tb,指mtb除了对inh、rfp同时耐药外,还对任何氟喹诺酮类抗生素及三种二线抗结核注射药物cm、km及akm中的至少一种耐药)。
4.目前,我国耐多药结核病患者数仅次于印度,位居全球第二位。2010年我国第五次结核病流调显示,我国西部地区肺结核的患病率明显高于中东部地区,且一线抗结核药物(hres)的耐药率为36.8%,dst常规检测的11种抗结核药物的耐药率为42.1%,耐多药率为6.8%,初治患者耐药率为42.7%,复治患者耐药率为38.5%。
5.链霉素(streptomycin,sm)是常用的一线抗结核药物之一并且是第一个用于治疗结合病的药物。由于用于治疗结核病历史较长,链霉素在耐药结核病种具有较高的耐药率。2010年我国第五次结核病流行病学抽样调查显示链霉素的耐药率为19.6%,仅次于异烟肼(isoniazid,inh)的耐药率为28.2%。研究表明,结核分枝杆菌对链霉素的耐药主要是由于编码s12核糖体蛋白的rpsl基因与编码16s rrna的rrs基因发生突变所致。rpsl基因的突变主要发生在43位密码子和88位密码子,其中43位密码子突变的发生率最高。相比rpsl基因,rrs基因的突变率相对较低,但突变类型更加多样,514位点碱基、517位点碱基、905位点碱基、906位点碱基、907位点碱基、908位点碱基、916位点碱基、918位点碱基突变都可能导致链霉素耐药。
6.现有技术中,检测mtb耐药基因的方法有xpert mtb/rif法、聚合酶链反应-单链构象多态性分析(polymerase chain reaction-single strand conformation polymorphism,pcr-sscp)法和细菌基因组dna直接测序法(direct sequencing,ds),但前两中方法检测速度较慢,检测结果存在假阴性的可能性且难以百分之百地消除。dna直接测
序法利用pcr扩增待测基因,产物纯化或克隆化,取其dna片段直接测序,其碱基序列与标准敏感株的同一dna片段比较异同,寻找碱基突变的位置和分布,其虽然检测准确率高,但是该方法周期长,费用大,且很容易发生交叉污染。
7.荧光pcr熔解曲线法一种简单快速的pcr检测方法,其主要检测原理为耐药基因的基因突变会导致dna双链的结合力下降,从而导致相应的tm值下降,即野生型基因有特定的tm值而突变型基因因为结合能力下降导致tm值发生变化,据此可以区分和检测出突变型和野生型。在技术上,荧光pcr熔解曲线法采用闭管法,即将检测样本和检测试剂集中于反应管中,在反应过程中无须打开,避免了扩增产物的污染,有利于反应后熔解曲线的分析。因此,开发一种基于荧光pcr熔解曲线法的结核分枝杆菌链霉素耐药突变检测方法及试剂盒十分重要。
技术实现要素:
8.本发明的目的在于提供一种结核分枝杆菌链霉素耐药突变检测方法。
9.本发明的另一目的在于提供一种用于检测结核分枝杆菌链霉素耐药突变的引物对组。
10.本发明的另一目的在于提供一种用于检测结核分枝杆菌链霉素耐药突变的引物探针混合液。
11.本发明的另一目的在于提供一种用于检测结核分枝杆菌链霉素耐药突变的试剂盒。
12.为解决上述技术问题,本发明第一方面提供了一种用于检测结核分枝杆菌链霉素耐药突变的pcr引物对组,所述pcr引物对组包括:
13.第一引物对(特异性检测rpsl基因的第43位突变位点),所述第一引物对包括如seq id no.:1所示的正向引物;和,如seq id no.:2所示的反向引物;和/或
14.第二引物对(特异性检测rpsl基因的第88位突变位点),所述第二引物对包括如seq id no.:3所示的正向引物;和,如seq id no.:4所示的反向引物;和/或
15.第三引物对(特异性检测rrs基因的第514和/或第517位突变位点),所述第三引物对包括如seq id no.:5所示的正向引物;和,如seq id no.:6所示的反向引物;和/或
16.第四引物对(特异性检测rrs基因的第906、第907、第908、第916和/或第918位突变位点),所述第四引物对包括如seq id no.:7所示的正向引物;和,如seq id no.:8所示的反向引物。
17.在一些优选的方案中,所述pcr引物对组包括第一引物对,并任选包括至少一组选自第二引物对、第三引物对和第四引物对的引物对。
18.在一些优选的方案中,所述pcr引物对组包括第二引物对,并任选包括至少一组选自第一引物对、第三引物对和第四引物对的引物对。
19.在一些优选的方案中,所述pcr引物对组包括第三引物对,并任选包括至少一组选自第一引物对、第二引物对和第四引物对的引物对。
20.在一些优选的方案中,所述pcr引物对组包括第四引物对,并任选包括至少一组选自第一引物对、第二引物对和第三引物对的引物对。
21.在一些优选的方案中,所述pcr引物对组包括第一引物对、第二引物对、第三引物
对和第四引物对。
22.本发明的第二方面提供了一种用于检测结核分枝杆菌链霉素耐药突变的引物探针混合液,所述引物探针混合液包括本发明第一方面所述的pcr引物对组和选自下组的一个或多个探针:
23.第一探针,特异性靶向rpsl基因的第43位突变位点;
24.第二探针,特异性靶向rpsl基因的第88位突变位点;
25.第三探针,特异性靶向rrs基因的第514和/或第517位突变位点;
26.第四探针,特异性靶向rrs基因的第906、第907、第908、第916和/或第918位突变位点。
27.在一些优选的方案中,所述引物探针混合液包括本发明第一方面所述的pcr引物对组和选自下组的一个或多个探针:
28.如seq id no.:9所示的第一探针;
29.如seq id no.:10所示的第二探针;
30.如seq id no.:11所示的第三探针;和
31.如seq id no.:12所示的第四探针。
32.在一些优选的方案中,所述第一探针和所述第三探针具有第一荧光标记;所述第二探针具有第二荧光标记;所述第四探针具有第三荧光标记;且,所述第一荧光标记、所述第二荧光标记和所述第三荧光标记互不相同。
33.在一些优选的方案中,所述第一荧光标记、所述第二荧光标记和所述第三荧光标记分别独立地选自texas red、cy5和vic。
34.在一些优选的方案中,seq id no:9、seq id no:11探针核苷酸序列的5’端标记有texas red,且3’端标记有bhq2。
35.在一些优选的方案中,seq id no:10探针的核苷酸序列的5’端标记有cy5,3’端标记有bhq2。
36.在一些优选的方案中,seq id no:12探针的核苷酸序列的5’端标记有vic,3’端标记有bhq1。
37.在一些优选的方案中,所述第一探针、所述第二探针和所述第三探针的tm值互不相同。
38.在一些优选的方案中,所述引物探针混合液包括:
39.所述第一引物对和所述第一探针,和/或
40.所述第二引物对和所述第二探针;
41.或者,所述引物探针混合液包括
42.所述第三引物对和所述第三探针,和/或
43.所述第四引物对和所述第四探针。
44.在一些优选的方案中,所述引物探针混合液包括第一引物探针混合体系和第二引物探针混合体系,
45.所述第一引物探针混合体系包括:
46.所述第一引物对和所述第一探针,和/或
47.所述第二引物对和所述第二探针;
48.所述第二引物探针混合体系包括:
49.所述第三引物对和所述第三探针,和/或
50.所述第四引物对和所述第四探针。
51.本发明的引物/探针序列信息见下表:
[0052][0053][0054]
本发明的第三方面,提供了一种检测结核分枝杆菌链霉素耐药突变的试剂盒,所述试剂盒包括本发明第一方面所述的pcr引物对组。
[0055]
在一些优选的方案中,所述试剂盒包括第一容器,所述第一容器包含本发明第二方面所述的引物探针混合液。
[0056]
在一些优选的方案中,所述第一容器包含所述第一引物探针混合体系。
[0057]
在一些优选的方案中,所述试剂盒还包括第二容器,所述第二容器包含所述第二引物探针混合体系。
[0058]
在一些优选的方案中,所述试剂盒还包括第三容器,所述第三容器包含pcr反应酶系;优选地,所述pcr反应酶系包括逆转录酶、热启动taq抗体酶或其稀释液。
[0059]
在一些优选的方案中,所述pcr反应酶系还包括udg酶。
[0060]
在一些优选的方案中,所述试剂盒还包括阴性质控品。
[0061]
在一些优选的方案中,所述试剂盒还包括阳性质控品。
[0062]
在一些优选的方案中,所述试剂盒包括本发明第二方面所述的引物探针混合液、5
×
dna buffer、热启动taq抗体酶、对照样本和纯化水。
[0063]
在一些优选的方案中,所述5
×
dna buffer包括(nh4)2so4、tris-hcl、mgcl2和tween-20。
[0064]
在一些优选的方案中,所述阴性质控品为纯化水。
[0065]
在一些优选的方案中,所述阳性质控品为人工合成的结核分枝杆菌rpsl基因和rrs基因野生型质粒。
[0066]
本发明的第四方面,提供了一种检测结核分枝杆菌链霉素耐药突变的方法,所述方法包括步骤:
[0067]
(1)提供待检测样本,所述样本中含有结核分枝杆菌核酸;
[0068]
(2)制备扩增反应体系,进行扩增反应;
[0069]
(3)对步骤(2)扩增反应所得产物进行熔解曲线分析;
[0070]
其中,所述扩增反应体系包括步骤(1)提供的待检测样本和本发明第一方面所述的引物对组。
[0071]
在一些优选的方案中,所述扩增反应体系包括步骤(1)提供的待检测样本和本发明第二方面所述的引物探针混合液。
[0072]
在一些优选的方案中,所述样本品为体液样品或组织样本,和更优选所述样本选自活组织检查样本、细跑培养物、经自化处理的样本(如石蜡包理样本)、全血、血浆、血洁、唾液、搞髓;在、汗液、痰、肺泡灌洗液、尿液、粪佳、分泌液、乳汁和腹膜液;例如痰液。
[0073]
在一些优选的方案中,所述方法为非诊断目的。例如,可用于检测体外培养中的结核分枝杆菌是否变异或者可以对环境样本进行,用于检测环境来源的结核分枝杆菌样品是否具有耐药性。
[0074]
本发明的第五方面,提供了本发明第一方面所述的引物对组、和本发明第二方面所述的引物探针混合液的用途,用于制备检测试剂盒,所述检测试剂盒用于检测结核分枝杆菌链霉素耐药突变。
[0075]
本发明实施方式相对于现有技术而言,至少具有以下优点:
[0076]
(1)本发明提供的引物、探针及包括该引物探针混合液的试剂盒可以同时检测结核病患者的结核分枝杆菌复合群阳性的痰液培养物样本中链霉素耐药基因rpsl和rrs耐药决定区,分别针对rpsl基因的2个突变密码子43、88和rrs基因7个突变碱基514、517、906、907、908、916、918进行耐药筛选,极大的简化了操作过程,降低了研究成本和技术复杂性,缩短了检测时间。
[0077]
(2)本发明提供的检测结核分枝杆菌链霉素耐药突变的方法硬件要求低,自动化程度高、检测耐药突变位点多,灵敏度高,准确度高。
[0078]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
[0079]
一个或多个实施例通过与之对应的附图中的图片进行示例性说明,这些示例性说明并不构成对实施例的限定。
[0080]
图1是根据本发明实施例中检测结核阴性样本的pcr结果(texas red通道);
[0081]
图2是根据本发明实施例中检测结核阴性样本的pcr结果(cy5通道);
[0082]
图3是根据本发明实施例中检测结核阴性样本的pcr结果(vic通道);
[0083]
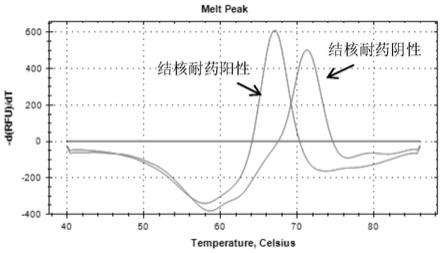
图4是根据本发明实施例中rpsl基因第43密码子突变型pcr反应管结核耐药阳性
样本和结核耐药阴性样本的pcr结果;
[0084]
图5是根据本发明实施例中rpsl基因第88密码子突变型pcr反应管结核耐药阳性样本和结核耐药阴性样本的pcr结果;
[0085]
图6是根据本发明实施例中rrs基因第514碱基突变型pcr反应管结核耐药阳性样本和结核耐药阴性样本的pcr结果;
[0086]
图7是根据本发明实施例中rrs基因第517碱基突变型pcr反应管结核耐药阳性样本和结核耐药阴性样本的pcr结果;
[0087]
图8是根据本发明实施例中rrs基因第906碱基突变型pcr反应管结核耐药阳性样本和结核耐药阴性样本的pcr结果;
[0088]
图9是根据本发明实施例中rrs基因第907碱基突变型pcr反应管结核耐药阳性样本和结核耐药阴性样本的pcr结果;
[0089]
图10是根据本发明实施例中rrs基因第908碱基突变型pcr反应管结核耐药阳性样本和结核耐药阴性样本的pcr结果;
[0090]
图11是根据本发明实施例中rrs基因第916碱基突变型pcr反应管结核耐药阳性样本和结核耐药阴性样本的pcr结果;
[0091]
图12是根据本发明实施例中rrs基因第918碱基突变型pcr反应管结核耐药阳性样本和结核耐药阴性样本的pcr结果;
[0092]
图13是根据本发明实施例中使用对照引物探针体系1灵敏度样本的pcr结果;
[0093]
图14是根据本发明实施例中使用对照引物探针体系2检测灵敏度样本的pcr结果。
具体实施方式
[0094]
现有技术中检测结核分枝杆菌链霉素耐药突变的方法周期长操作繁琐,检测结果存在假阴性,不利于临床检测。本发明人通过详尽的实验研究,开发了一种基于荧光pcr熔解曲线法的体外快速定性检测结核病患者的结核分枝杆菌复合群阳性的痰液培养物样本中链霉素耐药基因rpsl和rrs耐药决定区耐药的方法及试剂盒,本试剂盒通过引物和特异性探针的设计,检测链霉素耐药突变位点多,具有操作流程简单、检测时间短、检测成本低等优点。
[0095]
本发明的一些实施方式中提供了一种快速定性检测结核病患者的结核分枝杆菌复合群阳性的痰液样本中链霉素耐药基因rpsl和rrs基因的引物对组,所述引物对组包括:
[0096]
如seq id no:1所示的检测链霉素耐药基因rpsl的第43位突变位点的正向引物核苷酸序列;如seq id no:2所示的检测链霉素耐药基因rpsl的第43位突变位点的反向引物核苷酸序列;
[0097]
如seq id no:3所示的检测链霉素耐药基因rpsl的第88位突变位点的正向引物核苷酸序列;如seq id no:4所示的检测链霉素耐药基因rpsl的第88位突变位点的反向引物核苷酸序列;
[0098]
如seq id no:5所示的检测链霉素耐药基因rrs的第514和/或第517位突变位点的正向引物核苷酸序列;如seq id no:6所示的检测链霉素耐药基因rrs的第514和/或第517位突变位点的反向引物核苷酸序列;
[0099]
如seq id no:7所示的检测链霉素耐药基因rrs的第906、第907、第908、第916和/
或第918位突变位点的正向引物核苷酸序列;如seq id no:8所示的检测链霉素耐药基因rrs的第906、第907、第908、第916和/或第918位突变位点的反向引物核苷酸序列。
[0100]
本发明的一些实施方式中还提供了一种快速定性检测结核病患者的结核分枝杆菌复合群阳性的痰液样本中链霉素耐药基因rpsl和rrs的探针,所述探针包括:
[0101]
如seq id no:9所示的检测链霉素耐药基因rpsl的第43位突变位点的探针核苷酸序列;
[0102]
如seq id no:10所示的检测链霉素耐药基因rpsl的第88位突变位点的探针核苷酸序列;
[0103]
如seq id no:11所示的检测链霉素耐药基因rrs的第514和/或第517位突变位点的探针核苷酸序列;
[0104]
如seq id no:12所示的检测链霉素耐药基因rrs的第906、第907、第908和/或第916、第918位突变位点的探针核苷酸序列。
[0105]
优选地,seq id no:9、seq id no:11探针核苷酸序列的5’端标记有texas red,3’端标记有bhq2;
[0106]
seq id no:10探针的核苷酸序列的5’端标记有cy5,3’端标记有bhq2;
[0107]
seq id no:12探针的核苷酸序列的5’端标记有vic,3’端标记有bhq1。
[0108]
优选地,野生型和突变型基因检测下游引物在反应体系中的终浓度为2.1pmol/μl,检测野生型和突变型基因检测上游引物在反应体系中的终浓度为0.14pmol/μl,野生型检测探针在反应体系中的终浓度为0.32pmol/μl;所述野生型和突变型基因检测引物和探针序列如下表1:
[0109]
表1引探序列信息
[0110]
编号引物/探针名称核酸序列(5
’‑‑3’
)seq id no:1rpsl-43-f2-late1gtacaccaccactccgseq id no:2rpsl-43-r2-late1aaggttgcccgcgtgaaseq id no:3rpsl-88-f2-late1gcgagggccacaacctgcaseq id no:4rpsl-88-r2-late1cagcgaaccgcggatgatcttgtseq id no:5rrs-f1gagaagaagcaccggccaseq id no:6rrs-r1cacgaacaacgcgacaaaseq id no:7rrs-f2ttccttgggatccgtgccgseq id no:8rrs-r2tcgaattaatccacatgctccseq id no:943p-1-5cggggcccactccgaagaagccgaactcgccccgseq id no:1088p-4-ccgggcgccgggtgaaggacctgcccgcccgseq id no:11514-517-pccagcggtgccagcagccgcggtacgctggseq id no:12906-918-pcgggcgtaaaactcaaaggaattgacgcgcccg
[0111]
上述pcr引物和标有不同类型荧光基团的探针可分别用于对链霉素耐药基因rpsl突变密码子43、88和rrs基因突变碱基514、517、906、907、908、916、918耐药突变位点进行检测。通过荧光pcr仪检测荧光信号,根据各通道检测的tm值或熔解峰判断模板是否发生突变。对于点突变类型,当模板为野生型时,探针与模板的匹配度最佳,tm值最高;若模板为纯突变型,探针与模板不能完全匹配,tm值下降;若模板为不均一突变则检测结果为两个熔解
峰。
[0112]
上述特异性引物和探针所制备的试剂盒,基于pcr平台可快速定性检测链霉素耐药突变,为结核病的辅助诊断提供有效的技术指导。
[0113]
本发明还公开了基于荧光pcr熔解曲线法的结核分枝杆菌链霉素耐药突变检测试剂盒,包括用于配制pcr反应液的引物探针混合液、5
×
dna buffer、热启动taq抗体酶、对照样本和纯化水。其中,引物探针混合液包括如下成分,如表2:
[0114]
表2引物探针混合液
[0115][0116]
所述pcr反应液的5
×
buffer包括如下成分,如表3:
[0117]
表3 5
×
rt buffer
[0118]
编号组分组分中的主要成分15
×
rt buffer(nh4)2so4、tris-hcl、mgcl2、tween-20
[0119]
所述对照品包括如下成分,如表4:
[0120]
表4对照样本
[0121][0122]
本发明提供的试剂盒优选的适用样本为结核病患者的结核分枝杆菌复合群阳性的痰液培养物。
[0123]
本发明提供的试剂盒用于判定检测有效性的标准为:待检样本tm值使用tm s表示,具体数值由仪器自动读取对应的反应孔得到。当检测峰型为单一熔解峰时,可直接通过计算阳性质控品tm w与待检样本对应通道tm s值的差值进行判读。若任一tb sm反应管中texas red、cy5、vic通道满足tm w-tm s≥2℃,则为结核分枝杆菌链霉素耐药突变阳性;反之,则为结核分枝杆菌链霉素耐药突变阴性。
[0124]
本发明提供的检测结核分枝杆菌链霉素耐药突变的方法采用的是pcr熔解曲线法,其检测原理如下:本试剂盒采用荧光pcr熔解曲线法,使用特异引物经pcr扩增得到与探针序列互补的单链寡核苷酸序列,在扩增完成后进行熔解曲线分析,通过荧光pcr仪检测荧
光信号,然后仪器软件系统通过计算各荧光通道的荧光值与温度的负导数自动绘制熔解曲线,并得到熔解峰及熔点(tm),根据各通道检测的熔点或熔解峰判断模板是否发生突变。对于点突变类型,当模板为野生型时,探针与模板的匹配度最佳,tm值最高;若模板为纯突变型,探针与模板不能完全匹配,tm值下降;若模板为不均一突变则检测结果为两个熔解峰。此外,本试剂盒添加了防污组分(尿嘧啶dna糖基化酶,即udg/ung),其作用机理是选择性水解断裂含有du的双链或者单链dna中的尿嘧啶糖苷键,形成的有缺失碱基的dna链,在碱基介质以及高温下会进一步水解断裂,从而被消除。
[0125]
术语
[0126]
除非另有说明,否则本文所述的"引物"通常指与靶序列互补和退火的线性寡核苷酸。引物长度的下限按杂交能力而定,因为非常短的引物(例如小于5个核苷酸)在大多数杂交条件下不形成热力学稳定的双链体。引物长度通常在8~50个核苷酸内变化。在某些实施方案中,引物介于大约15~25个核苷酸之间。本文使用的术语"正向引物"是指与靶dna的一条特定链退火的寡核苷酸。本文使用的术语"反向引物"是指与靶dna的相反链退火的寡核苷酸。总之,正向引物和反向引物通常以类似于pcr引物的方式定向在靶dna序列上,使得其3'末端比其5'末端更接近靶序列。天然存在的核苷酸(尤其是鸟嘌呤、腺嘌呤、胞嘧啶和胸腺嘧啶,在下文称为"g"、"a"、"c"和"t")以及核苷酸类似物,都可用于本发明的引物。本文使用的术语“pcr引物”是指用于起始对核酸进行的pcr反应的寡核苷酸引物。
[0127]
除非另有说明,否则本文所述的"pcr产物"是指核酸模板,通过核酸pcr扩增而产生的扩增的核酸。
[0128]
除非另有说明,否则本文所述的“样本”包括含有核酸分子的任何样本。样本可来源于生物来源("生物样品"),倒如组织(例如活组织检查样品)、提取物或包括结核分枝杆菌的培养物和生物或生理流体,例如经固化处理的样品(如石蜡包埋样本)、全血、血浆、血清、唾液、脑髓液、汗液、痰、肺泡灌注液、尿液、粪便、分泌液、乳汁、腹膜液等。在本发明的一些实施例中,样本是痰。
[0129]
除非另有说明,否则本文中所述的“采样”为采集临床诊断为结核分枝杆菌复合群阳性的样本,例如采集临床诊断为结核分枝杆菌复合群阳性的人痰液样本。
[0130]
除非另有说明,否则本文中所述的“人痰液样本”包括即时痰、清晨痰和夜间痰,使用其中任意一种痰液样本培养即可。即时痰为患者就诊时深呼吸后咳出的痰液,清晨痰为清晨晨起立即用清水漱口后深咳出的痰液,夜间痰为送痰前一日夜间咳出的痰液,合格的痰液标本应是脓样、干酪样或脓性黏液样性质的痰液,痰量以3ml~5ml为宜。痰液标本应由检验人员或经培训合格的专人验收,痰液不合格者,要求重新送检;当难以获得合格标本时,也应进行细菌学检查,但应注明标本性状,以便分析结果时参考。对于当天不能制备培养的痰液标本应置2~8℃冰箱内保存,时间不能超过7天。痰液标本如需在机构之间运送应按照规定取得相关许可,然后冷藏运送。
[0131]
除非另有说明,否则本文中所述的“样本制备”指的是在培养基(例如罗氏固体培养基)上分离样本培养物,例如痰液样本培养物。在一个非限制地实施例中,所述样本为人痰液样本培养物,所述样本制备包括步骤:
[0132]
(1)样本处理
[0133]
采集临床诊断为结核分枝杆菌复合群阳性的痰液样本,抽取痰液样本至50ml离心
管中,按1~2倍的体积加入4%naoh,在漩涡振荡器上振荡1~2分钟使痰液充分匀化,置于生物安全柜静置15~20分钟。
[0134]
(2)分离培养:用吸管取4中制备的液化样本0.1ml,均匀接种在整个改良酸性罗氏培养基斜面,每份标本接种2支培养基。接种后将培养基斜面向上置于37
±
1℃恒温培养箱平放24小时后,检查培养基污染情况,拧紧瓶盖,直立放置继续培养。接种后第3天和第7天观察培养情况,发现菌落生长并经抗酸染色证实后可报告分枝杆菌生长。如没生长,此后每周观察一次,满8周后未见菌落生长,则报告培养阴性结果。
[0135]
(3)菌种鉴定
[0136]
取生长2周的分枝杆菌培养物置于玻璃磨菌器研磨,以生理盐水稀释,与标准麦氏比浊管比浊,配置成1mg/ml菌悬液,然后梯度稀释到0.01mg/ml。用22号标准接种环取一环(0.1ml),分别接种到对硝基苯甲酸和改良酸性罗氏培养基。37
±
1℃恒温培养箱,每周观察一次。快速生长的非结核分枝杆菌一周左右可见菌落,而结核分枝杆菌生长缓慢,约4周报告结果,结核分枝杆菌复合群在对硝基苯甲酸上不生长。
[0137]
(4)取样
[0138]
用22号标准接种环刮取一环改良酸性罗氏培养基培养4周后生长的菌落,注意尽量刮取多个菌落,然后置于200μl生理盐水中。重复取样3管,记录好患者姓名、编号、检查项目、痰液标本序号及送检日期。
[0139]
上述步骤(4)所得样本的短期保存可以置2-8℃冰箱内保存,但时间不超过7天;长期保存可以将结核分枝杆菌培养物菌液经离心沉淀后,去上清,悬浮于oadc保存液(含0.5%吐温80和50%丙三醇)中,-70℃或以下保存。
[0140]
为使本发明实施例的目的、技术方案和优点更加清楚,下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。以下实施例中所用的实验材料和试剂如无特别说明均可从市售渠道获得。
[0141]
除非另有指明,本文所用的技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义,需要注意的是,本文所用的术语仅为了描述具体实施方式,而非意图限制本技术的示例性实施方式。
[0142]
实施例1、结核分枝杆菌链霉素耐药突变的检测试剂盒和检测方法
[0143]
(1)样本采集及制备
[0144]
临床诊断为结核分枝杆菌复合群阳性的人痰液样本,并在培养基(例如罗氏固体培养基)上分离痰液样本培养物。
[0145]
(2)核酸提取(样本处理区)
[0146]
采用广州达安基因股份有限公司生产的核酸提取或纯化试剂(粤穗械备20181263号),具体的操作步骤详见试剂说明书。
[0147]
(3)pcr反应体系的配置(试剂准备区)
[0148]
反应体系构成如表5
[0149]
表5反应体系
[0150][0151][0152]
结核分枝杆菌链霉素耐药突变检测试剂盒的组成成分、包装及数量(以24人份/盒为例),如表6:
[0153]
表6试剂盒的组成成分、包装及数量
[0154][0155]
从结核分枝杆菌链霉素耐药突变检测试剂盒中取出pcr引物和探针反应混合液和酶系置于室温融化后振荡混匀,8,000rpm离心数秒后使用。取2n个(n=待测样本个数+阴性质控品+阳性质控品)pcr反应管。分别按照下表反应体系的用量,计算需要配制的各反应管总量,并分别配制成混合液。
[0156]
pcr反应管体系(1人份)
[0157]
引物探针混合液酶系总体积16μl4μl20μl
[0158]
将各管各组分充分混合后进行短时离心,以使管壁上的液体全部离心至管底,之后分别将20μl扩增体系分装到pcr管中。
[0159]
(3)加样(样本制备区)
[0160]
往上述配制的pcr反应管中分别依次加入5μl提取后的待测样本核酸、阴性质控品、阳性质控品。盖紧管盖,8000rpm瞬时离心后转移至扩增检测区。
[0161]
(4)pcr检测(扩增检测区)
[0162]
将反应管放入样品槽中,点击close lid盖上盖子。
[0163]
bio-rad cfx 96deep well dx system仪器设置:
[0164]
在bio-rad软件的主界面依次点击“file
”→“
new
”→“
protocol”,之后到“protocol editor”界面,并在此界面左边的列表里根据试剂盒的上机程序(表7)设置,反应体系体积设置为25μl,设置好后点击右下方的ok键。
[0165]
表7
[0166][0167]
进入“run setup”的界面,点击“plate”,进入反应板的设置界面,在此界面下首先点击“create new”,进入“plate editor”界面,再按照加样的位置顺序设定样品名称、类型,包括待检样本、阴性质控品、阳性质控品,并在右边列表里点击“select fluorophores”,选择“vic”,“texas red”,“cy5”通道。
[0168]
点击ok,并根据对话框提示保存plate的设置文件,之后显示“run setup”的界面,点击“start run”,根据对话框提示将文件保存,开始运行程序。
[0169]
反应结束后自动保存结果,在“data analysis”界面的工具栏显示不同的分析,点击“melt curve”可查看熔解曲线,求导后的熔解峰以及各荧光通道的tm值,根据勾选不同的通道对各个通道进行分析。
[0170]
实施例2、特异性检测
[0171]
用本发明实施例1的试剂盒和检测方法检测6份链霉素敏感型企业参考品(编号分别为n1-n6,分别为rpsl基因耐药决定区野生型、rrs基因耐药决定区野生型、rpsl-53(gcc-tct)突变型、rpsl-73(aac-agc)突变型、rrs-554(a-c)突变型、rrs-850(c-a)突变型均为结核分枝杆菌链霉素耐药突变基因质粒模拟菌株经提取核酸制备而成,经测序确认。)和3份结核阴性参考品(编号分别为c1-c3),特异性检测结果如表8所示。
[0172]
表8敏感型企业参考品检测结果
[0173]
编号检测结果n1突变阴性n2突变阴性n3突变阴性n4突变阴性n5突变阴性n6突变阴性c1结核阴性(图1)c2结核阴性(图2)c3结核阴性(图3)
[0174]
根据上表8所示结果,各链霉素敏感型参考品检出结果均为阴性,表明本发明试剂盒的特异性高。
[0175]
实施例3、准确性检测
[0176]
用本发明实施例1的试剂盒检测9份链霉素耐药型企业参考品(编号分别为p1-p9,分别为rpsl-43(aag-agg)、rpsl-88(aag-agg)、rrs-514(a-c)突变型、rrs-517(c-t)突变型、rrs-906(a-g)突变型、rrs-907(a-t)突变型、rrs-908(a-g)突变型、rrs-916(a-g)突变型、rrs-918(g-a)均为结核分枝杆菌链霉素耐药突变基因质粒模拟菌株经提取核酸制备而成,经测序确认)。对于链霉素耐药位点分别有rpsl基因的43位点密码子突变,88位点密码子突变和rrs基因的514、517、906、907、908、916和918位点碱基突变。结果如表9所示。
[0177]
表9耐药企业参考品检测结果
[0178][0179]
根据上表9所述结果,各链霉素耐药型企业参考品检测结果阳性率为100%,表明本发明试剂盒的准确性高,符合要求。
[0180]
实施例4、灵敏度检测
[0181]
用本发明实施例1的试剂盒检测链霉素耐药分枝杆菌最低检出量(浓度为1
×
104个菌/ml)。企业参考品共8份(编号分别为s1-s8,分别为rpsl-43(aag-agg)、rpsl-88(aag-agg)、rrs-514(a-c)突变型、rrs-517(c-t)突变型、rrs-906(a-g)突变型、rrs-907(a-t)突变型、rrs-908(a-g)突变型、rrs-918(g-a)均为结核分枝杆菌链霉素耐药突变基因质粒模拟菌株经提取核酸制备而成,经测序确认)。8份参考品由已定值的1
×
106个菌/ml人工合成的结核分枝杆菌链霉素耐药突变基因质粒,用1
×
te进行稀释至终浓度为1
×
104个菌/ml。检测结果如表10所示。
[0182]
表10最低检出限参考品检测结果
[0183][0184][0185]
根据上表10所述结果,低浓度下(1
×
104个菌/ml)链霉素耐药型企业参考品检测
结果阳性率为100%,表明本发明试剂盒的灵敏度检测符合要求。
[0186]
对比例1
[0187]
本发明人针对链霉素耐药基因目标序列设计了数对引物和数条探针,期望能够获得扩增效果好,灵敏度高,准确率高的引物组和检测探针。
[0188]
由于引物特异性差异、退火温度不一致、以及引物二聚体等原因,不同引物探针组合对于试剂检测灵敏度影响较大,很难获得较优的pcr扩增引物以及探针序列。而且,如果引物探针体系内的各序列存在相互影响,会导致熔解曲线线型变差,甚至无法获得熔解曲线。本发明人通过大量的实验,对设计的引物和探针进行优化选择并验证,最终确定了可以用于本试剂盒所采用的引物、探针序列及其组合。
[0189]
实验中发现,即使在已经基本确定针对各目标核酸的引物对和探针序列的情况下,不同引物对组合进行多重扩增的效果也存在显著差异。
[0190]
例如,使用如下表11和12的对照引物探针体系对阳性样本进行检测,其它检测步骤和条件同上述实施例:
[0191]
表11对照引物探针体系1
[0192][0193][0194]
表12对照引物探针体系2
[0195][0196]
使用上述对照引物探针体系1和对照引物探针体系2,按照实施例4的方法进行灵敏度检测。样品浓度为1
×
104个菌/ml时,对照引物1(图13)和2(图14)均无法得到熔解曲线,灵敏度差。
[0197]
本领域的普通技术人员可以理解,上述各实施方式是实现本发明的具体实施例,而在实际应用中,可以在形式上和细节上对其作各种改变,而不偏离本发明的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1