靶向B细胞成熟抗原的嵌合抗原受体的制作方法
靶向b细胞成熟抗原的嵌合抗原受体
发明领域
1.本发明涉及嵌合抗原受体(car)。car能够利用配体结合结构域的性质将免疫细胞的特异性和反应性重新定向至选定靶点。特别地,本发明涉及特异性结合b细胞成熟抗原的car(bcma特异性car)。本发明还涉及编码bcma特异性car的多核苷酸和在其表面表达bcma特异性car的分离的细胞。本发明还涉及改造免疫细胞在其表面表达bcma特异性car的方法。本发明特别有益于治疗b细胞淋巴瘤和白血病。本发明还涉及包括bcma特异性car的免疫细胞(bcma特异性car-t细胞)、包括bcma特异性car-t细胞的组合物、和使用该bcma特异性car-t细胞用于治疗与表达bcma的恶性细胞相关的病症(例如癌症)的方法。
2.发明背景
3.多发性骨髓瘤是以克隆浆细胞的积累为特征的恶性肿瘤(参见例如lonial et al.,clinical cancer res.,77(6):1264-1277(2011))。mm目前的治疗方法通常会导致缓解,但几乎所有的患者最终都会复发和死亡(参见例如rajkumar,nature rev.clinical oncol,5(8):479-491(2011))。
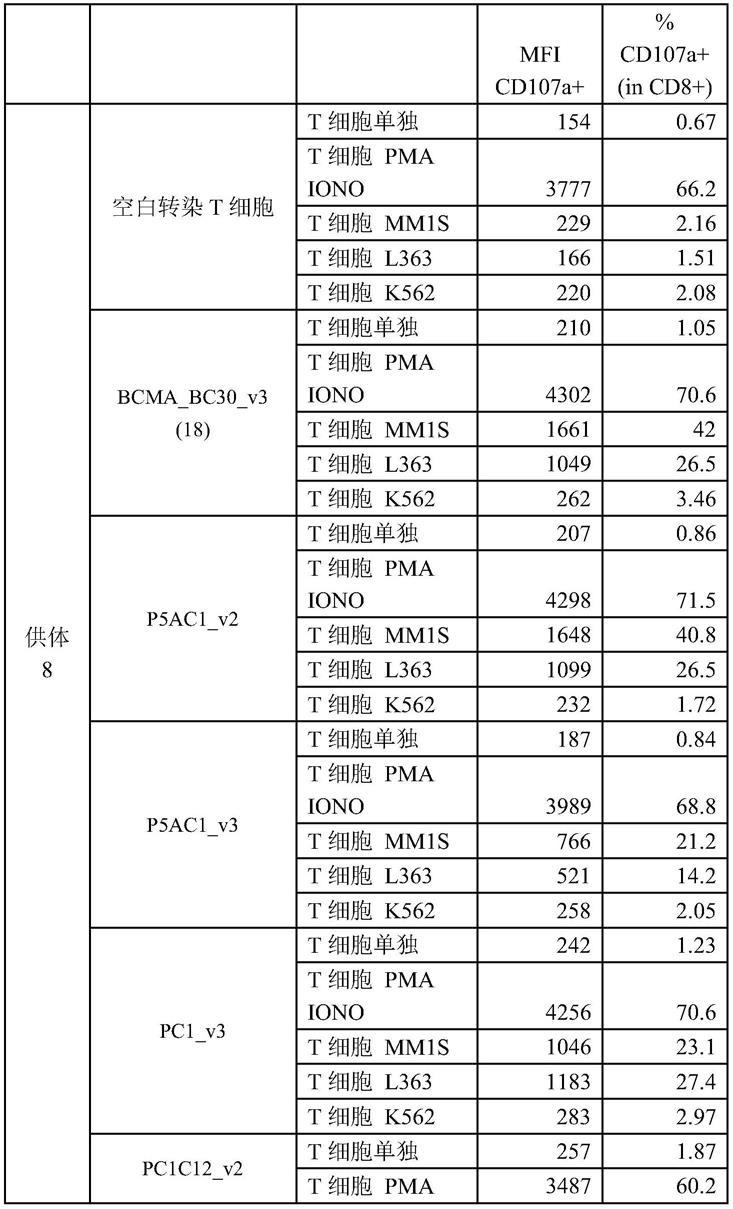
4.经过遗传修饰以识别恶性肿瘤相关抗原的t细胞的过继转移显示出作为治疗癌症的新方法的希望(参见例如brenner et al.,current opinion in immunology,22(2):251-257(2010);rosenberg et al.,nature reviews cancer,8(4):299-308(2008))。t细胞可被遗传修饰以表达嵌合抗原受体(car),其是由抗原识别部分和t细胞活化结构域组成的融合蛋白(参见例如eshhar et al.,proc.natl.acad.sci.usa,90(2):720-724(1993),and sadelain et al.,curr.opin.immunol,21(2):215-223(2009))。
5.b细胞成熟抗原(bcma、cd269或tnfrsf17)是肿瘤坏死因子受体(tnfr)超家族的成员。bcma在含有t(4;16)易位的恶性人t细胞淋巴瘤中被鉴定出。该基因在b细胞谱系中选择性表达,其中在浆母细胞和抗体分泌细胞的浆细胞中表达最高。bcma结合两种配体,分别是具有1um亲和力的b细胞激活因子(baff)(也称为b淋巴细胞刺激因子(blys)和apol相关白细胞表达配体(tall-1))和具有16nm亲和力的增殖诱导配体(april)。april或baff与bcma的结合促进涉及nf-κb、elk-1、c-jun n-末端激酶和p38丝裂原活化蛋白激酶的信号级联放大,其产生细胞存活和增殖的信号。bcma也表达于恶性b细胞和涉及b淋巴细胞的几种癌症,包括多发性骨髓瘤、浆细胞瘤、霍奇金淋巴瘤、和慢性淋巴细胞性白血病。在浆母细胞参与的诸如系统性红斑狼疮(sle)和类风湿性关节炎等自身免疫性疾病中,表达bcma的抗体生成细胞分泌攻击自身的自身抗体。
6.在多发性骨髓瘤的情况下,每年在美国新诊断出约24,000例新病例,这一数字占美国新诊断的血液癌的约15%。平均每年11,000人死于多发性骨髓瘤,平均5年生存率约44%,存活中位数为50-55个月。目前多发性骨髓瘤的治疗主要集中在浆细胞凋亡和/或降低破骨细胞活性(例如,化疗、沙利度胺、来那度胺、双膦酸盐和/或蛋白酶体抑制剂如硼替佐米或卡非佐米)。然而,多发性骨髓瘤仍然是不治之症,几乎所有患者都发展出对这些药物的耐药性并最终复发。因此,多发性骨髓瘤的替代治疗,例如使用包括bcma特异性car和bcma特异性car-t细胞的抗bcma拮抗剂,将成为优异的治疗剂。
cdr2;和(iii)含有seq id no:222、225、227、253、263、272、216或214所示序列的vl cdr3。
12.在一些实施方案中,本文提供的bcma特异性car的细胞外配体结合结构域结构域包括(a)重链可变(vh)区,其包括(i)含有seq id no:150、151或152所示序列的vh互补决定区1(cdr1);(ii)含有153或154所示序列的vh cdr2;和(iii)含有155所示序列的vh cd3;和/或(b)轻链可变区(vl),其包括(i)含有seq id no:209所示序列的vl cdr1;(ii)含有seq id no:221所示序列的vl cdr2,和(iii)含有seq id no:222所示序列的vl cdr2。
13.在一些实施方案中,本文提供的bcma特异性car的细胞外配体结合结构域结构域包括(a)重链可变(vh)区,其包括(i)含有seq id no:150、151或152所示序列的vh互补决定区1(cdr1);(ii)含有187或188所示序列的vh cdr2;和(iii)含有155所示序列的vh cd3;和/或(b)轻链可变区(vl),其包括(i)含有seq id no:249所示序列的vl cdr1;(ii)含有seq id no:221所示序列的vl cdr2,和(iii)含有seq id no:225所示序列的vl cdr3。
14.在一些实施方案中,本文提供的bcma特异性car的细胞外配体结合结构域结构域包括(a)重链可变(vh)区,其包括(i)含有seq id no:150、151或152所示序列的vh互补决定区1(cdr1);(ii)含有165或166所示序列的vh cdr2;和(iii)含有155所示序列的vh cd3;和/或(b)轻链可变区(vl),其包括(i)含有seq id no:226所示序列的vl cdr1;(ii)含有seq id no:221所示序列的vl cdr2,和(iii)含有seq id no:227所示序列的vl cdr3。
15.在一些实施方案中,本文提供的bcma特异性car的细胞外配体结合结构域结构域包括(a)重链可变(vh)区,其包括(i)含有seq id no:156、151或157所示序列的vh互补决定区1(cdr1);(ii)含有162或159所示序列的vh cdr2;和(iii)含有161所示序列的vh cd3;和/或(b)轻链可变区(vl),其包括(i)含有seq id no:251所示序列的vl cdr1;(ii)含有seq id no:252所示序列的vl cdr2,和(iii)含有seq id no:253所示序列的vl cdr3。
16.在一些实施方案中,本文提供的bcma特异性car的细胞外配体结合结构域结构域包括(a)重链可变(vh)区,其包括(i)含有seq id no:156、151或157所示序列的vh互补决定区1(cdr1);(ii)含有190或191所示序列的vh cdr2;和(iii)含有161所示序列的vh cd3;和/或(b)轻链可变区(vl),其包括(i)含有seq id no:262所示序列的vl cdr1;(ii)含有seq id no:252所示序列的vl cdr2,和(iii)含有seq id no:263所示序列的vl cdr3。
17.在一些实施方案中,本文提供的bcma特异性car的细胞外配体结合结构域结构域包括(a)重链可变(vh)区,其包括(i)含有seq id no:150、151或152所示序列的vh互补决定区1(cdr1);(ii)含有169或154所示序列的vh cdr2;和(iii)含有155所示序列的vh cd3;和/或(b)轻链可变区(vl),其包括(i)含有seq id no:271所示序列的vl cdr1;(ii)含有seq id no:221所示序列的vl cdr2,和(iii)含有seq id no:272所示序列的vl cdr3。
18.在一些实施方案中,本文提供的bcma特异性car的细胞外配体结合结构域结构域包括(a)重链可变(vh)区,其包括(i)含有seq id no:129、130或131所示序列的vh互补决定区1(cdr1);(ii)含有139或140所示序列的vh cdr2;和(iii)含有134所示序列的vh cd3;和/或(b)轻链可变区(vl),其包括(i)含有seq id no:217所示序列的vl cdr1;(ii)含有seq id no:210所示序列的vl cdr2,和(iii)含有seq id no:216所示序列的vl cdr3。
19.在一些实施方案中,本文提供的bcma特异性car的细胞外配体结合结构域结构域包括(a)重链可变(vh)区,其包括(i)含有seq id no:129、130或131所示序列的vh互补决定区1(cdr1);(ii)含有132或133所示序列的vh cdr2;和(iii)含有137所示序列的vh cd3;
和/或(b)轻链可变区(vl),其包括(i)含有seq id no:377所示序列的vl cdr1;(ii)含有seq id no:210所示序列的vl cdr2,和(iii)含有seq id no:214所示序列的vl cdr3。
20.在一些实施方案中,细胞内信号转导结构域包括cd3ζ信号转导结构域。在一些实施方案中,细胞内信号转导结构域包括4-1bb结构域。在一些实施方案中,car可以进一步包括另一细胞内信号转导结构域。在一些实施方案中,所述额外的细胞内信号转导结构域可以包括4-1bb结构域。
21.在一些实施方案中,car可以包括在细胞外配体结合结构域和第一跨膜结构域之间的茎结构域(stalk domain)。在一些实施方案中,茎结构域可以选自:人cd8α铰链、igg1铰链和fcγriiiα铰链。
22.在一些实施方案中,第一跨膜结构域可以包括cd8α链跨膜结构域。
23.在一些实施方案中,car可以包括cd20表位。
24.在一些实施方案中,car可以包括不特异性针对bcma的另一细胞外配体结合结构域。
25.在一些实施方案中,bcma特异性car可以包括如seq id no:396所示的氨基酸序列。
26.在car的一些实施方案中,细胞外配体结合结构域、第一跨膜结构域和细胞内信号转导结构域位于单个多肽上。
27.在一些实施方案中,car可以包括第二跨膜结构域,其中第一跨膜结构域和细胞外配体结合结构域位于第一多肽上,并且其中第二跨膜结构域和细胞内信号转导结构域位于第二多肽,其中第一跨膜结构域包括来自高亲和力ige受体(fcεri)的α链的跨膜结构域,第二跨膜结构域包括来自fcεri的γ或β链的跨膜结构域。在一些实施方案中,car可以包括第三多肽,其包括融合到来自共刺激分子的细胞内信号转导结构域的第三跨膜结构域,其中第三跨膜结构域包括来自fcεri的γ或β链的跨膜结构域。
28.在另一方面,本发明提供了分离的多核苷酸,其包括编码如本文所述的bcma特异性car的核酸序列。
29.在另一方面,本发明提供了表达载体,其包括编码如本文所述的bcma特异性car抗体的核酸序列。
30.在另一方面,本发明提供了经改造的免疫细胞,其在细胞表面膜表达本文所述的bcma特异性car。在一些实施方案中,经改造的免疫细胞可以包括不特异性针对bcma的另一car。在一些实施方案中,经改造的免疫细胞可以包括编码自杀多肽的多核苷酸。在一些实施方案中,自杀多肽是rqr8。
31.在一些实施方案中,免疫细胞可以衍生自炎性t淋巴细胞、细胞毒性t淋巴细胞、调节性t淋巴细胞或辅助性t淋巴细胞。
32.在一些实施方案中,经改造的免疫细胞可以包括破坏一个或多个内源基因,其中所述内源基因编码tcrα、tcrβ、cd52、糖皮质激素受体(gr)、脱氧胞苷激酶(dck)、或免疫检查点蛋白,例如程序性死亡-1(pd-1)。
33.在一些实施方案中,免疫细胞得自健康供体。在一些实施方案中,免疫细胞得自患者。
34.在另一方面,本发明提供了在细胞表面膜上表达本文所述的bcma特异性car的经
改造的免疫细胞,其作为药物使用。在一些实施方案中,该药物用于治疗选自以下的b细胞相关癌症:多发性骨髓瘤、恶性浆细胞肿瘤(malignant plasma cell neoplasm)、霍奇金淋巴瘤(hodgkin’s lymphoma)、结节性淋巴细胞优势型霍奇金淋巴瘤(nodular lymphocyte predominant hodgkin’s lymphoma)、卡勒氏病和骨髓瘤(kahler’s disease and myelomatosis)、浆细胞白血病(plasma cell leukemia)、浆细胞瘤(plasmacytoma)、b细胞幼淋巴细胞白血病(b-cell prolymphocytic leukemia)、毛细胞白血病(hairy cell leukemia)、b细胞非霍奇金淋巴瘤(nhl)、急性髓细胞性白血病(aml)、慢性淋巴细胞性白血病(cll)、急性淋巴细胞白血病(all)、慢性髓细胞性白血病(cml)、滤泡性淋巴瘤(follicular lymphoma)、伯基特氏淋巴瘤(burkitt’s lymphoma)、边缘区淋巴瘤(marginal zone lymphoma)、套细胞淋巴瘤(mantle cell lymphoma)、大细胞淋巴瘤(large cell lymphoma)、前体b淋巴母细胞淋巴瘤(precursor b-lymphoblastic lymphoma)、骨髓性白血病(myeloid leukemia)、瓦尔登斯特伦氏巨球蛋白血症(waldenstrom’s macroglobulienemia)、弥漫性大b细胞淋巴瘤(diffuse large b cell lymphoma)、滤泡性淋巴瘤(follicular lymphoma)、边缘区淋巴瘤(marginal zone lymphoma)、粘膜相关淋巴组织淋巴瘤(mucosa-associated lymphatic tissue lymphoma)、小细胞淋巴细胞淋巴瘤(small cell lymphocytic lymphoma)、套细胞淋巴瘤(mantle cell lymphoma)、伯基特淋巴瘤(burkitt lymphoma)、原发性纵隔(胸腺)大b细胞淋巴瘤(primary mediastinal(thymic)large b-cell lymphoma)、淋巴瘤浆细胞淋巴瘤(lymphoplasmactyic lymphoma)、巨球蛋白血症(macroglobulinemia)、淋巴结边缘区b细胞淋巴瘤(nodal marginal zone b cell lymphoma)、脾边缘区淋巴瘤(splenic marginal zone lymphoma)、血管内大b细胞淋巴瘤(intravascular large b-cell lymphoma)、原发性渗出性淋巴瘤(primary effusion lymphoma)、淋巴瘤样肉芽肿病(lymphomatoid granulomatosis)、t细胞/组织细胞丰富的大b细胞淋巴瘤(t cell/histiocyte-rich large b-cell lymphoma)、原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma)、原发性皮肤弥漫性大b细胞淋巴瘤(腿型)(primary cutaneous diffuse large b-cell lymphoma(leg type))、老年人ebv阳性弥漫性大b细胞淋巴瘤(ebv positive diffuse large b-cell lymphoma of the elderly)、炎症相关弥漫性大b细胞淋巴瘤(diffuse large b-cell lymphoma associated with inflammation)、血管内大b细胞淋巴瘤(intravascular large b-cell lymphoma)、alk阳性大b细胞淋巴瘤(alk-positive large b-cell lymphoma)、浆母细胞淋巴瘤(plasmablastic lymphoma)、hhv8相关多中心castleman病引起的大b细胞淋巴瘤(large b-cell lymphoma arising in hhv8-associated multicentric castleman disease)、具有弥漫性大b细胞淋巴瘤和伯基特淋巴瘤之间的中间特征的未分类b细胞淋巴瘤(b-cell lymphoma unclassified with features intermediate between diffuse large b-cell lymphoma and burkitt lymphoma)、具有弥漫性大b-细胞淋巴瘤和经典霍奇金淋巴瘤的中间特征的未分类b细胞淋巴瘤(b-cell lymphoma unclassified with features intermediate between diffuse large b-cell lymphoma and classical hodgkin lymphoma)、以及其他b细胞相关淋巴瘤。
35.在另一方面,本发明提供了一种改造免疫细胞的方法,其包括:提供免疫细胞;并
在细胞表面表达至少一种如本文所述的bcma特异性car。
36.在一些实施方案中,该方法包括:提供免疫细胞;将至少一种编码所述bcma特异性car的多核苷酸引入细胞;并将所述多核苷酸表达于细胞中。
37.在一些实施方案中,该方法包括提供免疫细胞;将至少一种编码所述bcma特异性car的多核苷酸引入细胞;并引入至少一种不特异性针对bcma的其他car。
38.在另一方面,本发明提供了治疗患有与恶性细胞相关的病症的对象的方法,该方法包括:提供在表面表达本文所述的bcma特异性car的免疫细胞;以及向所述患者施用所述免疫细胞。
39.在另一方面,本发明提供药物组合物,其包括本文所述的经改造的免疫细胞。
40.在另一方面,本发明提供了治疗对象中与表达bcma的恶性细胞相关的病症的方法,包括向对其有需要的对象施用有效量的如权利要求的包括本文所述经改造的免疫细胞的药物组合物。在一些实施方案中,该病症是癌症。在一些实施方案中,该癌症是选自以的b细胞相关癌症:多发性骨髓瘤、恶性浆细胞肿瘤、霍奇金淋巴瘤、结节性淋巴细胞优势型霍奇金淋巴瘤、卡勒氏病和骨髓瘤、浆细胞白血病、浆细胞瘤、b细胞幼淋巴细胞白血病、毛细胞白血病、b细胞非霍奇金淋巴瘤(nhl)、急性髓细胞性白血病(aml)、慢性淋巴细胞性白血病(cll)、急性淋巴细胞白血病(all)、慢性髓细胞性白血病(cml)、滤泡性淋巴瘤、伯基特氏淋巴瘤、边缘区淋巴瘤、套细胞淋巴瘤、大细胞淋巴瘤、前体b淋巴母细胞淋巴瘤、骨髓性白血病、瓦尔登斯特伦氏巨球蛋白血症、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤、边缘区淋巴瘤、粘膜相关淋巴组织淋巴瘤、小细胞淋巴细胞淋巴瘤、套细胞淋巴瘤、伯基特淋巴瘤、原发性纵隔(胸腺)大b细胞淋巴瘤、淋巴瘤浆细胞淋巴瘤、巨球蛋白血症、淋巴结边缘区b细胞淋巴瘤、脾边缘区淋巴瘤、血管内大b细胞淋巴瘤、原发性渗出性淋巴瘤、淋巴瘤样肉芽肿病、t细胞/组织细胞丰富的大b细胞淋巴瘤、原发性中枢神经系统淋巴瘤、原发性皮肤弥漫性大b细胞淋巴瘤(腿型)、老年人ebv阳性弥漫性大b细胞淋巴瘤、炎症相关弥漫性大b细胞淋巴瘤、血管内大b细胞淋巴瘤、alk阳性大b细胞淋巴瘤、浆母细胞淋巴瘤、hhv8相关多中心castleman病引起的大b细胞淋巴瘤、具有弥漫性大b细胞淋巴瘤和伯基特淋巴瘤之间的中间特征的未分类b细胞淋巴瘤、具有弥漫性大b-细胞淋巴瘤和经典霍奇金淋巴瘤的中间特征的未分类b细胞淋巴瘤、以及其他b细胞相关淋巴瘤。
41.在另一方面,本发明提供了在具有表达bcma的恶性细胞的对象中抑制肿瘤生长或发展的方法,包括向对其有需要的对象施用有效量的如权利要求的包括本文所述经改造的免疫细胞的药物组合物。
42.在另一方面,本发明提供了在对象中抑制表达bcma的恶性细胞的转移的方法,包括向对其有需要的对象施用有效量的包括本文所述的经改造的免疫细胞的药物组合物。
43.在另一方面,本发明提供了在具有表达bcma的恶性细胞的对象中诱导肿瘤消退方法,包括向对其有需要的对象施用有效量的包括本文所述经改造的免疫细胞的药物组合物。
44.在一些实施方案中,上述任一方法进一步包括施用一种或多种其它疗法,例如单克隆抗体和/或化疗药物。在一些实施方案中,单克隆抗体可以是例如结合检查点抑制剂的抗体,例如抗pd-1抗体或抗pd-l1抗体。在一些实施方案中,上述任一方法还包括向对象施用核苷类似物的治疗,例如氟达拉滨(fludarabine)或氯法拉滨(clofarabine)。
45.附图简述
46.图1描述的图是在mm1.s肿瘤模型中用bcma特异性car-t治疗结果的总结。
47.图2描述的图是在molp8肿瘤模型中用bcma特异性car-t治疗结果的总结。
48.发明详述
49.本文公开的发明提供了嵌合抗原受体(car)和包括特异性结合bcma(例如人bcma)的car的免疫细胞(car-t细胞)。本发明还提供了编码这些car的多核苷酸、包括这些car-t细胞的组合物、以及制备和使用这些car和car-t细胞的方法。本发明还提供了治疗对象中与恶性bcma表达相关的病症例如癌症的方法。
50.通用技术
51.除非另有说明,本发明的实践将采用本领域技术范围内的分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学和免疫学的常规技术。这些技术在文献中被完全解释,例如,molecular cloning:a laboratory manual,second edition(sambrook et al.,1989)cold spring harbor press;oligonucleotide synthesis(m.j.gait,ed.,1984);methods in molecular biology,humana press;cell biology:a laboratory notebook(j.e.cellis,ed.,1998)academic press;animal cell culture(r.i.freshney,ed.,1987);introduction to cell and tissue culture(j.p.mather and p.e.roberts,1998)plenum press;cell and tissue culture:laboratory procedures(a.doyle,j.b.griffiths,and d.g.newell,eds.,1993-1998)j.wiley and sons;methods in enzymology(academic press,inc.);handbook of experimental immunology(d.m.weir and c.c.blackwell,eds.);gene transfer vectors for mammalian cells(j.m.miller and m.p.calos,eds.,1987);current protocols in molecular biology(f.m.ausubel et al.,eds.,1987);pcr:the polymerase chain reaction,(mullis et al.,eds.,1994);current protocols in immunology(j.e.coligan et al.,eds.,1991);short protocols in molecular biology(wiley and sons,1999);immunobiology(c.a.janeway and p.travers,1997);antibodies(p.finch,1997);antibodies:a practical approach(d.catty.,ed.,irl press,1988-1989);monoclonal antibodies:a practical approach(p.shepherd and c.dean,eds.,oxford university press,2000);using antibodies:a laboratory manual(e.harlow and d.lane(cold spring harbor laboratory press,1999);the antibodies(m.zanetti and j.d.capra,eds.,harwood academic publishers,1995)。
52.定义
53.本文所用的术语“细胞外配体结合结构域”是指能够结合配体的寡肽或多肽。优选地,该结构域将能够与细胞表面分子相互作用。例如,可以选择细胞外配体结合结构域来识别作为与特定疾病状态相关的靶细胞细胞表面标志物的配体。
54.术语“茎结构域”或“铰链结构域”在本文中可互换使用,是指作用为将跨膜结构域与细胞外配体结合结构域连接起来的任何寡肽或多肽。特别地,茎结构域用于为细胞外配体结合结构域提供更多的灵活性和可接近性。
55.术语“细胞内信号转导结构域”是指转导效应信号功能信号并引导细胞进行专门的功能的蛋白质部分。
56.本文所用的“共刺激分子”是指t细胞上的同源结合配偶体,其与共刺激配体特异性结合,从而介导细胞的共刺激反应,例如但不限于增殖。共刺激分子包括但不限于mhc i类分子、btla和toll配体受体。共刺激分子的实施例包括cd27、cd28、cd8、4-1bb(cd137)、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3和与cd83等特异性结合的配体。
[0057]“共刺激配体”是指抗原呈递细胞上的分子,其特异性结合t细胞上同源共刺激信号分子,从而除了提供主要信号之外,还提供以下的信号:例如tcr/cd3复合物与负载肽的mhc分子的结合、介导t细胞应答,包括但不限于增殖激活、分化等。共刺激配体可以包括但不限于cd7、b7-1(cd80)、b7-2(cd86)、pd-l1、pd-l2、4-1bbl、ox40l、诱导型共刺激配体(icos-l)、细胞间粘附分子(icam、cd30l、cd40、cd70、cd83、hla-g、mica、m1cb、hvem、淋巴毒素β受体、3/tr6、ilt3、ilt4、结合toll配体受体的激动剂或抗体和特异性结合b7-h3的配体。共刺激配体还特别包括与t细胞上存在的共刺激分子特异性结合的抗体,例如但不限于cd27、cd28、4bbb、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、ltght、nkg2c、b7-h3、与cd83特异性结合的配体。
[0058]“抗体”是能够通过位于免疫球蛋白分子可变区的至少一个抗原识别位点特异性结合靶(如碳水化合物、多核苷酸、脂质、多肽等)的免疫球蛋白分子。如本文所用,该术语不仅包括完整的多克隆或单克隆抗体,而且包括其片段(例如fab、fab'、f(ab')2、fv)、单链(scfv)和结构域抗体(包括例如鲨鱼和骆驼抗体)、以及包括抗体的融合蛋白、以及包括抗原识别位点的任何其它修饰构型的免疫球蛋白分子。抗体包括任何类型的抗体,例如igg、iga或igm(或其亚类),并且抗体不需要属于任何特定的类型。取决于抗体重链恒定区的氨基酸序列,免疫球蛋白可以分配到不同的类型。有五种主要类型的免疫球蛋白:iga、igd、ige、igg和igm,其中几种可进一步分为亚类(同种型),例如igg1、igg2、igg3、igg4、iga1和iga2。对应于不同类型的免疫球蛋白的重链恒定区分别被称为α、δ、ε、γ和μ。不同类型的免疫球蛋白的亚基结构和三维构型是众所周知的。
[0059]
本文使用的抗体的术语“抗原结合片段”或“抗原结合部分”是指完整抗体的一个或多个片段,其保留特异性结合给定抗原(例如bcma)的能力。抗体的抗原结合功能可以通过完整抗体的片段进行。术语抗体的“抗原结合片段”中包括的结合片段的实例包括fab、fab’、f(ab’)2、由vh和ch1结构域组成的fd片段、由抗体单臂的vl和vh结构域组成的fv片段、单结构域抗体(dab)片段(ward et al.,nature 341:544-546,1989)、和分离的互补决定区(cdr)。
[0060]
抗体、抗体缀合物或多肽与靶点(例如,bcma蛋白)“优先结合”或“特异性结合”(在本文中可互换使用)是本领域中熟知的术语,并且这种特异性结合或优先结合的确定也是本领域熟知的。如果分子与特定细胞或物质的反应或结合比与另外的细胞或物质更频繁、更迅速、持续时间更长和/或亲和力更高,则认为其展示了“特异性结合”或“优先结合”。如果抗体与靶点的结合比与另外的物质亲和力(affinity)更高、亲合力(avidity)更高、更容易、和/或持续时间更长,则展示了“特异性结合”或“优先结合”。例如,特异性或优先与bcma表位结合的抗体是这样的抗体,其结合该表位比结合其它bcma表位或非bcma表位具有更高的亲和力、亲合力、更容易和/或具有更长持续时间。还应当理解,通过阅读该定义,例如,特异性或优先结合第一靶点的抗体(或部分或表位)可能特异性地或优先地结合第二靶点或
可能不特异性地或不优先地结合第二靶点。因此,“特异性结合”或“优先结合”不一定需要(尽管它可以包括)专一结合。通常但不一定,提及结合意味着优先结合。
[0061]
抗体的“可变区”是指单独或组合的抗体轻链可变区或抗体重链可变区。如本领域已知的,重链和轻链的可变区各自由通过也称为高变区的三个互补决定区(cdr)连接的四个框架区(fr)组成。每个链中的cdr被fr紧密地保持在一起,并且与来自另一链的cdr一起,参与抗体的抗原结合位点的形成。至少有两种用于确定cdr的技术:(1)基于跨物种序列变异的方法(即kabat et al.sequences of proteins of immunological interest,(5th ed.,1991,national institutes of health,bethesda md));和(2)基于抗原-抗体复合物的晶体学研究方法(al-lazikani et al.,1997,j.molec.biol.273:927-948)。如本文所用,cdr可以指通过任一方法或两种方法的组合定义的cdr。
[0062]
可变结构域的“cdr”是可变区内的氨基酸残基,其根据kabat、chothia的定义、kabat和chothia两者的积累、abm、接触、和/或构象定义或任一本领域公知的cdr测定方法来鉴定。抗体cdr可以被鉴定为由kabat等人最初定义的高变区。参见例如kabat et al.,1992,sequences of proteins of immunological interest,5th ed.,public health service,nih,washington d.c.。cdr的位置也可以被鉴定为由chothia等人最初描述的结构环(structural loop)结构。参见例如chothia et al.,nature 342:877-883,1989。cdr鉴定的其他方法包括“abm定义”,其是kabat和chothia之间的折中,并且由使用oxford molecular's abm抗体建模软件(现在的)衍生,或者基于观察到的抗原接触的cdr“接触定义”,在maccallum et al.,j.mol.biol.,262:732-745,1996中提出。在另一种方法中,在本文中称为cdr的“构象定义”,cdr的位置可以被鉴定为对抗原结合产生焓贡献(enthalpic contribution)的残基。参见例如makabe et al.,journal of biological chemistry,283:1156-1166,2008。其他cdr边界定义可能不严格遵循上述方法之一,但是仍将与kabat cdr的至少一部分重叠,不过鉴于预测或实验发现特定的残基或残基组或甚至整个cdr不显著影响抗原结合,它们可能缩短或延长。如本文所用,cdr可以指由本领域已知的任一方法(包括方法的组合)定义的cdr。本文使用的方法可以利用根据任何这些方法定义的cdr。对于包括多于一个cdr的任何给定实施方案,cdr可以根据kabat、chothia、两者扩展、abm、接触和/或构象定义中的任何一个来定义。
[0063]
如本文所用,“单克隆抗体”是指得自基本上均一的抗体群的抗体,即组成群的单个抗体是相同的,除了可能少量存在的天然出现的突变。单克隆抗体是高度特异性的,针对单个抗原位点。此外,与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂相反,每种单克隆抗体针对抗原上的单一决定簇。修饰语“单克隆”指出了得自基本上均一的抗体群的抗体的特征,并且不应被解释为需要通过任何特定方法生产抗体。例如,根据本发明使用的单克隆抗体可以通过首先由kohler and milstein,nature 256:495,1975描述的杂交瘤方法制备,或者可以通过如美国专利号4,816,567描述的重组dna方法制备。单克隆抗体也可以从使用例如mccafferty et al.,nature 348:552-554,1990所描述的技术产生的噬菌体文库中分离出来。
[0064]
如本文所用,“人源化”抗体是指作为嵌合免疫球蛋白、免疫球蛋白链或其片段(例如fv,fab,fab',f(ab')2或抗体的其他抗原结合序列)的非人(例如鼠)抗体的形式,含有最少的来自非人免疫球蛋白的序列。优选地,人源化抗体是人免疫球蛋白(受体抗体),其中来
自受体的互补决定区(cdr)的残基被来自非人物种(例如小鼠、大鼠或兔)的具有所需的特异性、亲和力和能力的cdr(供体抗体)的残基替代。在一些情况下,人免疫球蛋白的fv构架区(fr)残基被相应的非人残基代替。此外,人源化抗体可以包括既不在受体抗体中也不在引入的cdr或框架序列中发现的残基,而是包括进一步改进和优化抗体性能的残基。通常,人源化抗体将包括基本上所有的至少一个、通常为两个的可变结构域,其中所有或基本上所有的cdr区域对应于那些非人免疫球蛋白,并且所有或基本上所有的fr区是人免疫球蛋白共有序列的那些。最佳地人源化抗体也将包括免疫球蛋白恒定区或结构域(fc)的至少一部分,通常是人免疫球蛋白的恒定区或结构域(fc)。优选的是具有如wo 99/58572中所描述修饰的fc区的抗体。其他形式的人源化抗体具有相对于原始抗体改变的一个或多个cdr(cdr l1、cdr l2、cdr l3、cdr h1、cdr h2或cdr h3),其也被称为一个或多个cdr“衍生自”一个或多个来自原始抗体的cdr。
[0065]
如本文所用,“人抗体”是指具有对应于由人产生的抗体的氨基酸序列的抗体、和/或已经使用本领域技术人员已知的或本文公开的用于制备人抗体的任何技术制备的抗体。人抗体的这种定义包括含有至少一个人重链多肽或至少一个人轻链多肽的抗体。一个这样的实例是含有鼠轻链和人重链多肽的抗体。可以使用本领域已知的各种技术制备人抗体。在一个实施方案中,从噬菌体文库选择人抗体,其中所述噬菌体文库表达人抗体(vaughan et al.,nature biotechnology,14:309-314,1996;sheets et al.,proc.natl.acad.sci.(usa)95:6157-6162,1998;hoogenboom and winter,j.mol.biol.,227:381,1991;marks et al.,j.mol.biol.,222:581,1991)。人抗体也可以通过免疫已经在内源性基因座的位置转基因引入人免疫球蛋白基因座的动物(例如内源性免疫球蛋白基因已经被部分或完全失活的小鼠)制备。这种方法在美国专利号5,545,807、5,545,806、5,569,825、5,625,126、5,633,425、和5,661,016中被描述。或者,人抗体可以通过使产生针对靶抗原的抗体的人b淋巴细胞永生来制备(此类b淋巴细胞可以从个体或从cdna的单细胞克隆中重新获得,或者可以被体外免疫)。参见例如cole et al.monoclonal antibodies and cancer therapy,alan r.liss,p.77,1985;boerner et al.,j.immunol.,147(1):86-95,1991和美国专利号5,750,373。
[0066]
术语“嵌合抗体”是指抗体的可变区序列衍生自一个物种并且恒定区序列衍生自另一个物种,例如抗体的可变区序列衍生自小鼠抗体并且恒定区序列衍生自人抗体。
[0067]
术语“多肽”、“寡肽”、“肽”和“蛋白质”在本文中可互换使用以指任何长度的氨基酸链,优选相对较短(例如10-100个氨基酸)。链可以是线性或分支的,其可以包括修饰的氨基酸,和/或可被非氨基酸中断。该术语还包括已经被天然修饰或干预的氨基酸链;例如二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何其它操作或修饰,例如与标记组分的缀合。定义中还包括例如含有氨基酸(包括例如非天然氨基酸等)的一种或多种类似物的多肽,以及本领域已知的其它修饰。应当理解,多肽可以以单链或联合的链存在。
[0068]“单价抗体”每分子包括一个抗原结合位点(例如igg或fab)。在一些情况下,单价抗体可以具有多于一个的抗原结合位点,但结合位点来自不同的抗原。
[0069]“二价抗体”每分子包括两个抗原结合位点(例如igg)。在一些情况下,两个结合位点具有相同的抗原特异性。然而,二价抗体可以是双特异性的。
[0070]“双特异性(bispecific)”,“双重特异性(dual-specific)”或“双功能”抗体是具
有两个不同抗原结合位点的杂合抗体。双特异性抗体的两个抗原结合位点结合两个不同的表位,所述表位可以存在于相同或不同的蛋白质靶上。
[0071]
本发明的抗体可以使用本领域已知的技术生产,例如重组技术、噬菌体展示技术、合成技术或这些技术的组合或本领域中容易已知的其它技术(参见例如jayasena,s.d.,clin.chem.,45:1628-50,1999and fellouse,f.a.,et al,j.moi.biol.,373(4):924-40,2007)。
[0072]
如本领域已知的,本文互换使用的“多核苷酸”或“核酸”是指任何长度的核苷酸链,并且包括dna和rna。核苷酸可以是脱氧核糖核苷酸、核糖核苷酸、修饰的核苷酸或碱基、和/或其类似物,或可通过dna聚合酶或rna聚合酶掺入链中的任何底物。多核苷酸可以包括修饰的核苷酸,例如甲基化核苷酸及其类似物。如果存在,核苷酸结构的修饰可以在链的组装之前或之后给予。核苷酸序列可能被非核苷酸组分中断。聚合后可以进一步修饰多核苷酸,例如通过与标记组分缀合。其他类型的修饰包括例如“帽”、用类似物取代一个或多个天然存在的核苷酸、核苷酸间修饰、例如那些不带电荷的键(例如,甲基膦酸酯、磷酸三酯、磷酰胺化物、氨基甲酸酯等)和带电荷的键(例如硫代磷酸酯、二硫代磷酸酯等)、含有附属部分(pendant moiety)如蛋白质(例如核酸酶、毒素、抗体、信号肽、聚-l-赖氨酸等)的那些、具有嵌入剂(例如,吖啶、补骨脂素等)的那些、那些含有的螯合剂(例如金属、放射性金属、硼、氧化金属等)、含有烷基化剂的那些、具有修饰的键的那些(例如,α异头核酸等)、以及未修饰形式的多核苷酸。此外,通常存在于糖中的任何羟基可以被例如膦酸酯基团、磷酸基团取代,被标准保护基团保护,或被活化以制备与额外的核苷酸的额外的键接,或者可以被缀合至固体支持物。5'和3'末端oh可以被磷酸化或被胺或1到20个碳原子的有机封端基团(capping group)部分取代。其它羟基也可以衍生成标准保护基团。多核苷酸还可以含有本领域通常已知的类似形式的核糖或脱氧核糖,包括例如2'-o-甲基-、2'-o-烯丙基、2'-氟代-或2'-叠氮基-核糖、碳环糖类似物、α-或β-异头核糖、差向异构糖例如阿拉伯糖、木糖或来苏糖、吡喃糖、呋喃糖、景天庚酮糖、非环类似物和脱碱基核苷类似物如甲基核苷。一个或多个磷酸二酯键可以被另外的连接基团取代。这些另外的连接基团包括但不限于以下实施方案,其中磷酸酯(phosphate)被p(o)s(“硫代”)、p(s)s(“二硫代”)、(o)nr2(“酰胺化”)、p(o)r、p(o)or’、co或ch2(“甲缩醛”)取代,其中每个r或r'独立地是h或取代或未取代的烷基(1-20c),任选地含有醚的(-o-)键、芳基、烯基、环烷基、环烯基或芳烷基(araldyl)。并非所有多核苷酸中的键都必须相同。前述描述适用于本文提及的所有多核苷酸,包括rna和dna。
[0073]
如本领域已知的,抗体的“恒定区”是指单独或组合的抗体轻链的恒定区或抗体重链的恒定区。
[0074]
如本文所用,“基本上纯”是指材料至少50%纯(即,不含污染物),更优选地至少90%纯,更优选地至少95%纯,但更优选地至少98%纯,最优选地至少99%纯。
[0075]“宿主细胞”包括单个细胞或细胞培养物,其可以是或已经是用于掺入多核苷酸插入物的载体的受体。宿主细胞包括单个宿主细胞的后代,并且由于自然、意外或故意突变,后代可能不一定与原始亲本细胞完全相同(在形态学或基因组dna互补中)。宿主细胞包括用本发明的多核苷酸体内转染的细胞。
[0076]
如本文所用,“免疫细胞”是指造血起源的功能性参与启动和/或执行先天和/或适应性免疫应答的细胞。
[0077]
如本领域已知的,术语“fc区”用于定义免疫球蛋白重链的c末端区。“fc区”可以是天然序列fc区或变体fc区。尽管免疫球蛋白重链的fc区的边界可能改变,但人igg重链fc区通常被定义为从cys226或从pro230位置的氨基酸残基延伸到其羧基末端。fc区域中残基的编号是kabat所述eu索引的编号。kabat et al.,sequences of proteins of immunological interest,5th ed.public health service,national institutes of health,bethesda,md.,1991。免疫球蛋白的fc区通常包括两个恒定区:ch2和ch3。
[0078]
如本领域所用,“fc受体”和“fcr”描述了结合抗体fc区的受体。优选的fcr是天然序列人fcr。此外,优选的fcr是结合igg抗体(γ受体)并且包括fcγri、fcγrii和fcγriii亚类的受体,包括等位基因变体和这些受体的可变剪接形式。fcγrii受体包括fcγriia(“激活受体”)和fcγriib(“抑制受体”),其具有相似氨基酸序列,且主要区别为其细胞质结构域。fcr在以下文献中综述:ravetch and kinet,ann.rev.immunol.,9:457-92,1991;capel et al.,immunomethods,4:25-34,1994;and de haas et al.,j.lab.clin.med.,126:330-41,1995。“fcr”还包括负责将母体igg转移到胎儿的新生儿受体fcrn(guyer et al.,j.immunol.,117:587,1976;and kim et al.,j.immunol.,24:249,1994)。
[0079]
本文关于抗体使用的术语“竞争”是指第一抗体或其抗原结合片段(或部分)结合表位的方式与第二抗体或其抗原结合部分结合的方式充分相似,使得在第二抗体存在的情况下,第一抗体与其同源表位的结合比在第二抗体不存在的情况下可检测地降低。换过来的情况(其中在第一抗体存在下第二抗体与其表位的结合也可检测地降低)可以存在但不必如此。也就是说,第一抗体可以抑制第二抗体与其表位的结合,而第二抗体不抑制第一抗体与其各自表位的结合。然而,当每种抗体可检测地抑制其它抗体与其同源表位或配体的结合时,无论是否抑制相同、更大或更小程度,抗体被称为彼此“交叉竞争”结合其各自的表位。竞争和交叉竞争抗体都包括在本发明中。不管这种竞争或交叉竞争发生的机制(例如,位阻、构象变化、或与共同表位或其一部分结合),本领域技术人员将会基于本文提供的教导来理解,这种竞争和/或交叉竞争抗体被包括在本文公开内并且可用于本文公开的方法。
[0080]
如本文所用,“自体”是指用于治疗患者的细胞、细胞系或细胞群源自所述患者或源自人类白细胞抗原(hla)相容的供体。
[0081]
如本文所用,“同种异体”是指用于治疗患者的细胞或细胞群不是源自所述患者,而是来自供体。
[0082]
如本文所用,“治疗”是获得有益或期望的临床结果的方法。为了本发明的目的,有益或期望的临床结果包括但不限于以下一种或多种:减少(或破坏)肿瘤细胞或癌细胞的增殖、抑制肿瘤细胞的转移、收缩或减小表达bcma的肿瘤的大小、缓解bcma相关疾病(例如癌症)、减轻由bcma相关疾病(例如癌症)引起的症状、增加患有bcma相关疾病(例如癌症)的人的生活质量、减少治疗bcma相关疾病(如癌症)所需的其他药物的剂量、延缓bcma相关疾病(如癌症)的进展、治愈bcma相关疾病(例如癌症)、和/或延长患有bcma相关疾病(例如癌症)的患者的生存期。
[0083]
与不施用bcma抗体或bcma抗体缀合物相比,“改善”是指一种或多种症状的减轻或改善。“改善”还包括缩短或减少症状的持续时间。
[0084]
如本文所用,药物、化合物或药物组合物的“有效剂量”或“有效量”是足以实现任何一种或多种有益或期望结果的量。对于预防性使用,有益或期望的结果包括消除或降低
风险、减轻严重性或延迟疾病的开始,包括疾病的生物化学、组织学和/或行为症状、其并发症和在疾病发展期间呈现的中间病理表型。对于治疗用途,有益或期望的结果包括临床结果,例如各种bcma相关疾病或病症(例如多发性骨髓瘤)的一种或多种症状的发生率降低或改善、减少治疗疾病所需的其它药物的剂量、增强另一种药物的作用、和/或延缓患者的bcma相关疾病的进展。有效剂量可以在一次或多次施用中施用。为了本发明的目的,药物、化合物或药物组合物的有效剂量是足以直接或间接地完成预防性或治疗性治疗的量。如在临床情况中所理解的,药物、化合物或药物组合物的有效剂量可以与或可以不与另一种药物、化合物或药物组合物结合实现。因此,“有效剂量”可以在施用一种或多种治疗剂的环境中考虑,并且如果与一种或多种其他试剂结合的话期望结果可能或已经获得,单一试剂可以被考虑以有效剂量给予。
[0085]“个体”或“对象”是哺乳动物,更优选人。哺乳动物还包括但不限于农场动物、运动动物、宠物、灵长类动物、马、狗、猫、小鼠和大鼠。
[0086]
如本文所用,“载体”是指能够递送和优选在宿主细胞中表达感兴趣的一个或多个基因或序列的构建体。载体的实例包括但不限于病毒载体、裸dna或rna表达载体、质粒、粘粒或噬菌体载体、与阳离子缩合剂相结合的dna或rna表达载体、包于脂质体中的dna或rna表达载体、以及某些真核细胞如生产细胞。
[0087]
如本文所用,“表达控制序列”是指指导核酸转录的核酸序列。表达控制序列可以是启动子,例如组成型启动子或诱导型启动子,或增强子。表达控制序列与待转录的核酸序列可操作地连接。
[0088]
如本文所用,“药学上可接受的载体”或“药学上可接受的赋形剂”包括当与活性成分组合时允许所述成分保留生物活性并且与患者的免疫系统不反应的任何材料。实例包括但不限于任何标准药物载体,例如磷酸盐缓冲盐溶液、水、诸如油/水乳液的乳液和各种类型的润湿剂。用于气雾剂或肠胃外施用的优选稀释剂是磷酸盐缓冲盐水(pbs)或生理盐水(0.9%)。包括这种载体的组合物通过公知的常规方法配制(参见例如remington's pharmaceutical sciences,18th edition,a.gennaro,ed.,mack publishing co.,easton,pa,1990;和remington,the science and practice of pharmacy 21st ed.mack publishing,2005)。
[0089]
本文所用的术语“k
on”是指抗体与抗原结合的速率常数。
[0090]
本文所用的术语“k
off”是指抗体与抗体/抗原复合物解离的速率常数。
[0091]
本文所用的术语“k
d”是指抗体-抗原相互作用的平衡解离常数。
[0092]
本文提及“约”一个值或参数包括(和描述)针对该值或参数本身的实施方案。例如,提及“约x”的描述包括“x”的描述。数字范围把定义范围的数字包括在内。
[0093]
应当理解,在本文中用语言“包括”所描述的实施方案的任何地方,另外还提供了以“由......组成”和/或“基本上由
…
组成”所描述的类似实施方案。
[0094]
本发明的方面或实施方案依据马库什分组或其他可选方案分组来描述,本发明不仅包括整体列出的整个组,还涵盖该组中的每个单独成员和主组中的所有可能亚组,还包括缺少一个或多个组成员的主组。本发明还设想明确排除所要求保护的发明中的任何组成员中的一个或多个。
[0095]
除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域的普通技
术人员通常理解的相同的含义。在发生冲突的情况下,以本说明书(包括定义)为准。在本说明书和权利要求书中,单词“包括”或诸如“包括”的变体将被理解为暗示包括所述整体(integer)或整体的组,但不排除任何其他整体或整体的组。除非上下文另有要求,单数术语应包括复数,复数术语应包括单数。
[0096]
本文描述了示例性方法和材料,不过与本文所描述相似或等同的方法和材料也可用于本发明的实践或测试。材料、方法和实施例仅是说明性的而不是限制性的。
[0097]
bcma特异性car及其制备方法
[0098]
本发明提供了结合bcma(例如人bcma(例如,seq id no:354或登记号:q02223-2)的car。本文提供的bcma特异性car包括单链car和多链car。所述car利用单克隆抗体的抗原结合特性,具有以非mhc限制的方式使t细胞特异性和反应性重新定向至bcma的的能力。非mhc限制性抗原识别赋予表达car的t细胞识别与抗原加工无关的抗原的能力,从而绕过肿瘤逃逸的主要机制。
[0099]
在一些实施方案中,本文提供的car包括细胞外配体结合结构域(例如,单链可变片段(scfv))、跨膜结构域和细胞内信号转导结构域。在一些实施方案中,细胞外配体结合结构域、跨膜结构域和细胞内信号转导结构域位于一个多肽中,即在单链中。本文还提供了多链car和多肽。在一些实施方案中,所述多链car包括:包括跨膜结构域和至少一个细胞外配体结合结构域的第一多肽,以及包括跨膜结构域和至少一个细胞内信号转导结构域的第二多肽,其中多肽组装在一起以形成多链car。
[0100]
在一些实施方案中,bcma特异性多链car是基于ige的高亲和力受体(fcεri)。在肥大细胞和嗜碱性粒细胞上表达的fcεri引发过敏反应。fcεri是由单个α亚基、单个β亚基和两个二硫键连接的γ亚基组成的四聚体复合物。α亚基含有ige结合结构域。β和γ亚基含有介导信号转导的itam。在一些实施方案中,fcrα链的细胞外结构域缺失并被bcma特异性细胞外配体结合结构域代替。在一些实施方案中,多链bcma特异性car包括特异性结合bcma的scfv、cd8α铰链和fcrβ链的itam。在一些实施方案中,car可以包括或可以不包括fcrγ链。
[0101]
在一些实施方案中,细胞外配体结合结构域包括含有由柔性接头连接的靶抗原特异性单克隆抗体的轻链可变(vl)区和重链可变(vh)区的scfv。通过使用短连接肽连接轻链和/或重链可变区来制备单链可变区片段(bird et al.,science 242:423-426,1988)。连接肽的实例是具有氨基酸序列(ggggs)3(seq id no:333)的gs接头,其在一个可变区的羧基末端与另一个可变区的氨基末端之间桥接大约3.5nm。其他序列的接头已经设计并使用(bird et al.,1988,同上)。通常,接头可以是短的、柔性的多肽,优选包括约20个或更少的氨基酸残基。接头可以相应地进行修饰以用于额外的功能,例如附着药物或附着到固体支持物上。单链变体可以重组或合成产生。对于scfv的合成生产,可以使用自动合成仪。对于scfv的重组生产,可以将含有编码scfv的多核苷酸的合适的质粒导入合适的宿主细胞,或者是真核细胞,例如酵母、植物、昆虫或哺乳动物细胞,或者是原核细胞,例如大肠杆菌。编码感兴趣的scfv的多核苷酸可以通过常规操作例如连接多核苷酸来制备。可以使用本领域已知的标准蛋白质纯化技术分离所得的scfv。
[0102]
在一些实施方案中,细胞外配体结合结构域包括(a)vh区,其包括(i)含有序列syx1mx2(其中x1是a或p;x2为t、n或s(seq id no:301))、gftfx1sy(其中x1为g或s(seq id no:302))、或gftfx1syx2mx3(其中x1为g或s、x2为a或p;x3是t、n或s(seq id no:303))的vh互
补决定区1(cdr1);(ii)含有序列ax1x2x3x4gx5x6x7x8yadx9x
10
kg(其中x1是i、v、t、h、l、a或c;x2是s、d、g、t、i、l、f、m或v;x3是g、y、l、h、d、a、s或m;x4是s、q、t、a、f或w;x5为g或t;x6为n、s、p、y、w或f;x7为s、t、i、l、t、a、r、v、k、g或c;x8是f、y、p、w、h或g;x9为v、r或l;x
10
是g或t(seq id no:305))或x1x2x3x4x5x6(其中x1是s、v、i、d、g、t、l、f或m;x2是g、y、l、h、d、a、s或m;x3是s、g、f或w;x4是g或s;x5是g或t;x6是n、s、p、y或w(seq id no:306))的vh cdr2;和(iii)含有序列vspix1x2x3x4(其中x1是a或y;x2为a或s;x3是g、q、l、p或e(seq id no:307))、或ywpmx1x2(其中x1是d、s、t或a;x2是i、s、l、p或d(seq id no:308))的vh cdr3;以及vl区,其包括(i)含有序列x1x2x3x4x5x6x7x8x9x
10
x
11
x
12
(其中x1是r、g、w、a或c;x2为a、p、g、l、c或s;x3是s、g或r;x4是q、c、e、v或i;x5为s、l、p、g、a、r或d;x6是v、g或i;x7是s、e、d或p;x8是s、p、f、a、m、e、v、n、d或y;x9为i、t、v、e、s、a、m、q、y、h或r;x
10
为y或f;x
11
为l、w或p;x
12
为a、s或g(seq id no:309))的vl cdr1;(ii)含有序列x1asx2rax3(其中x1是g或d;x2是s或i;x3是t或p(seq id no:310))的vl cdr2;和(iii)含有序列qqyx1x2x3px4t(其中x1是g、q、e、l、f、a、s、m、k、r或y;x2是s、r、t、g、v、f、y、d、a、h、v、e、k或c;x3是w、f或s;x4为l或i(seq id no:311))、或qqyx1x2x3px4(其中x1为g、q、e、l、f、a、s、m、r、k或y;x2是s、r、t、g、r、v、d、a、h、e、k、c、f或y;x3是w、s或f;x4是l或i(seq id no:312))的vl cdr3。在一些实施方案中,vh和vl通过柔性接头连接在一起。在一些实施方案中,柔性接头包括seq id no:333所示的氨基酸序列。
[0103]
在另一方面,提供了特异性结合bcma的car,其中car包括细胞外配体结合结构域,细胞外配体结合结构域包括:vh区,其含有seq id no:2、3、7、8、24、25、26、27、28、29、30、31、32、33、35、37、39、42、44、46、48、50、52、54、56、58、60、62、64、66、68、70、72、74、76、78、83、87、92、78、95、97、99、101、104、106、110、112、114、118、120、122、112、125、127、313或314所示vh序列的vh cdr1、vh cdr2和vh cdr3;和/或vl区,其含有如seq id no:1、4、5、6、9、10、11、12、13、15、16、17、18、19、20、21、22、23、34、36、38、40、41、43、45、47、49、51、53、57、59、61、63、65、67、69、71、73、75、77、79、317、81、82、84、85、86、88、89、90、91、93、94、96、98、100、102、103、105、107、108、109、111、113、115、116、117、119、121、123、124、126、128、315、或316所示vl序列的vl cdr1、vl cdr2和vl cdr3。在一些实施方案中,vh和vl通过柔性接头连接在一起。在一些实施方案中,柔性接头包括seq id no:333所示的氨基酸序列。
[0104]
在一些实施方案中,本发明的car包括具有表1所列的任一个部分轻链序列和/或表1所列的任一个部分重链序列的细胞外配体结合结构域。在表1中,下划线的序列是根据kabat的cdr序列,且粗体显示的序列是根据chothia的cdr序列,除了重链cdr2序列(下划线为chothia cdr序列,且粗体为kabat cdr序列)。
[0105]
表1
[0106]
[0107]
[0108]
[0109]
[0110]
[0111]
[0112]
[0113]
[0114]
[0115]
[0116]
[0117]
[0118]
[0119]
[0120]
[0121]
[0122]
[0123]
[0124]
[0125][0126]
本文还提供了针对bcma的car细胞外配体结合结构域的cdr部分(包括chothia、kabat cdr和cdr接触区)。cdr区的测定完全在本领域的技术范围内。应当理解,在一些实施方案中,cdr可以是kabat和chothia cdr的组合(也称为“组合cr”或“扩展cdr”)。在一些实施方案中,cdr是kabat cdr。在其它实施方案中,cdr是chothia cdr。换句话说,在具有多于一个cdr的实施方案中,cdr可以是kabat、chothia、组合cdr或其组合中的任一种。表2提供了本文提供的cdr序列的实例。
[0127]
表2
[0128]
[0129]
[0130]
[0131]
[0132]
[0133]
[0134]
[0135]
[0136]
[0137]
[0138]
[0139]
[0140]
[0141]
[0142]
[0143]
[0144][0145]
[0146]
本发明包括对表1所示的本发明car和多肽的变体的修饰,包括功能上等同的car,其具有不显著影响其性质的修饰以及增强或降低的活性和/或亲和力的变体。例如,可以使氨基酸序列突变以获得具有对bcma期望结合亲和力的抗体。多肽的修饰是本领域的常规实践,不需要在此详细描述。经修饰的多肽的实例包括具有氨基酸残基的保守取代的多肽、一个或多个不显著有害地改变功能活性的氨基酸的缺失或添加、或者成熟(增强)多肽对其配体的亲合力、或使用化学类似物。
[0147]
氨基酸序列的插入包括长度从一个残基到含有上百个或更多残基的多肽的氨基和/或羧基-末端融合,以及单个或多个氨基酸残基的序列内插入。末端插入的实施例包括具有n-末端甲硫氨酰残基的抗体或与表位标签融合的抗体。抗体分子的其他插入变体包括抗体的n-或c-末端与酶或多肽融合从而增加抗体在血液循环中的半衰期。
[0148]
取代变体具有至少一个氨基酸残基在抗体分子中被除去,并且在其位置插入不同的残基。取代诱变最感兴趣的部位包括高变区,但也考虑了fr变化。保守取代在具有“保守取代”的标题的表2.1中列出。如果这样的取代导致生物活性的变化,则可以引入在表2.1中称为“示例性取代”或在下面参考氨基酸类中进一步描述的更多实质性的变化并筛选产物。
[0149]
表2.1:氨基酸取代
[0150]
[0151][0152]
在一些实施方案中,本发明提供了car,其包括结合bcma以及与此处描述的car竞争与bcma的结合的细胞外配体结合结构域,包括p6e01/p6e01、p6e01/h3.aq、l1.lgf/l3.kw/p6e01;l1.lgf/l3.ny/p6e01、l1.gdf/l3.ny/p6e01、l1.lgf/l3.kw/h3.al、l1.lgf/l3.kw/h3.ap、l1.lgf/l3.kw/h3.aq、l1.lgf/l3.py/h3.ap、l1.lgf/l3.py/h3.aq、l1.lgf/l3.ny/h3.al、l1.lgf/l3.ny/h3.ap、l1.lgf/l3.ny/h3.aq、l1.gdf/l3.kw/h3.al、l1.gdf/l3.kw/h3.ap、l1.gdf/l3.kw/h3.aq、l1.gdf/l3.py/h3.aq、l1.gdf/l3.ny/h3.al、l1.gdf/l3.ny/h3.ap、l1.gdf/l3.ny/h3.aq、l3.kw/p6e01、l3.py/p6e01、l3.ny/p6e01、
[0153]
l3.py/l1.ps/p6e01、l3.py/l1.ah/p6e01、l3.py/l1.ff/p6e01、l3.py/l1.ph/p6e01、l3.py/l3.ky/p6e01、l3.py/l3.kf/p6e01、l3.py/h2.qr、l3.py/h2.dy、l3.py/h2.yq、l3.py/h2.lt、l3.py/h2.ha、l3.py/h2.ql、l3.py/h3.ya、l3.py/h3.ae、l3.py/h3.aq、l3.py/h3.taq、l3.py/p6e01、l3.py/l1.ps/h2.qr、l3.py/l1.ps/h2.dy、l3.py/l1.ps/h2.yq、l3.py/l1.ps/h2.lt、l3.py/l1.ps/h2.ha、l3.py/l1.ps/h2.ql、l3.py/l1.ps/h3.ya、l3.py/l1.ps/h3.ae、l3.py/l1.ps/h3.aq、l3.py/l1.ps/h3.taq、l3.py/l1.ah/h2.qr、l3.py/l1.ah/h2.dy、l3.py/l1.ah/h2.yq、l3.py/l1.ah/h2.lt、l3.py/l1.ah/h2.ha、l3.py/l1.ah/h2.ql、l3.py/l1.ah/h3.ya、l3.py/l1.ah/h3.ae、l3.py/l1.ah/h3.aq、l3.py/l1.ah/h3.taq、l3.py/l1.ff/h2.qr、l3.py/l1.ff/h2.dy、l3.py/l1.ff/h2.yq、l3.py/l1.ff/h2.lt、l3.py/l1.ff/h2.ha、l3.py/l1.ff/h2.ql、l3.py/l1.ff/h3.ya、l3.py/l1.ff/h3.ae、l3.py/l1.ff/h3.aq、l3.py/l1.ff/h3.taq、l3.py/l1.ph/h2.qr、l3.py/l1.ph/h2.ha、l3.py/l1.ph/h3.ae、l3.py/l1.ph/h3.aq、l3.py/l1.ph/h3.taq、l3.py/l3.ky/h2.qr、l3.py/l3.ky/h2.dy、l3.py/l3.ky/h2.yq
[0154]
l3.py/l3.ky/h2.lt、l3.py/l3.ky/h2.ha、l3.py/l3.ky/h2.ql、l3.py/l3.ky/h3.ya
[0155]
l3.py/l3.ky/h3.taq、l3.py/l3.kf/h2.dy、l3.py/l3.kf/h2.yq、l3.py/l3.kf/h2.lt
[0156]
l3.py/l3.kf/h2.ql、l3.py/l3.kf/h3.ya、l3.py/l3.kf/h3.ae、l3.py/l3.kf/h3.aq
[0157]
l3.py/l3.kf/h3.taq、p5a2_vhvl、a02_rd4_0.6nm_c06、a02_rd4_0.6nm_c09a02_rd4_6nm_c16、a02_rd4_6nm_c03、a02_rd4_6nm_c01、a02_rd4_6nm_c26
[0158]
a02_rd4_6nm_c25、a02_rd4_6nm_c22、a02_rd4_6nm_c19、a02_rd4_0.6nm_c03
[0159]
a02_rd4_6nm_c07、a02_rd4_6nm_c23、a02_rd4_0.6nm_c18、a02_rd4_6nm_c10
[0160]
a02_rd4_6nm_c05、a02_rd4_0.6nm_c10、a02_rd4_6nm_c04、a02_rd4_0.6nm_c26
[0161]
a02_rd4_0.6nm_c13、a02_rd4_0.6nm_c01、a02_rd4_6nm_c08、p5c1_vhvl、c01_rd4_6nm_c24、c01_rd4_6nm_c26、c01_rd4_6nm_c10、c01_rd4_0.6nm_c27
[0162]
c01_rd4_6nm_c20、c01_rd4_6nm_c12、c01_rd4_0.6nm_c16、c01_rd4_0.6nm_c09
[0163]
c01_rd4_6nm_c09、c01_rd4_0.6nm_c03、c01_rd4_0.6nm_c06、c01_rd4_6nm_c04
[0164]
combo_rd4_0.6nm_c22、combo_rd4_6nm_c21、combo_rd4_6nm_c10、combo_rd4_0.6nm_c04、combo_rd4_6nm_c25、combo_rd4_0.6nm_c21、combo_rd4_6nm_c11、combo_rd4_0.6nm_c20、combo_rd4_6nm_c09、combo_rd4_6nm_c08、combo_rd4_0.6nm_c19、combo_rd4_0.6nm_c02、combo_rd4_0.6nm_c23、combo_rd4_0.6nm_c29、combo_rd4_0.6nm_c09、combo_rd4_6nm_c12、combo_rd4_0.6nm_c30、combo_rd4_0.6nm_c14、combo_rd4_6nm_c07、combo_rd4_6nm_c02、combo_rd4_0.6nm_c05、combo_rd4_0.6nm_c17、combo_rd4_6nm_c22、combo_rd4_0.6nm_c11、or combo_rd4_0.6nm_c29。
[0165]
在一些实施方案中,本发明提供了特异性结合bcma的car,其中car包括含有seq id no:33所示序列的vh区;和/或含有seq id no:34所示序列的vl区。在一些实施方案中,本发明提供了特异性结合bcma的car,其中car包括含有seq id no:33、72、39、76、83、92、25或8所示序列的vh区;和/或含有seq id no:34、73、40、77、84、93、18或80所示序列的vl区。在一些实施方案中,本发明还提供了car,其包括基于cdr接触区的针对bcma抗体的抗体cdr部分。cdr接触区是抗体区域,该区域赋予抗体针对抗原的特异性。一般来说,cdr接触区包括cdr中的残基位置和被约束以保持抗体结合特异性抗原的适当环结构的vernier带。参见例如makabe et al.,j.biol.chem.,283:1156-1166,2007。cdr接触区的测定完全在本领域技术内。
[0166]
如本文所述的bcma特异性car对bcma(例如人bcma(例如,(seq id no:354))的结合亲和力(kd)可以为约0.002至约6500nm。在一些实施方案中,结合亲和力约为以下的任一个:6500nm、6000nm、5986nm、5567nm、5500nm、4500nm、4000nm、3500nm、3000nm、2500nm、2134nm、2000nm、1500nm、1000nm、750nm、500nm、400nm、300nm、250nm、200nm、193nm、100nm、90nm、50nm、45nm、40nm、35nm、30nm、25nm、20nm、19nm、18nm、17nm、16nm、15nm、10nm、8nm、7.5nm、7nm、6.5nm、6nm、5.5nm、5nm、4nm、3nm、2nm、1nm、0.5nm、0.3nm、0.1nm、0.01nm、或0.002nm。在一些实施方案中,结合亲和力小于以下的任一个:6500nm、6000nm、5500nm、5000nm、4000nm、3000nm、2000nm、1000nm、900nm、800nm、250nm、200nm、100nm、50nm、30nm、20nm、10nm、7.5nm、7nm、6.5nm、6nm、5nm、4.5nm、4nm、3.5nm、3nm、2.5nm、2nm、1.5nm、1nm或0.5nm。
[0167]
根据本发明的car的细胞内信号转导结构域负责细胞外配体结合结构域与靶结合之后的细胞内信号转导,导致激活免疫细胞和免疫应答。细胞内信号转导结构域具有激活
表达car的免疫细胞的至少一种正常效应子功能的能力。例如,t细胞的效应子功能可以是细胞溶解活性或辅助活性,包括细胞因子的分泌。
[0168]
在一些实施方案中,用于car的细胞内信号转导结构域可以是细胞质序列,例如但不限于t细胞受体和共同受体(它们一致地起作用从而在抗原受体接合之后启动信号转导)的细胞质序列,以及任何这些序列的衍生物或变体以及具有相同功能能力的任何合成序列。细胞内信号转导结构域包括两种不同类型的细胞质信号转导序列:那些启动抗原依赖性初级激活的序列,以及那些以抗原非依赖性方式作用以提供次级或共刺激信号的序列。初级细胞质信号转导序列可以包括称为itam的免疫受体酪氨酸激活基序的信号转导基序。itam是用作syk/zap70类酪氨酸激酶的结合位点的各种受体的胞质内尾部中发现的明确的信号转导基序。本发明中使用的itam的实例可以包括衍生自tcrζ、fcrγ、fcrβ、fcrε、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b和cd66d的非限制性实例。在一些实施方案中,car的细胞内信号转导结构域可以包括cd3ζ信号转导结构域,其氨基酸序列与seq id no:324所示氨基酸序列具有至少约70%,优选至少80%,更优选至少90%、95%、97%或99%的序列相同性。在一些实施方案中,本发明的car的细胞内信号转导结构域包括共刺激分子的结构域。
[0169]
在一些实施方案中,本发明car的细胞内信号转导结构域包括共刺激分子的一部分,其选自以下41bb(genbank:aaa53133.)的片段和cd28(np_006130.1)的片段。在一些实施方案中,本发明car的细胞内信号转导结构域包括的氨基酸序列与seq id no:323和seq id no:327所示氨基酸序列具有至少70%,优选至少80%,更优选至少90%、95%、97%或99%的序列相同性。
[0170]
car在细胞的表面膜上表达。因此,car可以包括跨膜结构域。本文公开的car的合适跨膜结构域具有以下能力:(a)在细胞表面表达,优选免疫细胞,例如但不限于淋巴细胞或自然杀伤(nk)细胞,和(b)与配体结合结构域和细胞内信号转导结构域相互作用,用于指导免疫细胞对预定靶细胞的细胞应答。跨膜结构域可以衍生自天然来源或合成来源。跨膜结构域可以衍生自任何膜结合蛋白或跨膜蛋白。作为非限制性实例,跨膜多肽可以是t细胞受体的亚基如α亚基、β亚基、γ或δ亚基,组成cd3复合物的多肽,il-2受体的p55(a链)、p75(β链)或γ,fc受体的亚基链,特别是fcγ受体iii或cd蛋白。或者,跨膜结构域可以是合成的,并且可以主要包括疏水性残基,如亮氨酸和缬氨酸。在一些实施方案中,所述跨膜结构域衍生自人cd8α链(例如np_001139345.1)。跨膜结构域可以进一步包括位于细胞外配体结合结构域和所述跨膜结构域之间的茎结构域。茎结构域可以包括多达300个氨基酸,优选10-100个氨基酸,最优选25-50个氨基酸。茎区域可以衍生自天然存在的分子的全部或一部分,例如来自cd8、cd4或cd28的胞外区的全部或一部分,或来自抗体恒定区的全部或一部分。或者茎结构域可以是对应于天然存在的茎序列的合成序列,或者可以是完全合成的茎序列。在一些实施方案中,所述茎结构域是人cd8α链的一部分(例如,np_001139345.1)。在另一个具体实施方案中,所述跨膜结构域和铰链结构域包括人cd8α链的一部分,优选地其包括与选自seq id no:318的氨基酸序列至少70%,优选至少80%,更优选至少90%、95%、97%或99%的序列相同性。在一些实施方案中,本文公开的car可以包括特异性结合bcma的细胞外配体结合结构域、cd8α人铰链和跨膜结构域、cd3ζ信号转导结构域、和4-1bb信号转导结构域。
[0171]
表3提供了可用于本文公开的car的示例性结构域序列。
[0172]
表3:car组分示例性序列
[0173][0174][0175]
通常在癌细胞中观察到靶抗原的下调或突变,产生抗原缺失逃逸变体。因此,为了抵消肿瘤逃逸并使得免疫细胞对靶点更具特异性,bcma特异性car可以包括一个或多个额
外的细胞外配体结合结构域,以同时结合靶中的不同元件,从而增强免疫细胞激活和功能。在一个实施方案中,细胞外配体结合结构域可以串联置于相同的跨膜多肽上,并且任选地可以通过接头分离。在一些实施方案中,所述不同的细胞外配体结合结构域可以置于构成car的不同跨膜多肽上。在一些实施方案中,本发明涉及car的群体,每种car包括不同的细胞外配体结合结构域。特别地,本发明涉及一种改造免疫细胞的方法,包括提供免疫细胞并在细胞表面表达所述car群体,每种car包括不同的细胞外配体结合结构域。在另一个具体实施方案中,本发明涉及一种改造免疫细胞的方法,包括提供免疫细胞并将编码组成car群体的多肽的多核苷酸引入细胞内,每种car包括不同的细胞外配体结合结构域。car的群体其指的是至少两种、三种、四种、五种、六种或更多种car,每种car包括不同的细胞外配体结合结构域。根据本发明的不同的细胞外配体结合结构域可以优选地同时结合靶的不同元件,从而增强免疫细胞激活和功能。本发明还涉及分离的免疫细胞,其包括car群体,每种car包括不同的细胞外配体结合结构域。
[0176]
在另一方面,本发明提供了编码本文所述的任一car和多肽的多核苷酸。多核苷酸可以通过本领域已知的方法制备和表达。
[0177]
在另一方面,本发明提供包括本发明的任何细胞的组合物(例如药物组合物)。在一些实施方案中,组合物包括含有编码本文所述的任一car的多核苷酸的细胞。在其它实施方案中,组合物包括以下seq id no:367和seq id no:368中所示的多核苷酸之一或两者:
[0178]
p5a重链可变区
[0179]
gaggtgcagctgctggaatctggcggaggactggtgcagcctggcggctctctgagactgtcttgtgccgccagcggcttcaccttcagcagctacgccatgaactgggtgcgccaggcccctggcaaaggcctggaatgggtgtccgccatcagcgatagcggcggcagcacctactacgccgatagcgtgaagggccggttcaccatcagccgggacaacagcaagaacaccctgtacctgcagatgaacagcctgcgggccgaggacaccgccgtgtactactgtgccanatactggcccatggacatctggggccagggaaccttggtcaccgtctcctca(seq id no:367)
[0180]
p5a轻链可变区
[0181]
gagatcgtgctgacacagagccctggcaccctgagcctgtctccaggcgaaagagccaccctgtcctgcaaagccagccagagcgtgtccagcagctacctggcctggtatcagcaaaagcccggccaggctccccggctgctgatgtacgatgccagcatcagagccaccggcatccccgacagattttccggctctggcagcggcaccgacttcaccctgaccatcagcagactggaacccgaggacttcgccgtgtactactgccagcagtacggcagctggcccctgacatttggccagggcacaaaggtggagatcaaa(seq id no:368)
[0182]
在其它实施方案中,组合物包括以下seq id no:369和seq id no:370中所示的多核苷酸之一或两者:
[0183]
p5ac1重链可变区
[0184]
gaggtgcagctgctggaatctggcggaggactggtgcagcctggcggctctctgagactgtcttgtgccgccagcggcttcaccttcagcagctacgccatgaactgggtgcgccaggcccctggtaaaggtttggaatgggtttctgctattctgtcgtctggtggttctacttactatgccgattctgttaagggtagattcaccatttctagagacaactctaagaacaccttgtacttgcaaatgaactccttgagagctgaagatactgctgtttattactgtgctagatactggccaatggatatttggggtcaaggtactctggtcaccgtctcctca(seq id no:369)
[0185]
p5ac1轻链可变区
[0186]
gagatcgtgctgacacagagccctggcaccctgagcctgtctcctggtgaaagagctactttgtcttg
tagagggggtcaatccgtttcctcttcttatttggcttggtatcaacaaaaaccaggtcaagctccaagattattgatgtacgatgcttctattagagccaccggtattccagatagattttctggttctggttccggtactgatttcactttgactatctctagattggaaccagaagatttcgctgtttactactgtcaacaatatcagtcttggccattgacttttggtcaaggtacaaaggttgaaatcaaa(seq id no:370)在其它实施方案中,组合物包括以下seq id no:371和seq id no:372中所示的多核苷酸之一或两者:
[0187]
pc1重链可变区
[0188]
gaggtgcagctgctggaatctggcggaggactggtgcagcctggcggctctctgagactgtcttgtgccgccagcggcttcaccttcagcagctaccctatgagctgggtgcgccaggcccctggcaaaggactggaatgggtgtccgccatcggaggctctggcggcagcacctactacgccgatagcgtgaagggccggttcaccatcagccgggacaacagcaagaacaccctgtacctgcaaatgaacagcctgcgggccgaggacaccgccgtgtactactgtgccagatactggcccatggacagctggggccagggaactttggtcaccgtctcctca(seq id no:371)
[0189]
pc1轻链可变区
[0190]
gagatcgtgctgacacagagccctggcaccctgagcctgtctccaggcgaaagagccaccctgtcctgcaaagccagccagagcgtgtccagcacatacctggcctggtatcagcaaaagcccggccaggctccccggctgctgatctacgatgcctcttctagagcccctggcatccccgacagattcagcggctctggcagcggcaccgacttcaccctgaccatcagcagactggaacccgaggacttcgccgtgtactactgccagcagtacagcaccagccccctgacctttggccagggcacaaaggtggagatcaaa(seq id no:372).
[0191]
在其它实施方案中,组合物包括以下seq id no:373和seq id no:374中所示的多核苷酸之一或两者:
[0192]
pc1c12重链可变区
[0193]
gaggtgcagctgctggaatctggcggaggactggtgcagcctggcggctctctgagactgtcttgtgccgccagcggcttcaccttcagcagctaccctatgagctgggtgcgccaggcccctggtaaaggtttggaatgggtttctgctattggtggttcaggtggttggagttattatgccgattctgttaagggtagattcaccatttctagagacaactctaagaacaccttgtacttgcaaatgaactccttgagagctgaagatactgctgtttattactgtgctagatactggccaatggattcttggggtcaaggtactctggtcaccgtctcctca(seq id no:373)
[0194]
pc1c12轻链可变区
[0195]
gagatcgtgctgacacagagccctggcaccctgagcctgtctcctggtgaaagagctactttgtcttgttggttgtctcaatctgtttcctctacttacttggcttggtatcaacaaaaaccaggtcaagctccaagattattgatctacgatgcttcttctagagcaccaggtattccagatagattttctggttctggttccggtactgatttcactttgactatctctagattggaaccagaagatttcgctgtttactactgccaacaatactctgagtggccattgacttttggtcaaggtacaaaggttgaaatcaaa(seq id no:374).
[0196]
在其它实施方案中,组合物包括以下seq id no:375和seq id no:376中所示的多核苷酸之一或两者:
[0197]
com22重链可变区
[0198]
gaggtgcagctgctggaatctggcggaggactggtgcagcctggcggctctctgagactgtcttgtgccgccagcggcttcaccttcagcagctacgccatgaactgggtgcgccaggcccctggtaaaggtttggaatgggtttctgctatttctgattctggtggttctaggtggtatgccgattctgttaagggtagattcaccatttctagagacaactctaagaacaccttgtacttgcaaatgaactccttgagagctgaagatactgctgtttattactgtacgcggtactggccaatggatatttggggtcaaggtactctggtcaccgtctcctca(seq id no:375)
[0199]
com22轻链可变区
[0200]
gagatcgtgctgacacagagccctggcaccctgagcctgtctcctggtgaaagagctactttgtcttgttggttgtctcaatctgtttcctctacttacttggcttggtatcaacaaaaaccaggtcaagctccaagattattgatctacgatgcttcttctagagcaccaggtattccagatagattttctggttctggttccggtactgatttcactttgactatctctagattggaaccagaagatttcgctgtttactactgccaacaatactctgagtggccattgacttttggtcaaggtacaaaggttgaaatcaaa(seq id no:376).
[0201]
表达载体和多核苷酸组合物的施用在本文中进一步描述。
[0202]
在另一方面,本发明提供了制备本文所述的任何多核苷酸的方法。
[0203]
与任何这些序列互补的多核苷酸也包括在本发明中。多核苷酸可以是单链(编码或反义)或双链,并且可以是dna(基因组的,cdna或合成的)或rna分子。rna分子包括含有内含子并且以一对一的方式对应于dna分子的hnrna分子,以及不含有内含子的mrna分子。另外的编码或非编码序列可以但不是必须存在于本发明的多核苷酸内,并且多核苷酸可以但不必与其它分子和/或支持材料连接。
[0204]
多核苷酸可以包括天然序列(即编码抗体或其部分的内源序列),或可以包括这种序列的变体。多核苷酸变体包括一个或多个取代、添加、缺失和/或插入,使得所编码多肽的免疫反应性相对于天然免疫反应性分子不减少。对所编码多肽的免疫反应性的影响通常可以如本文所述进行评估。变体与编码天然抗体或其部分的多核苷酸序列优选地显示出至少约70%的相同性,更优选至少约80%的相同性,但更优选至少约90%的相同性,最优选至少约95%的相同性。
[0205]
如果两个核苷酸序列或氨基酸序列进行比对以达到如下所述的最大对应时相同,那么两个多核苷酸序列或多肽序列被称为“相同”。两个序列之间的比较通常通过在比较窗口上比较序列来进行,以识别和比较序列相似性的局部区域。本文所用的“比较窗口”是指至少约20个、通常为30至约75、或40至约50个邻接位置的片段,其中可以在两个序列最优地比对后将序列与相同数量的邻接位置的参考序列进行比较。
[0206]
用于比较的序列的最优比对可以使用默认参数的生物信息学软件(dnastar,inc.,madison,wi)的lasergene套件中的megalign程序进行。该程序体现了以下参考文献中描述的几种比对方案:dayhoff,m.o.,1978,a model of evolutionary change in proteins-matrices for detecting distant relationships.in dayhoff,m.o.(ed.)atlas of protein sequence and structure,national biomedical research foundation,washington dc vol.5,suppl.3,pp.345-358;hein j.,1990,unified approach to alignment and phylogenes pp.626-645methods in enzymology vol.183,academic press,inc.,san diego,ca;higgins,d.g.and sharp,p.m.,1989,cabios 5:151-153;myers,e.w.and muller w.,1988,cabios 4:11-17;robinson,e.d.,1971,comb.theor.11:105;santou,n.,nes,m.,1987,mol.biol.evol.4:406-425;sneath,p.h.a.and sokal,r.r.,1973,numerical taxonomy the principles and practice of numerical taxonomy,freeman press,san francisco,ca;wilbur,w.j.and lipman,d.j.,1983,proc.natl.acad.sci.usa 80:726-730。
[0207]
优选地,通过在至少20个位置的比较窗口上比较两个最佳比对序列来确定“序列相同性百分比”,其中与用于两个序列的最佳比对的参考序列(其不包括添加或缺失)相比,
比较窗口中多核苷酸或多肽序列的部分可以包括20%或更少、通常为5至15%、或10至12%的添加或缺失(即,缺口)。通过确定两个序列中存在的相同核酸碱基或氨基酸残基的位置数量以产生匹配位置数来计算百分比,将匹配位置数除以参考序列中的总位置数(即窗口大小),并将结果乘以100,以产生序列相同性百分比。
[0208]
变体也可以或者可选地与天然基因或其部分或互补体基本同源。这样的多核苷酸变体能够在中度严格条件下与天然存在的编码天然抗体的dna序列(或互补序列)杂交。
[0209]
合适的“中等严格条件”包括在5
×
ssc、0.5%sds、1.0mm edta(ph8.0)的溶液中预洗涤;在50℃-65℃、5
×
ssc下杂交过夜;然后用各含有0.1%sds的2
×
、0.5
×
和0.2
×
ssc在65℃下洗涤两次各20分钟。
[0210]
如本文所用,“高度严格条件”或“高严格条件”是:(1)使用低离子强度和高温来洗涤,例如在50℃下的0.015m氯化钠/0.0015m柠檬酸钠/0.1%十二烷基硫酸钠;(2)在杂交过程中使用变性剂,如甲酰胺,例如在42℃下的50%(体积/体积)甲酰胺与0.1%牛血清白蛋白/0.1%聚蔗糖/0.1%聚乙烯吡咯烷酮/ph 6.5的50mm磷酸钠缓冲液和750mm氯化钠、75mm柠檬酸钠;或(3)在42℃下使用50%甲酰胺、5
×
ssc(0.75m nacl、0.075m柠檬酸钠)、50mm磷酸钠(ph6.8)、0.1%焦磷酸钠、5
×
denhardt溶液、超声波处理的鲑鱼精子dna(50μg/ml)、0.1%sds和10%硫酸葡聚糖,以及在42℃下用0.2
×
ssc(氯化钠/柠檬酸钠)和在55℃下用50%甲酰胺洗涤,然后在55℃下进行由含有edta的0.1
×
ssc组成的高严格洗涤。技术人员将认识到如何根据需要调节温度、离子强度等以适应诸如探针长度等因素。
[0211]
本领域普通技术人员将理解,由于遗传密码的简并性,有许多编码本文所述的多肽的核苷酸序列。这些多核苷酸中的一些与任何天然基因的核苷酸序列具有最小的同源性。尽管如此,由于密码子使用的差异而变化的多核苷酸是本发明特别考虑的。此外,包括本文提供的多核苷酸序列的基因的等位基因在本发明的范围内。等位基因是由于一个或多个突变(例如核苷酸的缺失、添加和/或取代)而改变的内源性基因。所得到的mrna和蛋白质可以但不必具有改变的结构或功能。可以使用标准技术(例如杂交、扩增和/或数据库序列比较)鉴定等位基因。
[0212]
本发明的多核苷酸可以使用化学合成、重组方法或pcr获得。化学多核苷酸合成的方法是本领域熟知的,不需要在此详细描述。本领域技术人员可以使用本文提供的序列和商业dna合成仪来产生所需的dna序列。
[0213]
为了使用重组方法制备多核苷酸,可以将含有所需序列的多核苷酸插入到合适的载体中,并进而将载体引入合适的宿主细胞来进行复制和扩增,如本文进一步讨论的。多核苷酸可以通过本领域已知的任何方式插入到宿主细胞中。通过直接摄取、内吞作用、转染、f-接合或电穿孔引入外源多核苷酸来转化细胞。一旦引入,外源多核苷酸可以作为非整合载体(如质粒)保持在细胞内或整合到宿主细胞基因组中。如此扩增的多核苷酸可以通过本领域熟知的方法从宿主细胞中分离出来。参见例如sambrook et al.,1989。
[0214]
或者,pcr允许复制dna序列。pcr技术是本领域公知的,并且描述于美国专利号4,683,195、4,800,159、4,754,065和4,683,202中,以及pcr:the polymerase chain reaction,mullis et al.eds.,birkauswer press,boston,1994。
[0215]
可以通过使用在合适的载体中的分离的dna并将其插入合适的宿主细胞中来获得rna。当细胞复制并且dna被转录成rna时,可以使用本领域技术人员熟知的方法分离rna,例
如sambrook et al.,1989,同上所述。
[0216]
可以根据标准技术构建合适的克隆载体,或可以选自本领域可获得的大量克隆载体。尽管选择的克隆载体可以根据预期使用的宿主细胞而变化,但有用的克隆载体通常具有自我复制的能力、可以具有特定限制性核酸内切酶的单个靶点、和/或可以携带用于选择含有载体的克隆的标记基因。合适的实例包括质粒和细菌病毒,例如puc18、puc19、bluescript(例如pbs sk+)及其衍生物、mp18、mp19、pbr322、pmb9、cole1、pcr1、rp4、噬菌体dna、和穿梭载体如psa3和pat28。这些以及许多其他克隆载体可从商业供应商如biorad、strategene和invitrogen获得。
[0217]
表达载体通常是含有根据本发明的多核苷酸的可复制多核苷酸构建体。这意味着表达载体必须在宿主细胞中作为附加体(episome)或作为染色体dna的整合部分是可复制的。合适的表达载体包括但不限于质粒、病毒载体、包括pct公开号wo 87/04462中公开的腺病毒、腺相关病毒、逆转录病毒、粘粒和表达载体。载体组分通常可以包括但不限于以下中的一个或多个:信号序列;复制起点;一个或多个标记基因;合适的转录控制元件(如启动子、增强子和终止子)。为了表达(即翻译),还通常需要一种或多种翻译控制元件,例如核糖体结合位点、翻译起始位点和终止密码子。
[0218]
含有感兴趣多核苷酸的载体可以通过任何适当的方法引入宿主细胞,包括电穿孔;使用氯化钙、氯化铷、磷酸钙、deae-葡聚糖或其他物质的转染;微粒轰击;脂质体转染;和感染(例如,载体是感染性试剂如痘苗病毒)。导入载体或多核苷酸的选择通常取决于宿主细胞的特征。
[0219]
编码本文公开的bcma特异性car的多核苷酸可以存在于表达盒或表达载体(例如,用于引入细菌宿主细胞的质粒、或用于转染昆虫宿主细胞的如杆状病毒载体的病毒载体、或质粒、或用于转染哺乳动物宿主细胞的如慢病毒的病毒载体)。在一些实施方案中,多核苷酸或载体可以包括编码核糖体跳跃序列的核酸序列,例如但不限于编码2a肽的序列。在小核糖核酸病毒的口蹄疫病毒亚型中鉴定的2a肽导致核糖体从一个密码子“跳跃”到下一个,而不在密码子编码的两个氨基酸之间形成肽键(参见(donnelly and elliott 2001;atkins,wills et al.2007;doronina,wu et al.2008))。“密码子”是指mrna上(或dna分子的有义链上)的由核糖体翻译成一个氨基酸残基的三个核苷酸。因此,当多肽被框架中的2a寡肽序列分开时,可以由imrna内的单个邻接的开放阅读框合成两个多肽。这种核糖体跳跃机制是本领域公知的,并且已知用于由几个载体表达的由单个信使rna编码的几种蛋白质。
[0220]
为了将跨膜多肽导入宿主细胞的分泌途径,在一些实施方案中,在多核苷酸序列或载体序列中提供分泌信号序列(也称为前导序列、原序列或前序列)。分泌信号序列可操作地连接到跨膜核酸序列,即两个序列以正确的阅读框架连接并定位以将新合成的多肽导入宿主细胞的分泌途径。分泌信号序列通常位于编码感兴趣多肽的核酸序列5'端,尽管某些分泌信号序列可以位于感兴趣的核酸序列的其他位置(参见例如welch et al.,u.s.patent no.5,037,743;holland et al.,u.s.patent no.5,143,830)。在一些实施方案中,信号肽包括如seq id no:318或329所示的氨基酸序列。本领域技术人员将认识到,鉴于遗传密码的简并性,在这些多核苷酸分子之间可能有相当大的序列变异。在一些实施方案中,本发明的核酸序列是用于在哺乳动物细胞中表达的优化密码子,优选用于在人细胞中表达。密码子优化是指在感兴趣序列中把通常在给定物种的高度表达的基因中罕见的密
码子与通常在此物种的高度表达的基因中频繁的密码子交换,此类密码子编码被交换的密码子所编码的氨基酸。
[0221]
在一些实施方案中,根据本发明的多核苷酸包括选自以下的核酸序列:seq id no:1397。本发明涉及的多核苷酸包括与选自seq id no:1397的核酸序列具有至少70%、优选至少80%、更优选至少90%、95%、97%或99%的序列相同性。
[0222]
改造免疫细胞的方法
[0223]
本文提供了用于免疫治疗的免疫细胞的制备方法。在一些实施方案中,该方法包括将根据本发明的car引入免疫细胞并扩增细胞。在一些实施方案中,本发明涉及一种改造免疫细胞的方法,包括:提供细胞并在细胞表面表达至少一种如上所述的car。改造免疫细胞的方法描述于例如pct专利申请公开号wo/2014/039523、wo/2014/184741、wo/2014/191128、wo/2014/184744和wo/2014/184143中,其全部内容通过引用并入本文。在一些实施方案中,该方法包括:用如上所述的至少一种编码car的多核苷酸转染细胞,并在细胞中表达多核苷酸。
[0224]
在一些实施方案中,多核苷酸存在于慢病毒载体中以在细胞中稳定表达。
[0225]
在一些实施方案中,该方法可以进一步包括通过使至少一个基因失活的遗传修饰的步骤,至少一个基因所述基因表达例如但不限于tcr的组分、免疫抑制剂的靶、hla基因、和/或免疫检查点蛋白(例如pdcd1或ctla-4)。基因失活旨在使得目的基因不是以功能性蛋白质的形式表达。在一些实施方案中,待失活的基因选自以下一组,例如但不限于tcrα、tcrβ、cd52、gr、pd-1和ctla-4。在一些实施方案中,该方法包括通过向细胞中引入能够通过选择性dna切割来选择性地使基因失活的稀有切割核酸内切酶来使一种或多种基因失活。在一些实施方案中,稀有切割的核酸内切酶可以是例如转录激活子样效应子核酸酶(tale-核酸酶)或cas9核酸内切酶。
[0226]
在一些实施方案中,额外的催化结构域与稀有切割核酸内切酶一起使用以增强其使靶基因失活的能力。例如,额外的催化结构域可以是dna末端加工酶。dna末端加工酶的非限制性实施例包括5-3'核酸外切酶、3-5'核酸外切酶、5-3'碱性核酸外切酶、5'瓣状核酸内切酶(flap endonuclease)、解旋酶、磷酸酶(hosphatase)、水解酶和模板非依赖性dna聚合酶。这种催化结构域的非限制性实施例包括选自以下一组的蛋白质结构域或蛋白质结构域的催化活性衍生物:hexoi(exo1_human)、酵母exoi(exo1_yeast)、大肠杆菌exoi、人trex2、小鼠trex1、人trex1、牛trex1、大鼠trex1、tdt(末端脱氧核苷酸转移酶)人dna2、酵母dna2(dna2_yeast)。在一些实施方案中,额外的催化结构域可以具有3'-5'-核酸酶外切活性,以及在一些实施方案中,所述额外的催化结构域是trex,更优选trex2催化结构域(wo2012/058458)。在一些实施方案中,所述催化结构域由单链trex多肽编码。额外的催化结构域可以与核酸酶融合蛋白或嵌合蛋白融合。在一些实施方案中,使用例如肽接头将额外的催化结构域融合。
[0227]
在一些实施方案中,该方法还包括向细胞中引入含有至少与靶核酸序列的一部分同源的序列的外源核酸的步骤,使得靶核酸序列和外源核酸之间发生同源重组。在一些实施方案中,所述外源核酸分别包括与靶核酸序列的5'区域和3'区域同源的第一部分和第二部分。外源核酸还可以包括位于第一部分和第二部分之间的第三部分,其不包括与靶核酸序列的5'区域和3'区域的同源性。在靶核酸序列切割之后,在靶核酸序列和外源核酸之间
刺激同源重组事件。在一些实施方案中,可以在供体基质内使用至少约50bp、大于约100bp、或大于约200bp的同源序列。外源核酸可以是例如但不限于约200bp至约6000bp,更优选约1000bp至约2000bp。共享的核酸同源性位于断裂位点的上游和下游侧翼区域,并且待引入的核酸序列位于两个臂之间。
[0228]
在一些实施方案中,核酸依次包括与所述切割上游序列同源的第一区域;用于失活选自以下一组靶基因的序列:tcrα、tcrβ、cd52、糖皮质激素受体(gr)、脱氧胞苷激酶(dck)和免疫检查点蛋白(例如程序性死亡-1(pd-1));以及与切割下游的序列同源的第二区域。多核苷酸引入步骤可以在引入或表达稀有切割核酸内切酶之前或之后或同时进行。根据其中发生断裂事件的靶核酸序列的位置,这种外源核酸可用于敲除基因,例如,当外源核酸位于基因的开放阅读框内时,或引入新的感兴趣的序列或基因。通过使用这样的外源核酸的序列插入可以用于修饰靶基因,通过校正或替换基因(作为非限制性实施例的等位基因交换)、或者上调或下调靶基因的表达(作为非限制性实施例的启动子交换)、靶基因校正或替换。在一些实施方案中,选自tcrα、tcrβ、cd52、gr、dck和免疫检查点蛋白的基因的失活可以在由特异性tale-核酸酶靶向的精确基因组位置处进行,其中所述特异性tale-核酸酶催化切割,并且其中所述外源核酸依次包括至少一个同源区域和一种通过同源重组整合的使得选自以下一组靶向基因失活的序列:tcrα、tcrβ、cd52、gr、dck、免疫检验点蛋白。在一些实施方案中,几种基因可以依次或同时通过分别使用若干tale-核酸酶而依次或同时失活,并且特异性靶向一个特定基因和几个特异性多核苷酸来使具体基因失活。
[0229]
在一些实施方案中,所述方法包括使一种或多种选自以下的额外基因失活:tcrα、tcrβ、cd52、gr、dck和免疫检查点蛋白。在一些实施方案中,基因的失活可以通过向细胞中引入至少一种稀有切割核酸内切酶来实现,使得稀有切割核酸内切酶特异性催化细胞基因组靶向序列中的切割;并且任选地,向细胞中依次引入包括与切割上游序列同源的第一区域、待插入细胞基因组的序列、和与切割下游序列同源的第二区域的外源核酸;其中引入的外源核酸使基因失活并且整合至少一种编码至少一种目标重组蛋白质的外源多核苷酸序列。在一些实施方案中,外源多核苷酸序列被整合到编码选自以下一组蛋白的基因内:tcrα、tcrβ、cd52、gr、dck和免疫检查点蛋白。
[0230]
在另一方面,遗传修饰细胞的步骤可以包括:通过使至少一种表达免疫抑制剂靶点的基因失活来修饰t细胞,以及;任选地在免疫抑制剂的存在下扩增细胞。免疫抑制剂是通过几种作用机制之一抑制免疫功能的制剂。免疫抑制剂可以减少免疫应答的程度和/或贪婪(voracity)。免疫抑制剂的非限制性实施例包括钙调神经磷酸酶抑制剂、雷帕霉素靶点、白细胞介素-2α链阻断剂、肌苷一磷酸脱氢酶抑制剂、二氢叶酸还原酶抑制剂、皮质类固醇和免疫抑制抗代谢物。一些细胞毒性免疫抑制剂通过抑制dna合成起作用。其他的可以通过激活t细胞或通过抑制辅助细胞的激活来起作用。根据本发明的方法允许通过使t细胞中的免疫抑制剂靶点失活的免疫治疗来赋予t细胞免疫抑制抗性。作为非限制性实施例,免疫抑制剂的靶点可以是免疫抑制剂的受体,例如但不限于cd52、糖皮质激素受体(gr)、fkbp家族基因成员和亲环蛋白家族基因成员。
[0231]
在一些实施方案中,该方法的遗传修饰包括在提供的待改造细胞中表达一种稀有切割核酸内切酶的使得稀有切割核酸内切酶特异性催化一种靶基因中的切割,从而使目标基因失活。在一些实施方案中,改造细胞的方法包括以下步骤中的至少一个:提供t细胞,例
如来自细胞培养物或来自血液样品;选择表达免疫抑制剂靶的t细胞中的基因;向t细胞中引入能够通过dna切割选择性失活的稀有切割核酸内切酶,优选通过双链断裂编码免疫抑制剂靶的基因,以及扩增细胞,任选地在免疫抑制剂存在下。
[0232]
在一些实施方案中,该方法包括:提供t细胞,例如来自细胞培养物或来自血液样品;在t细胞中选择基因,其中所述基因表达免疫抑制剂的靶;用编码通过dna切割选择性失活的稀有切割核酸内切酶的核酸转染t细胞,优选通过双链断裂编码免疫抑制剂靶的基因,并将稀有切割核酸内切酶表达到t细胞中;以及扩增细胞,任选地在免疫抑制剂的存在下。
[0233]
在一些实施方案中,稀有切割核酸内切酶特异性靶向cd52或gr。在一些实施方案中,选择用于灭活的基因编码cd52,以及免疫抑制治疗包括靶向cd52抗原的人源化抗体。在一些实施方案中,选择用于失活的基因编码gr,并且免疫抑制治疗包括皮质类固醇,例如地塞米松。在一些实施方案中,选择用于失活的基因是fkbp家族基因成员或其变体,并且免疫抑制治疗包括fk506,也称为他克莫司或藤霉素(fujimycin)。在一些实施方案中,fkbp家族基因成员是fkbp12或其变体。在一些实施方案中,选择用于灭活的基因是亲环蛋白家族基因成员或其变体,并且免疫抑制治疗包括环孢菌素。
[0234]
在一些实施方案中,稀有切割核酸内切酶可以是例如大范围核酸酶、锌指核酸酶、或tale-核酸酶(talen)。在一些实施方案中,稀有切割核酸内切酶是tale-核酸酶。
[0235]
本文还提供了适用于免疫治疗的t细胞的改造方法,其中该方法包括:通过使至少免疫检查点蛋白失活来遗传修饰t细胞。在一些实施方案中,免疫检查点蛋白是例如pd-1和/或ctla-4。在一些实施方案中,遗传修饰细胞的方法包括:通过使至少一种免疫检查点蛋白失活来修饰t细胞;并扩增细胞。免疫检查点蛋白包括但不限于程序性死亡1(pd-1,也称为pdcd1或cd279,登记号:nm-005018)、细胞毒性t淋巴细胞抗原4(ctla-4,也称为cd152,genbank登记号af414120.1)、lag3(也称为cd223,登记号:nm-002286.5)、tim3(也称为havcr2,genbank登录号:jx049979.1)、btla(也称为cd272,登记号:nm-181780.3)、by55(也称为cd160,genbank登记号:cr541888.1)、tigit(也称为vstm3,登记号:nm-173799)、b7h5(也称为c10orf54,小鼠vista基因的同源物,登记号:nm-022153.1)、lair1(也称为cd305,genbank登记号:cr542051.1)、siglec10(genebank登记号:ay358337.1)、2b4(也称为cd244,登记号:nm-001166664.1),其直接抑制免疫细胞。例如,ctla-4是在某些cd4和cd8 t细胞上表达的细胞表面蛋白;当通过其配体(b7-1和b7-2)与抗原呈递细胞上接合时,t细胞活化和效应子功能被抑制。
[0236]
在一些实施方案中,所述用于改造细胞的方法包括以下步骤中的至少一个:提供t细胞,例如来自细胞培养物或来自血液样品;向t细胞中引入能够通过dna切割选择性失活的稀有切割核酸内切酶,优选通过双链断裂编码免疫检查点蛋白的基因;并扩增细胞。在一些实施方案中,所述方法包括:提供t细胞,例如来自细胞培养物或来自血液样品;用编码能够通过dna切割选择性失活的稀有切割核酸内切酶的核酸转染所述t细胞,优选通过双链断裂编码免疫检查点蛋白的基因;将稀有切割核酸内切酶表达到t细胞中;扩增细胞。在一些实施方案中,稀有切割核酸内切酶特异性靶向选自以下的基因:pd-1、ctla-4、lag3、tim3、btla、by55、tigit、b7h5、lair1、siglec10、2b4、tcrα和tcrβ。在一些实施方案中,稀有切割核酸内切酶可以是大范围核酸酶、锌指核酸酶、或tale-核酸酶。在一些实施方案中,稀有切割核酸内切酶是tale-核酸酶。
[0237]
在一些实施方案中,本发明可特别适用于同种异体免疫治疗。在这样的实施方案中,可以通过以下方法修饰细胞,所述方法包括:在t细胞中使至少一种编码t细胞受体(tcr)组分的基因失活;并扩增t细胞。在一些实施方案中,该方法的遗传修饰依赖于所提供的细胞中表达一稀少切割的核酸内切酶,使得稀有切割核酸内切酶特异性催化一靶向基因中的切割,从而使目标基因失活。在一些实施方案中,所述用于改造细胞的方法包括以下步骤中的至少一个:提供t细胞,例如来自细胞培养物或来自血液样品;向t细胞中引入能够通过dna切割选择性失活的稀有切割核酸内切酶,优选通过双链断裂至少一种编码t细胞受体(tcr)组分的基因,并扩增细胞。
[0238]
在一些实施方案中,所述方法包括:提供t细胞,例如来自细胞培养物或来自血液样品;用编码能够通过dna切割选择性失活的稀有切割核酸内切酶的核酸转染所述t细胞,优选通过双链断裂至少一种编码t细胞受体(tcr)组分的基因;将稀有切割核酸内切酶表达到t细胞中;对在其细胞表面不表达tcr的转化t细胞进行分选;以及扩增细胞。
[0239]
在一些实施方案中,稀有切割核酸内切酶可以是大范围核酸酶、锌指核酸酶、或tale-核酸酶。在一些实施方案中,稀有切割核酸内切酶是tale-核酸酶。在一些实施方案中,tale-核酸酶识别并切割编码tcrα或tcrβ的序列。在一些实施方案中,tale-核酸酶包括选自seq id no:334、335、336、337、338、339、340或341中所示的氨基酸序列的多肽序列
[0240]
tale-核酸酶多肽序列:
[0241]
repeat trac_t01-l
[0242]
ltpqqvvaiasngggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpqqvvaiasngggrpale(seq id no:334)
[0243]
repeat trac_t01-r
[0244]
ltpeqvvaiashdggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpqqvvaiasngggrpale(seq id no:335)
[0245]
repeat trbc_t01-l
[0246]
ltpqqvvaiasnnggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpqqvvaiasnnggk
qaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpqqvvaiasngggrpale(seq id no:336)
[0247]
repeat trbc_t01-r
[0248]
npqrstvwyltpqqvvaiasnnggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpqqvvaiasngggrpale(seq id no:337)
[0249]
repeat trbc_t02-l
[0250]
ltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpqqvvaiasngggrpale(seq id no:338)
[0251]
repeat trbc_t02-r
[0252]
ltpqqvvaiasnnggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpqqvvaiasngggrpale(seq id no:339)
[0253]
repeat cd52_t02-l
[0254]
ltpqqvvaiasngggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqv
vaiashdggkqaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpqqvvaiasngggrpale(seq id no:340)
[0255]
repeat cd52_t02-r
[0256]
ltpqqvvaiasngggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpqqvvaiasnnggkqaletvqrllpvlcqahgltpqqvvaiasngggkqaletvqrllpvlcqahgltpeqvvaiasniggkqaletvqallpvlcqahgltpeqvvaiashdggkqaletvqrllpvlcqahgltpqqvvaiasngggrpale(seq id no:341)
[0257]
在另一方面,遗传修饰细胞的另一步骤可以是扩增tcrα缺陷型t细胞的方法,包括将ptα(也称为pretcrα)或其功能变体引入t细胞,并扩增细胞,任选地通过刺激cd3复合物。在一些实施方案中,该方法包括:a)用编码至少一个ptα片段的核酸转染细胞以支持cd3表面表达;b)将所述ptα表达到细胞中;和c)扩增细胞,任选地通过刺激cd3复合物。
[0258]
还提供了制备用于免疫治疗的t细胞的方法,包括t细胞扩增方法的步骤。在一些实施方案中,ptα多核苷酸序列可以随机引入或通过同源重组引入。在一些实施方案中,插入可以与tcrα基因的失活相关。
[0259]
可以使用ptα的不同功能变体。肽的“功能变体”是指与整个肽或其片段基本上相似的分子。ptα或其功能变体的“片段”是指分子的任何亚单位,即比全长ptα短的肽。在一些实施方案中,ptα或功能变体可以是例如全长ptα或c末端缺失的ptα版本。c末端缺失的ptα缺少c末端的一个或多个残基。作为非限制性实施例,c-末端缺失的ptα版本缺少蛋白质c末端的18、48、62、78、92、110或114个残基。肽的氨基酸序列变体可以通过突变编码肽的dna来制备。此类功能变体包括例如氨基酸序列内的残基缺失或插入或取代。也可以是缺失、插入和取代的任何组合以得到最终构建体,提供的最终构建体具有期望的活性,特别是功能性cd3复合物的恢复。在优选的实施方案中,如上所述,在不同的ptα版本中引入至少一个突变以影响二聚化。作为非限制性实施例,突变的残基可以至少是人ptα蛋白的w46r、d22a、k24a、r102a或r117a,或使用clustalw方法在ptα家族或同系物上比对的位置。优选如上所述的ptα或其变体包括突变残基w46r或突变残基d22a、k24a、r102a和r117a。在一些实施方案中,作为非限制性实施例,所述ptα或变体与信号转导结构域融合,例如cd28、ox40、icos、cd27、cd137(4-1bb)和cd8。如上所述的ptα或变体的细胞外结构域可以与tcrα蛋白的片段融合,特别是tcrα的跨膜结构域和细胞内结构域。ptα变体也可以与tcrα的细胞内结构域融合。
[0260]
在一些实施方案中,ptα版本可以与细胞外配体结合结构域融合。在一些实施方案中,ptα或其功能变体与包括通过柔性接头连接的靶抗原特异性单克隆抗体的轻链可变片段和重链可变片段的单链抗体片段(scfv)融合。
[0261]
术语“tcrα缺陷型t细胞”是指缺乏功能性tcrα链表达的分离的t细胞。这可以通过不同的手段实现,作为非限制性实施例,通过改造t细胞使得其在其细胞表面上不表达任何功能性tcrα,或通过改造t细胞使得其在其表面上产生非常少的功能性tcrα链,或通过改造
t细胞来表达突变形式或缺失形式tcrα链。tcrα缺陷细胞不能再通过cd3复合物扩增。因此,为了克服这个问题并允许tcrα缺陷细胞的增殖,将ptα或其功能变体引入细胞中,从而恢复功能性cd3复合物。在一些实施方案中,该方法还包括向所述t细胞中引入能够通过dna切割而选择性失活一编码t细胞受体(tcr)组分基因的稀有切割核酸内切酶。在一些实施方案中,稀有切割核酸内切酶是tale-核酸酶。
[0262]
在另一方面,通过本文所述方法获得的经改造的t细胞可与双特异性抗体接触。例如,t细胞可以在施用至患者之前离体接触双特异性抗体,或者在施用至患者后在体内接触。双特异性抗体包括具有不同抗原性质的两个可变区,其促使经改造的细胞接近靶抗原。作为非限制性实施例,双特异性抗体可针对肿瘤标志物和淋巴细胞抗原,例如但不限于cd3,并且具有重新定向和激活任何循环t细胞抵抗肿瘤的潜力。
[0263]
在一些实施方案中,编码根据本发明的多肽的多核苷酸可以是直接引入细胞的mrna,例如通过电穿孔。在一些实施方案中,cytopulse技术可用于暂时透化活细胞以将材料输送到细胞中。可以修改参数以便确定以最小的死亡率达到高转染效率的条件。
[0264]
本文还提供了转染t细胞的方法。在一些实施方案中,该方法包括:使t细胞与rna接触并向t细胞施加由以下组成的agile pulse序列:(a)电脉冲,其电压范围为约2250至3000v/厘米;(b)脉冲宽度0.1ms;(c)步骤(a)和(b)的电脉冲之间的脉冲间隔约为0.2至10ms;(d)电脉冲,其电压范围为约2250至3000v、脉冲宽度约100ms,以及步骤(b)的电脉冲与步骤(c)的第一电脉冲之间的脉冲间隔约为100ms;和(e)四个电脉冲,其电压约为325v、脉冲宽度约为0.2ms,以及4个电脉冲每个之间的脉冲间隔为2ms。在一些实施方案中,一种转染t细胞的方法,包括使所述t细胞与rna接触并向t细胞施加由以下组成的agile pulse序列:(a)电脉冲,其电压为约2250、2300、2350、2400、2450、2500、2550、2400、2450、2500、2600、2700、2800、2900或3000v/厘米;(b)脉冲宽度0.1ms;(c)步骤(a)和(b)的电脉冲之间的脉冲间隔约为0.2、0.5、1、2、3、4、5、6、7、8、9或10ms;(d)电脉冲,其电压范围从约2250、如2250、2300、2350、2400、2450、2500、2550、2400、2450、2500、2600、2700、2800、2900到3000v、脉冲宽度约100ms,以及步骤(b)的电脉冲与步骤(c)的第一电脉冲之间的脉冲间隔约为100ms;和(e)四个电脉冲,其电压约为325v、脉冲宽度约为0.2ms,以及4个电脉冲每个之间的脉冲间隔为2ms。在本技术中公开了包括在上述值范围内的任何值。电穿孔介质可以是本领域已知的任何合适的介质。在一些实施方案中,电穿孔介质具有跨越约0.01至约1.0毫西门子的范围内的电导率。
[0265]
在一些实施方案中,作为非限制性实施例,rna编码稀有切割核酸内切酶、稀有切割核酸内切酶的一种单体如半-tale-核酸酶、car、多链嵌合抗原受体的至少一种组分、ptα或其功能变体、外源核酸、和/或一额外的催化结构域。
[0266]
经改造的免疫细胞
[0267]
本发明还提供包括本文所述的任何car多核苷酸的经改造的免疫细胞。在一些实施方案中,可以通过质粒载体将car作为转基因引入免疫细胞。在一些实施方案中,质粒载体还可以含有例如选择标记,其提供接收载体的细胞的鉴定和/或选择。
[0268]
在将编码car多肽的多核苷酸引入细胞后,可以在细胞中原位合成car多肽。或者,可以在细胞外生产car多肽,然后将其引入细胞。将多核苷酸构建体引入细胞的方法是本领域已知的。在一些实施方案中,可以使用稳定的转化方法将多核苷酸构建体整合到细胞的
基因组中。在其他实施方案中,瞬时转化方法可用于瞬时表达多核苷酸构建体,并且多核苷酸构建体未整合到细胞的基因组中。在其它实施方案中,可以使用病毒介导的方法。多核苷酸可以通过任何合适的方法引入细胞,例如重组病毒载体(例如逆转录病毒、腺病毒),脂质体等。瞬时转化方法包括,例如但不限于显微注射、电穿孔或微粒轰击。多核苷酸可以包括在载体中,例如质粒载体或病毒载体。
[0269]
本文还提供了通过上述本文提供的改造细胞方法获得的分离的细胞和细胞系。在一些实施方案中,分离的细胞包括至少一种如上所述的car。在一些实施方案中,分离的细胞包括car的群体,每种car包括不同的细胞外配体结合结构域。
[0270]
本文还提供了根据上述任一方法获得的分离的免疫细胞。能够表达异源dna的任何免疫细胞可用于表达感兴趣的car的目的。在一些实施方案中,免疫细胞是t细胞。在一些实施方案中,免疫细胞可以衍生自例如但不限于干细胞。干细胞可以是成体干细胞、非人胚胎干细胞、更具体地是非人干细胞、脐带血干细胞、祖细胞、骨髓干细胞、诱导多能干细胞、全能干细胞或造血干细胞。代表性的人细胞是cd34+细胞。分离的细胞还可以是树突状细胞、杀伤树突状细胞、肥大细胞、nk细胞、b细胞或选自以下的t细胞:炎性t淋巴细胞、细胞毒性t淋巴细胞、调节性t淋巴细胞、或辅助性t淋巴细胞。在一些实施方案中,细胞可以衍生自以下的细胞:cd4+t淋巴细胞和cd8+t淋巴细胞。
[0271]
在扩增和遗传修饰之前,细胞来源可以通过各种非限制性方法从患者处获得。细胞可以从许多非限制性来源获得,包括外周血单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、来自感染部位的组织、腹水、胸腔积液、脾组织和肿瘤。在一些实施方案中,可以使用本领域技术人员可用和已知的任何数量的t细胞系。在一些实施方案中,细胞可以衍生自健康供体、来自诊断为癌症的患者、或诊断患有感染的患者。在一些实施方案中,细胞可以是呈现不同表型特征的细胞的混合群的一部分。
[0272]
本文还提供根据任何上述方法从转化t细胞获得的细胞系。本文还提供了对免疫抑制治疗具有抗性的经修饰的细胞。在一些实施方案中,根据本发明的分离的细胞包括编码car的多核苷酸。
[0273]
本发明的免疫细胞可以在t细胞的遗传修饰之前或之后被激活和扩增,通常使用如下描述的方法,例如但不限于美国专利6,352,694;6,534,055;6,905,680;6,692,964;5,858,358;6,887,466;6,905,681;7,144,575;7,067,318;7,172,869;7,232,566;7,175,843;5,883,223;6,905,874;6,797,514;6,867,041;和美国专利申请公开号20060121005。t细胞可以在体外或体内扩增。通常,本发明的t细胞可以例如通过与刺激cd3 tcr复合物和t细胞表面上的共刺激分子以产生t细胞激活信号的试剂接触来扩增。例如,可以使用诸如钙离子载体a23187、佛波醇12-肉豆蔻酸酯13-乙酸酯(pma)、或有丝分裂凝集素如植物血凝素(pha)的化学品来产生t细胞的激活信号。
[0274]
在一些实施方案中,t细胞群体可以通过在体外与例如抗cd3抗体、或其抗原结合片段、或固定在表面上的抗cd2抗体接触被刺激,或通过与蛋白激酶c激活剂(例如,苔藓抑素)连同钙离子载体的接触来刺激。为了共同刺激t细胞表面上的辅助分子,使用结合辅助分子的配体。例如,在适合于刺激t细胞增殖的条件下,t细胞群可与抗cd3抗体和抗cd28抗体接触。适用于t细胞培养的条件包括可能含有增殖和活力所必需因子的合适培养基(例如minimal essential media或rpmi media 1640、或x-vivo 5、(lonza)),其中必需的因子包
括血清(例如胎牛或人类血清)、白介素-2(il-2)、胰岛素、ifn-γ、il-4、il-7、gm-csf、il-10、il-2、il-15、tgfp和tnf,或本领域技术人员已知的用于细胞生长的添加剂。其它用于细胞生长的添加剂包括但不限于表面活性剂、人血浆蛋白粉、和还原剂如n-乙酰-半胱氨酸和2-巯基乙酸。培养基可以包括rpmi 1640、a1m-v、dmem、mem、a-mem、f-12、x-vivo 1和x-vivo 20、optimizer、添加氨基酸、丙酮酸钠和维生素、无血清或适量补充的血清(或血浆)或一组明确的激素、和/或一定量的足以使t细胞生长和扩增的细胞因子。抗生素例如青霉素和链霉素仅包括在实验培养物中,而不在要灌注患者的细胞培养物中。靶细胞保持在支持生长所必需的条件下,例如适当的温度(例如37℃)和环境(例如,空气加5%co2)。暴露于不同刺激时间的t细胞可能表现出不同的特征。
[0275]
在一些实施方案中,本发明的细胞可以通过与组织或细胞共培养来扩增。细胞还可以在体内扩增,例如在将细胞施用至患者之后在患者的血液中扩增。
[0276]
在一些实施方案中,根据本发明的分离的细胞包括选自以下的一种失活基因:cd52、gr、pd-1、ctla-4、lag3、tim3、btla、by55、tigit、b7h5、lair1、siglec10、2b4、hla、tcrα和tcrβ和/或表达car、多链car和/或ptα转基因。在一些实施方案中,分离的细胞包括编码含有多链car的多肽的多核苷酸。在一些实施方案中,根据本发明的分离的细胞包括选自以下的两种失活基因:cd52和gr、cd52和tcrα、cdr52和tcrβ、gr和tcrα、gr和tcrβ、tcrα和tcrβ、pd-1和tcrα、pd-1和tcrβ、ctla-4和tcrα、ctla-4和tcrβ、lag3和tcrα、lag3和tcrβ、tim3和tcrα、tim3和tcrβ、btla和tcrα、btla和tcrβ、by55和tcrα、by55 tcrβ、tigit和tcrα、tigit和tcrβ、b7h5和tcrα、b7h5和tcrβ、lair1和tcrα、lair1和tcrβ、siglec10和tcrα、siglec10和tcrβ、2b4和tcrα、2b4和tcrβ和/或表达car、多链car和ptα转基因。
[0277]
在一些实施方案中,通过失活tcrα基因和/或tcrβ基因,tcr在根据本发明的细胞中不起作用。在一些实施方案中,提供了从个体获得经修饰的细胞的方法,其中所述细胞增殖独立于主要组织相容性复合物(mhc)信号传导途径。通过独立于主要组织相容性复合物(mhc)信号传导途径增殖的经修饰的细胞易于通过该方法获得,该经修饰的细胞被包括在本发明的范围内。本文公开的经修饰的细胞可用于治疗对其有需要的患者,用于对抗宿主抗移植物(hvg)排斥和移植物抗宿主病(gvhd);因此在本发明的范围内的一种治疗对其有需要的患者的用于对抗宿主抗移植物(hvg)排斥和移植物抗宿主病(gvhd)的方法,包括通过向所述患者施用有效量的含有灭活tcrα和/或tcrβ基因的经修饰的细胞来治疗所述患者。
[0278]
在一些实施方案中,经改造的免疫细胞对一种或多种化疗药物具有抗性。化疗药物可以是例如嘌呤核苷酸类似物(pna),从而使免疫细胞适合于过继性免疫治疗和化疗结合的癌症治疗。示例性的pna包括,例如单独或组合的氯法拉宾、氟达拉滨和阿糖胞苷。pna被脱氧胞苷激酶(dck)代谢为单磷酸pna、二磷酸pna和三磷酸pna。它们的三磷酸盐形式与atp竞争用于dna合成,作为促凋亡剂,并且是参与三核苷酸生产的核糖核苷酸还原酶(rnr)的有效抑制剂。本文提供了包括失活的dck基因的bcma特异性car-t细胞。在一些实施方案中,通过例如mrna电穿孔用编码针对dck基因的特异性tal-核酸酶的多核苷酸转染t细胞来制备dck敲除细胞。dck敲除bcma特异性car-t细胞对pna(包括例如克罗莫拉滨和/或氟达拉滨)具有抗性并维持t细胞对bcma表达细胞的细胞毒性活性。
[0279]
在一些实施方案中,本发明的分离的细胞或细胞系可以包括ptα或其功能变体。在
一些实施方案中,分离的细胞或细胞系可通过使tcrα基因失活来进一步进行遗传修饰。
[0280]
在一些实施方案中,car-t细胞包括编码自杀多肽的多核苷酸,例如rqr8。参见例如wo2013153391a,其全部内容通过引用并入本文。在包括多核苷酸的car-t细胞中,自杀多肽在car-t细胞的表面表达。在一些实施方案中,自杀多肽包括seq id no:342所示的氨基酸序列。cpysnpslcsggggselptqgtfsnvstnvspakptttacpysnpslcsggggspaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvllls lvitlycnhrnrrrvckcprpvv(seq id no:342)
[0281]
自杀多肽还可以在氨基末端包括信号肽。在一些实施方案中,自杀多肽包括seq id no:400所示的氨基酸序列。
[0282]
mgtsllcwmalcllgadhadacpysnpslcsggggselptqgtfsnvstnvspakptttacpysnpslcsggggspaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlycnhrnrrrvckcprpvv(seq id no:400)
[0283]
当自杀多肽在car-t细胞的表面表达时,利妥昔单抗与多肽的r表位的结合导致细胞溶解。多于一个利妥昔单抗分子可以结合细胞表面表达的每个多肽。多肽的每个r表位可以结合单独的利妥昔单抗分子。bcma特异性car-t细胞的删除可以在体内发生,例如通过向患者施用利妥昔单抗。删除转移的细胞的决定可能来自转移的细胞在患者体内检测到的不良作用,其被归因于转移的细胞,例如当检测到不可接受的毒性水平时。
[0284]
在一些实施方案中,car-t细胞在scfv内包含被特异性抗体识别的具有特异性的选定的表位。参见例如pct申请“mab-driven chimeric antigen receptor systems for sorting/depleting engineered immune cells”,于2016年1月25日提交,其全部内容通过引用并入本文。这样的表位有助于分选和/或减少car-t细胞。表位可以选自本领域已知的任何数目的表位。在一些实施方案中,表位可以是被批准用于医疗用途的单克隆抗体的靶点,例如但不限于利妥昔单抗所识别的cd20表位。在一些实施方案中,表位包括seq id no:397所示的氨基酸序列。
[0285]
cpysnpslc(seq id no:397)
[0286]
在一些实施方案中,表位位于car内。例如但不限于,表位可以位于car的scfv和铰链之间。在一些实施方案中,通过接头分开的相同表位的两种实例可以在car中使用。例如,包括如seq id no:398所示氨基酸序列的多肽可以在位于car内的轻链可变区和铰链之间使用。
[0287]
gsggggscpysnpslcsggggscpysnpslcsggggs(seq id no:398)
[0288]
在一些实施方案中,表位特异性抗体可以与细胞毒性药物缀合。还可以通过使用其上是补体系统的嫁接组分的经改造的抗体来促进cdc细胞毒性。在一些实施方案中,car-t细胞的激活可以通过使用识别表位的抗体减少细胞来调节。
[0289]
治疗应用
[0290]
通过上述方法获得的分离的细胞或衍生自这些分离的细胞的细胞系可以用作药物。在一些实施方案中,这种药物可用于治疗癌症。在一些实施方案中,癌症是多发性骨髓瘤、恶性浆细胞肿瘤、霍奇金淋巴瘤、结节性淋巴细胞优势型霍奇金淋巴瘤、卡勒氏病和骨髓瘤、浆细胞白血病、浆细胞瘤、b细胞幼淋巴细胞白血病、毛细胞白血病、b细胞非霍奇金淋巴瘤(nhl)、急性髓细胞性白血病(aml)、慢性淋巴细胞性白血病(cll)、急性淋巴细胞白血
病(all)、慢性髓细胞性白血病(cml)、滤泡性淋巴瘤、伯基特氏淋巴瘤、边缘区淋巴瘤、套细胞淋巴瘤、大细胞淋巴瘤、前体b淋巴母细胞淋巴瘤、骨髓性白血病、瓦尔登斯特伦氏巨球蛋白血症、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤、边缘区淋巴瘤、粘膜相关淋巴组织淋巴瘤、小细胞淋巴细胞淋巴瘤、套细胞淋巴瘤、伯基特淋巴瘤、原发性纵隔(胸腺)大b细胞淋巴瘤、淋巴瘤浆细胞淋巴瘤、巨球蛋白血症、淋巴结边缘区b细胞淋巴瘤、脾边缘区淋巴瘤、血管内大b细胞淋巴瘤、原发性渗出性淋巴瘤、淋巴瘤样肉芽肿病、t细胞/组织细胞丰富的大b细胞淋巴瘤、原发性中枢神经系统淋巴瘤、原发性皮肤弥漫性大b细胞淋巴瘤(腿型)、老年人ebv阳性弥漫性大b细胞淋巴瘤、炎症相关弥漫性大b细胞淋巴瘤、血管内大b细胞淋巴瘤、alk阳性大b细胞淋巴瘤、浆母细胞淋巴瘤、hhv8相关多中心castleman病引起的大b细胞淋巴瘤、具有弥漫性大b细胞淋巴瘤和伯基特淋巴瘤之间的中间特征的未分类b细胞淋巴瘤、具有弥漫性大b-细胞淋巴瘤和经典霍奇金淋巴瘤的中间特征的未分类b细胞淋巴瘤、以及其他b细胞相关淋巴瘤。
[0291]
在一些实施方案中,根据本发明的分离的细胞或衍生自分离的细胞的细胞系可用于制备用于在对其有需要的患者中治疗癌症的药物。
[0292]
本文还提供了治疗患者的方法。在一些实施方案中,该方法包括向对其有需要的患者提供本发明的免疫细胞。在一些实施方案中,该方法包括将本发明的转化的免疫细胞施用至对其有需要的患者的步骤。
[0293]
在一些实施方案中,本发明的t细胞可以经历体内强键的t细胞扩增并且可以持续更长的时间。
[0294]
本发明的治疗方法可以是改善、治愈或预防。本发明的方法可以是自体免疫治疗的一部分或同种异体免疫治疗的一部分。本发明特别适用于同种异体免疫治疗。可以使用标准方案将来自供体的t细胞转化为非同种异体反应性细胞,并根据需要进行复制,从而产生可以施用至一个或多个患者的car-t细胞。这样的car-t细胞疗法可以作为“现成的”治疗产品获得。
[0295]
可以与所公开的方法一起使用的细胞在前面的部分中描述。治疗可用于治疗诊断为例如癌症的患者。可以治疗的癌症包括,例如但不限于涉及b淋巴细胞的癌症,包括任一上述癌症。用本发明的car和car-t细胞治疗的癌症的类型包括但不限于某些白血病或恶性淋巴肿瘤。还包括成人肿瘤/癌症和儿科肿瘤/癌症。在一些实施方案中,治疗可以结合一种或多种选自以下一组针对癌症的疗法:抗体治疗、化学治疗、细胞因子治疗、树突状细胞治疗、基因治疗、激素治疗、激光治疗和放射治疗。
[0296]
在一些实施方案中,可以将治疗施用于进行免疫抑制治疗的患者。实际上,本发明优选依赖于由于编码这种免疫抑制剂受体的基因失活而使其对至少一种免疫抑制剂具有抗性的细胞或细胞群。在这方面,免疫抑制治疗应有助于在患者体内选择和扩增根据本发明的t细胞。根据本发明的细胞或细胞群的施用可以以任何方便的方式进行,包括通过雾化吸入、注射、摄入、输血、植入或移植。本文所述的组合物施用可以通过静脉内或淋巴内注射至皮下、皮内、肿瘤内、淋巴内、髓内、肌内,或腹膜内施用。在一个实施方案中,本发明的细胞组合物优选通过静脉内注射施用。
[0297]
在一些实施方案中,细胞或细胞群的施用可以包括施用例如约104至约109个细胞/kg体重,包括在该范围内的所有细胞数的整数值。在一些实施方案中,细胞或细胞群的施用
可以包括施用约105至106个细胞/kg体重,包括在该范围内的所有细胞数的整数值。可以以一种或多种剂量施用细胞或细胞群。在一些实施方案中,所述有效量的细胞可以以单一剂量施用。在一些实施方案中,所述有效量的细胞可以在一段时间内以多于一种的剂量施用。施用时间在管理医师的判断之内,并取决于患者的临床状况。细胞或细胞群可以从任何来源获得,例如血库或供体。尽管个体需要不同,但确定特定疾病或病症的给定细胞类型的有效量的最佳范围在本领域技术范围内。有效量是指提供治疗或预防益处的量。施用的剂量将取决于接受者的年龄、健康和体重、同时治疗的种类(如果有的话),治疗频率和所需效果的本质。在一些实施方案中,有效量的细胞或组合物包括那些肠胃外施用的细胞。在一些实施方案中,施用可以是静脉内施用。在一些实施方案中,可以直接通过在肿瘤内注射施用。
[0298]
在本发明的一些实施方案中,将细胞与任何数量的相关治疗方式联合(例如,之前、同时或之后)施用于患者,包括但不限于用诸如单克隆抗体治疗、ccr2拮抗剂(例如inc-8761)、抗病毒治疗、西多福韦和白介素-2、阿糖胞苷(也称为ara-c)或对ms患者的nataliziimab治疗或对牛皮癣患者的efaliztimab治疗或对pml患者的其他治疗。在一些实施方案中,将bcma特异性car-t细胞与以下一种或多种联合施用于患者:抗pd-1抗体(例如,nivolumab、pembrolizumab、或pf-06801591)、抗pd-l1抗体(例如,avelumab、atezolizumab或durvalumab)、抗ox40抗体(例如pf-04518600)、抗4-1bb抗体(例如pf-05082566)、抗mcsf抗体(pd-0360324)、抗gitr抗体、和/或抗tigit抗体。在一些实施方案中,将包括seq id no:396所示氨基酸序列的bcma特异性car与抗pd-l1抗体avelumab联合施用于患者。在另外的实施方案中,本发明的t细胞可以与化疗、放疗、免疫抑制剂如环孢菌素、硫唑嘌呤、甲氨蝶呤、霉酚酸酯和fk506、抗体或其它免疫消融剂如campath、抗cd3抗体或其他抗体疗法、细胞毒素、氟达拉滨、环孢菌素、fk506、雷帕霉素、支原体酚酸、类固醇、fr901228、细胞因子和/或照射治疗。这些药物抑制钙依赖钙调神经磷酸酶(环孢菌素和fk506)或抑制对生长因子诱导的信号转导很重要的p70s6激酶(雷帕霉素)(henderson,naya et al.1991;liu,albers et al.1992;bierer,hollander et al.1993)。在另一个实施方案中,本发明的细胞组合物联合骨髓移植(例如,之前、同时或之后),t细胞消融治疗使用化疗剂如氟达拉滨、外放射治疗(xrt)、环磷酰胺、或抗体如okt3或campath。在一些实施方案中,本发明的细胞组合物在b细胞消融治疗(例如与cd20反应的药剂,例如rituxan)后施用。例如,在一个实施方案中,对象可以通过高剂量化学疗法进行标准治疗,然后进行外周血干细胞移植。在某些实施方案中,在移植后,对象接受本发明的扩增免疫细胞的输注。在一些实施方案中,在手术之前或之后施用扩增的细胞。
[0299]
试剂盒
[0300]
本发明还提供了用于本方法的试剂盒。本发明的试剂盒包括一个或多个容器,其包括编码bcma特异性car的多核苷酸,或包括本文所述的编码bcma特异性car的多核苷酸的经改造的免疫细胞,以及根据本文所述的本发明的任何方法使用的说明书。通常,这些说明书包括用于上述治疗性治疗的经改造的免疫细胞的施用描述。
[0301]
本文所述的涉及经改造的免疫细胞的使用的说明书通常包括关于预期治疗的剂量、施用方案和施用途径的信息。容器可以是单位剂量、批量包装(例如,多剂量包装)或亚单位剂量。在本发明的试剂盒中提供的说明书通常是在标签上或包装插页(例如,包括在试剂盒中的纸张)上的书面说明,但是机器可读说明(例如,磁性或光学存储盘上携带的说明)
也是可以接受的。
[0302]
本发明的试剂盒是在合适的包装中。合适的包装包括但不限于小瓶、瓶、罐、软包装(例如,密封的聚酯薄膜袋或塑料袋)等。还可以考虑的是用于与特定装置组合使用的包装,例如吸入器、鼻部施用装置(例如,雾化器)或诸如微型泵的输液装置。试剂盒可以具有无菌入口(例如,容器可以是静脉内溶液袋或具有能被皮下注射针刺穿的塞子的小瓶)。容器还可以具有无菌入口(例如,容器可以是静脉内溶液袋或具有能被皮下注射针刺穿的塞子的小瓶)。组合物中至少有一种活性剂是bcma抗体。容器还可以包括第二药物活性剂。
[0303]
试剂盒可以可选地提供额外组件,例如缓冲液和解释信息。通常,该试剂盒包括容器和在容器上或与容器相联的标签或包装插页。
[0304]
提供以下实施例仅用于说明目的,并不意图以任何方式限制本发明的范围。实际上,除了本文所示和所述的那些之外,本发明的各种修改对于本领域技术人员将从前述中变得明显,并且落在所附权利要求的范围内。
[0305]
本发明的代表性材料于2016年2月9日保藏在美国典型培养物保藏中心(atcc)中。具有atcc保藏号pta-122834的生物保藏是包括编码bcma特异性car的多核苷酸的载体。该保藏是根据“国际承认用于专利程序的微生物保存布达佩斯条约(布达佩斯条约)”规定进行的。这确保从保藏之日起维持30年保藏物的有生存活力的培养物。该保藏物将由atcc根据“布达佩斯条约”的条款提供,并且应服从辉瑞有限公司与atcc之间的协议,这可确保在相关美国专利授权时或在任何美国或外国专利申请公开时(以先到者为准),公众对保藏物的派样无的子代的永久和不受限制的可得性,并确保后代可提供给commissioner of patents and trademarks根据35u.s.c.第112条及根据commissioner’rule确定的有权获得的人(包括37c.f.r.第1.14条,特别是参照886og 638)。
[0306]
本技术的受让人同意,如果保藏材料的培养物在合适的条件下培养时死亡或丢失或毁坏,则将在通知后立即更换为相同的材料。保藏材料的获得不得视为违反任何政府根据其专利法授权授予的权利来实施发明的许可。
实施例
[0307]
实施例1:在25℃和/或37℃下测定bcma/人igg相互作用的动力学和亲和力
[0308]
该实施例测定各种抗bcma抗体在25℃和37℃下的动力学和亲和力。
[0309]
所有实验均在bio-rad proteon xpr36表面等离子体共振生物传感器(bio-rad,hercules,ca)上进行。在bio-rad glc传感器芯片上使用胺偶联法制备一批抗bcma抗体,其类似于abdiche,et al.,anal.biochem.411,139-151(2011)中所描述的。固定的分析温度为25℃,运行缓冲液为hbs-t+(10mm hepes、150mm nacl、0.05%tween-20、ph 7.4)。通过以30μl/min的流速注射1mm ecd和0.25mm nhs的混合物3分钟,在分析物(水平)方向上激活通道。通过在配体(垂直)方向上注射1.5分钟的在30μg/ml 10mm醋酸盐缓冲液(ph 4.5)中的20μg/ml igg,将igg固定在激活点上。通过以30μl/min的流速在分析物方向注射1m乙醇胺(ph8.5)3分钟,以封闭活化表面。
[0310]
在补充有1mg/ml bsa的hbs-t+运行缓冲液中,bcma结合分析的分析温度为37℃或25℃。采用动力学滴定法进行相互作用分析,如abdiche等人所述。使用从低浓度到高浓度的连续注射将人bcma(hubcma)或食蟹猴bcma(cybcma)分析物注射到分析物方向。使用的浓
度为0.08nm、0.4nm、2nm、10nm和50nm(5元系列、5倍稀释因子和最高浓度为50nm)。给定分析物稀释的结合时间为2分钟。在50nm bcma注射后立即监测解离2小时。在bcma分析物注射之前,在bcma分析物周期下使用相同的结合和解离时间注射缓冲液5次以制备用于双参考目的的缓冲空白传感图(双参考,如myszka,j.mol.recognit.12,279-284,1999)。
[0311]
在biaevaluation software 4.1.1版(ge lifesciences,piscataway,nj)中,传感图双参考并拟合至1:1langmuir质量传递动力滴定模型。本发明的各种抗bcma抗体的动力学和亲和力参数示于表4a-4c中。表4a-4c所示的抗体共享与具有相同名称的表1所示的car相同的vh区和vl区。
[0312]
表4a
[0313]
样品ka(1/ms)kd(1/s)t
1/2
(min)kd(pm)a02_rd4_6nm_c011.2e+062.8e-0541124a02_rd4_6nm_c161.1e+066.2e-0518759combo_rd4_0.6nm_c296.6e+061.4e-048321l3py/h3taq2.6e+061.4e-048453
[0314]
表4b
[0315]
[0316]
[0317]
[0318]
[0319][0320]
表4c
[0321]
[0322]
[0323]
[0324][0325]
实施例2:bcma特异性car-t细胞
[0326]
本实施例说明bcma特异性car-t细胞对bcma阳性(bcma+)肿瘤细胞的功能活性。
[0327]
在产生的所有bcma特异性car分子中,基于bcma的亲和力、人bcma和食蟹猴bcma的交叉反应性、以及表位,选择8个用于进一步的活性测试。测试的car分子包括:p5a、p5ac1、p5ac16、pc1、pc1c12、com22、p6dy和p6ap。设计了三种不同的结构:版本1(v1)包括fcγriiiα铰链、版本2(v2)包括cd8α铰链、版本3(v3)包括igg1铰链。制备表5所示的嵌合抗原受体(car),并使用和评估其对bcma+细胞的脱粒活性。在人t细胞中测定每种瞬时表达的car的脱粒活性。
[0328]
表5:示例性bcma特异性car
[0329]
[0330]
[0331]
[0332]
[0333]
[0334]
[0335]
[0336]
[0337]
[0338]
[0339]
[0340]
[0341]
[0342]
sciences)从efs(etablissementsang,paris,france)提供的白膜层样品中纯化t细胞。回收pbmc层,并使用市售的t细胞富集试剂盒(stem cell technologies)纯化t细胞。纯化的t细胞在x-vivo
tm-15培养基(lonza)中被激活,该培养基补充有20ng/ml人il-2(miltenyi biotech)、5%人血清(sera laboratories)和以珠子:细胞比例1:1的dynabeads人t激活剂cd3/cd28(life technologies)。激活后细胞生长并保持在补充有20ng/ml人il-2(miltenyi biotec)和5%人血清(sera laboratories)的x-vivo
tm-15培养基(lonza)中。
[0349]
car mrna转染
[0350]
t细胞纯化和激活后,在第4/5天或第11/12天进行转染。用15μg编码不同car构建体的mrna转染5百万个细胞。使用mmessage mmachine t7试剂盒(life technologies)制备car mrna,并使用rneasy minispin columns(qiagen)纯化。使用pulseagile
tm
cytopulse技术进行转染,该技术通过在最终体积为200μl的“cytoporation buffer t”(btx harvard apparatus)的0.4cm间隔比色杯中施加3000v/cm的2个0.1ms脉冲,之后施加325v/cm的四个0.2ms脉冲。将细胞立即在x-vivo
tm-15培养基(lonza)中稀释,并在37℃下5%co2孵育。il-2(来自miltenyi biotec)在20ng/ml电穿孔后2h加入。
[0351]
脱粒检测(cd107a动员)
[0352]
将t细胞与等量的表达或不表达bcma蛋白的细胞在96孔板(50,000细胞/孔)中孵育。将共培养物在最终体积为100μl的x-vivo
tm-15培养基(lonza)中在37℃下5%co2中保持6小时。cd107a染色在细胞刺激过程中完成,通过在共培养开始时加入荧光抗cd107a抗体(apc结合的,来自miltenyi biotec),连同1μg/ml抗cd49d(bd pharmingen)、1μg/ml抗cd28(miltenyi biotec)、和1
×
莫能菌素溶液(ebioscience)。6h孵育期后,用可固定的活力染料(fixable viability dye)(efluor 780,来自ebioscience)和荧光染料结合的抗cd8(pe结合的miltenyi biotec)染色细胞,并通过流式细胞术分析。测定脱粒活性为cd8+/cd107a+细胞的%,并测定cd8+细胞cd107a染色的平均荧光强度(mfi)信号。mrna转染后24h进行脱粒测定。结果总结在下表6a-9h和9a-9c中。在表中,第二列(标记为“car-t细胞”)表示在转染的t细胞中表达的bcma特异性car。
[0353]
细胞上表达的cd107a是抗原特异性激活的标志物。当与bcma高(h929)、中(mm1s)和低(kms12bm,l363)表达细胞但不是bcma阴性细胞(k562和daudi)孵育时,表达bcma特异性car的cd8 t细胞的cd107a的百分比和mfi增加(表6a-9h和9a-9c)。cd107a表达水平在与bcma接触的空白转染t细胞上没有增加。因此,bcma特异性car-t细胞在表达bcma的细胞存在的情况下被激活,但在不表达bcma的细胞存在的情况下不被激活。
[0354]
这些结果表明,当与表达bcma的细胞孵育时,表达bcma特异性car的t细胞被激活,并且该激活是抗原特异性的。
[0355]
ifnγ释放测定
[0356]
将t细胞与(a)表达bcma的细胞(mm1s、kms12bm、和l363)或(b)不表达bcma蛋白的细胞(k562)一起在96孔板(50,000细胞/孔)中一起孵育。将共培养在最终体积为100μl的x-vivo
tm-15培养基(lonza)中在37℃下5%co2保持24小时。在此孵育期后,将平板以1500rpm离心5分钟,并将上清液回收到新板中。通过elisa试验(人ifnγquantikine elisa试剂盒,来自r&d systems)检测细胞培养上清液中的ifnγ。通过在mrna转染后24小时开始细胞共
培养来进行ifnγ释放测定。结果总结在下表8a-8d和10中。
[0357]
如表8a-8d和10所示,当与中表达bcma细胞(mm1s)或低bcma表达细胞(kms12bm、l363)孵育时,表达bcma特异性car的cd8 t细胞产生ifnγ。相反,当与bcma阴性细胞(k562)孵育时,表达bcma特异性car的cd8 t细胞产生可忽略的ifnγ。
[0358]
这些结果表明,当与bcma表达细胞孵育时,表达bcma特异性car的t细胞被激活,并且该激活是抗原特异性的。
[0359]
细胞毒性测定
[0360]
将t细胞与10,000个靶细胞(表达bcma)和10,000个对照(bcmaneg)细胞在96孔板(100,000细胞/孔)同一孔中一起孵育。在与car+t细胞共培养前,用荧光细胞内染料(cfse或cell trace violet,来自life technologies)标记靶细胞和对照细胞。共培养物在37℃下5%co2孵育4小时。在该孵化期后,用可固定的活力染料(efluor 780,来自ebioscience)标记细胞,并通过流式细胞术分析。测定每个细胞群(靶细胞或bcmaneg对照细胞)的活力,并计算特异性细胞裂解的%。细胞毒性测定在mrna转染后48h进行。结果总结在下表7a-7h中。在表中,细胞毒性数据显示为活细胞百分比,然后以活bcma阳性细胞/活bcma阴性细胞的比例计算。细胞裂解计算为100-空白转染的t细胞。
[0361]
如表7a-7h所示,当表达bcma特异性car的t细胞与中bcma表达细胞(mm1s)或低bcma表达细胞(l363)孵育时,表现出杀伤活性。相比之下,与bcma阴性细胞(k562)孵育时,表达bcma特异性car的cd8 t细胞不显示杀伤活性。
[0362]
综上所述,表达所选择的bcma特异性car的t细胞在与表达bcma的细胞接触时选择性激活。虽然所有版本的bcma特异性car显示出bcma特异性激活,但是与包括fcγriiiα(v1)铰链或igg1(v3)铰链的bcma特异性car相比,包括cd8α铰链(v2)的bcma特异性car显示出增加的激活水平。
[0363]
表6a:脱粒检测结果,供体1
[0364]
[0365][0366]
表6b:脱粒检测结果,供体2
[0367]
[0368][0369]
表6c:脱粒检测结果,供体3
[0370]
[0371][0372]
表6d:脱粒检测结果,供体4
[0373][0374][0375]
表6e:脱粒检测结果,供体5
[0376]
[0377][0378]
表6f:脱粒检测结果,供体6
[0379][0380]
[0381][0382]
表6g:脱粒检测结果,供体7
[0383]
[0384]
[0385][0386]
表6h:脱粒检测结果,供体8
[0387]
[0388][0389]
表7a:细胞毒性数据,供体6
[0390]
[0391][0392]
表7b:细胞毒性数据,供体6
[0393][0394]
表7c:细胞毒性数据,供体7
[0395][0396]
表7d:细胞毒性数据,供体7
[0397]
[0398][0399]
表7e:细胞毒性数据,供体8
[0400][0401]
表7f:细胞毒性数据,供体8
[0402][0403]
表7g:细胞毒性数据,供体9
[0404]
[0405][0406]
表7h:细胞毒性数据,供体9
[0407][0408]
表8a:ifnγ产生(pg/ml),供体6
[0409]
[0410][0411]
[0412]
表8b:ifnγ产生(pg/ml),供体7
[0413]
[0414][0415]
表8c:ifn-γ产生(pg/ml),供体8
[0416]
[0417]
[0418][0419]
表8d:ifn-γ产生(pg/ml),供体9
[0420]
[0421][0422]
表9a:脱粒检测结果,供体10
[0423]
[0424][0425]
表9b:脱粒检测结果,供体11
[0426][0427]
[0428]
表9c:脱粒检测结果,供体12
[0429]
[0430][0431]
表10:ifn gamma释放检测结果,供体10
[0432]
[0433][0434]
实施例3:bcma特异性car-t细胞在mm1.s肿瘤模型中诱导肿瘤消退
[0435]
该实施例说明使用mm1.s肿瘤模型利用bcma特异性car-t细胞治疗肿瘤。
[0436]
用表达荧光素酶和gfp的mm1.s原位模型进行bcma特异性car-t细胞的体内功效研究。将五百万mm1.s luc2agfp细胞通过尾静脉静脉注射到6-8周龄的雌性nod/scid/il2rg-/-(nsg)动物中。腹膜内注射d-荧光素(regis technologies,morton grove,il)(每只动物以15mg/ml注射200ul),随后用异氟烷麻醉,随后的全身生物发光成像(bli)能够监
测肿瘤负荷。通过肿瘤细胞表达的荧光素酶和荧光素之间的相互作用发射的生物发光信号被捕获为图像,通过使用ivis spectrum ct(perkin elmer,ma)进行成像,使用living image 4.4(caliper life sciences,alameda,ca)定量为总光通量(光子/秒)。
[0437]
在本研究中使用三种不同的bcma特异性car-t细胞:表达bcma特异性car构建体的t细胞包括p5ac1-v2、pc1c12-v2或com22-v2(参见上文表5)。非转导对照(non-transduced control)t细胞用作阴性对照。所有t细胞被改造为tcrα缺陷。
[0438]
当所有动物(肿瘤植入后第20天)的总光通量平均达到45e6时,将动物随机分成四组。通过推注尾静脉注射施用单剂量的人bcma特异性car-t细胞或非转导对照t细胞。当它们出现后肢麻痹或体重减轻20%时,终止动物,这是mm1.s原位模型的终点。
[0439]
该研究的结果总结在图1中。在图1中,总光通量[p/s]表示肿瘤进展。与阴性对照(圆圈)相比,使用bcma特异性car-t细胞(三角形、菱形、正方形)的治疗导致较低的总光通量。因此,与阴性对照相比,用bcma特异性car-t细胞治疗抑制肿瘤进展。
[0440]
这些结果表明bcma特异性car-t细胞有效诱导肿瘤消退。
[0441]
实施例4:用bcma特异性car-t细胞治疗多发性骨髓瘤
[0442]
该实施例说明使用molp8原位模型利用bcma特异性car-t细胞治疗多发性骨髓瘤。
[0443]
用表达荧光素酶和gfp的molp8原位模型进行bcma特异性car-t细胞的体内功效研究。将两百万molp8 luc2agfp细胞通过尾静脉静脉内注射入6-8周龄的雌性nsg动物。腹膜内注射d-荧光素(regis technologies,morton grove,il)(每只动物以15mg/ml注射200ul),随后用异氟烷麻醉,随后的全身生物发光成像(bli)能够监测肿瘤负荷。通过肿瘤细胞表达的荧光素酶和荧光素之间的相互作用发射的生物发光信号被捕获为图像,通过使用ivis spectrum ct(perkin elmer,ma)进行成像,使用living image 4.4(caliper life sciences,alameda,ca)定量为总光通量(光子/秒)。
[0444]
当所有动物(肿瘤植入后第8天)的总光通量平均达到30e6时,将动物随机分成三组。每组施用以下细胞之一:1)用作对照的非转导性t细胞tcr ko(“tcr ko”),2)表达p5ac1-v2.1的bcma特异性car-t细胞(“p5ac1 v2 r2 tcr ko”),或3)表达p5ac1-v2和rqr8自杀多肽的bcma特异性car-t细胞(“p5ac1 v2 rqr8 tcr ko”)。所有1-3细胞都是tcrα缺陷的。如上述实施例中所述制备bcma特异性car-t细胞。bcma特异性car构建体p5ac1-v2.1和p5ac1-v2如上表5所示。通过推注尾静脉注射施用单剂量的300万对照(tcr ko)或bcma特异性car-t(p5ac1 v2 r2 tcr ko或p5ac1 v2 rqr8 tcr ko)细胞。当它们失去超过总体重的15%时,终止动物,这是molp8原位模型的终点。
[0445]
研究结果总结在图2中。单剂量的300万p5ac1 r2 tcrko bcma特异性car-t细胞(正方形)或p5ac1 rqr8 tcrko car-t细胞(三角形)bcma特异性car-t细胞导致较低的总通量与阴性对照(圆圈)相比,肿瘤植入后第10-35天(图2)。因此,与阴性对照相比,用bcma特异性car-t细胞治疗抑制肿瘤进展。
[0446]
这些结果表明bcma特异性car-t细胞有效抑制肿瘤进展。
[0447]
实施例5:用bcma特异性car-t细胞治疗多发性骨髓瘤
[0448]
该实施例说明了bcma特异性car-t细胞在多发性骨髓瘤的原位小鼠模型中的治疗活性。
[0449]
使用两个人源化小鼠模型来评估bcma特异性car-t细胞对表达bcma的人骨髓瘤细
胞系的功效。从jackson laboratories购买了六(6)至八(8)周龄的雌性nod/scid il2rg-/-(nsg)小鼠。所有动物都被安置在rinat的无病原体动物房设施中,并根据实验动物使用与管理委员会(iacuc)指导方案进行实验。
[0450]
mm1.s和molp-8细胞系购自美国菌种保藏中心(atcc.org)和德国微生物菌种保藏中心(dsmz.de)。将细胞系改造以使用慢病毒颗粒(amsbio)表达luc-gfp融合蛋白。细胞在加有l-谷氨酰胺的rpmi 1640培养基中在37℃、5%二氧化碳(co2)中培养,其中mm1.s细胞补充有10%胎牛血清,或者molp-8细胞补充有20%fcs。收获生长在指数生长期的细胞,并用于肿瘤接种。
[0451]
如所述制备治疗性bcma特异性car-t细胞。健康的人供体细胞、外周血单核细胞(pbmc)或纯化的pan-t细胞用编码bcma特异性car的慢病毒颗粒和由ef-1a启动子驱动的rqr8激活和转导。本研究使用了三种不同的bcma特异性car:p5ac1-v2、pc1c12-v2和com22-v2(见上表5)。t细胞被基因编辑为tcrα基因缺失。培养细胞14至17天,然后在90%fcs/10%dmso中冷冻保存。对于t细胞注射,t细胞在37℃水浴中迅速解冻,并用含有25mm hepes的rpmi 1640培养基洗涤两次。将细胞通过含有25mm hepes的0.2ml rpmi 1640注射入荷瘤动物的尾静脉。
[0452]
肿瘤细胞接种前一天,用1gy全身照射(rad source technologies)照射nsg小鼠。将5
×
106个mm1.s/luc2-egfp细胞或2
×
106个molp-8/luc2-egfp细胞通过0.1ml磷酸盐缓冲盐水(pbs)注射到尾静脉中。使用生物发光成像每周测量肿瘤负担。将溶解在0.2ml pbs中的3μg d-萤光素注射入小鼠并用异氟烷麻醉。注射后7分钟,使用perkin elmer ivis spectrum相机系统对动物进行成像。测量除了小鼠尾巴以外的全身发光,并将肿瘤负荷报告为总光通量(光子/秒)。允许肿瘤建立直到发生指数增长。基于总光通量将动物随机分为治疗组,并用相同供体的bcma特异性car-t细胞或未转导对照t细胞治疗。使用生物发光成像和体重测量每周两次评估car-t治疗的效果。当第一只动物表明终末期疾病呈现体重减轻(》20%的初始体重)、后肢麻痹或其他动物窘迫迹象时,达到研究终点。使用graphpad prism 6进行统计分析。使用tukey's校正的重复测量one-way anova来比较所有组之间的抗肿瘤功效。p《0.05被认为是显著的。
[0453]
结果总结在下表11(mm1.s)和表12(molp-8)(光子每秒+/-sem中的总光通量的log
10
值)上。使用次优car-t细胞剂量来比较具有不同scfv的bcma特异性car-t细胞。bcma特异性car-t细胞组是p5ac1-v2、pc1c12-v2和com22-v2(参见上面的表5)。在mm1.s模型中,肿瘤植入后第17天注射3.5
×
106个表达car的t细胞。在molp8模型中,肿瘤植入后第7天注射4
×
106个表达car的t细胞。在mm1.s小鼠模型中施用的bcma特异性car-t细胞的转导效率为19%至29%,而在molp8小鼠模型中施用的bcma特异性car-t细胞为31%至36%。对照组使用未转导的t细胞的等效总剂量。mm1.s的对照t细胞治疗组展示进行性肿瘤生长直到第35天的研究终点,molp8的直到第23天。使用rm-anova分析与dunnets校正进行的肿瘤负荷的统计分析显示,在所有三种bcma特异性car-t治疗组中,肿瘤负荷与对照组的肿瘤负荷相比显著降低(p《0.01)(表11和12)。例如,在mm1.s肿瘤模型中,与给予对照t细胞的动物中的9.22log10光子/秒相比,用p5ac1-v2bcma特异性car-t细胞处理的动物中的平均总光通量在第25天为6.44log10光子/秒(表11)。在肿瘤植入后第35天,与给予对照t细胞的动物中的10.18log10光子/秒相比,用p5ac1-v2bcma特异性car-t细胞处理的动物中的平均总光通量
为6.82log10光子/秒(表11)。在molp8肿瘤模型中,与给予对照t细胞的动物中的9.39log10光子/秒相比,用p5ac1-v2bcma特异性car-t细胞处理的动物中的平均总光通量在第14天为7.88log 10光子/秒(表12)。在肿瘤植入后第23天,与给予对照t细胞的动物中的10.37log10光子/秒相比,用p5ac1-v2bcma特异性car-t细胞处理的动物中的平均总光通量为9.29log10光子/秒,(表12)。
[0454]
这些结果表明用bcma特异性car-t细胞治疗有效诱导肿瘤消退。
[0455]
表11:原位mm1.s肿瘤模型的肿瘤生物发光测定
[0456][0457][0458]
表12:原位molp-8肿瘤模型的肿瘤生物发光测定
[0459][0460][0461][0462][0463][0464]
实施例6:用tcrα/dck敲除bcma特异性car-t细胞治疗多发性骨髓瘤
[0465]
该实施例说明了bcma特异性car-t细胞在多发性骨髓瘤的原位小鼠模型中的治疗活性。
[0466]
使用人源化小鼠模型来评估bcma car-t细胞对表达bcma的人骨髓瘤细胞系的功效。从jackson laboratories购买了6至8周龄的雌性nod/scid il2rg-/-(nsg)小鼠。所有动物都被安置在rinat的无病原体动物房设施中,并根据实验动物使用与管理委员会(iacuc)指导方案进行实验。
[0467]
mm1.s细胞系购自美国菌种保藏中心(atcc.org)。将细胞系改造以使用慢病毒颗粒(amsbio)表达luc-gfp融合蛋白,以及使用talen核酸酶基因编辑使脱氧胞苷激酶(dck)功能缺陷。细胞在加有l-谷氨酰胺并补充有10%胎牛血清的rpmi 1640培养基中在37℃、5%二氧化碳(co2)中培养。收获生长在指数生长期的细胞,并用于肿瘤接种。
[0468]
如所述制备治疗性car-t细胞。使用编码bcma scfv、cd8铰链、cd8跨膜、41bb和cd3ζ的慢病毒颗粒激活和转导健康的供体细胞、外周血单核细胞(pbmc)或纯化的pan-t细胞,其中rqr8基因在ef-1a启动子控制下。使用tcrα和dck talen的组合或单独的tcrαtalen,将bcma特异性car-t细胞进行基因编辑,以删除tcrα和/或dck基因。所有t细胞的转导效率为70%。使用cd3阳性细胞的磁选择试剂盒(miltenyi)纯化tcrα敲除t细胞;dck敲除t细胞通过在0.5μm氯法拉滨存在下的扩增来纯化。培养细胞14至17天,然后在90%fcs/10%dmso中冷冻保存。对于t细胞注射,t细胞在37℃水浴中迅速解冻,并用含有25mm hepes的rpmi 1640培养基洗涤两次。为了治疗,将t细胞用含有25mm hepes的0.2ml rpmi 1640注射到荷瘤动物动物的尾静脉中。
[0469]
对于小鼠肿瘤模型,动物被注射mm1.s/dck ko肿瘤细胞。然后在肿瘤细胞植入后第18天用2.5
×
106个bcma特异性car-t细胞处理小鼠。使用接受tcrα和dck talen的等量未转导t细胞作为对照。t细胞注射后,用氯法拉滨或载体处理动物5天。
[0470]
结果:对照t细胞治疗组在第35天达到研究终点时(表13,组1)展示进行性肿瘤生长。与对照相比,用tcrα敲除bcma特异性car-t细胞和载体处理的组展示了肿瘤负荷显著降低(p《0.05),肿瘤负荷在联合施用布法拉滨时显著减小(p《0.05)(表13,组2和3)。用tcrα/dck双敲除car-t细胞处理的动物的肿瘤负荷显著降低,不论动物是否接受载体或氯法拉滨(p《0.05)(表13,组4和5)。接受tcrα/dck双敲除t细胞的组的肿瘤负荷的减少与接受tcrα单一敲除t细胞和载体的组没有差异(p》0.1)(表13,组2、组4和组5)。
[0471]
这些结果表明,使用tcrα/dck双敲除bcma car-t细胞的治疗在核苷类似物治疗如氟达拉滨和氯法拉滨存在下有效诱导肿瘤消退。
[0472]
表13:核苷类似物治疗抗肿瘤原位mm1.s肿瘤模型的肿瘤生物发光测定。
[0473][0474][0475]
虽然已经参考各种申请、方法、试剂盒和组合物所描述的公开的教导,但是应当理
解,在不脱离本文和下文所要求保护的发明的情况下,可以进行各种改变和修改。提供前述实施例以更好地说明所公开的教导,并不旨在限制本文呈现的教导的范围。虽然已经根据这些示例性实施例描述了本教导,但是本领域技术人员将容易地理解,这些示例性实施例的许多变化和修改是可能的而不用过度实验。所有这些变化和修改都在本教导的范围内。
[0476]
本文引用的所有参考文献,包括专利、专利申请、论文、教科书等,以及其中所引用的参考文献,在某种程度它们尚未被全部参考,也全部作为参考并入本文。该申请在一个或多个引用的文献和类似的材料与本技术不同或相矛盾的情况下(包括但不限于定义的术语、术语使用、描述的技术等)进行控制。
[0477]
前述和实施例详细描述了本发明的某些具体实施方案并且描述了发明人预期的最佳模式。然而,应当理解,无论前述内容在文中如何详细地描述,本发明可以以许多方式实施,并且本发明应根据所附权利要求及其任何等效权利要求来解释。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1