一种深海来源的马拉硫磷降解菌株及其应用
1.本发明属于生物技术领域,涉及一种深海来源的马拉硫磷降解菌株及其应用。
背景技术:
2.有机磷化合物是人工合成的含磷高毒物质,广泛应用于农药、阻燃剂、增塑剂、化学武器等农业、工业和国防领域。有机磷类农药(organophosphorus pesticides,ops),由于其具有高效、广谱、低残留和使用成本低等特点,在农业生产中被广泛使用。目前,世界上有机磷农药的种类已达150多种,在有机磷农药中80%以上是剧毒有机磷农药。我国生产的有机磷农药的品种就有30余种,其产量占整个农药产量的30%左右。有机磷农药具有抑制人体乙酰胆碱酯酶的功能,对人存在着程度不同的毒性,急性中毒可引起人肌肉痉挛、瞳孔收缩、呼吸困难直至死亡。随着人们生活质量的提高和环保意识的加强,有机磷农药的残留毒性问题越来越受到人们的关注。此外,多种有机磷农药在果蔬产品中均有检出,包括二嗪农、甲拌磷、乐果、甲基对硫磷、氧化乐果、敌敌畏、杀螟硫磷、倍硫磷、对硫磷、甲胺磷、马拉硫磷等。残留在蔬菜、水果等食品上的低剂量有机磷农药对人可产生慢性毒性,会诱导多发性神经病、中风等。
3.有机磷农药中的马拉硫磷是一种高效、高毒的有机磷杀虫剂,广泛应用于农作物虫害的防治,同时马拉硫磷被列为环境内分泌干扰物,对水生生物具有很大的毒性,其残留时间长,易污染环境,对人类的健康具有潜在的威胁,因此降解马拉硫磷的研究是非常必要的。
4.农药微生物降解的研究始于20世纪50年代,已有大量试验验证了微生物降解是农药在环境中降解的最重要方式。微生物具有种类多、变异快、易操作等特点。现有报道的降解马拉硫磷的菌株,包括交替假单胞菌、大肠杆菌、短波单胞菌属、黄杆菌、节细菌、曲霉菌等,未见有关假海源菌属的细菌对马拉硫磷降解的报道。
技术实现要素:
5.本发明的目的之一在于提供一种能够降解马拉硫磷的菌株。
6.本发明提供了霍米海角假海源菌(pseudidiomarina homiensis)r2058-fg2-ml,其保藏号为cgmcc no.23946。下述简称菌株fg2。
7.本发明还提供了上述的菌株或其培养液或其发酵液或含有其的菌剂在降解马拉硫磷中的应用。
8.本发明还提供了上述的菌株或其培养液或其发酵液或含有其的菌剂在制备降解马拉硫磷产品中的应用。
9.本发明还提供了上述的菌株或其培养液或其发酵液或含有其的菌剂在降低马拉硫磷使用后的残留量中的应用。
10.本发明还提供了降解马拉硫磷的产品,包括上述的菌株或其培养液或其发酵液或含有其的菌剂。
11.本发明还提供了一种降解马拉硫磷的方法,包括向马拉硫磷或含有马拉硫磷的样品中加入上述的菌株或其培养液或其发酵液或含有其的菌剂,实现降解。
12.上文中,菌株fg2可按照如下方法制备:在液体培养基(例如2216e液体培养基)中培养菌株fg2,收集发酵液。
13.上述菌剂的活性成分可为菌株fg2或/和菌株fg2的代谢物,上述菌剂的活性成分还可含有其他生物成分或非生物成分,上述菌剂的其他活性成分本领域技术人员可根据菌剂的效果确定。
14.所述菌剂还可包括载体。所述载体可为固体载体或液体载体。所述固体载体为矿物材料、生物材料;所述矿物材料可为草炭、粘土、滑石、高岭土、蒙脱石、白碳、沸石、硅石和硅藻土中的至少一种;所述生物材料为各类作物的秸秆、松壳、稻草、花生壳、玉米粉、豆粉、淀粉、草炭和动物的粪便中的至少一种;所述液体载体可为水;所述菌剂中,菌株fg2或/和菌株fg2的代谢物可以以被培养的活细胞、活细胞的发酵液、细胞培养物的滤液或细胞与滤液的混合物的形式存在。所述菌剂的剂型可为多种剂型,如液剂、乳剂、悬浮剂、粉剂、颗粒剂、可湿性粉剂或水分散粒剂。
15.根据需要,所述菌剂中还可添加表面活性剂(如吐温20、吐温80等)、粘合剂、稳定剂(如抗氧化剂)、ph调节剂等。
16.本发明筛选出具有马拉硫磷降解作用的菌株fg2,可用于降解有机磷农药中的马拉硫磷,有助于解决马拉硫磷残留问题。
17.保藏说明
18.菌种名称:霍米海角假海源菌
19.拉丁名:pseudidiomarina homiensis
20.菌株编号:r2058-fg2-ml
21.保藏机构:中国微生物菌种保藏管理委员会普通微生物中心
22.保藏机构简称:cgmcc
23.地址:北京市朝阳区北辰西路1号院3号
24.保藏日期:2021年11月22日
25.保藏中心登记入册编号:cgmcc no.23946
附图说明
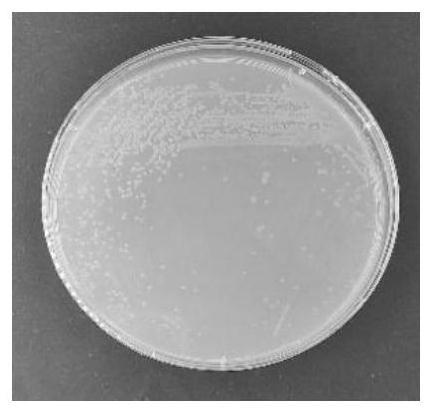
26.图1为r2058-fg2-ml在2216e固体培养基划线培养24h后的菌群形态。
27.图2为r2058-fg2-ml在2216e液体培养基中培养10h后电镜扫描的菌株形态。
28.图3为实施例2blast进行同源性比对分析部分结果。
29.图4为实施例2海源菌科16s rdna进化树。
30.图5为r2058-fg2-ml在含有马拉硫磷的无机盐液体培养基中培养48h后电镜扫描的菌株形态。
31.图6为实施例3在无机盐培养基中培养12h后马拉硫磷的hplc检测结果。
32.图7为实施例3在无机盐培养基中培养18h后马拉硫磷的hplc检测结果。
33.图8为实施例3在无机盐培养基中培养24h后马拉硫磷的hplc检测结果。
34.图9为实施例3在无机盐培养基中培养40h后马拉硫磷的hplc检测结果。
35.图10为实施例3在无机盐培养基中培养48h后马拉硫磷的hplc检测结果。
36.图11为实施例3马拉硫磷降解率曲线图。
具体实施方式
37.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
38.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
39.实施例1、菌株r2058-fg2-ml的分离与纯化
40.1.培养基制备
41.下述实施例所使用的培养基组成、制备具体如下。
42.人工海水:nacl:23.477g;na2so4:3.917g;mgcl2·
6h2o:4.981g;cacl2:1.102g;nahco3:193mg;kc1:664mg;kbr:6mg;h3bo3:20mg;srcl2:24mg;naf:3mg;用ddh2o定容至1l。
43.1)2216e液体培养基组成:胰蛋白胨:5g;酵母粉提取物1g;用人工海水定容至1l,121℃下高压湿热灭菌20min。
44.2)2216e固体培养基组成如下:胰蛋白胨:5g;酵母粉提取物:1g;琼脂20g;用人工海水定容至1000ml,121℃下高压湿热灭菌20min。
45.3)无机盐液体培养基组成:海盐:18g;(nh4)so4:1g;葡萄糖:0.3g;酵母提取物:0.4g;ddh2o定容至1l,121℃下高压湿热灭菌20min。
46.4)马拉硫磷溶液:将马拉硫磷标准品(cdct-c14710000)溶于dmso中,终浓度为50g/l。
47.2.菌株的分离与纯化
48.取南海古热液样品(采样于2018年5月1日,采样地点为南海n13.136305,e114.490582;水深为3014m处的沉积物样品)采用2216e平板固体培养基在30℃的条件下进行划线筛选、纯化,得单一纯化微生物菌株r2058-fg2-ml(下述简称fg2)。
49.实施例2、菌株fg2的鉴定
50.(1)菌落形态
51.将fg2接种于2216e固体培养基划线培养24小时后,菌落形态如图1所示,菌落呈圆形,淡黄色透明,表面光滑且凸起。
52.采用电镜扫描观察菌株fg2在于2216e液体培养基培养10小时后的形态,如图2所示,菌株fg2呈杆状,表面不光滑且有凸起,有长短不一的丝状物,菌株之间丝状物相互黏附。
53.(2)菌株鉴定
54.将fg2接入2216e液体培养基的三角瓶,37℃、200rpm振荡培养10h,离心后取少量菌体。采用细菌基因组dna提取试剂盒(dp302-02)提取fg2基因组dna,提取步骤参照细菌基因组dna提取试剂盒说明书。以fg2基因组dna为模板,采用引物eubac 27f和eubac 1492r进行pcr扩增。
55.选用引物序列如下:
56.引物eubac 27f:agagtttgatcmtggctcag
57.引物eubac 1492r:acggctaccttgttacgact
58.pcr扩增反应体系(25μl)包括:2
×
lamp master mix(dye plus):12.5μl;dntp:1μl;正向引物(10μm):1μl;反向引物(10μm):1μl;模板(1μm):1μl;ddh2o:9.5μl。
59.pcr反应条件:95℃预变性3min;95℃变性30s;52℃退火30s;72℃延伸1min,35个循环;72℃延伸7min。
60.扩增产物(即fg2的16s rdna)进行测序。
61.fg2的16s rdna序列如seq id no.1所示,将所得序列与ncbi核酸数据库用blast进行同源性比对分析,部分序列比对如图3所示,根据比对信息,与pseudidiomarina homiensis strain po-m2(nr 043732.1)的相似性为99.79%
62.挑选海源菌科菌株与fg2菌株的16s rdna进行系统发育分析,用mega 7.0软件中的邻接法(neighbor-joining)构建系统发育树。系统发育树如图4所示,其中,fg2为fg2菌株的16s rdna序列,海源菌科分为三个海源菌属,fg2与pseudidiomarina homiensis strain po-m2(nr 043732.1)的物种关系更为相近。
63.最终根据形态学特征,同源性远近以及系统发育树,确定fg2为假海源菌属细菌,鉴定为pseudidiomarina homiensis。fg2在中国微生物菌种保藏管理委员会普通微生物中心的登记入册编号为cgmcc no.23946。
64.实施例3马拉硫磷降解检测
65.(1)发酵液制备
66.将实施例1纯化后的fg2菌株单菌落接入装有2216e液体培养基的三角瓶,37℃、200rpm振荡培养10h,得到发酵液,备用。
67.(2)转接无机盐培养基培养
68.将得到的发酵液于紫外分光光度计检测od
600
,收集od
600
=4的发酵液于室温、3500rpm离心8min,弃去上清液,用等体积的无机盐培养基重悬,洗涤1-2次,备用。
69.实验组将洗涤重悬后的发酵液,按照3%(v/v)的比例添加至10ml无机盐液体培养基中,最后按照1%(v/v)添加50g/l马拉硫磷溶液。对照组则只按照1%(v/v)50g/l马拉硫磷溶液添加至10ml无机盐液体培养基。28℃条件下,200rpm遮光振荡培养12h、18h、24h、40h、48h,获得无机盐发酵液备用。并采用电镜扫描观察fg2的菌株形态。
70.(3)马拉硫磷萃取
71.向无机盐培养发酵液中,加入等体积的正己烷,充分震荡30s,室温下,静置2-3h,吸取上层有机相溶液1ml,25℃条件下旋转蒸发15min,加入1ml水-乙腈混合溶液(体积比1:1)重悬,过滤,溶液备用,该溶液即为萃取出马拉硫磷的溶液。
72.(4)马拉硫磷降解检测
73.利用hplc检测对照组和实验组步骤(3)获得的溶液中马拉硫磷的含量。
74.hplc检测条件:使用c18反向分析柱(eclipse plus c18,4.6mm
×
100mm,dp=35μm)与合适的护柱和紫外检测器,使用乙腈∶水(50∶50)作为流动相,流速为1ml/min,10min,注射量为10μl,保留时间为:7.28min,检测到马拉硫磷的含量。根据峰面积的差值确定降解效率。
75.在含有马拉硫磷的无机盐培养基中培养48h后的fg2菌株形态如图5所示,菌株呈杆状
76.在无机盐培养基中培养12h的检测结果如图6所示,hplc检测结果显示对照组和实验组步骤(3)获得的溶液中马拉硫磷在保留时间7.28min时出现特征峰,根据峰面积计算得到:实验组马拉硫磷降解率为67.1%。
77.在无机盐培养基中培养18h的检测结果如图7所示,hplc检测结果显示对照组和实验组步骤(3)获得的溶液中马拉硫磷在保留时间7.28min时出现特征峰,根据峰面积计算得到:实验组马拉硫磷降解率为90.7%。
78.在无机盐培养基中培养24h的检测结果如图8所示,hplc检测结果显示对照组和实验组步骤(3)获得的溶液中马拉硫磷在保留时间7.286min时出现特征峰,根据峰面积计算得出,实验组马拉硫磷降解率为96.2%。
79.在无机盐培养基中培养40h的检测结果如图9所示,hplc检测结果显示对照组和实验组步骤(3)获得的溶液中马拉硫磷在保留时间7.286min时出现特征峰,根据峰面积计算得出,实验组马拉硫磷降解率为98.9%。
80.在无机盐培养基中培养48h的检测结果如图10所示,hplc检测结果显示对照组步骤(3)获得的溶液中马拉硫磷在保留时间7.28min时出现特征峰,实验组步骤(3)获得的溶液在保留时间7.28min时,未检测到特征峰,即在培养48h后,实验组马拉硫磷降解率为100%。
81.根据降解率和培养时间绘制的马拉硫磷降解率曲线图如图11所示,表明随着培养时间的推移,马拉硫磷的含量下降,fg2对马拉硫磷具有降解作用。
82.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1