一种氟代联苯甲基间苯二酚醚类衍生物、其制备方法和应用
1.本发明涉及一种氟代联苯甲基间苯二酚醚类衍生物、其制备方法和应用。
背景技术:
2.随着对肿瘤免疫研究的深入,人们发现肿瘤微环境可以保护肿瘤细胞不被集体免疫系统识别和杀伤,即发生免疫逃逸,肿瘤细胞的免疫逃逸在肿瘤发生、发展中扮演了非常重要的角色。机体免疫细胞的激活或者抑制是通过正性信号和负性信号来调节的,其中程序死亡受体蛋白1(pd-1)与其配体(pd-l1)是一对负性免疫调节信号,抑制t 细胞的免疫活性,介导肿瘤细胞免疫逃逸。
3.肿瘤细胞所具有的逃避免疫系统的能力,是通过肿瘤细胞表面表达的程序死亡配体 (pd-l1)与t细胞表面表达的pd-1蛋白结合来实现的。机体内的肿瘤微环境会诱导浸润的t细胞高表达pd-1蛋白,肿瘤细胞高表达pd-1的配体pd-l1和pd-l2,导致肿瘤微环境中pd-1/pd-l1通路的持续激活,t细胞功能被抑制而不能发现肿瘤以至于不能向免疫系统发出攻击肿瘤和杀伤肿瘤细胞的信号。pd-1或pd-l1单克隆抗体是分别靶向键合pd-1或者pd-l1的抗体蛋白,使得pd-1和pd-l1两种蛋白不能发生结合,从而阻断这一通路,部分恢复t细胞的功能,继续杀伤肿瘤细胞。
4.基于pd-1/pd-l1免疫检查点抑制剂的肿瘤免疫疗法是当前备受瞩目的新一代免疫疗法,旨在利用人体自身的免疫系统杀伤肿瘤,通过阻断pd-1/pd-l1信号通路诱导凋亡,具有治疗多种类型肿瘤的效果。最近,一系列令人惊喜的研究成果证实pd-1/pd-l1 通路抑制性抗体对多种肿瘤展现出强大的抗癌活性,格外引人注目。2014年9月4日美国默沙东公司开发的单克隆抗体药物pembrolizumab(商品名)成为fda批准的首例pd-1单抗,用于治疗对其它药物治疗无效的晚期或无法切除的黑色素瘤患者。目前,默沙东正在研究keytruda在30多种不同类型癌症中的治疗潜力,包括各类血液癌症、肺癌、乳腺癌、膀胱癌、胃癌、头颈部癌症。2014年12月22日,制药巨头百时美施贵宝公司不负重望,获得美国食品药品监督管理局(fda)加速批准其研发的单克隆抗体药物nivolumab(商品名opdivo)上市。该药用于治疗对其它药物没有应答的、不可切除的或转移性黑色素瘤患者,是继默沙东keytruda之后第二个在美国上市的pd-1 抑制剂。fda于2015年3月4日批准了nivolumab用于治疗在以顺铂为基础的化疗期间或化疗后发生疾病进展的转移性鳞性非小细胞肺癌。根据默沙东公布的 keytruda(pembrolizumab)治疗实体瘤的一项lb期keyn0te-028研究数据,keytruda治疗在25例胸膜间皮瘤(pleuralmesothelioma,pm)患者中取得了28%的总缓解率(orr),并有48%的患者病情稳定,疾病控制率达到了76%。对当前任何已获批药物均无治疗反应的晚期霍奇金淋巴瘤(hl)患者,接受默沙东keytruda和百时美opdvio治疗后,能够达到完全缓解。在2015aacr年会上,约翰霍普金斯基梅尔癌症中心(kimmel cancercenter)的leisha a.emens做出的报道指出,罗氏的mpdl3280a这一具有抗pd-l1 作用的单克隆抗体,在晚期三阴性乳腺癌中表现出了持久的疗效。虽然肿瘤免疫治疗被认为是靶向治疗后癌症治疗的革命,但是,单抗治疗药物有其本身的缺陷:易被消化液分解,在体内不
稳定,不能口服;易产生免疫交叉反应;产品质量不易控制,制作技术要求高;大批量制备和纯化比较困难,生产成本高昂;使用不方便,只能静脉注射或点滴及平均应答率低于30%,以及有可能产生免疫原性。所以,开发pd1/pd-l1相互作用小分子抑制剂用于肿瘤免疫治疗具有重大的现实意义。
技术实现要素:
5.本发明解决的技术问题是提供一种具有抑制pd1/pd-l1相互作用的氟代联苯甲基间苯二酚醚类衍生物(结构通式如i所示),以及其立体异构体及其可药用盐,及其制备方法、和其在制备预防或治疗与pd1/pd-l1信号通路有关疾病药物中的用途。
6.通式i所示的氟代联苯甲基间苯二酚醚类衍生物及其立体异构体以及其可药用盐,
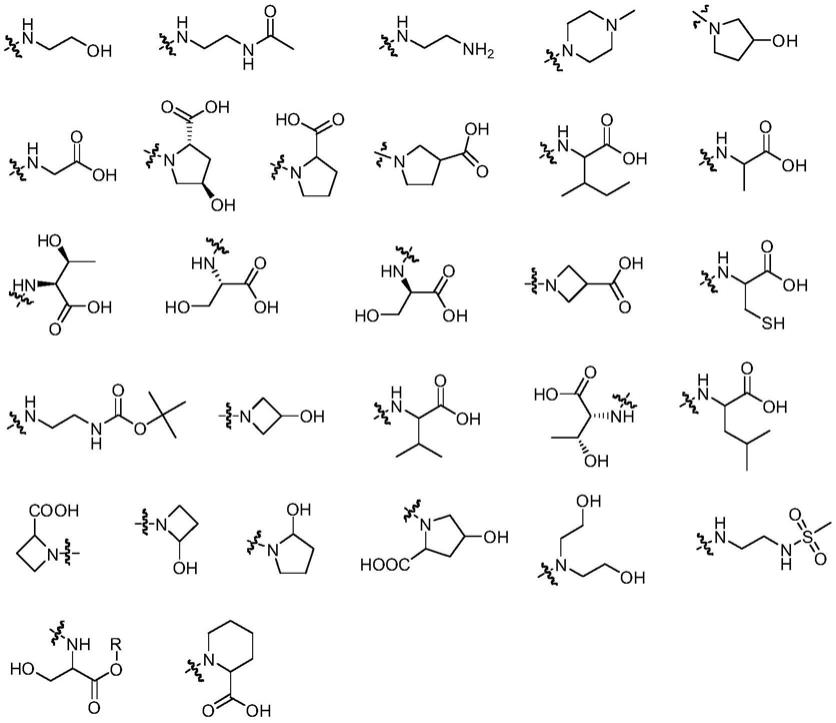
7.r1可以下列之一:(其中在本发明中,取代基团分子结构中的波浪线表示与其他基团连接的键位,下同。例如r1表示邻氟苯基、2,5-二氟苯基中的一种);
8.r2可以下列之一:氟、氯、甲氧基;
9.x可以下列之一:氢、氯、溴、碘、c1-c4烷基、甲氧基;
10.r3可以下列之一:
11.r4可以下列之一:取代的c1-c8饱和烷氨基、取代的c2-c6不饱和烷氨基、取代的c2-c6氮杂环-1-基,取代基可以是氢、氟、氯、溴、碘、羟基、c1-c5烷基、c1-c5 烷氧基、氨基、c1-c6烷氨基、乙酰氨基、氰基、脲基、胍基、脲氨基、胍氨基、磺酰氨基、氨磺酰基、甲磺酰氨基、羟基甲酰基、c1-c8烷氧甲酰基、巯基、咪唑基、噻唑基、噁唑基或四氮唑基。
12.优选的氟代联苯甲基苯基醚类衍生物及其立体异构体以及其可药用盐,其特征在于,所述的化合物结构如式(ia-1)所示:
[0013][0014]
r2可以下列之一:氟、氯、甲氧基;
[0015]
x可以下列之一:氢、氯、溴、碘、c1-c4烷基、甲氧基;
[0016]
r3可以下列之一:
[0017]
r4可以下列之一:取代的c1-c8饱和烷氨基、取代的c2-c6不饱和烷氨基、取代的c2-c6氮杂环-1-基,取代基可以是氢、氟、氯、溴、碘、羟基、c1-c5烷基、c1-c5 烷氧基、氨基、c1-c6烷氨基、乙酰氨基、氰基、脲基、胍基、脲氨基、胍氨基、磺酰氨基、氨磺酰基、甲磺酰氨基、羟基甲酰基、c1-c8烷氧甲酰基、巯基、咪唑基、噻唑基、噁唑基或四氮唑基。
[0018]
优选的氟代联苯甲基间苯二酚醚类衍生物及其立体异构体以及其可药用盐,其特征在于,所述的化合物结构如式(ia-2)所示:
[0019][0020]
r2可以下列之一:氟、氯、甲氧基;
[0021]
x可以下列之一:氢、氯、溴、碘、c1-c4烷基、甲氧基;
[0022]
r3可以下列之一:
[0023]
r4可以下列之一:取代的c1-c8饱和烷氨基、取代的c2-c6不饱和烷氨基、取代的c2-c6氮杂环-1-基,取代基可以是氢、氟、氯、溴、碘、羟基、c1-c5烷基、c1-c5 烷氧基、氨基、c1-c6烷氨基、乙酰氨基、氰基、脲基、胍基、脲氨基、胍氨基、磺酰氨基、氨磺酰基、甲磺酰氨基、羟基甲酰基、c1-c8烷氧甲酰基、巯基、咪唑基、噻唑基、噁唑基或四氮唑基。
[0024]
以上通式中,优选的氟代联苯甲基间苯二酚醚类衍生物及其立体异构体以及其可药用盐,其特征在于,所述r4可以是下列之一:
[0025][0026]
r=甲基、乙基、丙基、异丙基、丁基、戊基、己基、庚基或辛基。
[0027]
最优选的化合物可以是下列之一:
[0028]
n-羟乙基-2-(3-氰基苄氧基)-4-(2-氯-3-邻氟苯基苄氧基)苄胺,
[0029][0030]
n-乙酰胺乙基-2-(5-氰基吡啶-3-甲氧基)-4-(2-氯-3-邻氟苯基苄氧基)苄胺盐酸盐,
[0031][0032]
n-羟乙基-2-(5-氰基吡啶-3-甲氧基)-4-(2-氯-3-邻氟苯基苄氧基)苄胺盐酸盐,
[0033][0034]
n-[2-(3-氰基苄氧基)-4-(2-氯-3-邻氟苯基苄氧基)苄基)]吖丁啶-3-羧酸,
[0035][0036]
n-[2-(3-氰基苄氧基)-4-(2-氯-3-邻氟苯基苄氧基)苄基)]l-丝氨酸,
[0037][0038]
n-[2-(3-氰基苄氧基)-4-(2-氯-3-邻氟苯基苄氧基)苄基)]d-丝氨酸,
[0039][0040]
n-羟乙基-2-(5-氨甲酰基吡啶-3-甲氧基)-4-(2-氯-3-邻氟苯基苄氧基)苄胺盐酸盐,
[0041][0042]
n-羟乙基-2-(5-氰基吡啶-3-甲氧基)-4-[2-氟-3-(2,5-二氟苯基)苄氧基]苄胺,
[0043][0044]
n-羟乙基-2-(5-氰基吡啶-3-甲氧基)-4-[2-氟-3-(2,5-二氟苯基)苄氧基]-5-氯苄胺,
[0045]
[0046]
另外,上述反应中的起始原料及中间体较容易得到。通式i所述化合物可以溶剂化物或非溶剂化物的形式存在,利用不同的溶剂进行结晶可能得到不同的溶剂化物。通式i所述药学上可接受的盐包括不同酸所成的盐,如下列无机酸或有机酸的酸所成的盐:盐酸,氢溴酸,磷酸,硫酸,甲烷磺酸,对甲苯磺酸,三氟乙酸,枸杞酸,马来酸,酒石酸,富马酸,柠檬酸或乳酸。通式i所述药学上可接受的盐还包括不同碱金属盐(锂,钠,钾盐),碱土金属盐(钙,镁盐)及铵盐。在本发明范围内的所有这些盐都可采用常规方法制备。在所述的通式i化合物及其溶剂化物和其盐的制备过程中,不同结晶条件可能出现多晶或共晶。
[0047]
本发明技术方案的第二方面是提供了第一方面所述化合物的制备方法:为了制备本发明通式i所述的化合物,依据通式i的结构,本发明制备通式i化合物将分为五步。
[0048][0049]
(1)以化合物1和取代的苯硼酸为基本原料,通过suzuki偶联反应得到中间体化合物2;
[0050]
(2)以中间体化合物2为原料,通过nbs使取代苄醇溴化得到溴代物中间体3;
[0051]
(3)以溴代物中间体3为原料,在碱性条件下与中间体4反应,得到苄芳醚中间体5;
[0052]
(4)以苄芳醚中间体5为原料,在碱性条件下与各种取代芳基卤化物反应,得到含醛基的中间体化合物6;
[0053]
(5)以含醛基的中间体化合物6为原料,与含氨基或亚氨基的hr4进行还原胺化反应得到目标化合物i;
[0054]
化合物1-6中的取代基r1、r2、r3、r4、x的定义同目标化合物i中。
[0055]
本发明取得的有益效果是:本发明的氟代联苯甲基间苯二酚醚类衍生物是新型 pd-l1抑制剂,通常在小于10nm的浓度下就可以显著抑制pd-1和pd-l1两种蛋白之间的相互作用,且活性显著优于已知的pd-l1抑制剂bms-202。本发明的氟代联苯甲基间苯二酚醚类衍生物还可以显著地阻断pd-l1对t细胞的抑制作用,并可阻断肿瘤细胞抑制t细胞增殖和分泌ifn-γ的效应,因而具有增强t细胞抗肿瘤免疫的功效。本发明的氟代联苯甲基间苯二酚醚类衍生物的合成步骤少、操作简便易行,原料便宜易得,合成工艺安全、绿色环保,易于规模化生产。尤其重要的是,本发明的新型联苯类化合物不仅对pd-l1具有很高的抑制活性,同时还具有非常好的化学稳定性和代谢稳定性,因而具有很好的成药性。
附图说明
[0056]
图1为本技术化合物的药理活性实验中,不同待测化合物解除配体pd-l1抑制ifn-γ表达的能力的测试结果。
具体实施方式
[0057]
以下将结合实施例对发明作进一步说明,但并不限制本发明的范围。
[0058]
测定仪器:核磁共振光谱用bruker av-400 bruker av-600型核磁共振仪。质谱用zad-2f 和vg300质谱仪。
[0059]
实施例1:n-乙酰胺乙基-2-(3-氰基苄氧基)-4-(2-甲氧基-3-邻氟苯基苄氧基)苄胺,
[0060][0061]
(1)2-甲氧基-3-邻氟苯基苄醇
[0062]
在一个100ml的圆底烧瓶中,加入3-溴-2-甲氧基苄醇(434.1mg,2.0mmol,1.0eq), 邻氟苯硼酸(336.8mg,2.4mmol,1.2eq),k2co3(691.1mg,5.0mmol,2.5eq),二氧六环 (10ml),水(2.5ml),氮气置换三次后,搅拌20min,再加入pdcl2(dppf)(73.2mg,0.1 mmol,0.05eq)。圆底烧瓶上加装冷凝装置后,反应体系再次用氮气置换三次,加热至80℃搅拌反应15h。tlc检测反应完成后,停止加热,反应体系降至室温,用硅藻土过滤。滤液减压浓缩后,加入水和乙酸乙酯萃取3次。合并有机相,有机相用饱和食盐水洗涤,无水硫酸钠干燥,过滤,减压浓缩至干得粗品:475.3mg,直接投下一步。
[0063]
(2)2-甲氧基-3-邻氟苯基苄溴
[0064]
在一个100ml的圆底烧瓶中,加入2-甲氧基-3-邻氟苯基苄醇(464.5mg,2.0mmol,1.0 eq),三苯基膦(786.9mg,3.0mmol,1.5eq),二氯甲烷(10ml),搅拌溶解后,冰浴降温下,分批加入n-溴代丁二酰亚胺(nbs)(533.9mg,3.0mmol,1.5eq)。加料完毕后,缓慢升至室温,反应4h。tlc检测原料反应完全后,向反应液中加入三倍量的硅胶,浓缩至干后,过柱纯化,洗脱剂pe:ea=40:1(v/v),得到无色油状物:472.2mg,收率:80%。
[0065]1h-nmr(600mhz,cdcl3)δ7.46(ddd,j=9.9,7.6,1.9hz,2h),7.40(tdd,j=7.6,5.0,1.8 hz,1h),7.32(dt,j=7.6,1.3hz,1h),7.24(td,j=7.4,1.2hz,1h),7.20(td,j=8.7,7.7,5.3 hz,2h),4.67(s,2h),3.53(s,3h)。
[0066]
(3)2-羟基-4-(2-甲氧基-3-邻氟苯基苄氧基)苯甲醛
[0067]
在一个50ml的圆底烧瓶中,加入2-甲氧基-3-邻氟苯基苄溴(295.2mg,1.0mmol, 1.0eq),2,4-二羟基苯甲醛(165.7mg,1.2mmol,1.2eq),k2co3(207.3mg,1.5mmol,1.5eq),碘化钠(75.0mg,0.5mmol,0.5eq),dmf(5ml),加料完毕后,升温至60℃反应2h。反应液降至室温后,加入水和乙酸乙酯,搅拌5min后分层,水相用乙酸乙酯萃取三次,合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥,减压浓缩至干后,柱色谱纯化得白色固体:140.9mg,收率:40%。
[0068]
(4)2-(3-氰基苄氧基)-4-(2-甲氧基-3-邻氟苯基苄氧基)苯甲醛
[0069]
在一个50ml的圆底烧瓶中,加入2-羟基-4-(2-甲氧基-3-邻氟苯基苄氧基)苯甲醛 (70.5mg,0.2mmol,1.0eq),间氰基苄氯(36.4mg,0.24mmol,1.2eq),cs2co3(97.7mg, 0.3mmol,1.5eq),碘化钠(15.0mg,0.1mmol,0.5eq),dmf(3ml),加料完毕后,升温至 60℃反应2h。反应液降至室温后,加入水和乙酸乙酯,搅拌5min后分层,水相用乙酸乙酯萃取三次,合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥,减压浓缩至干得粗品:90.2mg,直接投下一步。
[0070]
(5)n-乙酰胺乙基-2-(3-氰基苄氧基)-4-(2-甲氧基-3-邻氟苯基苄氧基)苄胺
[0071]
将2-(3-氰基苄氧基)-4-(2-甲氧基-3-邻氟苯基苄氧基)苯甲醛(90.2mg,0.19mmol, 1.0eq)溶于2ml dmf中,加入2-乙酰氨基乙胺(38.8mg,0.38mmol,2.0eq),四滴冰醋酸至反应体系中。室温搅拌20min后,加入氰基硼氢化钠(23.9mg,0.38mmol,2.0eq),室温搅拌过夜。停止反应,加入水和乙酸乙酯萃取分离。有机相用饱和食盐水洗涤,无水硫酸钠干燥,过滤,减压旋干,柱层析纯化得到白色固体:32.6mg,收率:31.5%, hplc分析产品纯度:96.5%。1h-nmr(600mhz,chcl
3-d)δ7.76(d,j=1.8hz,1h), 7.72
–
7.67(m,1h),7.65(dt,j=7.8,1.4hz,1h),7.56
–
7.48(m,2h),7.47
–
7.36(m,2h),7.33 (dt,j=7.5,1.4hz,1h),7.27(s,1h),7.27
–
7.16(m,3h),6.80(s,1h),6.65(dd,j=8.3,2.3 hz,1h),6.60(d,j=2.3hz,1h),5.15(s,4h),3.91(s,2h),3.44(s,3h),3.39(q,j=5.6hz, 2h),2.86(t,j=5.5hz,2h),1.94(s,3h)。
[0072]
实施例2:n-[2-(3-氰基苄氧基)-4-(2-甲氧基-3-邻氟苯基苄氧基)苄基)]l-丝氨酸
[0073][0074]
实验步骤重复实施例1,不同之处仅在于步骤(5)中用同等摩尔量的l-丝氨酸代替2
‑ꢀ
乙酰氨基乙胺,其余操作同实施例1,得到白色固体,收率:37.1%,hplc分析产品纯度:96.1%。1h-nmr(600mhz,chcl
3-d)δ7.76
–
7.60(m,2h),7.50(s,1h),7.43
–
7.34(m, 4h),7.29(d,j=12.7hz,2h),7.21(td,j=7.5,1.2hz,1h),7.19
–
7.13(m,2h),6.57(d,j= 8.2hz,1h),6.54(s,1h),5.09(s,2h),5.05(s,2h),4.20(s,2h),3.92(s,2h),3.52
–
3.40(m, 1h),3.38(s,3h).
[0075]
实施例3:n-乙酰胺乙基-2-(3-氰基苄氧基)-4-(2-甲氧基-3-邻氟苯基苄氧基)-5-氯苄胺
[0076][0077]
实验步骤重复实施例1,不同之处仅在于步骤(3)中用同等摩尔量的2,4-二羟基-5-氯苯甲醛代替2,4-二羟基苯甲醛与2-甲氧基-3-邻氟苯基苄溴反应,得到的中间体按照与实施例1中相同的投料摩尔量依次重复实施例1中步骤(4)和步骤(5)的操作过程,即步骤
(4)中间体的投料摩尔量是0.2mmol,步骤(5)中间体的投料摩尔量是0.19mmol,其余操作同实施例1,得到白色固体,收率:34.8%,hplc分析产品纯度:96.3%。1h-nmr (600mhz,chcl
3-d)δ7.74(td,j=1.7,0.8hz,1h),7.66(dp,j=5.8,1.6hz,2h),7.58(dd, j=7.7,1.8hz,1h),7.53(t,j=7.8hz,1h),7.44
–
7.38(m,2h),7.36
–
7.29(m,2h),7.24(td, j=7.5,1.2hz,2h),7.18(ddd,j=10.0,8.7,1.2hz,1h),6.68(s,1h),6.59(s,1h),5.28(s, 2h),5.10(s,2h),3.79(s,2h),3.48(s,3h),3.35(q,j=5.6hz,2h),2.78(dd,j=6.7,4.9hz, 2h),1.96(s,3h).
[0078]
实施例4:n-羟乙基-2-(3-氰基苄氧基)-4-(2-甲氧基-3-邻氟苯基苄氧基)苄胺
[0079][0080]
实验步骤重复实施例1,不同之处仅在于步骤(5)中用同等摩尔量的2-氨基乙醇代替 2-乙酰氨基乙胺,其余操作同实施例1,得到白色固体,收率:44.0%,hplc分析产品纯度:95.9%。1h-nmr(600mhz,chcl
3-d)δ7.76(d,j=1.8hz,1h),7.71(d,j=7.6hz, 1h),7.66
–
7.61(m,1h),7.56
–
7.48(m,2h),7.47
–
7.36(m,2h),7.33(dt,j=7.6,1.4hz,1h), 7.28
–
7.16(m,4h),6.65(dd,j=8.3,2.3hz,1h),6.62(d,j=2.3hz,1h),5.16(s,4h),3.98 (s,2h),3.70(t,j=5.0hz,2h),3.44(s,3h),2.92
–
2.87(m,2h).
[0081]
实施例5:n-乙酰胺乙基-2-(5-氰基吡啶-3-甲氧基)-4-(2-甲氧基-3-邻氟苯基苄氧基)苄胺
[0082][0083]
实验步骤重复实施例1,不同之处仅在于用同等摩尔量的5-氯甲基烟碱甲腈代替间氰基苄氯与2-羟基-4-(2-甲氧基-3-邻氟苯基苄氧基)苯甲醛反应,得到中间体2-(5-氰基吡啶-3-甲氧基)-4-(2-甲氧基-3-邻氟苯基苄氧基)苯甲醛,再以0.19mmol的投料摩尔量与2-乙酰氨基乙胺(0.38mmol)进行还原胺化反应,各原料或中间体的投料摩尔量重复实施例1中,操作同实施例1,得到淡黄色固体,收率:30.6%,hplc分析产品纯度: 96.5%。1h-nmr(600mhz,chcl
3-d)δ8.95(d,j=2.1hz,1h),8.88(d,j=2.0hz,1h), 8.19(t,j=2.1hz,1h),7.50(dd,j=7.7,1.7hz,1h),7.47
–
7.37(m,2h),7.35
–
7.29(m,2h), 7.27
–
7.21(m,2h),7.18(ddd,j=9.7,8.3,1.2hz,1h),7.01(s,1h),6.67(dd,j=8.4,2.3hz, 1h),6.62(d,j=2.3hz,1h),5.20(s,2h),5.16(s,2h),3.94(s,2h),3.45(s,3h),3.40(q,j= 5.7hz,2h),2.91(t,j=5.4hz,2h),1.96(s,3h).
[0084]
实施例6:n-羟乙基-2-(5-氰基吡啶-3-甲氧基)-4-(2-甲氧基-3-邻氟苯基苄氧基)苄胺
[0085][0086]
实验步骤重复实施例1,不同之处仅在于用同等摩尔量的5-氯甲基烟碱甲腈代替间氰基苄氯与2-羟基-4-(2-甲氧基-3-邻氟苯基苄氧基)苯甲醛反应,得到中间体2-(5-氰基吡啶-3-甲氧基)-4-(2-甲氧基-3-邻氟苯基苄氧基)苯甲醛,再以0.19mmol的投料摩尔量与2-氨基乙醇(0.38mmol)进行还原胺化反应,各原料或中间体的投料摩尔量重复实施例1中,操作同实施例1,得到淡黄色胶状固体,收率:40.1%,hplc分析产品纯度: 96.3%。1h-nmr(600mhz,chcl
3-d)δ8.93(d,j=2.1hz,1h),8.86(d,j=2.0hz,1h), 8.20(t,j=2.1hz,1h),7.51(dd,j=7.6,1.8hz,1h),7.44(td,j=7.5,1.8hz,1h), 7.43
–
7.37(m,1h),7.33(dt,j=7.5,1.5hz,1h),7.30(s,1h),7.27
–
7.20(m,2h),7.19(ddd, j=9.7,8.2,1.2hz,1h),6.68(dd,j=8.3,2.3hz,1h),6.63(d,j=2.3hz,1h),5.20(s,2h), 5.18(s,2h),3.96(s,2h),3.69
–
3.61(m,2h),3.45(s,3h),2.92
–
2.87(m,2h).
[0087]
实施例7:n-羟乙基-2-(3-氰基苄氧基)-4-(2-甲氧基-3-邻氟苯基苄氧基)-5-氯苄胺
[0088][0089]
实验步骤重复实施例1,不同之处仅在于将实施例1中第三步反应的原料2,4-二羟基苯甲醛进行替换为同等摩尔量的5-氯-2,4-二羟基苯甲醛,再与2-甲氧基-3-邻氟苯基苄溴反应得到中间体2-羟基-4-(2-甲氧基-3-邻氟苯基苄氧基)-5-氯苯甲醛,再与间氰基苄氯反应得到中间体2-(3-氰基苄氧基)-4-(2-甲氧基-3-邻氟苯基苄氧基)-5-氯苯甲醛,最后再与2-氨基乙醇进行还原胺化反应,各原料或中间体的投料摩尔量重复实施例1中,操作同实施例1,得到类白色固体,收率:45.2%,hplc分析产品纯度:96.9%。1h-nmr (600mhz,chcl
3-d)δ7.76(d,j=1.7hz,1h),7.69(d,j=7.7hz,1h),7.65(dt,j=7.8,1.4 hz,1h),7.57(dd,j=7.6,1.7hz,1h),7.53(t,j=7.8hz,1h),7.45
–
7.38(m,2h),7.34
–ꢀ
7.29(m,2h),7.27
–
7.21(m,2h),7.21
–
7.15(m,1h),6.70(s,1h),5.28(s,2h),5.13(s,2h), 3.86(s,2h),3.69(t,j=5.1hz,2h),3.48(s,3h),2.84(t,j=5.1hz,2h).
[0090]
实施例8:n-乙酰胺乙基-2-(5-氰基吡啶-3-甲氧基)-4-(2-甲氧基-3-邻氟苯基苄氧基)-5
‑ꢀ
氯苄胺盐酸盐
[0091]
nmr(600mhz,chcl
3-d)δ7.77(d,j=1.9hz,1h),7.71(dt,j=7.7,1.5hz, 1h),7.65(dt,j=7.7,1.5hz,1h),7.59(dd,j=7.7,1.7hz,1h),7.53(t,j=7.7hz,1h), 7.43(dddd,j=8.3,7.2,5.1,1.8hz,1h),7.38(t,j=7.6hz,1h),7.33(ddd,j=7.5,5.4,3.4 hz,2h),7.30
–
7.23(m,2h),7.20(ddd,j=9.6,8.3,1.1hz,1h),6.63(dd,j=8.3,2.3hz, 1h),6.60(d,j=2.3hz,1h),5.22(s,2h),5.15(s,2h),3.90(s,2h),3.70
–
3.65(m,2h),2.85 (t,j=5.1hz,2h).esi-ms m/z:517.2[m+h]
+
.
[0099]
实施例11:n-乙酰胺乙基-2-(5-氰基吡啶-3-甲氧基)-4-(2-氯-3-邻氟苯基苄氧基)苄胺盐酸盐
[0100][0101]
实验步骤重复实施例1,不同之处仅在于将实施例1中起始原料3-溴-2-甲氧基苄醇替换为3-溴-2-氯苄醇,进行反应得到中间体2-羟基-4-(2-氯-3-邻氟苯基苄氧基)苯甲醛,该中间体再与5-氯甲基烟碱甲腈反应得到中间体2-(5-氰基吡啶-3-甲氧基)-4-(2-氯-3
‑ꢀ
邻氟苯基苄氧基)苯甲醛,最后再与2-乙酰氨基乙胺进行还原胺化反应,各原料或中间体的投料摩尔量重复实施例1中,操作同实施例1,得到类白色蜡状固体,收率:30.7%, hplc分析产品纯度:96.1%。1h-nmr(600mhz,chcl
3-d)δ8.93(d,j=2.1hz,1h),8.88 (d,j=2.0hz,1h),8.13(t,j=2.1hz,1h),7.59(dd,j=7.7,1.7hz,1h),7.46
–
7.39(m,1h), 7.38(t,j=7.6hz,1h),7.33(ddd,j=7.5,5.7,1.8hz,2h),7.29
–
7.22(m,2h),7.19(ddd,j= 9.6,8.3,1.2hz,1h),6.65(dd,j=8.3,2.3hz,1h),6.61(d,j=2.3hz,1h),6.46(d,j=5.9 hz,1h),5.23(s,2h),5.18(s,2h),3.85(s,2h),3.37(q,j=5.6hz,2h),2.82(t,j=5.7hz, 2h),1.97(s,3h).
[0102]
实施例12:n-羟乙基-2-(5-氰基吡啶-3-甲氧基)-4-(2-氯-3-邻氟苯基苄氧基)苄胺盐酸盐
[0103]
实验步骤重复实施例1,不同之处仅在于将实施例1中起始原料:3-溴-2-甲氧基苄醇替换为:3-溴-2-氯苄醇,进行反应得到中间体2-羟基-4-(2-氯-3-邻氟苯基苄氧基)苯甲醛,该中间体再与5-氯甲基烟碱甲腈反应得到中间体:2-(5-氰基吡啶-3-甲氧基)-4-(2-氯
ꢀ‑
3-邻氟苯基苄氧基)苯甲醛,最后再与2-氨基乙醇进行还原胺化反应,各原料或中间体的投料摩尔量重复实施例1中,操作同实施例1,得到淡黄色胶状固体,收率:31.7%, hplc分析产品纯度:96.7%。1h-nmr(600mhz,chcl
3-d)δ8.92(d,j=2.1hz,1h),8.88 (d,j=2.0hz,1h),8.18(t,j=2.1hz,1h),7.60(dd,j=7.6,1.7hz,1h),7.43(dddd,j=8.3, 7.2,5.2,1.8hz,1h),7.38(t,j=7.6hz,1h),7.33(dtd,j=7.4,4.1,3.7,1.8hz,2h), 7.31
–
7.23(m,2h),7.19(ddd,j=9.6,8.3,1.2hz,1h),6.66(dd,j=8.3,2.3hz,1h),6.62(d, j=2.3hz,1h),5.24(s,2h),5.19(s,2h),3.89(s,2h),3.69
–
3.65(m,2h),2.85(dd,j=5.9, 3.9hz,
2h).esi-ms m/z:518.1664[m+h]
+
.
[0104]
实施例13:n-[2-(3-氰基苄氧基)-4-(2-氯-3-邻氟苯基苄氧基)苄基)]甘氨酸
[0105][0106]
实验步骤重复实施例1,不同之处仅在于将实施例1中起始原料:3-溴-2-甲氧基苄醇替换为:3-溴-2-氯苄醇,进行反应得到中间体2-羟基-4-(2-氯-3-邻氟苯基苄氧基)苯甲醛,该中间体再与间氰基苄氯反应得到中间体:2-(3-氰基苄氧基)-4-(2-氯-3-邻氟苯基苄氧基)苯甲醛,最后再与甘氨酸进行还原胺化反应,各原料或中间体的投料摩尔量重复实施例1中,操作同实施例1,得到类白色固体,收率:46.1%,hplc分析产品纯度: 97.4%。1h-nmr(600mhz,chcl
3-d)δ7.71(s,1h),7.65(d,j=7.9hz,1h),7.52
–
7.48(m, 2h),7.44
–
7.37(m,3h),7.34
–
7.28(m,3h),7.27
–
7.20(m,1h),7.20
–
7.14(m,1h),6.51(d,j =23.5hz,2h),5.07(s,4h),4.12(s,2h),3.38(s,2h).
[0107]
实施例14:n-[2-(3-氰基苄氧基)-4-(2-氯-3-邻氟苯基苄氧基)苄基)]吖丁啶-3-羧酸
[0108][0109]
实验步骤重复实施例1,不同之处仅在于将实施例1中起始原料:3-溴-2-甲氧基苄醇替换为:3-溴-2-氯苄醇,进行反应得到中间体2-羟基-4-(2-氯-3-邻氟苯基苄氧基)苯甲醛,该中间体再与间氰基苄氯反应得到中间体:2-(3-氰基苄氧基)-4-(2-氯-3-邻氟苯基苄氧基)苯甲醛,最后再与吖丁啶-3-羧酸进行还原胺化反应,各原料或中间体的投料摩尔量重复实施例1中,操作同实施例1,得到类白色固体,收率:41.5%,hplc分析产品纯度:97.1%。1h-nmr(600mhz,chcl
3-d)δ7.73(s,1h),7.68(d,j=7.8hz,1h),7.61(d, j=7.7hz,1h),7.55(dd,j=7.6,1.8hz,1h),7.51(t,j=7.7hz,1h),7.46
–
7.38(m,2h), 7.36(t,j=7.6hz,1h),7.31(td,j=7.3,1.8hz,2h),7.24(td,j=7.5,1.2hz,1h),7.18(ddd, j=9.5,8.3,1.2hz,1h),6.64(dd,j=8.5,2.3hz,1h),6.57(d,j=2.3hz,1h),5.19(s,2h), 5.13(s,2h),4.29(s,2h),4.20(s,2h),4.01(s,2h),3.31(s,1h).
[0110]
实施例15:n-[2-(3-氰基苄氧基)-4-(2-氯-3-邻氟苯基苄氧基)苄基)]吡咯烷-3-羟基
[0111][0112]
实验步骤重复实施例1,不同之处仅在于将实施例1中起始原料:3-溴-2-甲氧基苄醇替换为:3-溴-2-氯苄醇,进行反应得到中间体2-羟基-4-(2-氯-3-邻氟苯基苄氧基)苯甲醛,该中间体再与间氰基苄氯反应得到中间体:2-(3-氰基苄氧基)-4-(2-氯-3-邻氟苯基苄
氧基)苯甲醛,最后再与3-羟基吡咯烷进行还原胺化反应,各原料或中间体的投料摩尔量重复实施例1中,操作同实施例1,得到类白色固体,收率:45.1%,hplc分析产品纯度:96.0%。1h-nmr(400mhz,chcl
3-d)δ7.80
–
7.71(m,2h),7.65(d,j=7.6hz,1h), 7.61
–
7.51(m,2h),7.48
–
7.30(m,5h),7.26(td,j=7.5,1.1hz,1h),7.19(dd,j=9.9,8.2hz, 1h),6.68(dd,j=8.3,2.2hz,1h),6.63(d,j=2.3hz,1h),5.24(d,j=3.1hz,4h),4.63(s, 1h),4.27(s,2h),3.49
–
3.19(m,5h),2.28(s,1h),2.12(s,1h).
[0113]
实施例16:n-[2-(3-氰基苄氧基)-4-(2-氯-3-邻氟苯基苄氧基)苄基)]l-丝氨酸
[0114][0115]
实验步骤重复实施例1,不同之处仅在于将实施例1中起始原料:3-溴-2-甲氧基苄醇替换为:3-溴-2-氯苄醇,进行反应得到中间体2-羟基-4-(2-氯-3-邻氟苯基苄氧基)苯甲醛,该中间体再与间氰基苄氯反应得到中间体:2-(3-氰基苄氧基)-4-(2-氯-3-邻氟苯基苄氧基)苯甲醛,最后再与l-丝氨酸进行还原胺化反应,各原料或中间体的投料摩尔量重复实施例1中,操作同实施例1,得到白色固体,收率:37.5%,hplc分析产品纯度: 96.1%。1h-nmr(400mhz,chcl
3-d)δ7.71(s,1h),7.65(d,j=7.6hz,1h),7.49(dd,j= 7.1,2.7hz,2h),7.41(tdd,j=7.3,4.8,1.9hz,2h),7.35
–
7.26(m,4h),7.23(t,j=7.4hz, 1h),7.17(t,j=9.0hz,1h),6.51(d,j=13.2hz,2h),5.06(d,j=4.7hz,4h),4.35
–
4.10(m, 2h),3.94(s,2h),3.47(s,1h).
[0116]
实施例17:n-[2-(3-氰基苄氧基)-4-(2-氯-3-邻氟苯基苄氧基)苄基)]d-丝氨酸
[0117][0118]
实验步骤重复实施例1,不同之处仅在于将实施例1中起始原料:3-溴-2-甲氧基苄醇替换为:3-溴-2-氯苄醇,进行反应得到中间体2-羟基-4-(2-氯-3-邻氟苯基苄氧基)苯甲醛,该中间体再与间氰基苄氯反应得到中间体:2-(3-氰基苄氧基)-4-(2-氯-3-邻氟苯基苄氧基)苯甲醛,最后再与d-丝氨酸进行还原胺化反应,各原料或中间体的投料摩尔量重复实施例1中,操作同实施例1,得到白色固体,收率:37.5%,hplc分析产品纯度: 96.6%。1h-nmr(400mhz,chcl
3-d)δ7.69(s,1h),7.64(d,j=7.8hz,1h),7.51
–
7.44(m, 2h),7.40(tdd,j=7.2,5.0,1.9hz,2h),7.34
–
7.25(m,4h),7.22(t,j=7.4hz,1h),7.16(t,j =9.0hz,1h),6.54
–
6.46(m,2h),5.04(d,j=17.9hz,4h),4.20(s,2h),3.94(s,2h),3.48 (d,j=8.3hz,1h).
[0119]
实施例18:n-羟乙基-2-(5-氨甲酰基吡啶-3-甲氧基)-4-(2-氯-3-邻氟苯基苄氧基)苄胺盐酸盐
[0120][0121]
实验步骤重复实施例1,不同之处仅在于将实施例1中起始原料:3-溴-2-甲氧基苄醇替换为:3-溴-2-氯苄醇,进行反应得到中间体:2-羟基-4-(2-氯-3-邻氟苯基苄氧基)苯甲醛,该中间体再与5-氯甲基烟酰胺反应得到中间体:2-(5-氨甲酰基吡啶-3-甲氧基)-4
‑ꢀ
(2-氯-3-邻氟苯基苄氧基)苯甲醛,最后再与2-氨基乙醇进行还原胺化反应,各原料或中间体的投料摩尔量重复实施例1中,操作同实施例1,得到淡黄色胶状固体,收率: 32.9%,hplc分析产品纯度:95.8%。1h nmr(500mhz,chloroform-d)δ9.02(d,j=2.1 hz,1h),8.87(d,j=2.1hz,1h),8.36(t,j=2.2hz,1h),8.23(s,1h),7.71
–
7.65(m,2h), 7.55
–
7.46(m,2h),7.45
–
7.39(m,2h),7.38(dd,j=7.7,1.9hz,1h),7.36
–
7.30(m,2h), 6.93(d,j=2.4hz,1h),6.76(dd,j=8.4,2.3hz,1h),5.28(d,j=16.7hz,4h),5.21(s,1h), 4.10(s,2h),3.62(d,j=6.3hz,2h),2.92(t,j=5.4hz,2h).esi-ms m/z:535.87[m+h]
+
.
[0122]
实施例19:n-羟乙基-2-(3-氰基苄氧基)-4-(2-氟-3-邻氟苯基苄氧基)苄胺
[0123][0124]
实验步骤重复实施例1,不同之处仅在于将实施例1中起始原料:3-溴-2-甲氧基苄醇替换为:3-溴-2-氟苄醇,进行反应得到中间体:2-羟基-4-(2-氟-3-邻氟苯基苄氧基)苯甲醛,该中间体再与间氰基苄氯反应得到中间体:2-(3-氰基苄氧基)-4-(2-氟-3-邻氟苯基苄氧基)苯甲醛,最后再与2-氨基乙醇进行还原胺化反应,各原料或中间体的投料摩尔量重复实施例1中,操作同实施例1,得到类白色固体,收率:47.8%,hplc分析产品纯度:97.2%。1h-nmr(600mhz,chcl
3-d)δ7.75(s,1h),7.69(d,j=7.9hz,1h),7.64 (d,j=7.7hz,1h),7.53(q,j=7.9,7.3hz,2h),7.45
–
7.36(m,3h),7.26(td,j=8.6,8.1,3.9 hz,3h),7.20(dd,j=10.2,8.3hz,1h),6.63(dd,j=8.3,2.3hz,1h),6.59(d,j=2.3hz, 1h),5.19(s,2h),5.13(s,2h),3.88(s,2h),3.67(t,j=5.1hz,2h),2.83(t,j=5.1hz,2h).
[0125]
实施例20:n-羟乙基-2-(3-氰基苄氧基)-4-[2-氟-3-(2,5-二氟苯基)苄氧基]苄胺
[0126][0127]
实验步骤重复实施例1,不同之处仅在于将实施例1中起始原料:邻氟苯硼酸、3-溴-2
‑ꢀ
甲氧基苄醇分别替换为:2,5-二氟苯硼酸、3-溴-2-氟苄醇,进行两步反应得到中间体: 2-羟基-4-[2-氟-3-(2,5-二氟苯基)苄氧基]苯甲醛,该中间体再与间氰基苄氯反应得
到中间体:2-(3-氰基苄氧基)-4-[2-氟-3-(2,5-二氟苯基)苄氧基]苯甲醛,最后再与2-氨基乙醇进行还原胺化反应,各原料或中间体的投料摩尔量重复实施例1中,操作同实施例1,得到类白色固体,收率:30.9%,hplc分析产品纯度:97.1%。1h-nmr(600mhz,chcl
3-d) δ7.76(d,j=1.7hz,1h),7.71(d,j=7.6hz,1h),7.66
–
7.62(m,1h),7.59
–
7.50(m,2h), 7.40
–
7.36(m,1h),7.30(d,j=8.3hz,1h),7.26(d,j=7.7hz,1h),7.13(dddd,j=23.1,8.9, 7.0,4.0hz,3h),6.66
–
6.58(m,2h),5.17(d,j=3.8hz,4h),4.05(s,2h),3.74(t,j=4.8hz, 2h),2.94(t,j=5.0hz,2h).
[0128]
实施例21:n-羟乙基-2-(5-氰基吡啶-3-甲氧基)-4-[2-氟-3-(2,5-二氟苯基)苄氧基]苄胺
[0129][0130]
实验步骤重复实施例1,不同之处仅在于将实施例1中起始原料:邻氟苯硼酸、3-溴-2
‑ꢀ
甲氧基苄醇分别替换为:2,5-二氟苯硼酸、3-溴-2-氟苄醇,进行两步反应得到中间体: 2-羟基-4-[2-氟-3-(2,5-二氟苯基)苄氧基]苯甲醛,该中间体再与5-氯甲基烟碱甲腈反应得到中间体:2-(5-氰基吡啶-3-甲氧基)-4-[2-氟-3-(2,5-二氟苯基)苄氧基]苯甲醛,最后再与2-氨基乙醇进行还原胺化反应,各原料或中间体的投料摩尔量重复实施例1中,操作同实施例1,得到类白色固体,收率:33.5%,hplc分析产品纯度:96.7%。1h-nmr(600 mhz,chcl
3-d)δ8.93
–
8.90(m,1h),8.86
–
8.83(m,1h),8.17(s,1h),7.56(t,j=7.2hz,1h), 7.41
–
7.36(m,1h),7.29(q,j=5.7,3.7hz,2h),7.20
–
7.08(m,3h),6.68
–
6.61(m,2h), 5.20(d,j=13.8hz,4h),4.04(s,2h),3.76
–
3.73(m,2h),2.95(t,j=5.1hz,2h).
[0131]
实施例22:n-羟乙基-2-(3-氰基苄氧基)-4-[2-氟-3-(2,5-二氟苯基)苄氧基]-5-氯苄胺
[0132][0133]
实验步骤重复实施例1,不同之处仅在于将实施例1中起始原料:邻氟苯硼酸、3-溴-2
‑ꢀ
甲氧基苄醇分别替换为:2,5-二氟苯硼酸、3-溴-2-氟苄醇,进行两步反应得到中间体: 2-羟基-4-[2-氟-3-(2,5-二氟苯基)苄氧基]-5-氯苯甲醛,该中间体再与间氰基苄氯反应得中间体:2-(3-氰基苄氧基)-4-[2-氟-3-(2,5-二氟苯基)苄氧基]-5-氯苯甲醛,最后再与2
‑ꢀ
氨基乙醇进行还原胺化反应,各原料或中间体的投料摩尔量重复实施例1中,操作同实施例1,得到类白色固体,收率:44.2%,hplc分析产品纯度:97.3%。1h-nmr(500mhz, chcl
3-d)δ7.65(s,1h),7.58(q,j=7.7hz,3h),7.46(t,j=7.8hz,1h),7.31(t,j=7.2hz, 1h),7.27(s,1h),7.23(t,j=7.6hz,1h),7.06(dtd,j=14.2,8.1,7.0,3.9hz,3h),6.57(s, 1h),5.21(s,2h),5.02(s,2h),3.76(s,2h),3.62(t,j=5.2hz,2h),2.70(t,j=5.2hz,2h).
[0134]
实施例23:n-羟乙基-2-(5-氰基吡啶-3-甲氧基)-4-[2-氟-3-(2,5-二氟苯基)苄氧基]-5-氯苄胺
[0135][0136]
实验步骤重复实施例1,不同之处仅在于将实施例1中起始原料:邻氟苯硼酸、3-溴-2
‑ꢀ
甲氧基苄醇分别替换为:2,5-二氟苯硼酸、3-溴-2-氟苄醇,进行两步反应得到中间体: 2-羟基-4-[2-氟-3-(2,5-二氟苯基)苄氧基]-5-氯苯甲醛,该中间体再与5-氯甲基烟碱甲腈反应得到中间体:2-(5-氰基吡啶-3-甲氧基)-4-[2-氟-3-(2,5-二氟苯基)苄氧基]-5-氯苯甲醛,最后再与2-氨基乙醇进行还原胺化反应,各原料或中间体的投料摩尔量重复实施例1中,操作同实施例1,得到淡黄色胶状固体,收率:40.1%,hplc分析产品纯度:97.1%。1h-nmr(500mhz,chcl
3-d)δ8.87(t,j=1.8hz,2h),8.10(t,j=2.1hz,1h),7.69
–
7.63 (m,1h),7.37(d,j=4.2hz,2h),7.30(t,j=7.6hz,1h),7.20
–
7.07(m,3h),6.63(s,1h), 5.31(d,j=4.1hz,2h),5.11(s,2h),3.81(s,2h),3.69(t,j=5.1hz,2h),2.82(t,j=5.1hz, 2h).
[0137]
实施例24:n-{2-(3-氰基苄氧基)-4-[2-氟-3-(2,5-二氟苯基)苄氧基]-5-氯苄基}吖丁啶-3
‑ꢀ
羧酸
[0138][0139]
实验步骤重复实施例1,不同之处仅在于将实施例1中起始原料:邻氟苯硼酸、3-溴-2
‑ꢀ
甲氧基苄醇分别替换为:2,5-二氟苯硼酸、3-溴-2-氟苄醇,进行两步反应得到中间体:2-羟基-4-[2-氟-3-(2,5-二氟苯基)苄氧基]-5-氯苯甲醛,该中间体再与间氰基苄氯反应得到中间体:2-(3-氰基苄氧基)-4-[2-氟-3-(2,5-二氟苯基)苄氧基]-5-氯苯甲醛,最后再与吖丁啶-3-羧酸进行还原胺化反应,各原料或中间体的投料摩尔量重复实施例1中,操作同实施例1,得到类白色固体,收率:45.5%,hplc分析产品纯度:96.6%。1h-nmr(500mhz, chcl
3-d)δ7.69(s,1h),7.65(t,j=7.5hz,2h),7.63
–
7.58(m,1h),7.53(t,j=7.8hz,1h), 7.44(s,1h),7.38(t,j=6.9hz,1h),7.29(t,j=7.7hz,1h),7.13(ddt,j=15.5,7.9,4.6hz, 3h),6.64(s,1h),5.26(s,2h),5.13(s,2h),4.12(d,j=9.8hz,4h),3.96(t,j=9.4hz,2h), 3.25(d,j=10.4hz,1h).
[0140]
化合物的药理活性
[0141]
1、体外活性评价化合物对pd-1与pd-l1相互作用的抑制活性:体外蛋白水平的检测方法采用cisbio公司pd-1/pd-l1 binding assay kit检测试剂盒。
[0142]
pd-1/pd-l1小分子抑制剂的筛选原理和方法
[0143]
(1)原理:pd-1蛋白带his标签,pd-1的配体pd-l1带hfc标签,分别用eu标记的 anti-hfc抗体和xl665标记的anti-his抗体与两个标签蛋白结合,激光激发后,能量能够从供体eu上转移到受体xl665,使得xl665发光,而加入抑制剂(化合物或抗体)后,阻断pd-1与pd-l1的结合,使得eu和xl665距离较远,能量不能转移,xl665不会发光。
[0144]
(2)实验方法:具体方法可参考cisbio公司的pd-1/pd-l1试剂盒(货号64icp01peg) 简单描述如下,384孔白色酶标板,每孔加入4μl pd-1蛋白和4μl pd-l1蛋白,然后每孔再加入2μl稀释液或者用稀释液稀释的目标化合物,常温孵育15min,再每孔加入10μl anti-tag 1-eu3+和anti-tag2-xl665的混合液,室温孵育1h-4h后用多功能酶标仪检测665nm和620nm处的荧光信号。htrf率=(665nm/620nm)*104。每个化合物检测8-10个浓度,采用graphpad软件计算ic
50
。
[0145]
(3)筛选结果见表1。
[0146]
按照上述方法,检测实施例1-24制备的目标化合物对pd-1与pd-l1相互作用的抑制活性,并以bms202作为对照药剂。
[0147]
表1.实施例化合物在分子水平对pd-1与pd-l1相互作用的抑制活性评价筛选结果
[0148]
实施例ic
50
(nm)实施例ic
50
(nm)12.41
×
10313≤5002
‑‑‑‑‑‑
1433.6631.99
×
10315≤50041.65
×
103166.005≤103177.3864.15
×
102185.047≤103191.30
×
10283.34
×
102202.26
×
10293.48
×
1022124.581012.7222≤5001110.132328.78123.9224
‑‑‑‑‑‑
bms20255.06
ꢀꢀ
[0149]
2、实施例化合物解除配体pd-l1抑制ifn-γ表达的能力
[0150]
ifn-γ的表达能够反映t淋巴细胞的增殖活性。通过提取人外周血中的pbmcs,在anti-cd3/anti-cd28抗体激活t淋巴细胞的基础上,加入配体pd-l1蛋白能够抑制t 淋巴细胞分泌ifn-γ的水平,加入待测化合物考察化合物解除配体抑制作用的能力。
[0151]
具体操作如下,提前使用anti-cd3(5μg/ml)50μl每孔预包被96孔板,4℃过夜或者37℃包被2h,用前将孔板内包被液吸出,再用pbs洗两遍备用。将新鲜血液与pbs 以1:1体积比例稀释,将血液稀释液与淋巴细胞分离液以4:3体积混合(血液稀释液沿壁缓缓加入淋巴细胞分离液中),密度梯度离心,抽取pbmc层细胞,以2
×
10^4个/ 孔的密度接种到96孔板中,加入anti-cd28抗体(2μg/ml)及il-2(10ng/ml),激活增殖2-4天后,加入待测化合物及pd-l1蛋白(5pg/ml)。48h后采用达科为公司的ifn-γ检测试剂盒检测上清液中的ifn-γ的表达水平。按照上述测试方法,实验结果如图1中。
[0152]
图1中,(-)表示不含有该成分,(+)表示含有该成分。
[0153]
待测化合物为bms202、实施例10、11、12、16、17或18制得的目标化合物。从图1中可以看出,待测化合物在体系中的检测浓度为1μm、2μm、4μm三个浓度点。实验结果表明,实施例10、11、12、16、17、18制得的目标化合物,在1μm、2μm、4μm 时有不同程度的部分解除pd-l1
配体抑制作用的能力。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1