一种用于微量标记核酸样本检测和测序的样品制备方法
1.本发明涉及生物技术领域,具体涉及一种用于微量标记核酸样本检测和测序的样品制备方法。
背景技术:
2.核酸合成是细胞存活和分裂必不可少的过程,在核酸合成时添加核酸类似物,可有效标记新合成的核酸。例如,哺乳动物细胞的dna合成被认为主要发生在细胞周期的s期,marchalc等人利用胸腺嘧啶核苷酸类似物——brdu插入s期正在复制的dna分子,结合全基因组测序技术开发出e/l repli-seq,实现了对dna复制时间的全基因组分析(marchal c,et al. genome-wide analysis of replication timing by next-generation sequencing with e/l repli-seq.natprotoc.2018may;13(5):819-839.)。虽然zhao pa等人对该方法进行了改进,但此类方法仍然受限于核苷酸类似物的实际标记总量,不适用于低标记水平的核酸样本,数据的极限分辨率也因此受到了限制(zhao pa,et al.high-resolution repli-seq defines the temporal choreographyof initiation,elongation and termination of replication in mammalian cells.genome biol.2020mar24;21(1):76.)。
3.因此,本领域还缺乏一种针对微量标记核酸样本检测和测序的样品制备方法。
技术实现要素:
4.针对现有技术的不足,本发明的目的是提供一种用于微量标记核酸样本检测和测序的样品制备方法,目标片段富集效率高,非特异性信号少,检测灵敏度高,适合微量标记核酸样本的检测和测序。
5.为实现上述目的,本发明采用的技术方案是:
6.本发明提供一种用于微量标记核酸样本检测和测序的样品制备方法,包括以下步骤:
7.(1)提供一用核苷酸类似物标记的核酸样品;
8.(2)对上述核酸样品进行片段化处理后,进行不包含pcr扩增的文库制备;
9.(3)对上一步骤获得的文库预制备样品进行核酸纯化,加入非特异性短片段脱氧核糖核苷酸溶液作为封闭剂;
10.(4)加入与核苷酸类似物对应的特异性识别抗体进行孵育;
11.(5)高速离心获得“核酸-抗体”复合物沉淀,蛋白酶消化和核酸纯化去除蛋白;
12.(6)纯化后的样品即为富集含有标记片段的核酸样品,可用于定量检测;
13.(7)纯化后的样品通过pcr扩增完成文库制备,可用于高通量测序分析。
14.优选地,所述核酸样品选自dna样品或rna样品。
15.优选地,步骤(2)中,所述核酸样品片段化处理后的序列长度大于100bp。
16.优选地,步骤(3)中,所述非特异性短片段脱氧核糖核苷酸的片段长度小于50bp。
17.优选地,所述核苷酸类似物选自brdu、bru或edu,和/或所述核苷酸类似物有效标记的核酸样品量大于0.5ng。
18.作为优选的技术方案,以brdu标记的dna样本为例,用于微量brdu标记的dna样本检测和测序的样品制备方法,步骤如下:
19.(a)提供用brdu标记的核酸样品,进行片段化处理;
20.(b)对上述样品进行dna文库预制备,即末端修复,连接接头,并添加user酶剪开环状结构,随后终止进行dna纯化处理,去除体系中的酶;
21.(c)纯化后的核酸样品按1:1000混入非特异性短片段脱氧核糖核苷酸悬液作为封闭剂;
22.(d)混合后的样品按1:5加入te buffer,95℃共变性处理5min,冰上放置2min复性;
23.(e)按10:1向上述混合体系中添加预冷的ip buffer,依次加入抗标记物的一抗和相应的二抗,每个抗体的孵育时间为30min;
24.(f)高速离心获得“目标核酸片段-一抗-二抗”复合物的沉淀,用含蛋白酶k的消化缓冲液重悬,37℃摇床过夜处理,再用蛋白酶k于56℃处理1h,随后进行dna纯化处理,去除体系中的酶;
25.(g)纯化后的样品即为富集含有标记片段的核酸样品,取2μl稀释十倍通过qpcr进行目标片段的定量检测;
26.(h)通过pcr对纯化后的样品进行接头添加和扩增,并进行目标片段长度筛选,获得富集含有标记片段的核酸样品用于高通量测序分析。
27.优选地,步骤(a)中,所述片段化处理后的核酸样品的片段长度分布在200bp
–
400bp。
28.优选地,步骤(b)中,用于dna文库预制备的核酸样品入口量不大于1μg。
29.优选地,步骤(c)中,所述非特异性短片段脱氧核糖核苷酸来源于鱼的短片段dna,片段长度小于50bp。
30.发明人经过广泛而深入的研究,开发一种能够用于微量标记的核酸样本检测和测序的样品制备方法,通过在目标样品中加入非特异性短片段脱氧核糖核苷酸溶液作为核酸杂交的封闭剂,在免疫沉淀反应中和特异性识别标记片段共同被收集,避免了核酸样本中部分非标记片段与抗标记物抗体的非特异性结合,有效降低了免疫沉淀后的非特异性信号,并且封闭剂未参与文库制备,不含文库中的接头,因此不会在qpcr循环中被识别和扩增,实现了对标记片段的高灵敏度检测。此外,封闭剂中的脱氧核糖核苷酸片段长度小于50bp,与目标核酸片段有较大差别,因可以通过片段长度筛选和接头等非目标产物一起被筛去,获得高效富集的核酸产物用于进一步的高通量测序。本发明的主要优点至少在于:
31.(1)本发明的方法可用于微量标记的核酸样本的检测和测序;
32.(2)本发明的方法操作容易,制备产物检测灵敏度高,稳定性强;
33.(3)本发明的方法富集获得的目标片段纯度和富集效率高,测序结果噪音少,检测灵敏度高。
附图说明
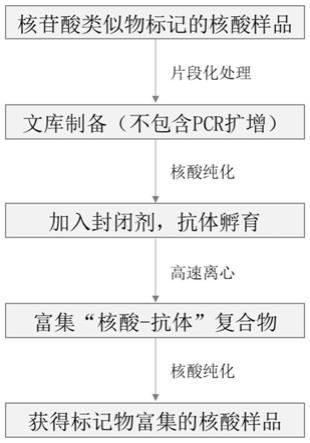
34.图1为一实施例中用于微量标记核酸样本检测和测序的样品制备方法流程图。
35.图2为0.5μg建库入口量的brdu全标记样品以及未标记空白对照样品在封闭剂添加和未添加后的qpcr检测结果。
36.图3为添加封闭剂后的不同含量标记样品qpcr定量检测结果。
37.图4为实施例1中纯化后的样品进行2100质量检测合格后的测序结果。
具体实施方式
38.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明的试验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
39.图1示例性地描述了一种用于微量标记核酸样本检测和测序的样品制备方法,过程如下:对核苷酸类似物标记的核酸样品,进行片段化处理;随后进行不包含pcr扩增的文库制备;核酸纯化去除蛋白后,加入非特异性短片段脱氧核糖核苷酸溶液作为封闭剂;随后加入与核苷酸类似物对应的特异性识别抗体进行孵育,高速离心获得“核酸-抗体”复合物沉淀;核酸纯化去除蛋白后的样品即为富集含有标记片段的核酸样品,可通过qpcr进行定量检测,也可通过pcr扩增完成文库制备后进行高通量测序分析。
40.实施例1
41.本实施例采用s期brdu标记10min的hct116贴壁细胞提取核酸样品。
42.第一步:制备brdu标记的dna片段化样品
43.以5
×
106初始细胞量于10cm细胞培养皿中接种hct116贴壁细胞,同时添加1mm羟基脲,在条件为37℃、5%co2的细胞培养箱中培养24h,获取同步至g1时期的细胞;
44.取出细胞培养皿,pbs清洗3次,更换新鲜的细胞培养基,使细胞从g1期释放进入s 期,加入10μmbrdu标记10min,胰酶消化2min后加入完全培养基终止消化,取5
×
106细胞,用dna提取试剂盒(品牌:qiagen;货号:51304)进行dna抽提;
45.测定样品浓度后取总量为1μg的dna样品,加入dd h2o将总体系补平至50μl后,进行 200bp片段化处理,超声打断处理条件为“peak power:50w,duty factor:20%,cycles per burst: 200,time:200s,temperature:6℃”。
46.第二步:dna文库预制备
47.用dna文库制备试剂盒(品牌:neb;货号:e7645s)中的试剂和相应反应条件进行 dna文库预制备,预制备流程包括:末端修复和加da尾,接头连接,user酶剪切;
48.用dna纯化试剂盒(品牌:上海吉泰依科赛生物科技有限公司;货号:d4013),对上述文库预制备样品进行纯化,去除体系中的酶,纯化后的样本体积为50μl。
49.第三步:免疫沉淀
50.取纯化后的50μl样本,加入短片段的鱼dna(品牌:sigma-aldrich;货号:31149-10g-f),并稀释成500μl混合荣溶液,体系如表1所示:
51.表1
52.50μldna样本纯化去酶50μl10
×
te buffer100mm tris(ph 8.0),10mm edta
50μlfish dna20mg/ml(小于50bp)350μlddh2o补足至500μl
53.高温变性:将上述500μl的混合溶液于95℃金属浴加热5min,随后立即冰上静置2min,获得变性为单链的dna样本;
54.抗体孵育:将上述变性处理的500μl混合溶液转移至新的1.5ml管,并加入预冷的10x ip buffer 60μl,随后加入抗brdu的鼠源一抗1μg于混匀器上室温孵育(条件为25rpm,30min), 再加入40μg抗鼠二抗于混匀器上室温孵育(条件为25rpm,30min);其中,50ml 10
×
ip buffer 配方如表2所示:
55.表2
56.5ml1m硫酸钠溶液(ph7.0)14ml5m氯化钠溶液2.5ml10%triton x-100溶液28.5mlddh2o(补足至50ml)
57.蛋白消化:从上述抗体孵育后的溶液通过高速离心收集“目标dna片段-一抗-二抗”复合物,用含有蛋白酶k的消化缓冲液重悬孵育,将目标dna片段从抗体蛋白中释放,具体方法如表3所示:
58.表3
[0059][0060]
其中,50ml消化缓冲液的配方如表4所示:
[0061]
表4
[0062]
2.5ml1m tris-hcl(ph8.0)1ml0.5m edta2.5ml10%sds溶液44mlddh2o(补足至50ml)
[0063]
dna纯化:使用dna纯化试剂盒,去除体系中的酶,得到20μl纯化的dna样本。
[0064]
第四步:qpcr检测和定量
[0065]
从上述20μl纯化的dna样本中,取2μl用dd h2o稀释10倍,取稀释后的样品配置qpcr 上样体系,用于检测和定量,qpcr上样体系如表5所示:
[0066]
表5
[0067]
7.5μl2
×
mix buffer(品牌:neb;货号:m3003s)3μl引物混合液
1.5μldd h2o3μl样品
[0068]
引物混合液如表6所示:
[0069]
表6
[0070]
10μm上游引物(acactctttccctacacgacgc)10μm下游引物(gactggagttcagacgtgtgc)
[0071]
第五步:完成dna文库制备
[0072]
根据qpcr结果确定合适的pcr扩增循环数,样品的扩增循环数如表7所示:
[0073]
表7
[0074]
样品qpcr ct meanpcr amplification cyclecontrol121410min brdu(+fish)1214
[0075]
确定扩增循环后,用dna文库制备试剂盒中的试剂和相应反应条件完成文库制备,对不同的样品使用不同的index引物,pcr扩增体系如表8所示:
[0076]
表8
[0077]
15μl纯化的dna样本25μlq5 hot start hifi master mix5μl10μm universal primer5μl10μm index primer
[0078]
第六步:dna文库纯化
[0079]
使用磁性筛选法对扩增后的样品进行片段筛选纯化,本实施例的文库的片段长度分布在 350bp左右,筛选流程如下:
[0080]
step1:取扩增后的样品添加50μl ddh2o补足至100μl,转移至用于磁性筛选的低吸附 1.5ml离心管中;
[0081]
step2:加入55μl beads吹打混匀10次,室温静置5min,低速离心5s,转移至磁性分离架上,静置5min,将上清液转移至新的低吸附1.5ml离心管中;
[0082]
step 3:加入30μl beads吹打混匀10次,室温静置5min,低速离心5s,转移至磁性分离架上,静置5min,去除上清液;
[0083]
step 4:保持样品在磁性分离架上,加入200μl 80%乙醇,室温静置30s,去除上清;
[0084]
step 5:重复step 4,低速离心5s,放回磁性分离架上,去除残余上清,静置5min;
[0085]
step6:在磁性分离架取下,加入32μl 10mm tris-hcl,吹打混匀10次,低速离心5s,转移至磁性分离架上,静置5min,收集30μl上清液。
[0086]
此时的样品为纯化后的样品,进行2100质量检测合格后,即可用于全基因组测序。
[0087]
0.5μg建库入口量的brdu全标记样品以及未标记空白对照样品在封闭剂添加和未添加后的qpcr检测结果如图2所示,用于qpcr检测的样品为稀释十倍后的样品,每个样品进行三次重复,结果表明封闭剂的添加显著提高了检测灵敏度,在添加封闭剂的体系中,空白对照样品的ctmean由10.5cycle降为17cycle。
[0088]
添加封闭剂后的不同含量标记样品qpcr定量检测结果如图3所示,分别以500ng、50ng5ng、0.5ng brdu全标样品添加相应的未标记空白样品混合,获得总量为0.5μg的混合样品。结果表明不低于0.5ng微量标记的dna样本可被高灵敏度地检测出。
[0089]
实施例1中纯化后的样品进行2100质量检测合格后测序结果如图4所示,其中复制时间数据来自replication domain数据库,实验组的组内重复相关性达到0.97。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1