咪唑并吡啶衍生物及其用途的制作方法
1-基)甲基)-3-(氧杂环丁烷-2-基甲基)咪唑并[1,2-a]吡啶-6-甲酸,
[0009][0010]
及其药学上可接受的盐。
[0011]
本发明提供的化合物及其药学上可接受的盐在治疗中可以单独使用或与至少一种其他治疗剂结合使用。
[0012]
本发明提供了一种药物组合物,其含有式i所示的化合物及其药学上可接受的盐,以及一种或两种以上其他治疗活性成分。
[0013]
本发明还提供了一种药物制剂,其含有式i所示的化合物及其药学上可接受的盐,及一种或两种以上药用载体;所述的药物制剂为临床上可接受的任一种制剂剂型。
[0014]
本发明提供的化合物及其药学上可接受的盐可以组成固体剂型,如胶囊、片剂、丸剂、锭剂、糖衣剂、颗粒剂、粉末剂、软膏剂、乳膏剂、滴剂等;本发明提供的化合物及其药学上可接受的盐可以是液体剂型,如酏剂、糖浆剂、乳剂、分散剂、悬浮剂、溶液剂、喷雾剂等。
[0015]
本发明的药物组合物或药物制剂中可用的药用载体和/或药用稀释剂可以使药物制剂领域中任何常规的载体和/或稀释剂。
[0016]
本发明所述的药学上可接受的盐包括酸价成盐及碱盐。
[0017]
本发明提供的化合物及其药学上可接受的盐可以是以手性形态存在的,即s构型或r构型。本发明提供的化合物及其药学上可接受的盐可以是以非手性形态存在的。本发明所表述的化合物,当以其中一种构型例举结构时,也表示公开了其另一种构型或非手性形式的结构。
[0018]
本发明所述的化合物包括化合物的立体异构体。本发明所述的立体异构体是指当化合物存在不对称碳原子时,会产生对映异构体;当化合物存在碳碳双键或环状结构时,会产生顺反异构体;当化合物存在酮或肟时,会产生互变异构体;作为一种具体的实施方式,本发明所述的立体异构体包括但不限于:对映异构体、非对映异构体、消旋异构体、顺反异构体、互变异构体、几何异构体、差向异构体及其混合物。
[0019]
本发明所述的药学上可接受的盐可呈非溶剂化及溶剂化形式存在。
[0020]
本发明还提供了如式i所示的化合物及其药学上可接受的盐,在制备用于治疗和/或代谢相关疾病的药物中的用途了所述的代谢相关疾病包括glp-1介导的疾病及相关疾病,包括但不限于:糖尿病、高血糖症、胰岛素抗性、葡萄糖耐受不良、糖尿病肾病、糖尿病神经疾病、糖尿病视网膜病变、脂肪细胞功能障碍、肥胖症、血脂异常症、高胰岛素血症、等;其中,所述的糖尿病包含但不限于,t1d和/或t2dm、特发性t1d、早发性t2d、潜伏性自身免疫性糖尿病、青少年非典型性糖尿病、妊娠糖尿病等。
[0021]
本发明还提供了一种疾病的治疗方法,该方法包括向有需要的患者给药治疗有效量的如式i所示的化合物及其药学上可接受的盐,其中,所述的疾病为glp-1介导的疾病及
相关疾病;所述的疾病包括但不限于:糖尿病、高血糖症、胰岛素抗性、葡萄糖耐受不良、糖尿病肾病、糖尿病神经疾病、糖尿病视网膜病变、脂肪细胞功能障碍、肥胖症、血脂异常症、高胰岛素血症、等;其中,所述的糖尿病包含但不限于,t1d和/或t2dm、特发性t1d、早发性t2d、潜伏性自身免疫性糖尿病、青少年非典型性糖尿病、妊娠糖尿病等。
[0022]
本发明提供的如式i所示的化合物及其药学上可接受的盐,具有优秀的glp-1受体激动活性,能够治疗和/或预防glp-1介导的疾病及相关疾病。
[0023]
本发明还提供上述的化合物或其药学上可接受的盐在制备glp-1受体激动剂相关药物中的应用。
[0024]
在本发明的一些实施方案中,所述glp-1受体激动剂相关药物是用于治疗ii型糖尿病、i型糖尿病和肥胖。
[0025]
本发明还提供一种式x化合物2-(羟甲基)-3-(氧杂环丁烷-2-基甲基)咪唑并[1,2-a]吡啶-6-羧酸甲酯的制备方法。
[0026][0027]
本发明的2-(羟甲基)-3-(氧杂环丁烷-2-基甲基)咪唑并[1,2-a]吡啶-6-羧酸甲酯的制备方法为,以3-氯丙烷-1,2-丙二醇或其衍生物为原料,任选的经过取代、氧化、芳构化、碘代、偶联、氧化、酯化、亲核取代、亲核取代水解、酯化和脱保护反应制备得到式x化合物。
[0028]
本发明的所述的式x的制备方法包括如下步骤:
[0029]
a.3-氯丙烷-1,2-丙二醇(式1-1)经取代反应生成1-((叔丁基二甲基甲硅烷基)氧基)-3-氯丙-2-醇(式1-2)
[0030][0031]
b.1-((叔丁基二甲基甲硅烷基)氧基)-3-氯丙-2-醇经氧化(式1-2)反应生成1-((叔丁基二甲基甲硅烷基)氧基)-3-氯丙烷-2-酮(式1-3)
[0032][0033]
c.1-((叔丁基二甲基甲硅烷基)氧基)-3-氯丙烷-2-酮(式1-3)与6-氨基烟酸乙酯(式1-3-1)经芳构化生成2-(((叔丁基二甲基甲硅烷基)氧基)甲基)咪唑并[1,2-a]吡啶-6-羧酸乙酯(式1-4)
[0034]
[0035]
d.2-(((叔丁基二甲基甲硅烷基)氧基)甲基)咪唑并[1,2-a]吡啶-6-羧酸乙酯(式1-4)经碘代反应生成2-(((叔丁基二甲基甲硅烷基)氧基)甲基)-3-碘咪唑并[1,2-a]吡啶-6-羧酸乙酯(式1-5)
[0036][0037]
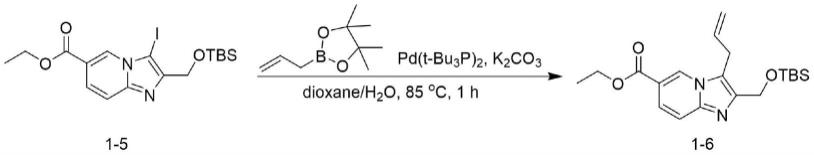
e.2-(((叔丁基二甲基甲硅烷基)氧基)甲基)-3-碘咪唑并[1,2-a]吡啶-6-羧酸乙酯(式1-5)与2-烯丙基-4,4,5,5-四甲基-1,3,2-二恶硼烷经偶联反应生成3-烯丙基-2-(((叔丁基二甲基甲硅烷基)氧基)甲基)咪唑并[1,2-a]吡啶-6-羧酸乙酯(式1-6)
[0038][0039]
f.3-烯丙基-2-(((叔丁基二甲基甲硅烷基)氧基)甲基)咪唑并[1,2-a]吡啶-6-羧酸乙酯(式1-6)经氧化反应生成2-(((叔丁基二甲基甲硅烷基)氧基)甲基)-3-(2,3-二羟丙基)咪唑并[1,2-a]吡啶-6-羧酸乙酯(式1-6-1),再经酯化反应生成2-(((叔丁基二甲基甲硅烷基)氧基)甲基)-3-(3-羟基-2-(甲苯磺酰氧基)丙基)咪唑并[1,2-a]吡啶-6-羧酸乙酯(式1-6-2),后经亲核取代生成2-(((叔丁基二甲基甲硅烷基)氧基)甲基)-3-(环氧乙烷-2-基甲基)咪唑并[1,2-a]吡啶-6-羧酸乙酯(式1-7)
[0040][0041]
g.2-(((叔丁基二甲基甲硅烷基)氧基)甲基)-3-(环氧乙烷-2-基甲基)咪唑并[1,2-a]吡啶-6-羧酸乙酯(式1-7)经亲核取代水解后生成2-(((叔丁基二甲基甲硅烷基)氧基)甲基)-3-(氧杂环丁烷-2-基甲基)咪唑并[1,2-a]吡啶-6-羧酸(式1-8)
[0042][0043]
h.2-(((叔丁基二甲基甲硅烷基)氧基)甲基)-3-(氧杂环丁烷-2-基甲基)咪唑并
[1,2-a]吡啶-6-羧酸(式1-8)经过酯化反应生成2-(((叔丁基二甲基甲硅烷基)氧基)甲基)-3-(氧杂环丁烷-2-基甲基)咪唑并[1,2-a]吡啶-6-羧酸甲酯(式1-9)
[0044][0045]
i.2-(((叔丁基二甲基甲硅烷基)氧基)甲基)-3-(氧杂环丁烷-2-基甲基)咪唑并[1,2-a]吡啶-6-羧酸甲酯(式1-9)经过脱保护生成2-(羟甲基)-3-(氧杂环丁烷-2-基甲基)咪唑并[1,2-a]吡啶-6-羧酸甲酯(式i化合物)
[0046][0047]
作为一种具体的实施方式,反应步骤a的溶剂选自n,n-二甲基甲酰胺、n,n-二甲基乙酰胺或二甲基亚砜中的一种或两种以上,优选n,n-二甲基甲酰胺。
[0048]
作为一种具体的实施方式,反应步骤b的溶剂选自二氯甲烷、甲苯、四氢呋喃、2-甲基四氢呋喃中的一种或两种以上,优选二氯甲烷。
[0049]
作为一种具体的实施方式,反应步骤c的溶剂选自甲醇、乙醇或异丙醇。
[0050]
作为一种具体的实施方式,反应步骤d的溶剂为乙酸或丙酮。
[0051]
作为一种具体的实施方式,反应步骤e的溶剂选自1,4-二氧六环,n-甲基吡咯烷酮,二甲基亚砜中的一种或两种以上与水的混合溶剂,优选1,4-二氧六环与水的混合溶剂。
[0052]
作为一种具体的实施方式,反应步骤f中的氧化反应的溶剂选自乙酸或丙酮与水的混合溶剂,优选为丙酮与水的混合溶剂。
[0053]
作为一种具体的实施方式,反应步骤f中的酯化反应的溶剂为二氯甲烷。
[0054]
作为一种具体的实施方式,反应步骤f中的亲核取代的溶剂为四氢呋喃。
[0055]
作为一种具体的实施方式,反应步骤g的溶剂为2-甲基-2-丙醇。
[0056]
作为一种具体的实施方式,反应步骤h的溶剂为二氯甲烷。
[0057]
作为一种具体的实施方式,反应步骤i的溶剂为四氢呋喃。
[0058]
本发明所述的式x化合物具有作为glp-1受体激动剂合成中间体的用途。
[0059]
本发明所述的式x化合物具有下述的核磁共振氢谱,1h nmr(400mhz,dmso-d6)δ9.09(s,1h),7.60
–
7.56(m,2h),5.08(t,j=5.6hz,1h),5.01(dd,j=12.3,6.1hz,1h),4.61(d,j=5.5hz,2h),4.43(dd,j=13.7,7.8hz,1h),4.25
–
4.22(m,1h),3.88(s,3h),3.46(dd,j=5.3,3.3hz,2h),2.70
–
2.58(m,1h),2.48
–
2.39(m,1h);lc-ms:(esi)m/z:277.0[m+h]
+
。
[0060]
本发明所表述的化合物是依据化学结构式命名的,如果表示同一化合物时化合物的命名与化学结构式不符,则以化学结构式为准。
[0061]
本发明提供的化合物及其药学上可接受的盐可以是以手性形态存在的,即s构型或r构型。本发明提供的化合物及其药学上可接受的盐可以是以非手性形态存在的。本发明
所表述的化合物,当以其中一种构型例举结构时,也表示公开了其另一种构型或非手性形式的结构。
[0062]
本发明所述的化合物包括化合物的立体异构体。本发明所述的立体异构体是指当如式i所示的化合物存在不对称碳原子时,会产生对映异构体。作为一种具体的实施方案,本发明所述的立体异构体包括但不限于:对映异构体、非对映异构体、消旋异构体、顺反异构体、互变异构体、几何异构体、差向异构体及其混合物。
[0063]
本发明的化合物可以存在特定的几何或立体异构体形式。本发明设想所有的这类化合物,包括顺式和反式异构体、(-)-和(+)-对映体、(r)-和(s)-对映体、非对映异构体、(d)-异构体、(l)-异构体,及其外消旋混合物和其他混合物,例如对映异构体或非对映体富集的混合物,所有这些混合物都属于本发明的范围之内。烷基等取代基中可存在另外的不对称碳原子。所有这些异构体以及它们的混合物,均包括在本发明的范围之内。
[0064]
除非另有说明,术语“对映异构体”或者“旋光异构体”是指互为镜像关系的立体异构体。
[0065]
除非另有说明,术语“顺反异构体”或者“几何异构体”系由因双键或者成环碳原子单键不能自由旋转而引起。
[0066]
除非另有说明,术语“非对映异构体”是指分子具有两个或多个手性中心,并且分子间为非镜像的关系的立体异构体。
[0067]
可以通过手性合成或手性试剂或者其他常规技术制备光学活性的(r)-和(s)-异构体以及d和l异构体。如果想得到本发明化合物的一种对映体,可以通过不对称合成或者具有手性助剂的衍生作用来制备,其中将所得非对映体混合物分离,并且辅助基团裂开以提供纯的所需对映异构体。或者,当分子中含有碱性官能团(如胺基)或酸性官能团(如羧基)时,与适当的光学活性的酸或碱形成非对映异构体的盐,然后通过本领域所公知的常规方法进行非对映异构体拆分,然后回收得到纯的对映体。此外,对映异构体和非对映异构体的分离通常是通过使用色谱法完成的,所述色谱法采用手性固定相,并任选地与化学衍生法相结合(例如由胺生成胺基甲酸盐)。
[0068]
本发明的化合物可以在一个或多个构成该化合物的原子上包含非天然比例的原子同位素。例如,可用放射性同位素标记化合物,比如氚(3h),碘-125(125i)或c-14(14c)。又例如,可用重氢取代氢形成氘代药物,氘与碳构成的键比普通氢与碳构成的键更坚固,相比于未氘化药物,氘代药物有降低毒副作用、增加药物稳定性、增强疗效、延长药物生物半衰期等优势。本发明的化合物的所有同位素组成的变换,无论放射性与否,都包括在本发明的范围之内。
[0069]
本发明的术语“药学上可接受的”是指针对那些化合物、材料、组合物和/或剂型而言,它们在可靠的医学判断的范围之内,适用于与人类和动物的组织接触使用,而没有过多的毒性、刺激性、过敏性反应或其它问题或并发症,与合理的利益/风险比相称。
[0070]
本发明的术语“药学上可接受的盐”是指本发明化合物的盐,由本发明发现的具有特定取代基的化合物与相对无毒的酸或碱制备。当本发明的化合物中含有相对酸性的官能团时,可以通过在纯的溶液或合适的惰性溶剂中用足够量的碱与这类化合物接触的方式获得碱加成盐。药学上可接受的碱加成盐包括钠、钾、钙、铵、有机胺或镁盐或类似的盐。当本发明的化合物中含有相对碱性的官能团时,可以通过在纯的溶液或合适的惰性溶剂中用足
够量的酸与这类化合物接触的方式获得酸加成盐。药学上可接受的酸加成盐的实例包括无机酸盐,所述无机酸包括例如盐酸、氢溴酸、硝酸、碳酸、碳酸氢根、磷酸、磷酸一氢根、磷酸二氢根、硫酸、硫酸氢根、氢碘酸、亚磷酸等;以及有机酸盐,所述有机酸包括如乙酸、丙酸、异丁酸、马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、反丁烯二酸、乳酸、扁桃酸、邻苯二甲酸、苯磺酸、对甲苯磺酸、柠檬酸、酒石酸和甲磺酸等类似的酸;还包括氨基酸(如精氨酸等)的盐,以及如葡糖醛酸等有机酸的盐。本发明的某些特定的化合物含有碱性和酸性的官能团,从而可以被转换成任一碱或酸加成盐。
[0071]
本发明的药学上可接受的盐可由含有酸根或碱基的母体化合物通过常规化学方法合成。一般情况下,这样的盐的制备方法是:在水或有机溶剂或两者的混合物中,经由游离酸或碱形式的这些化合物与化学计量的适当的碱或酸反应来制备。
具体实施方式
[0072]
下面结合具体实施例对本发明作进一步的详细说明。以下实施例用于理解本发明的方法和核心思想,对于本领域的技术人员来说,在不脱离本发明构思的前提下,进行任何可能的变化或替换,均属于本发明的保护范围。本发明实施例中未注明具体条件的实验方法,通常为常规条件,或按照原料或商品制造厂商所建议的条件;未注明来源的试剂,通常为通过商业途径可购得的常规试剂。
[0073]
化合物鉴定与表征
[0074]
本发明的1h nmr谱是用bruker仪器(400mhz)测定而得,化学位移用ppm表示。使用四甲基硅烷内标准(0.00ppm)。1h nmr的表示方法:s=单峰,d=双重峰,t=三重峰,m=多重峰,br=变宽的,dd=双重峰的双重峰,dt=三重峰的双重峰。若提供偶合常数时,其单位为hz。
[0075]
本发明的质谱是用lc/ms仪测定得到,离子化方式可为esi或apci。
[0076][0077]
生物测试方法
[0078]
(1)测试仪器及试剂
[0079]
试剂/仪器供应商型号camp-gs dynamic kitcisbio62am4pecdmemcellmaxcgn101.5fbsgemini900-1081%pen-3trepsangom bioteche607011-0100ibmxmeilunbiomb5226384well platecorning3824incubatorthermo3111microscope江南xd-202cell countercounter starstar ic1000plate readertecantecan spark
[0080]
(2)glp-1r试剂盒
[0081]
glp-1r介导的激动剂活性是利用均相时间分辨荧光(即htrf)的camp检测试剂盒,通过基于细胞的功能测定来测定的,所述试剂盒测量细胞中的camp水平。该方法是竞争性免疫测定。它使得能够直接药理学表征在贴壁或悬浮细胞中作用于gs-偶联受体的化合物。
[0082]
细胞产生的天然camp或未标记的camp标准曲线与d2标记的camp红色受体竞争结合单克隆抗camp穴状化合物铕供体,特异性信号与标准或实验样品中camp的浓度成反比。
[0083]
将人glp-1r编码序列(ncbi参考序列np_002053.3)亚克隆到pegfp-n1(tsingke)
中,并分离稳定表达该受体的细胞系,通过在荧光显微镜下观察gfp的表达证实glp-1r表达密度。
[0084]
(3)glp-1r-gfp-293a细胞培养
[0085]
293a gfp-glp-1r细胞在dmem生长培养基,10%热灭活胎牛血清(gemini cat#900-108),1%pen-3trep(sangom biotech cat#e607011-0100)]中培养,并在37℃下在湿润和5%co2培养箱中培养。
[0086]
(4)camp水平测试方法
[0087]
将不同浓度的各待测化合物(在dmso中)在刺激缓冲液中用蒸馏水中1:5稀释,加入500μm 3-异丁基-1-甲基黄质(ibmx;meilunbiocat#mb5226)以获得2x化合物工作溶液,然后用多通道移液管将5μl化合物加入白色384孔测定板(corning3824)中。测定缓冲液混合物中的最终dmso浓度为1
‰
。
[0088]
从t25组织培养瓶中收集细胞,并在室温下以1000rpm离心5分钟。然后将细胞沉淀重悬1ml刺激缓冲液。在计数器star ic1000上对20μl细胞悬浮液样品进行计数,以确定细胞存活力和每毫升细胞计数。然后用刺激缓冲液调节剩余的细胞悬浮液,以使用多通道移液管每孔递送2000个活细胞。将5μl细胞悬浮液加入到已经含有化合物的测定板的每个孔中。将板密封并在37℃下用5%co2温育30分钟。
[0089]
在30分钟温育后,将5μl d2标记的camp和5μl抗camp穴状化合物(两者均在细胞裂解缓冲液中以1:20稀释)加入到测定板的每个孔中。然后将板在室温下温育,60分钟后,用tecan spark读板机读取htrf信号的变化,激发340nm/发射615nm和665nm的吸光值。通过从camp标准曲线内插法将原始数据转化为nm camp,并相对于每个板上包含的完全激动剂glp-17~37(400nm)的饱和浓度确定百分比效果。ec
50
测定是从激动剂剂量-反应曲线进行的,所述曲线是使用4参数逻辑剂量-反应方程用曲线拟合程序分析的。本试验证明本发明的化合物通过camp途径激活glp-1r信号传导,因此起glp-1r激动剂的作用。试验数据以基于所列重复次数的几何平均值(ec
50
s)的形式呈现结果。
[0090]
(5)实验结果
[0091]
化合物编号ec
50emax
1575.2nm46.32》10μm0.077
[0092]
制备实施例
[0093]
制备过程中所用中间体反应物料是参考wo2018109607a1所述的制备方法制得的。
[0094]
实施例1
[0095]
式i化合物2-((4-(6-((4-氰基-2-氟苄基)氧基)吡啶-2-基)哌啶-1-基)甲基)-3-(氧杂环丁烷-2-基甲基)咪唑并[1,2-a]吡啶-6-甲酸(以下简称“化合物1”)的制备方法
[0096][0097]
(1)化合物1-2的制备
[0098][0099]
将化合物1-1(20.0g,181.8mmol)和tbscl(27.4g,181.8mmol)加入到dmf(300ml)中,然后分别加入咪唑(12.3g,181.8mmol)和dmap(5.5g,45.4mmol)。在氮气气氛下,将反应溶液于室温反应16小时。加入h2o(500ml),反应溶液用etoac(3
×
500ml)萃取。用h2o(3
×
500ml)和盐水(400ml)洗涤合并的有机相,干燥(na2so4),过滤并浓缩。快速色谱法(sio2,10%etoac-己烷)处理得到化合物1-2(35.5g,86.7%),[1h nmr(400mhz,dmso-d6)δ5.13(d,j=5.1hz,1h),3.68-3.45(m,5h),0.84-0.80(m,9h),0.02-0.03(m,6h)]。
[0100]
(2)化合物1-3的制备
[0101][0102]
将化合物1-2(30g,133.3mmol)加入dcm(500ml)中,在0℃下分批加入dmp(198.3g,466.6mmol),反应在室温进行16小时,通过在0℃下加入na2s2o3饱和水溶液(500ml)猝灭反应溶液,然后用dcm(3
×
300ml)萃取。合并的有机相用盐水(300ml)洗涤,干燥(na2so4),过滤并浓缩。快速色谱法(sio2,10%etoac-己烷)处理得到化合物1-3(22.5g,76%),[1h nmr(400mhz,dmso-d6)δ4.45(s,2h),4.36(s,2h),0.84
–
0.82(m,9h),0.01
–‑
0.01(m,6h)]。
[0103]
(3)化合物1-4的制备
[0104][0105]
将化合物1-3(40g,180.1mmol)和化合物1-3-1(19.9g,120.1mmol)加入到etoh(500ml)中,然后加入nahco3(37.8g,450.4mmol)和ki(19.9g,120.1mmol)。在氮气气氛下,将反应溶液在80℃搅拌3小时。将反应溶液冷却至室温,加入h2o(500ml),将反应溶液用etoac(3
×
500ml)萃取。合并的有机相用盐水(500ml)洗涤,干燥(na2so4),过滤并浓缩。快速色谱法(sio2,20%etoac-己烷)处理得到化合物1-4(26g,43%),[1hnmr(400mhz,dmso-d6)δ9.23
–
9.20(m,1h),7.91(s,1h),7.51(dd,j=9.5,1.7hz,1h),7.44(d,j=9.4hz,1h),4.71(s,2h),4.27
–
4.23(m,2h),1.24(t,j=7.1hz,3h),0.82(s,9h),0.02(m,6h);lc-ms:(esi)
m/z:336.0[m+h]
+
]。
[0106]
(4)化合物1-5的制备
[0107][0108]
将化合物1-4(10g,29.94mmol)加入溶剂hoac(100ml)中。在0℃下分批加入nis(6.774g,29.94mmol),并在0℃下搅拌反应30分钟。在0℃下将反应溶液在冰水(300ml)中猝灭,然后用dcm(3
×
300ml)萃取。合并的有机相用nahco3(水溶液)、盐水(300ml)洗涤,用na2so4干燥并浓缩,得到化合物1-5(12.3g,89.3%),[1h nmr(400mhz,dmso)δ8.75
–
8.71(1h,m),7.62(dd,j=9.4,1.7hz,1h),7.41(1h,dd,9.4,0.8hz,1h),4.72(s,2h),4.31
–
4.28(m,2h),1.30
–
1.26(m,3h),0.82
–
0.73(m,9h),-0.00(s,6h);lcms:(esi)m/z:460.9[m+h]
+
]。
[0109]
(5)化合物1-6的制备
[0110][0111]
在氮气氛下,向化合物1-5(7.5g,16.3mmol)在二氧杂环己烷/水(4/1,200ml)中的溶液中加入2-烯丙基-4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷(8.2g,48.9mmol)、pd(t-bu3p)2(833mg,1.6mmol)、k2co3(13.5g,97.8mmol),将混合物在85℃下搅拌1小时,反应完成后,减压除去大部分溶剂,将混合物倒入水中,用etoac(3
×
300ml)萃取,用盐水洗涤,用na2so4干燥,过滤,蒸除溶剂,将残余物通过快速柱色谱(硅胶,用pe中的etoac从0%-20%洗脱)纯化,得到化合物1-6(3.2g,52%),[1h nmr(400mhz,cdcl3)δ8.56(s,1h),7.58(dd,j=9.4,1.5hz,1h),7.43(d,j=9.5hz,1h),5.80
–
5.77(m,1h),5.03(dd,j=10.1,1.1hz,1h),4.93(dd,j=17.2,1.2hz,1h),4.82(s,2h),4.31
–
4.27(m,2h),3.73(d,j=5.7hz,2h),1.29(t,j=7.1hz,3h),0.80(s,9h),0.00(s,6h);lcms:(esi)m/z:375.0[m+h]
+
]。
[0112]
(6)化合物1-6-1的制备
[0113][0114]
向化合物1-6(300mg,0.8mmol)、nmo(281mg,2.4mmol)在丙酮/水(3:2,5.0ml)中的溶液中加入k2oso2(oh)4(15mg,0.04mmol)。在室温下搅拌反应过夜后,加入na2s2o3,搅拌混合物2小时,用etoac(3
×
10ml)萃取反应溶液。合并的有机层用盐水(10ml)洗涤,干燥(4)并过滤。减压浓缩溶剂,并将残余物通过快速柱色谱法(硅胶,用pe中的etoac 0-100%)纯化,得到化合物1-6-1(212mg,61%),[1h nmr(400mhz,dmso-d6)δ9.08(s,1h),7.59
–
7.53(m,2h),4.91(d,j=4.7hz,1h),4.83
–
4.71(m,3h),4.40
–
4.30(m,2h),3.78
–
3.67(m,1h),3.36(dd,j=10.7,5.3hz,1h),3.31
–
3.19(m,2h),3.01(dd,j=15.1,7.8hz,1h),1.34(t,j=
7.1hz,3h),0.88(s,9h),0.09(d,j=1.8hz,6h);lc-ms:(esi)m/z:409.1[m+h]
+
]。
[0115]
(7)化合物1-6-2的制备
[0116][0117]
在室温下搅拌21小时后,在0℃下,向化合物1-6-1(162mg,0.39mmol)在干燥ch2cl2(2ml)中的悬浮液内,添加对甲苯磺酰氯(76mg,0.39mmol)、三乙胺(39mg,0.39mmol)和氧化二丁基锡(2.0mg,0.007mmol),真空浓缩该混合物。获得的残留物通过快速柱色谱法(硅胶,用50%-100%的pe中的etoac洗脱)纯化,得到化合物1-6-2(127mg,57%),[1h nmr(400mhz,dmso-d6)δ8.94(s,1h),7.70(d,j=8.3hz,2h),7.55
–
7.51(m,2h),7.40(d,j=8.2hz,2h),5.40(d,j=4.5hz,1h),4.68(q,j=12.4hz,2h),4.05
–
3.79(m,4h),3.11
–
3.07(m,2h),2.35(s,3h),1.28(t,j=7.1hz,3h),0.79(s,10h),-0.00(d,j=2.8hz,6h);lc-ms:(esi)m/z:563.1[m+h]
+
]。
[0118]
(8)化合物1-7的制备
[0119][0120]
在0℃下,向1-6-2(127mg,0.31mmol)在无水thf(5ml)中的溶液中加入叔丁醇钾(42mg,0.37mmol),将反应混合物在室温下搅拌16小时,然后用水猝灭。用乙酸乙酯萃取后,有机层用盐水洗涤,用无水na2so4干燥,真空浓缩。纯化残余物通过快速柱色谱法纯化残余物(硅胶,用0-10%meoh/dcm洗脱),得到化合物1-7(32mg,32%),[1h nmr(400mhz,dmso-d6)δ8.90(s,1h),7.53
–
7.50(m,2h),4.72(s,2h),4.27(q,j=7.1hz,2h),3.54(dd,j=15.6,3.3hz,1h),3.20
–
3.07(m,3h),2.64
–
2.58(m,1h),1.25(t,j=7.1hz,3h),0.79(s,9h),0.00(d,j=1.7hz,6h);lc-ms:(esi)m/z:390.2[m+h]
+
]。
[0121]
(9)化合物1-8的制备
[0122][0123]
向搅拌的叔丁氧基钾(862mg,7.68mmol,10eq)的2-甲基-2-丙醇(20ml)溶液中加入碘三甲基-λ6-硫烷(591.69g,7.68mmol,10当量)和化合物1-7(300mg,0.76mmol,1.00当量)。将所得混合物在80℃下搅拌1小时。然后减压除去溶剂,用h2o(50ml)猝灭反应,用1m hcl中和至ph为7,用etoac萃取后,用盐水洗涤有机层,用无水na2so4干燥,真空浓缩,得到残余物化合物1-9(280mg粗品),[lc-ms:(esi)m/z:377.1[m+h]
+
]。
[0124]
(10)化合物1-9的制备
[0125][0126]
在氮气下,于室温下,在圆底烧瓶中,将化合物1-8(280mg,0.74mmol,1.0eq)、ch3i(116mg,0.81mmol,1.1当量)和k2co3(308mg,2.23mmol,3.0eq)在dmf(5ml)中的混合物搅拌1小时。用h2o(20ml)猝灭反应,用etoac萃取。有机层用盐水洗涤,用无水na2so4干燥,真空浓缩,得到残余物。将残余物通过快速柱色谱法(硅胶,用0-10%meoh/dcm洗脱)纯化,得到化合物1-9,[1h nmr(400mhz,dmso-d6)δ9.10(s,1h),7.62
–
7.53(m,2h),5.06
–
4.98(m,1h),4.81(dd,j=12.5,4.4hz,2h),4.43(dd,j=14.4,7.1hz,1h),4.26
–
4.15(m,1h),3.88(s,3h),3.46(t,j=4.9hz,1h),3.30
–
3.17(m,1h),2.66
–
2.56(m,1h),2.44(dd,j=9.5,5.7hz,1h),0.88(s,9h),0.09(d,j=2.6hz,6h);lc-ms:(esi)m/z:391.1[m+h]
+
]。
[0127]
(11)式x化合物的制备
[0128][0129]
向化合物1-9(45mg,0.11mmol,1.0eq)在thf(4ml)中的搅拌溶液中加入et3n
·
hf(56mg,0.34mmol,3eq)。将所得混合物在室温搅拌另外16小时。然后减压除去溶剂,用h2o(10ml)猝灭反应。用(chcl3:ipa=1:3)萃取后,用盐水洗涤有机层,用无水na2so4干燥,并真空浓缩,得到残余物。粗产物经hplc纯化(梯度:10%mecn/90%h2o,0.1%nh3·
h2o至100%mecn),得到产物1-10,为中间体x(10mg,29%),[1hnmr(400mhz,dmso-d6)δ9.09(s,1h),7.60
–
7.56(m,2h),5.08(t,j=5.6hz,1h),5.01(dd,j=12.3,6.1hz,1h),4.61(d,j=5.5hz,2h),4.43(dd,j=13.7,7.8hz,1h),4.25
–
4.22(m,1h),3.88(s,3h),3.46(dd,j=5.3,3.3hz,2h),2.70
–
2.58(m,1h),2.48
–
2.39(m,1h);lc-ms:(esi)m/z:277.0[m+h]
+
]。
[0130]
(12)化合物1-11的制备
[0131][0132]
向式x化合物(20mg,0.07mmol)在无水dcm(5ml)中的溶液中加入mscl(10mg,0.08mmol)和tea(22mg,0.21mmol)。将反应混合物在0℃下搅拌3小时,然后用水淬灭。用dcm萃取后,用盐水洗涤有机层,用无水na2so4干燥,真空浓缩,得到残余物为化合物1-11(26mg,粗品)。
[0133]
(13)化合物1-12的制备
[0134][0135]
将化合物1-11(26mg,0.07mmol),3-氟-4-(((6-(哌啶-4-基)吡啶-2-基)氧基)甲基)苄腈(23mg,0.07mmol)和tea(15mg,0.14mmol)在1,4-二恶烷(1.5ml)和ch3cn(1ml)中的混合物在rt下搅拌过夜。将反应混合物蒸发至干,得到粗产物。残余物通过快速柱色谱法纯化(硅胶,用0-10%meoh/dcm洗脱),得到产物化合物1-12(20mg,粗品),[lc-ms:(esi)m/z:570.4[m+h]
+
]。
[0136]
其中,中间体3-氟-4-(((6-(哌啶-4-基)吡啶-2-基)氧基)甲基)苄腈是参考wo2018109607a1所述的制备方法制得的。
[0137]
(14)化合物1的制备
[0138][0139]
将化合物1-12(20mg,0.03mmol)、lioh(0.5ml)在thf(0.5ml)和meoh(0.5ml)中的混合物在室温下搅拌2小时。然后减压除去溶剂,得到粗产物,将其通过hplc纯化(梯度:10%mecn/90%h2o,0.1%nh3·
h2o至100%mecn),得到终产物2-((4-(6-((4-氰基-2-氟苄基)氧基)吡啶-2-基)哌啶-1-基)甲基)-3-(氧杂环丁烷-2-基甲基)咪唑并[1,2-a]吡啶-6-甲酸(2.5mg,13%),为化合物1,[1h nmr(400mhz,dmso-d6)δ8.73(s,1h),7.89(d,j=10.1hz,1h),7.70(d,j=3.8hz,2h),7.63(dd,j=8.5,5.6hz,2h),7.30(d,j=9.2hz,1h),6.87(d,j=7.3hz,1h),6.71(d,j=8.2hz,1h),5.46(s,2h),5.06
–
4.97(m,1h),4.45(dd,j=13.7,7.8hz,1h),4.38
–
4.35(m,1h),3.61(dd,j=25.2,13.1hz,2h),3.41(s,2h),3.04
–
2.93(m,2h),2.68
–
2.51(m,3h),2.12
–
2.08(m,2h),1.78
–
1.59(m,4h);lc-ms:(esi)m/z:556.1[m+h]
+
]。
[0140]
实施例2
[0141]
2-((4-(6-((4-氰基-2-氟苄基)氧基)吡啶-2-基)哌啶-1-基)甲基)-3-(吗啉代甲基)咪唑并[1,2-a]吡啶-6-甲酸(化合物2)的制备方法
[0142][0143]
(1)化合物2-2的制备
[0144][0145]
将含有干燥dmf(50ml)的烧瓶冷却至0℃,加入磷酰氯(8.5ml,93mmol)。除去冷却浴,并将溶液在室温下搅拌1小时。将红色反应混合物用6-溴咪唑并[1,2-a]吡啶-2-羧酸乙酯(10g,37.2mmol)的无水dmf(50ml)溶液处理,3小时后将混合物加热至60℃,将反应混合物倒入冰水(100ml)中,通过加入2n氢氧化钠水溶液中,用二氯甲烷(3
×
80ml)萃取。将合并的有机相经硫酸钠干燥,并真空浓缩,得到化合物2-2(5.6g,34%),[1h nmr(400mhz,cdcl3)δ10.66(s,1h),9.83(dd,j=1.9,0.8hz,1h),7.78(dd,j=9.5,0.7hz,1h),7.67(dd,j=9.5,1.9hz,1h),4.59
–
4.53(m,2h),1.48(t,j=7.1hz,3h);lcms:m/z(esi):298.9[m+h]
+
]。
[0146]
(2)化合物2-3的制备
[0147][0148]
将三乙酰氧基硼氢化钠(7.1g,33mmol)加入到6-溴-3-甲酰基咪唑并[1,2-a]吡啶-2-羧酸乙酯(3.3g,11mmol)的二氯乙烷(60ml)溶液中。将所得混合物在室温搅拌2天。用nahco3水溶液(100ml)猝灭反应混合物,用etoac(200ml)稀释,用h2o(100ml)和盐水(100ml)洗涤。有机层用na2so4干燥,过滤并蒸发。快速色谱(sio2,5%meoh-ch2cl2)得6-溴-3-(羟基甲基)咪唑并[1,2-a]吡啶-2-羧酸酯,为化合物2-3(2.1g,64%),[1h nmr(400mhz,cdcl3)δ8.43(d,j=0.9hz,1h),7.58(dd,j=9.6,0.6hz,1h),7.36
–
7.32(m,1h),5.25(d,j=5.2hz,2h),4.47
–
4.42(m,2h),2.91(s,1h),1.49
–
1.45(m,3h);lcms:m/z(esi):299.9[m+h]
+
]。
[0149]
(3)化合物2-5的制备
[0150][0151]
将甲磺酰氯(760mg,6.6mmol)加入到6-溴-3-(羟甲基)咪唑并[1,2-a]吡啶-2-羧酸乙酯(1g,3.3mmol)中,加入et3n(1.7g,16.8mmol)的ch2cl2(10ml)溶液,将混合物在0℃搅
拌2小时,加入吗啉(1.7g,19.5mmol)。将所得混合物在室温搅拌过夜。将反应物倒入etoac(100ml)中,用饱和nahco3水溶液(100ml)、h2o(100ml)和盐水(100ml)洗涤有机层,干燥(na2so4),过滤并浓缩。快速色谱法(sio2,30%etoac-pe)得6-溴-3-(吗啉代甲基)咪唑并[1,2-a]吡啶-2-甲酸乙酯,为化合物2-5(560mg,45.5%),[1h nmr(400mhz,dmso-d6)δ8.76(d,j=1.0hz,1h),7.64(dd,j=9.6,0.6hz,1h),7.51(dd,j=9.6,1.9hz,1h),4.35
–
4.31(m,2h),4.19(s,2h),3.57
–
3.42(m,3h),3.32(s,2h),2.42(s,3h),1.36
–
1.32(m,3h);lcms:m/z(esi):369.0[m+h]
+
]。
[0152]
(4)化合物2-6的制备
[0153][0154]
在-78℃下,将dibal-h(1.5m的甲苯溶液,20ml,30mmol)加入到6-溴-3-(吗啉代甲基)咪唑并[1,2-a]吡啶-2-羧酸乙酯(2.1g,5.7mmol)的ch2cl2(40ml)溶液中,然后在-78℃下搅拌反应2小时。在0℃加入乙醚(20ml),加入h2o(1.2ml),在0℃加入15%naoh(4ml),然后将混合物在室温搅拌15分钟,加入na2so4(2.0g),然后在室温搅拌15分钟,过滤并用etoac(50ml)稀释。有机层用水(50ml)、盐水(50ml)洗涤,干燥(na2so4),过滤并浓缩。将粗产物通过快速硅胶色谱法(洗脱梯度为0至100%etoac/pe)纯化,得到(6-溴-3-(吗啉代甲基)咪唑并[1,2-a]吡啶-2-基)甲醇,为化合物2-6(1.2g,64.5%),[1h nmr(400mhz,cdcl3)δ10.24(s,1h),8.64(s,1h),7.58(d,j=9.6hz,1h),7.39(d,j=9.4hz,1h),4.21(s,2h),3.78
–
3.57(m,4h),2.52(s,4h);lcms:m/z(esi):327.0[m+h]
+
]。
[0155]
(5)化合物2-7的制备
[0156][0157]
将三乙酰氧基硼氢化钠(900mg,4.2mmol)加入到6-溴-3-(吗啉代甲基)咪唑并[1,2-a]吡啶-2-甲醛(450mg,1.38mmol)、3-氟-4-(((6-(哌啶-4-基)吡啶-2-基)氧基)甲基)苄腈(450mg,1.45mmol)在ch2cl2(15ml)中的混合物中,并将该混合物在室温搅拌16小时,将该混合物用nahco3水溶液(50ml)猝灭,用etoac(100ml)稀释,用h2o(50ml)和盐水(100ml)洗涤。有机层用na2so4干燥,过滤并蒸发。快速色谱法(sio2,10%meoh-ch2cl2),得到4-(((6-(1-((6-溴-3-(吗啉代甲基)咪唑并[1,2-a]吡啶-2-基)甲基)哌啶-4-基)吡啶-2-基)氧基)甲基)-3-氟苄腈,为化合物2-7(450mg,52%),[1h nmr(400mhz,cdcl3)δ8.51(s,1h),7.62(t,j=7.5hz,1h),7.55
–
7.40(m,3h),7.37(d,j=9.3hz,1h),7.23(s,1h),6.74(d,j=
7.3hz,1h),6.63(d,j=8.1hz,1h),5.43(d,j=53.0hz,2h),3.87(s,2h),3.78
–
3.64(m,6h),3.04(d,j=11.2hz,2h),2.47(d,j=4.3hz,4h),2.18(s,2h),1.83(s,5h);lcms:m/z(esi):620.0[m+h]
+
]。
[0158]
(6)化合物2的制备
[0159][0160]
在4-(((6-(1-((6-溴-3-(吗啉代甲基)咪唑并[1,2-a]吡啶-2-基)甲基)哌啶-4-基)吡啶-2-基)氧基)甲基)-3-氟苄腈(200mg,0.32mmol)的et3n(10ml)中,加入乙酸钯(60mg,0.27mmol)、三苯基膦(150mg,0.57mmol)后,在一氧化碳气氛下,在55℃下搅拌反应16小时。过滤混合物并浓缩,粗产物通过制备性hplc纯化。蒸干含有所需化合物的馏分,得到2-((4-(6-((4-氰基-2-氟苄基)氧基)吡啶-2-基)哌啶-1-基)甲基)-3-(吗啉代甲基)咪唑并[1,2-a]吡啶-6-甲酸(4mg),为化合物2,[1h nmr(400mhz,dmso-d6)δ9.02(s,1h),7.88(d,j=10.3hz,1h),7.68(d,j=17.4hz,4h),7.52(d,j=10.1hz,1h),6.88(s,1h),6.71(d,j=7.2hz,1h),5.46(s,2h),3.97(s,2h),3.66(s,3h),3.00(s,3h),2.42(s,4h),2.16(s,2h),2.00(s,1h),1.71(d,j=18.8hz,5h),1.24(s,2h);lcms:m/z(esi):585.0[m+h]
+
]。
[0161]
以上本发明所提供的glp-1受体激动剂及其应用进行了详细的介绍。本文中应用了具体实施例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其中心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1