一种多卤代氮杂螺环己二烯酮类化合物的合成方法
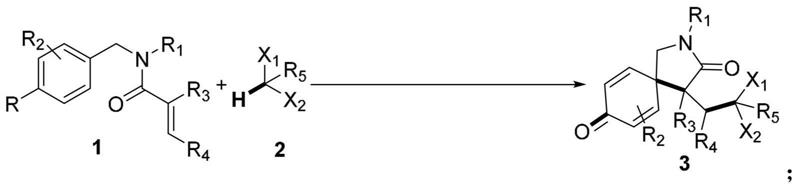
1.本技术属于有机合成方法学技术领域,具体涉及一种多卤代氮杂螺环己二烯酮类化合物的合成方法。
背景技术:
2.含卤素的有机分子结构是重要的结构单元,广泛地存在于天然产物、杀虫剂和生物活性分子中,也是有机合成中通用的合成中间体。其中,多卤代化合物,特别是具有二或三氯甲基的化合物在天然产物中广泛存在,表现出广泛的生物活性,包括抗肿瘤、抗炎等性质。因此,化学研究者付出了相当大的努力来开发构建多卤化骨架分子的新方法。自从kharasch课题组报道了以溴代三氯甲烷为多卤代自由基源,与不饱和烃的原子转移自由基加成反应以来(j.am.chem.soc.1945,67,1626-1627.),自由基介导的烯烃的反应已成为快速构建各种多卤代化合物的最有效方法之一。通常,这些方法根据多卤代烷基自由基的生成方式可分为两类,如下所示:(a)合成多卤代分子的方法通常侧重于烯烃与多卤代烷烃发生自由基介导的反应,通过使用光催化剂、热催化剂、有机金属试剂和/或剧毒有机引发剂(通常是aibn和bu3snh)来使碳-卤键断裂;(b)通过选择性裂解c(sp3)-h键,将多卤代烷烃(例如ch2cl2和chcl3)转化为多卤代烷基自由基以引发烯烃的自由基串联环化反应(org.lett.2018,20,212-215.;org.chem.front.2014,1,1289-1294.;rsc adv.2014,4,64855-64859.;org.biomol.chem.2018,16,5752-5755.;org.chem.front.2019,6,512-516.;chem.commun.2021,57,3684-3687.;j.org.chem.2015,80,2621-2626.;org.lett.2014,16,4698-4701.)。尽管该领域取得了令人瞩目的进展,但这些方法需要苛刻的条件、昂贵的金属催化剂(通常是ir或ru)或过量的过氧化物(例如dcp和lpo)。因此,直接简便的策略构建多卤化代合物是十分必要且急需的。
3.n-苄基丙烯酰胺类化合物已经被证明是良好的自由基受体,容易经自由基介导的串联螺环化反应制备各种不同的氮杂螺环己烯酮类化合物(org.lett.2016,18,1048-1051.;org.biomol.chem.2018,16,2406-2410.;j.org.chem.2011,76,9278-9293.;org.lett.2014,16,3188-3191.;org.lett.2014,16,5914-5917;chem.commun.2016,52,3709-3712.;tetrahedron letters.2017,58,2127-2130.;org.biomol.chem.2020,18,8376-8380.;org.biomol.chem.2021,19,7602-7606.),特别是发展了n-苄基丙烯酰胺类化合物与卤代烷烃作为烷基自由基源以制备氮杂螺环己烯酮类化合物的有效策略。然而,由于反应需要昂贵的金属催化剂或氧化剂,这些方法中的大多数都受到限制。此外,这些从烷基卤化物形成烷基自由基的方法仅通过碳-卤键断裂,而不是碳-氢键断裂。据我们所知,从容易获得的多卤代烷烃(例如ch2cl2和chcl3)通过选择性裂解c(sp3)-h键生成多卤代烷基自由基以引发烯烃的螺环化反应的方法尚未见报道。因此,我们报告了一种简便的无金属催化策略,用于通过自由基介导的n-苄基丙烯酰胺类化合物与多卤代烷烃类化合物的串联螺环化来合成多卤代氮杂螺环己二烯酮类化合物,其中多卤代烷烃通过断裂c(sp3)-h键生成多卤代烷基自由基。
技术实现要素:
4.本发明的目的在于丰富现有技术多卤代氮杂螺环己二烯酮类化合物的合成途径,提供一种简便的无金属催化策略,通过自由基介导的n-苄基丙烯酰胺类化合物与多卤代烷烃类化合物的串联螺环化来合成多卤代氮杂螺环己二烯酮类化合物,其中多卤代烷烃类化合物通过断裂c(sp3)-h键生成多卤代烷基自由基。
5.根据本发明提供的一种多卤代氮杂螺环己二烯酮类化合物的合成方法,包括如下步骤:
6.向反应器中依次加入式1所示的n-苄基丙烯酰胺类化合物、式2所示的多卤代烷烃类化合物、芳香族四氟硼酸重氮盐和碱,随后将反应器用惰性气氛置换,在室温条件下搅拌反应,反应完全后经后处理得到式3所示的多卤代氮杂螺环己二烯酮类化合物;反应式如下:
[0007][0008]
其中,r表示or’,r’选自c
1-12
烷基、c
6-20
芳基-c
1-12
烷基、三(c
1-12
烷基)硅基、c
1-12
酰基;优选为c
1-6
烷基、c
6-20
芳基-c
1-6
烷基、三(c
1-6
烷基)硅基、c
1-6
酰基;进一步优选为甲基、乙基、正丙基、异丙基、正丁基、叔丁基、苄基、三甲基硅基、三乙基硅基、叔丁基二甲基硅基、甲酰基、乙酰基、特戊酰基;最优选为苄基、甲基、叔丁基二甲基硅基、特戊酰基。
[0009]
r1选自c
1-12
烷基、c
6-20
芳基-c
1-12
烷基、c
3-8
环烷基;优选为c
1-8
烷基、c
6-20
芳基-c
1-6
烷基、c
3-6
环烷基;进一步优选为甲基、乙基、正丙基、异丙基、正丁基、叔丁基、正戊基、正己基、正庚基、正辛基、正癸基、苄基、苯乙基、环丙基、环丁基、环戊基、环己基;最优选为乙基、正辛基、苄基、苯乙基、异丙基、叔丁基、环丙基、环戊基、环己基。
[0010]
r2选自氢、卤素、c
1-6
烷基、c
1-6
烷氧基;优选为氢、氟、氯、溴、甲基、乙基、正丙基、异丙基、叔丁基、甲氧基、乙氧基、叔丁氧基;最优选为氢、氯、溴、甲氧基。
[0011]
r3、r4选自氢、c
1-6
烷基;优选为氢、甲基、乙基、正丙基、异丙基、叔丁基;最优选为氢、甲基。
[0012]
r5选自氢、c
1-6
烷基、c
1-6
卤代烷基;优选地为氢、甲基、乙基、正丙基、一氯甲基、二氯甲基、三氯甲基、一氟甲基、二氟甲基、三氟甲基、一溴甲基、二溴甲基、三溴甲基;最优选地为氢、一氯甲基、二氯甲基。
[0013]
x1,x2表示卤素,彼此独立地选自氟、氯、溴、碘;优选地,x1,x2彼此独立地为氯或溴。
[0014]
根据本发明前述的合成方法,其中,所述的芳香族四氟硼酸重氮盐为取代或未取代的苯基四氟硼酸重氮盐,优选地为苯基四氟硼酸重氮盐、甲氧基取代的苯基四氟硼酸重氮盐、卤素取代的苯基四氟硼酸重氮盐、甲基取代的苯基四氟硼酸重氮盐、硝基取代的苯基四氟硼酸重氮盐;最优选地为苯基四氟硼酸重氮盐、4-甲氧基苯基四氟硼酸重氮盐、4-硝基苯基四氟硼酸重氮盐。
[0015]
根据本发明前述的合成方法,其中,所述的碱为无机碱,所述的无机碱选自碳酸
钠、碳酸钾、磷酸钾、碳酸铯、碳酸氢钠、碳酸氢钾、氢氧化钠、氢氧化钾中的一种或几种的混合物;优选地为碳酸钠、碳酸钾、磷酸钾、碳酸铯、碳酸氢钠中的任意一种;最优选为碳酸钠。
[0016]
根据本发明前述的合成方法,所述方法不使用有机溶剂,并且其中,式1所示的n-苄基丙烯酰胺类化合物、式2所示的多卤代烷烃类化合物、芳香族四氟硼酸重氮盐和碱的投料摩尔比为1∶(10~1000)∶(1~5)∶(1~5);优选地为1∶(20~100)∶(1~3)∶(1~3);进一步优选为1∶50∶2∶2。
[0017]
根据本发明前述的合成方法,所述的惰性气氛为氮气气氛或氩气气氛,优选地为氩气气氛。
[0018]
根据本发明前述的合成方法,所述搅拌反应的反应时间为4~48小时,优选为8~24小时,更优选为12~16小时。
[0019]
根据本发明前述的合成方法,其中,所述的后处理操作如下:反应完全后,将反应液过滤,减压蒸馏除去溶剂,再经硅胶柱层析分离得到式3所示的多卤代氮杂螺环己二烯酮类化合物。
[0020]
本发明的方法具有如下有益效果:
[0021]
(1)本发明首次报道了通过自由基介导的n-苄基丙烯酰胺类化合物与多卤代烷烃类化合物的串联螺环化来合成多卤代氮杂螺环己二烯酮类化合物的合成策略,反应机理控制试验表明,本发明中多卤代烷烃类化合物通过断裂c(sp3)-h键生成多卤代烷基自由基,该合成策略未见现有技术报道。
[0022]
(2)本发明的合成方法不需要使用昂贵的金属催化剂或氧化剂,不需要使用另外地添加有机溶剂,在芳香族四氟硼酸重氮盐和碱的条件下即可顺利进行串联自由基加成和分子内环化/脱芳构化反应,通过一步反应形成多种化学键和螺环结构,反应条件温和简单,在室温下即可进行,操作简便。
[0023]
(3)本发明的合成方法具有宽泛的反应底物适应范围,目标产物分离产率高达91%。
具体实施方式
[0024]
以下结合具体实施例,对本发明作进一步详述。在下文中,所使用的n-苄基丙烯酰胺类化合物(1)通过已知方法制备(参见背景技术引用文献),多卤代烷烃类化合物(2)通过常规商业途径购买获得且未经进一步纯化。
[0025]
实施例1-15反应条件筛选及放大试验
[0026]
以式1a所示的n-苄基丙烯酰胺类化合物与二氯甲烷为模板底物,筛选最优反应条件,结果见表1。反应式如下:
[0027][0028]
实施例反应变量yield(%)b1无882不加入4-meoc6h4n2bf403不加入na2co304k2co3代替na2co3565k3po4代替na2co3626cs2co3代替na2co3557nahco3代替na2co3528koh代替na2co3239net3代替na2co35104-meoc6h4n2bf4(1当量)70114-meoc6h4n2bf4(3当量)8712反应温度为50℃8513c6h5n2bf4代替4-meoc6h4n2bf481144-no2c6h5n
2-bf4代替4-meoc6h4n2bf47215c无82
[0029]a反应条件:1a(0.2mmol),2a(10mmol),4-meoc6h4n2bf4(2equiv)和na2co3(2equiv),室温和氩气保护下反应16h。
[0030]b分离产率。
[0031]c1a(1mmol),2a(50mmol),反应24h。
[0032]
其中实施例1反应条件和操作如下:
[0033]
向schlenk封管反应器中加入式1a所示的n-苄基丙烯酰胺类化合物(0.2mmol),二氯甲烷(10mmol,50.0当量),4-meoc6h4n2bf4(0.4mmol,2.0当量),na2co3(0.4mmol,2.0当量)。随后在反应器在氩气保护(latm)下室温搅拌反应16h,经tlc/gc-ms检测反应原料被消耗完全,停止反应。反应完全后将反应液过滤,减压蒸馏除去溶剂,将残余物经硅胶柱层析分离(洗脱溶剂为石油醚/乙酸乙酯,v/v=3:1)得到式3aa所示的多卤代氮杂螺环己二烯酮类化合物,58.1mg,88%。黄色油状液体;1h nmr(400mhz,cdcl3)δ:6.91(d,j=10.4hz,2h),6.47-6.44(m,2h),6.13-6.10(m,1h),3.51(d,j=10.8hz,1h),3.32(d,j=10.8hz,1h),2.73(dd,j=4.4hz,j=15.2hz,1h),2.30(dd,j=6.4hz,j=15.2hz,1h),1.42(s,9h),1.31(s,3h);
13
c{1h}nmr(100mhz,cdcl3)δ184.5,175.3,147.7,147.3,131.9,131.1,68.9,54.8,52.1,49.9,48.5,47.6,27.5,17.4;hrms m/z(esi)calcd for c
16h22
cl2no2([m+h]
+
)330.1022,found 330.1034。
[0034]
由表1可以看出,在不加入4-meoc6h4n2bf4和/或na2co3的条件下反应是无法进行的,这表明芳香族四氟硼酸重氮盐和碱的使用对反应能否进行具有关键影响。na2co3是最佳的碱种类,其余碱种类的替换并不能获得更高的产率。4-meoc6h4n2bf4的最佳投料量为式1a化合物2摩尔当量。反应温度升高至50℃导致目标产物产率有所降低。其它芳香族四氟硼酸重氮盐例如c6h4n2bf4和4-no2c6h4n2bf4,也能够很好地促进反应进行,但是反应效果不如4-meoc6h4n2bf4。实施例15在反应工艺放大5倍的情况下,仍然能够以良好的产率获得目标产物,这表明本发明合成工艺适应于放大生产。
[0035]
在获得最佳工艺条件(实施例1)的基础上,为了探究该合成策略的反应底物适应
性,通过在实施例1的工艺条件下,仅改变反应底物种类,制备获得一系列所需要的式3所示的多卤代氮杂螺环己二烯酮类化合物,结果如下:
[0036][0037]
上述结果显示不同取代基的n-苄基丙烯酰胺类化合物(1)和多卤代烷烃类化合物(2)对最佳工艺条件均具有良好的适应性,表明本发明的合成策略反应底物适应范围宽泛。
[0038]
产物的结构表征:
[0039]
3ba:黄色油状液体;1h nmr(400mhz,cdcl3)δ:6.94-6.88(m,2h),6.48-6.44(m,2h),6.15(dd,j=4.8hz,j=6.4hz,1h),3.49(d,j=10.4hz,1h),3.34-3.30(m,2h),3.25
(d,j=10.4hz,1h),2.77(dd,j=4.4hz,j=15.2hz,1h),2.33(dd,j=6.4hz,j=15.6hz,1h),1.57(q,j=7.2hz,2h),1.36(s,3h),0.95(t,j=7.2hz,3h);
13
c{1h}nmr(100mhz,cdcl3)δ184.4,175.1,147.5,147.1,131.9,131.1,68.8,51.7,51.7,48.5,48.5,44.6,20.5,17.8,11.3;hrmsm/z(esi)calcd for c
15h20
cl2no2([m+h]
+
)316.0866,found 316.0878.。
[0040]
3ca:黄色油状液体;1h nmr(400mhz,cdcl3)δ:6.93-6.87(m,2h),6.47-6.43(m,2h),6.15(dd,j=4.4hz,j=6.4hz,1h),3.48(d,j=10.4hz,1h),3.34(dd,j=6.0hz,j=8.0hz,2h),3.24(d,j=10.8hz,1h),2.76(dd,j=4.8hz,j=15.6hz,1h),2.33(dd,j=6.4hz,j=15.6hz,1h),1.53(t,j=7.2hz,2h),1.35(s,3h),1.30-1.27(m,10h),0.88(t,j=6.8hz,3h);
13
c{1h}nmr(100mhz,cdcl3)δ184.4,175.0,147.4,147.2,131.9,131.1,68.8,51.7,51.7,48.5,48.5,43.0,31.7,29.1,29.1,27.1,26.8,22.6,17.7,14.1;hrms m/z(esi)calcd for c
20h30
cl2no2([m+h]
+
)386.1648,found 386.1657.。
[0041]
3da:黄色油状液体;1h nmr(400mhz,cdcl3)δ:7.39-7.33(m,3h),7.25-7.23(m,2h),6.84-6.78(m,2h),6.42-6.37(m,2h),6.18(dd,j=4.4hz,j=6.4hz,1h),4.51(dd,j=14.4hz,j=31.6hz,2h),3.32(d,j=10.8hz,1h),3.09(d,j=10.4hz,1h),2.77(dd,j=4.4hz,j=15.6hz,1h),2.35(dd,j=6.8hz,j=15.6hz,1h),1.35(s,3h);
13
c{1h}nmr(100mhz,cdcl3)δ184.4,175.1,147.3,147.0,135.2,131.9,131.1,129.1,128.4,128.3,68.7,51.6,51.0,48.4,48.3,47.1,17.7;hrms m/z(esi)calcd for c
19h20
cl2no2([m+h]
+
)364.0866,found 364.0876.。
[0042]
3ea:黄色油状液体;1h nmr(400mhz,cdcl3)δ:7.34-7.31(m,2h),7.25-7.22(m,3h),6.72(dd,j=3.2hz,j=10.4hz,1h),6.60(dd,j=3.2hz,j=10.4hz,1h),6.39-6.31(m,2h),6.07(dd,j=4.8hz,j=6.4hz,1h),3.73-3.62(m,2h),3.28(d,j=10.4hz,1h),3.03(d,j=10.4hz,1h),2.94-2.89(m,2h),2.66(dd,j=4.8hz,j=15.2hz,1h),2.23(dd,j=6.4hz,j=15.6hz,1h),1.20(s,3h);
13
c{1h}nmr(100mhz,cdcl3)δ184.4,175.2,147.5,147.1,137.7,131.8,130.8,128.8,128.7,127.0,68.8,52.0,51.5,48.5,48.3,43.7,33.5,17.7;hrms m/z(esi)calcd for c
20h22
cl2no2([m+h]
+
)378.1022,found 378.1025.。
[0043]
3fa:黄色油状液体;1h nmr(400mhz,cdcl3)δ:6.93-6.86(m,2h),6.48-6.43(m,2h),6.15(dd,j=4.8hz,j=6.4hz,1h),4.45-4.38(m,1h),3.41(d,j=10.4hz,1h),3.23(d,j=10.4hz,1h),2.77(dd,j=4.8hz,j=15.2hz,1h),2.32(dd,j=6.4hz,j=15.2hz,1h),1.33(s,3h),1.17(dd,j=5.6hz,j=6.4hz,6h);
13
c{1h}nmr(100mhz,cdcl3)δ184.4,174.3,147.4,147.2,131.9,131.2,68.8,51.8,48.4,46.8,43.1,31.6,19.6,17.5,14.1;hrms m/z(esi)calcd for c
15h20
cl2no2([m+h]
+
)316.0866,found 316.0867.。
[0044]
3ga:黄色油状液体;1h nmr(400mhz,cdcl3)δ:6.91-6.84(m,2h),6.47-6.43(m,2h),6.13(dd,j=4.8hz,j=6.4hz,1h),3.44(d,j=10.4hz,1h),3.21(d,j=10.4hz,1h),2.77-2.68(m,2h),2.30(dd,j=6.4hz,j=15.2hz,1h),1.33(s,3h),0.88-0.77(m,3h),0.70-0.66(m,1h);
13
c{1h}nmr(100mhz,cdcl3)δ184.4,176.0,147.3,147.0,131.9,131.2,68.8,52.0,52.0,48.5,48.3,25.7,17.7,5.5,5.2;hrms m/z(esi)calcd for c
15h18
cl2no2([m+h]
+
)314.0709,found 314.0731.。
[0045]
3ha:黄色油状液体;1h nmr(400mhz,cdcl3)δ:6.94-6.86(m,2h),6.48-6.43(m,
2h),6.15(dd,j=4.8hz,j=6.0hz,1h),4.57-4.49(m,1h),3.44(d,j=10.8hz,1h),3.24(d,j=10.4hz,1h),2.77(dd,j=4.8hz,j=15.2hz,1h),2.31(dd,j=6.4hz,j=15.2hz,1h),1.92-1.88(m,2h),1.70-1.62(m,4h),1.50-1.45(m,2h),1.33(s,3h);
13
c{1h}nmr(100mhz,cdcl3)δ184.5,174.8,147.4,147.3,131.9,131.2,68.9,52.8,51.8,48.5,48.4,47.8,28.8,28.6,24.2,24.2,17.6;hrms m/z(esi)calcd for c
17h22
cl2no2([m+h]
+
)342.1022,found 342.1024.。
[0046]
3ia:黄色油状液体;1h nmr(400mhz,cdcl3)δ:6.93-6.86(m,2h),6.47-6.43(m,2h),6.15(dd,j=4.8hz,j=6.0hz,1h),4.01-3.96(m,1h),3.43(d,j=10.4hz,1h),3.24(d,j=10.8hz,1h),2.77(dd,j=4.8hz,j=15.2hz,1h),2.31(dd,j=6.4hz,j=15.2hz,1h),1.84-1.68(m,5h),1.43-1.35(m,3h),1.33(s,3h),1.29-1.22(m,1h),1.13-1.06(m,1h);
13
c{1h}nmr(100mhz,cdcl3)δ184.5,174.4,147.5,147.3,131.9,131.2,68.9,51.8,51.0,48.5,48.4,47.8,30.0,30.0,25.2,25.2,17.6;hrms m/z(esi)calcd for c
18h24
cl2no2([m+h]
+
)356.1179,found 356.1172.。
[0047]
3ja(d.r.=1.3∶1):黄色油状液体;1h nmr(400mhz,cdcl3)δ:6.91-6.86(m,1h),6.67(s,1h),6.45-6.42(m,1h),6.11(dd,j=4.8hz,j=6.4hz,0.56h),6.07(dd,j=4.8hz,j=6.0hz,0.44h),3.52-3.47(m,1h),3.30(dd,j=10.4hz,j=16.8hz,1h),2.75-2.68(m,1h),2.34-2.25(m,1h),1.97(s,3h),1.43(s,4h),1.42(s,5h),1.31(s,1.67h),1.28(s,1.33h);
13
c{1h}nmr(100mhz,cdcl3)δ185.2,175.6,175.5,147.7,147.4,142.6,142.3,138.6,137.9,131.4,130.7,69.1,69.0,54.7,54.7,52.1,52.0,50.1,50.0,48.7,48.5,47.5,47.5,27.5,17.5,16.4,16.3;hrms m/z(esi)calcd for c
17h24
cl2no2([m+h]
+
)344.1179,found 344.1179.。
[0048]
3ka(d.r.=1∶1):黄色油状液体;1h nmr(400mhz,cdcl3)δ:6.97-6.91(m,1h),6.47(s,0.5h),6.45(s,0.5h),6.14(dd,j=4.8hz,j=6.4hz,0.5h),6.06(dd,j=4.8hz,j=6.0hz,0.5h),5.72(t,j=2.4hz,1h),3.72(s,3h),3.55(d,j=10.4hz,0.5h),3.51(d,j=10.4hz,0.5h),3.40(d,j=10.4hz,0.5h),3.30(d,j=10.4hz,0.5h),2.78(dd,j=4.8hz,j=15.6hz,0.5h),2.69(dd,j=4.4hz,j=15.6hz,0.5h),2.37(dd,j=5.6hz,j=15.6hz,0.5h),2.26(dd,j=6.4hz,j=15.6hz,0.5h),1.44(s,4.5h),1.43(s,4.5h),1.36(s,1.5h),1.25(s,1.5h);
13
c{1h}nmr(100mhz,cdcl3)δ179.8,179.7,175.7,175.3,153.0,152.8,148.5,148.2,130.7,130.1,113.5,113.2,69.1,68.9,55.1,55.1,54.8,54.7,52.3,51.8,50.9,50.8,49.0,48.5,48.3,48.3,27.6,27.5,17.7,17.2;hrms m/z(esi)calcd for c
17h24
cl2no3([m+h]
+
)360.1128,found 360.1120.。
[0049]
3la(d.r.>20∶1):黄色油状液体;1h nmr(400mhz,cdcl3)δ:7.06(d,j=2.8hz,1h),6.94(dd,j=2.8hz,j=10.4hz,1h),6.54(d,j=10.0hz,1h),6.12(dd,j=4.0hz,j=7.2hz,1h),3.56(d,j=10.8hz,1h),3.35(d,j=10.4hz,1h),2.75(dd,j=4.0hz,j=15.2hz,1h),2.29(dd,j=7.2hz,j=15.2hz,1h),1.43(s,9h),1.33(s,3h);
13
c{1h}nmr(100mhz,cdcl3)δ177.6,174.8,147.9,143.2,135.5,130.0,68.8,55.0,52.5,50.1,49.7,48.3,27.5,17.4;hrms m/z(esi)calcd for c
16h21
cl3no2([m+h]
+
)364.0632,found 364.0628.。
[0050]
3ma(d.r.>20∶1):黄色油状液体;1hnmr(400mhz,cdcl3)δ:7.33(d,j=2.8hz,1h),
6.95(dd,j=2.8hz,j=10.0hz,1h),6.54(d,j=10.0hz,1h),6.11(dd,j=4.0hz,j=7.2hz,1h),3.56(d,j=10.4hz,1h),3.35(d,j=10.4hz,1h),2.75(dd,j=4.0hz,j=15.6hz,1h),2.30(dd,j=7.2hz,j=15.6hz,1h),1.43(s,9h),1.33(s,3h);
13
c{1h}nmr(100mhz,cdcl3)δ177.5,174.8,147.8,147.7,129.5,127.3,68.8,55.0,52.5,51.1,49.5,48.3,27.5,17.4;hrms m/z(esi)calcd for c
16h21
brcl2no2([m+h]
+
)408.0127,found 408.0138.。
[0051]
3na(d.r.>20∶1):黄色油状液体;1h nmr(400mhz,cdcl3)δ:6.85(d,j=10.4hz,1h),6.53(d,j=1.6hz,1h),6.47(dd,j=2.0hz,j=10.4hz,1h),6.13(dd,j=3.6hz,j=6.0hz,1h),3.71(d,j=10.8hz,1h),3.64(d,j=11.2hz,1h),2.78(dd,j=3.6hz,j=15.2hz,1h),2.47(dd,j=6.4hz,j=15.2hz,1h),1.46(s,9h),1.23(s,3h);
13
c{1h}nmr(100mhz,cdcl3)δ183.0,173.8,155.7,147.0,131.3,130.9,68.5,55.2,53.5,51.8,51.4,49.6,27.4,16.2;hrms m/z(esi)calcd for c
16h21
cl3no2([m+h]+)364.0632,found 364.0637.。
[0052]
3oa:黄色油状液体;1h nmr(400mhz,cdcl3)δ:6.91-6.85(m,2h),6.47-6.42(m,2h),6.14(q,j=4.4hz,1h),3.63(d,j=10.0hz,1h),3.32(d,j=10.4hz,1h),2.97(dd,j=4.4hz,j=9.6hz,1h),2.47-2.39(m,1h),1.88-1.81(m,1h),1.43(s,9h);
13
c{1h}nmr(100mhz,cdcl3)δ184.9,172.3,149.1,146.5,132.1,131.1,71.1,54.9,51.5,48.7,45.8,40.6,27.7;hrms m/z(esi)calcd for c
15h20
cl2no2([m+h]
+
)316.0866,found 316.0878.。
[0053]
3ob(d.r.=1∶1):黄色油状液体;
13
c{1h}nmr(100mhz,cdcl3)δ6.92-6.75(m,2h),6.39-6.32(m,2h),4.70-4.64(m,0.5h),3.86-3.80(m,0.5h),3.70-3.62(m,1h),3.58-3.47(m,2h),3.25(d,j=10.4hz,0.5h),3.19(d,j=10.0hz,0.5h),3.00(dd,j=4.4hz,j=10.0hz,0.5h),2.92(dd,j=2.0hz,j=10.8hz,0.5h),2.12-1.88(m,2h),1.37(s,4.5h),1.36(s,4.5h);
13
c nmr(100mhz,cdcl3)δ:185.1,184.9,173.2,172.4,150.4,149.1,147.0,146.9,132.2,131.4,131.0,131.0,59.4,57.7,51.6,51.3,48.8,48.5,48.1,47.8,46.3,45.7,32.8,32.2,27.7,27.6;hrms m/z(esi)calcd for c
16h22
cl2no2([m+h]
+
)330.1022,found 330.1037.。
[0054]
3oc:黄色油状液体;1h nmr(400mhz,cdcl3)δ:6.86(dd,j=3.2hz,j=10.0hz,1h),6.75(dd,j=3.2hz,j=10.0hz,1h),6.38-6.35(m,2h),3.95(dd,j=12.0hz,j=29.6hz,2h),3.59(d,j=10.0hz,1h),3.24(d,j=10.0hz,1h),3.04(t,j=4.0hz,1h),2.73(dd,j=5.2hz,j=15.2hz,1h),1.89(dd,j=3.6hz,j=15.2hz,1h),1.37(s,9h);
13
c{1h}nmr(100mhz,cdcl3)δ185.1,171.8,149.7,146.4,131.8,131.7,90.2,55.1,54.9,51.4,49.3,46.9,40.7,27.7;hrms m/z (esi)calcd for c
16h21
cl3no2([m+h]
+
)364.0632,found 364.0632.。
[0055]
3ad:黄色油状液体;1h nmr(400mhz,cdcl3)δ:7.02(dd,j=3.2hz,j=10.4hz,1h),6.93(dd,j=3.2hz,j=10.4hz,1h),6.46-6.41(m,2h),3.66-3.57(m,2h),3.18(d,j=10.4hz,1h),2.95(d,j=16.4hz,1h),1.56(s,3h),1.42(s,9h);
13
c{1h}nmr(100mhz,cdcl3)δ184.8,174.6,148.3,148.0,131.6,130.7,96.7,56.8,55.0,54.9,50.7,48.1,27.4,16.2;hrms m/z(esi)calcd for c
16h21
cl3no2([m+h]
+
)364.0632,found 364.0640.。
[0056]
3oe:黄色油状液体;1h nmr(400mhz,cdcl3)δ:6.91(dd,j=3.2hz,j=13.6hz,2h),
6.46(d,j=10.0hz,2h),6.02(dd,j=4.8hz,j=6.4hz,1h),3.50(d,j=10.4hz,1h),3.33(d,j=10.8hz,1h),3.11(dd,j=4.8hz,j=15.6hz,1h),2.66(dd,j=6.0hz,j=16.0hz,1h),1.43(s,9h),1.34(s,3h);
13
c{1h}nmr(100mhz,cdcl3)δ184.5,175.1,147.6,147.5,131.8,131.3,54.8,53.4,50.5,49.8,47.6,37.8,27.6,17.0;hrms m/z(esi)calcd for c
16h22
br2no2([m+h]
+
)418.0012,found 418.0021.。
[0057]
3oe
′
:黄色油状液体;1h nmr(400mhz,cdcl3)δ:6.96(dd,j=3.2hz,j=10.4hz,1h),6.87(dd,j=3.2hz,j=10.0hz,1h),6.46-6.40(m,2h),3.55-3.49(m,1h),3.41(dd,j=10.4hz,j=16.8hz,2h),3.32-3.25(m,1h),2.30-2.22(m,1h),1.90-1.82(m,1h),1.42(s,9h),1.13(s,3h);
13
c{1h}nmr(100mhz,cdcl3)δ184.7,175.4,148.1,147.9,131.3,131.2,54.6,53.4,49.8,47.6,38.1,27.6,27.3,16.8;hrms m/z(esi)calcd for c
16h23
brno2([m+h]
+
)340.0907,found 340.0931.。
[0058]
反应机理控制试验一:
[0059]
为了研究n-苄基丙烯酰胺类化合物(1)苯环对位取代基(r)的影响,发明人进一步在实施例1的最佳工艺条件下,以r为甲氧基、叔丁基二甲基硅氧基、特戊酰基、氢或氟的n-苄基丙烯酰胺类化合物(1)为原料进行反应,结果如下:
[0060][0061]
以上结果表明,本发明的合成策略脱芳构化形成环己二烯酮结构单元中的氧来源于含氧的r基团。
[0062]
反应机理控制试验二:
[0063]
在实施例1的最佳工艺条件下,加入自由基抑制剂,包括tempo,bht和对苯二酚,反应是无法进行的,这表明本发明的反应过程为自由基机理。
[0064][0065]
反应机理控制试验三:
[0066]
将4-no2c6h4n2bf4和氘代氯仿在本发明的最佳工艺条件下反应,经gc-ms分析生成了4-氘代甲氧基苯,这表明本发明的合成策略经历了芳基自由基的生成,同时也表明本发明中多卤代烷烃类化合物通过断裂c(sp3)-h键生成多卤代烷基自由基。
[0067][0068]
根据上述反应机理控制试验结合现有技术文献,本发明可能的反应机理如下所示:
[0069][0070]
以上所述实施例仅为本发明的优选实施例,而并非本发明可行实施的穷举。对于本领域技术人员而言,在不背离本发明原理和精神的前提下,对其所作出的任何显而易见的改动,都应当被认为包含在本发明的权利要求保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1