工程化小细胞外囊泡的制备方法及其在人工椎体中的应用
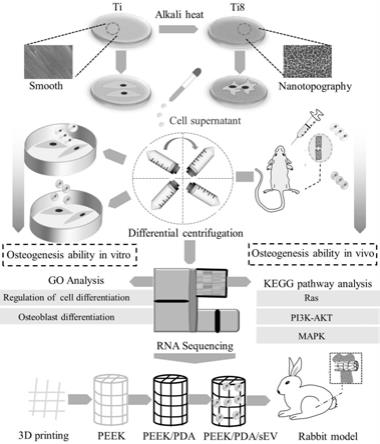
1.本发明属于骨疾病研究领域,尤其涉及工程化小细胞外囊泡的制备方法及其在人工椎体中的应用。
背景技术:
2.大型骨缺损会严重降低个体的生活质量。首选治疗方法是自体骨,临床医生认为这是金标准。然而,自体骨的可用性有限。并且患者供体部位的发病率限制了其广泛使用。合成骨替代品结合生物活性因子或人骨髓间充质干细胞(hmsc)可增强修复功效。然而,hmsc的使用有几个限制,包括免疫排斥、非定向细胞分化和低存活率。
3.近年来,由于其可定制的结构和理想的特性,使用三维(3d)打印支架促进骨再生已引起相当大的关注。聚醚醚酮(peek)具有适当的机械性能和低得多的弹性模量比钛(ti)(3-4gpa对102-110gpa),这可以避免应力屏蔽效应。此外,与金属植入物相比,peek是射线可透的,不会产生伪影。由于上述优点,peek目前被认为是ti及其合金的替代材料,并且peek相关材料越来越多地应用于临床实践中,用于各种用途,例如髋关节假体,椎间融合装置,和牙种植体。然而,peek材料具有高度疏水性,会降低细胞粘附和生物惰性,从而限制骨组织再生并导致植入物松动甚至过早失效。已经使用不同的方法对peek进行改性以增强其生物力学相容性。peek支架。例如,托斯特里克等人。将多孔peek与等离子喷涂钛涂层peek进行比较,并得出结论,多孔peek比光滑peek具有更好的成骨分化和骨整合能力。此外,多孔peek的射线可透特性使得可以通过μct直接观察骨向内生长。将peek与石墨烯纳米片结合以实现骨组织再生。严等人。通过聚多巴胺和丝将cuo/ag微/纳米颗粒掺入多孔peek,并通过ph控制释放cu2+和ag+以促进骨再生。然而,这些方法大多侧重于添加生物活性材料,如细胞因子、含有金属离子的纳米材料和干细胞,其安全性存在争议。
4.sev是经内吞吐体途径分泌的30-150nm的囊泡。通过sev进行细胞间通讯是组织进展的关键过程。sev可以转移其封装的生物活性成分,如rna、蛋白质和脂质,以调节细胞行为。
5.生物材料的宏观尺度、微观尺度和纳米尺度特征等物理地形线索对细胞反应的调节产生深远的影响,包括粘附、增殖和分化。最近,doloff等人。研究了具有不同表面形貌的临床批准的乳房植入物的免疫相关并发症,如异物反应和包膜纤维化,他们得出结论,平均粗糙度为4μm的乳房植入物可以在很大程度上抑制免疫相关并发症和引起最少的炎症。胡等人。评估了三种类型的电纺膜表面形貌对伤口愈合和免疫调节特性的影响。他们通过单细胞rna测序揭示了多种免疫细胞异质性。上述研究表明物理地形特征显着影响细胞的行为。此外,纳米形态对骨整合的影响更大。例如,姚等人。通过对ti进行水热处理制备了纳米薄片结构,并证明该纳米结构具有优越的成骨作用。白等人。研究了纳米表面特性对骨再生中血凝块特性和炎症反应的影响,并得出结论,直径为15nm的二氧化钛纳米管通过操纵有利的骨免疫调节环境来促进骨再生。
6.最近的研究强调了细胞“机械记忆”的重要性。“机械记忆”是指细胞保留来自过去
机械微环境的信息。例如,将hmsc从较硬的基质表面转移到较软的基质表面,hmsc依旧保存有原有微环境的信息,进而依旧能保存促成骨信息,抑制成脂。李等人。证明msc通过在病理生理学上坚硬或柔软的基质上培养获得了肌成纤维细胞的机械记忆。虽然改变了随后的机械刺激。msc传代至少两代仍然保留了过去的信息,此外,从软基质移植的msc提高了伤口质量。以上研究均表明机械微环境对细胞有重要影响。
技术实现要素:
7.针对上述问题,本发明提供工程化小细胞外囊泡的制备方法及其在人工椎体中的应用,主要提供了新的骨类疾病治疗制剂,以及相关机理调节制剂。
8.为了解决上述问题,本发明采用如下技术方案:
9.纳米拓扑结构衍生型sev的制备方法,包括下述步骤
10.将hmsc细胞在具有碱性热处理ti纳米形态的材料上进行分化培养,
11.从培养时间β所得细胞中提取前述细胞分泌所得的tiα-β-sev(工程化所得小细胞外囊泡)。
12.在一些方式中,hmsc细胞分化培养时间β为14-21天。
13.在一些方式中,所述ti纳米形态为通过浓度为αm的naoh热处理后钛板上形成的tiα纳米形态。
14.在一些方式中,所述所述ti纳米形态通过8mol/l的naoh热处理在钛板上形成ti8纳米形态。
15.前述tiα-β-sev在制备人工椎体中的应用。
16.前述tiα-β-sev在制备促进成骨制剂中的应用。
17.前述tiα-β-sev在制备促进opn、runx2、alp中至少之一表达制剂中的应用。
18.前述tiα-β-sev在制备促进ras、pi3k-akt信号通路、p53信号通路、矿物质吸收、mapk信号通路、粘着斑、ecm-受体相互作用和细胞周期中至少之一表达的制剂中的应用。
19.经碱性溶液热处理的钛在制备促进成骨制剂中的应用。
20.在一些方式中,所述经碱性溶液热处理的钛为经8mol/l的naoh热处理的钛。
21.在一些方式中,所述应用为经碱性溶液热处理的钛在制备培养促进成骨细胞的材料中的应用。
22.成骨材料,包括peek支架以及负载于peek支架中的tiα-β-sev。
23.本发明的有益效果是:
24.提供了一种新的材料,同时开发了其一些新用途。针对骨疾病尤其是骨损伤疾病的治疗提供了新的制剂,并且也进一步针对其中一些作用机理提供了调节制剂。
附图说明
25.图1为具有纳米形态记忆的小细胞外囊泡促进成骨的示意图;
26.图2为ti上的纳米形貌表征和hmsc在相应表面上的形态变化,其中:(a)不同样品在sem下的表面形貌表征,比例尺=1μm(第一组)和200nm(第二组),(b)不同样品的接触角,(c)不同样品的afm图像,(d、e、f、g)ra、rq、不同ti样品的最大峰深和最小峰深,(h)不同ti样品上hmscs形态的sem,比例尺=20μm(第一组)和10μm(第二组),(i)不同ti样品上细胞形
态的荧光图像,比例尺=100μm,(j)基于sem图像的定量细胞扩散区域,(k)基于sem图像的定量细胞纵横比,(l)基于cck8的细胞活力,在不同ti样品上培养的hmsc的活-死染色,比例尺=500μm,统计显着性:*p《0.05,**p《0.01,***p《0.001相对于ti组,n.s.不显著;
27.图3为纳米拓扑促进hmsc分化和sev的表征,其中:(a)纳米拓扑图促进hmsc分化并通过不同离心获得sev的方案说明,(b)21天后在纳米拓扑图上培养的hmsc的alp和ars染色,(c、d)21天后在纳米拓扑结构上培养的hmsc的alp和ars染色的定量结果,(e)ti-21-sev和ti8-21-sev的tem图像,比例尺=100nm,(f)cd9和cd63蛋白的表达通过蛋白质印迹分析进行评估,(g)sev的纳米粒子跟踪分析(nta),(h)hmsc对pkh26标记的sev的内化,比例尺=200μm,**p《0.01,***p《0.001;
28.图4为ti8-21-sev在体外的促成骨能力,其中:(a)21天后在ti纳米形貌上培养的hmsc分泌的sev(ti8-21-sev)和ti8-21-sev促进成骨的示意图,(b)用ti8-21-sev和ti-21-sev培养7天后hmsc的alp和ars染色,比例尺=200μm,(c)成骨标记物的免疫荧光染色(if),包括hmsc的runx2、ocn和alp,在与ti8-21-sev和ti-21-sev孵育后,比例尺=200μm,(d、e、f)通过qrt-pcr检测到与成骨相关的标记opn、runx2和alp,*p《0.05,**p《0.01;
29.图5为ti8-21-sev在体内的促成骨能力,其中:(a)通过ti-21-sev和ti8-21-sev治疗小鼠骨折的方案说明,每组n=6,(b)14天和21天后ti-21-sev和ti8-21-sev治疗的小鼠骨折的显微ct图像,(c)三点弯曲试验,用于测量14天和21天后愈合骨的生物力学强度,*p《0.05,***p《0.001,ns,意义不大,(d、e、f、g)电视、bv/tv、tb,th和tb,基于micro-ct对新骨组织的sp进行定量,(h)14天和21天后新骨组织ocn的组织学染色和免疫组织化学染色,比例尺分别为200μm和50μm;
30.图6为ti8-21-sev促进成骨的机理分析,其中:(a,c)与细胞分化相关的go术语,我们使用气泡图显示了与细胞分化相关的前10个go术语,(b,d)差异表达基因的前20条kegg通路,(e)sev的潜在分子信号通路从在ti表面纳米拓扑上培养的hmsc分泌,影响成骨分化;
31.图7为装载有用于骨再生的sev的3d打印peek支架,其中:(a)装载sev的3d打印peek支架植入兔股骨髁缺损的示意图,(b)peek板、peek/pda板和peek/pda/ti8-21-sev板的sem图像,黑色箭头:ti8-21-sev,比例尺=1μm,(c)12周后基于microct的2d(横向、冠状和矢状)和3d重建图像,(d、e、f、g、h、i)bv、bv/tv、tb的定量结果,th,tb,n,tb,不同组之间的sp和bmd,(j)植入12周后组织切片的van-gieson(vg)和甲苯胺蓝染色,**p《0.01,***p《0.001,ns,不显著;
32.图s1:纳米拓扑促进hmsc分化,其中:(a)7和14天后,在纳米形貌上培养hmsc的alp和ars染色。(b,c)14天后在纳米形貌上培养的hmsc的alp和ars染色的定量结果。(d,e,f,g)通过rt-pcr检测成骨相关标志物*p《0.05,**p《0.01,***p《0.001,ns,不显著;
33.图s2:ti-21-sev和ti8-21-sev通过tem显示,放大率较低.比例尺=500牛米;
34.图s3:骨折部位累积的did标记sev;
35.图s4:在14天和21天后,使用相同的小鼠模型和相同小鼠中的相同骨折部位测量骨折部位的再生;
36.图s5:与ti-21-sev和ti8-21-sev培养的hmsc的rna序列,其中:(a)计划用ti-21-sev和ti8-21-sev培养的hmsc的rna序列图解,(b)pearson不同样本的相关性,(c)差分表示数的维恩图不同群体之间的基因,(d)三组间差异表达基因的热图分析,(e)根据三组间差
异表达基因的火山图计算不同表达的上调和下调基因;
37.图s6:ti-21-sev处理的hmsc组与对照组的go分析(bva);
38.图s7:ti8-21-sev治疗hmsc组与对照组(cva)的go分析;
39.图s8:ti8-21-sev处理的hmsc组与ti-21-sev处理的hmsc组(cvb)的go分析;
40.图s9:c和b之间差异表达基因的前10个细胞分化期和kegg途径的go分析;
41.图s10:(a)通过sem观察到的不同peek样品的形态,标尺=100μm,(b)通过sem标尺=20μm观察到的在不同peek样品上培养的hmsc的形态,(c)使用共焦激光扫描显微镜在peek板上用did标记的sev的荧光显微镜图像,(d)释放p/pda/ti8-21-sev(左)和peek(右)的小动物成像;
42.图s11:装载sev用于骨再生的3d打印peek支架,其中:(a)6周后,基于microct的2d(横向、冠状面和矢状面)和3d重建图像,(b、c、d、e、f、g)bv、bv/tv、tb的定量结果,结核病,n、结核病,不同组间的sp和bmd,(h)植入6周后,对组织切片进行van gieson(vg)和甲苯胺蓝染色*p《0.05,***p《0.001,ns,不显著。
具体实施方式
43.下面对本发明作进一步介绍:
44.本部分第一方面介绍tiα-β-sev以及其自身:
45.纳米拓扑结构衍生型sev的制备方法,包括下述步骤
46.将hmsc细胞在具有碱性热处理ti纳米形态的材料上进行分化培养,
47.从培养时间β所得细胞中提取前述细胞分泌所得的物质tiα-β-sev(工程化小细胞外囊泡)。
48.上述提取所得分泌物表示为tiα-β-sev,但不限定其具体的形态。
49.其中,tiα-β-sev为产物型号,不具有特定的形态功能等限定。培养时间β的具体时长、单位根据实际情况进行确定,在一些方式中,hmsc细胞分化培养时间β为14-21天。其中β用于区分处理时长,α用于区分碱性溶液浓度。
50.当β为21天,α为8mol/l时,分泌所得物质为ti8-21-sev。
51.热处理、物质提取方式在一些方式中可采用现有技术。
52.碱性热处理为通过碱溶液热处理,钛经过相关相关热处理后,其发生变化,产生一些纳米形态,主要表现为表面形成纳米产物层。
53.在一些方式中,所述ti纳米形态为通过浓度为αm的naoh热处理后钛板上形成的tiα纳米形态。进一步的情况中,所述所述ti纳米形态通过8mol/l的naoh热处理在钛板上形成ti8纳米形态,当然,如果采用10mol/l碱性溶液时,就表示为形成ti10纳米形态。
54.本部分第二方面介绍前述所得分泌物tiα-β-sev的一些应用:
55.前述第一方面中tiα-β-sev在制备人工椎体中的应用,但不局限于椎体。将该新材料用于人工椎体中作为促骨生长的附着材料。其中工程化小细胞囊泡即小细胞囊泡在相应纳米结构ti中培养后的物质,其具有分泌tiα-β-sev的能力。
56.工程化后小细胞外囊泡能够产生tiα-β-sev。
57.tiα-β-sev自身也应当在保护范围内;其具有特定的物性,但并不限定其一定采用本发明所描述方法制备而得,只要能够认定所使用的物质与本发明所制得物质相同或相近
时,均应视为与本发明产品相同。
58.前述第一方面中涉及的tiα-β-sev在制备促进成骨制剂中的应用。其一种应用方式为,将tiα-β-sev作为成骨促进剂使用,通过tiα-β-sev实现对骨质生长进行促进。其另一种方式为,将tiα-β-sev附载于peek中,然后将其用于骨损坏部。peek支架可采用3d打印的方式制备,其具有多孔结构。
59.前述第一方面中涉及的tiα-β-sev在制备促进opn、runx2、alp中至少之一表达制剂中的应用。
60.前述第一方面中涉及的tiα-β-sev在制备促进ras、pi3k-akt、p53信号通路、mapk信号通路的表达、骨头矿物质吸收、粘着斑表达形成、促进ecm-受体相互作用和细胞周期中至少之一的制剂中的应用。tiα-β-sev可应用于前述一种或多种的调节。其中,促进表现为升高或者使其维持不降低,或者表现为提高吸收能力等。
61.本部分第三方面对另一些相关内容介绍:
62.经碱性溶液热处理的钛在制备促进成骨制剂中的应用。
63.其一种应用方式为,将“经碱性溶液热处理的钛”在制备成骨促进剂中进行应用,作为相关细胞的培养基。
64.在一些方式中,所述经碱性溶液热处理的钛为经8mol/l的naoh热处理的钛。其中,处理后的钛具有两种形式,其一为钛经过热处理后形成的产物,其二为经过热处理钛片(包含内层钛片以及外层反应所得产物)。
65.在一些方式中,所述应用为经碱性溶液热处理的钛在制备培养促进成骨细胞的材料中的应用。
66.成骨材料,包括peek(聚醚醚酮)支架以及负载于peek支架中的tiα-β-sev。两者相互结合形成一个整体,将成骨材料置于相应的骨损伤位置时,其可增强修复功效。其中,在一些形式中,peek支架为3d打印peek人工椎体。
67.本部分第四方面结合具体的研究项目进行说明:
68.材料和方法
69.1.1样品制备和表征
70.通过碱和热处理制造具有不同纳米形貌设计的商用钛板(纯度》99%)。使用sic纸(240、400、800和1200网格)连续抛光ti板。接下来,用丙酮、乙醇和去离子水依次超声清洗抛光的ti板。然后,将ti样品在80℃的8mnaoh中浸泡2小时;该样品命名为ti8,未加工抛光钛板为对照组。最后用乙醇和水洗涤ti8板3次。
71.ti和ti8表面形貌的表征是通过场发射sem(zeiss sigma 500)进行的。在攻丝模式下使用afm设备(solver nano,nt-mdt,俄罗斯)检查表面粗糙度。通过接触角测角仪(jc2000d2,powerach,china)测量不同样品的润湿性。
72.1.2细胞培养
73.在获得签署的知情同意后,从接受关节置换术的患者的骨髓中分离人骨髓间充质干细胞(hmsc)。将细胞在含有15%胎牛血清和1%青霉素-链霉素的生长培养基中在5%co2的细胞培养箱中在37℃下培养。每三天更换细胞上清液。细胞通过0.05%胰蛋白酶-edta消化。
74.1.3不同钛板上的细胞形态
75.hbmscs生长在ti或ti8板上。培养24h后,用2.5%戊二醛固定细胞25min。然后,我们使用不同浓度(15%、30%、50%、75%、95%和100%)的乙醇进行梯度脱水。接下来,在平板上喷金120s,通过sem(zeiss sigma 500,德国)观察细胞形态。根据sem图像使用imagej软件计算细胞铺展面积和细胞纵横比。为了观察细胞骨架,在使用鬼笔环肽显露f-肌动蛋白和dapi显露细胞核之前,将细胞用2.5%戊二醛固定25分钟。
76.1.4细胞活力
77.使用cell counting kit-8(cck-8,dojindo,日本)检查在不同ti样品上培养的hbmscs的活力。简而言之,将3
×
104hmsc接种在预先放置在24孔板中的不同ti样品上。孵育1、3、5天后,按说明书加入cck-8试剂。样品用pbs洗涤3次,每孔加入10%cck-8工作液。然后,将样品在室温下避光孵育3小时。最后,我们从每个孔中提取100μl溶液并将其添加到新的96孔板中。基于450nm波长处的光密度(od)测量细胞活力。
78.1.5活/死细胞染色
79.在ti和ti8上培养的细胞的活力通过钙黄绿素-am/pi(dojindo,日本)进一步量化。ti组表示为对照。先用pbs漂洗细胞3次,然后用2μmol/l钙黄绿素-am和4μmol/l碘化丙啶(pi)在37℃避光培养15min。最后,通过荧光显微镜(olympus ix71,tokyo,japan)观察活细胞和死细胞。
80.1.6茜素红染色(ars)和定量
81.使用ars测量细胞的成骨分化能力。hmsc用pbs洗涤,然后用4%甲醛固定25分钟。然后用pbs洗涤细胞,用1%茜素红染色细胞30分钟。最后,通过倒置显微镜观察钙结节。为了定量分析矿化结节,将10%十六烷基氯化吡啶与细胞一起孵育,并通过酶标仪在562nm处测量。
82.1.7碱性磷酸酶(alp)染色和活性测量
83.通过alp染色和定量分析进一步测量成骨分化能力。对于alp染色,细胞用4%甲醛固定25分钟。然后,用bcip/nbt kit(beyotime,china)对细胞进行染色,并通过倒置显微镜观察图像。此外,使用碱性磷酸酶测定试剂盒(中国南京建成生物工程研究所)对alp进行定量分析,并使用二辛可宁酸(bca)蛋白质测定试剂盒(博斯特生物科技有限公司)测定蛋白质总量)。然后根据制造商的指导,根据alp含量和总蛋白含量计算定量结果。
84.1.8rna提取和定量逆转录聚合酶链反应(qrt-pcr)
85.使用trizol试剂(invitrogen)从hmsc中提取总rna。然后,通过使用nanodrop分光光度计(thermo fisher scientific,waltham,ma,usa)获得rna浓度。使用cdna合成试剂盒(takara,日本)对提取的rna进行逆转录,然后使用rt supermix for qpcr(takara,日本)进行qrt-pcr。使用归一化为gapdh的2-δδct方法计算结果。我们研究中使用的引物列在表s1中。
86.表s1用于rt-pcr的引物
[0087][0088]
1.9hmsc衍生的sev的分离
[0089]
hmscs用购自上海新普生物科技有限公司的去除外泌体的胎牛血清培养,收集上清液。然后,通过差速离心法分离sev。首先,通过300g和2000g低速离心20分钟去除细胞碎片。然后,使用10,000g离心去除大的细胞外囊泡(500-1000nm)。最后,以100,000g离心70分钟以沉淀sev。将ev重新悬浮在100μlpbs中并储存在-80℃。使用bca蛋白质分析试剂盒确定ev中的蛋白质浓度。
[0090]
1.10透射电子显微镜(tem)
[0091]
sev的大小是通过透射电子显微镜(tem)测量的。sev用2.5%戊二醛固定25分钟,然后在碳涂层铜网上孵育15分钟。然后,使用1%的醋酸双氧铀溶液在室温下对样品染色2分钟。最后,使用透射电子显微镜(fei tecnai g20 twin,美国)获得sev图像。使用nanosight ns300系统(英国马尔文)测量sev的大小。使用nta软件分析结果。
[0092]
1.11蛋白质印迹分析
[0093]
sev的标志物,即cd9(abcam)和cd63(abcam),通过蛋白质印迹分析确定。使用bca蛋白质测定试剂盒测量蛋白质含量。然后,将细胞的蛋白质和等量的sev在10%sds-page凝胶上分离并转移到0.22μmpvdf膜上。最后,通过使用增强的化学发光系统(bio-rad)使膜可视化。
[0094]
1.12sev内化实验
[0095]
首先将细胞与pkh26(sigma-aldrich)标记的sev孵育24小时。然后,将细胞用4%多聚甲醛固定25分钟,并使用dapi标记细胞核。最后,使用显微镜(日本奥林巴斯)观察pkh26-sev的内化。
[0096]
1.13免疫荧光(if)
[0097]
将hmsc接种在载玻片上,并与50μg/ml对照-sev、ti-21-sev和ti8-21-sev孵育3天。在细胞培养皿上培养的hmsc分泌的sev表示为对照。7天后,细胞用4%多聚甲醛固定25分钟,pbs洗3次。然后,将细胞用0.2%triton x-100透化并用牛血清白蛋白封闭30分钟,然后在4℃下用一抗如runx2(abcam)、ocn(abcam)和alp(abcam)孵育过夜。此外,荧光偶联的二抗与细胞一起孵育1小时,f-肌动蛋白用fitc-鬼笔环肽染色。使用4-6-二脒基-2-苯基吲哚(dapi,beyotime biotechnology,china)将细胞核染色5分钟。最后,通过荧光显微镜(olympus,bx53;melville,ny,usa)观察图像。使用imagej(美国国立卫生研究院)计算荧光强度。
[0098]
1.14小鼠股骨骨折模型和sev治疗
[0099]
从华中科技大学实验动物科学研究所(中国武汉)获得总共60只小鼠(10wc57bl/6j;雄性)。所有动物研究均经华中科技大学(中国武汉)动物实验委员会批准。为了构建小鼠骨折模型,我们首先使用1%戊巴比妥钠对小鼠进行腹腔麻醉。使用金刚石圆盘和23号注射器针头构建右侧股骨中段骨折以稳定骨折,四只小鼠在手术过程中死亡。术后第二天在骨折部位连续注射50μg/ml、200μlpbs、ti-21-sev和ti8-21-sev,连续注射5天,以pbs注射组为对照组。在14天和21天后收集股骨标本用于后续实验。
[0100]
1.15rna测序
[0101]
在用ti-21-sev和ti8-21-sev培养hmsc21天后进行rna测序。我们使用的是p2同一人的干细胞,我们没有添加成骨诱导培养基。未接受任何处理的细胞为对照组,记为a;ti-21-sev孵育的细胞记为b,ti-21-sev孵育的细胞记为c。rna测序每组重复3次。使用trizol试剂(invitrogen,carlsbad,ca,usa)分离总rna。每个样品1微克rna用作rna样品制备的输入材料。我们使用ultratm rna library prep kit(illumina,neb,美国)作为测序文库。
[0102]
质量评估后,文库制备物在illumina hiseq平台上进行测序。选择差异表达分析,倍数变化》|2|并且p值《0.05。go富集和kegg用于识别潜在途径。
[0103]
1.163d打印peek支架的制作与改造
[0104]
使用来自evonik industries ag(德国)的直径为1.75mm的peek长丝,通过熔融沉积建模(fdm)逐层制造直径为5mm和高度为10mm的peek支架。为了在peek支架上装饰ti8-21-sev,首先将支架浸入2mg/ml多巴胺溶液(10mmtris-hcl,ph8.5,sigma-aldrich,圣路易斯,密苏里州)和在37℃下振摇24小时。然后,支架在超声波清洗器中用蒸馏水清洗3次以去除未附着的多巴胺,随后在75%乙醇中灭菌并用pbs清洗。最后,将peek/pda支架在4℃下浸入50μg/ml sev溶液中24小时。
[0105]
1.17活体成像系统
[0106]
对peek支架和peek/pda/sev支架进行了体内荧光成像。peek和peek/pda/sev分别放入c57bl/6j小鼠身体右侧和左侧的皮肤中。1、3、5、7天后,使用fxpro成像系统(bruker,karlsruhe,germany)对小鼠进行成像,激发波长为550nm,发射波长为600nm。对于保留在小鼠股骨骨折损伤部位的ev,在骨折部位连续五天注射did标记sev,小鼠在640nm激发和700nm发射下成像。
[0107]
1.18peek/pda/ti8-21-sev支架成骨的体内评价
[0108]
为了评估peek/pda/ti8-21-sev支架的骨再生能力,从华中科技大学实验动物研究所采购了20只新西兰白兔(雄性,2.5公斤,6个月大)(中国武汉)。所有动物研究均经华中科技大学(中国武汉)动物实验委员会批准。苏面心(0.15ml/kg)麻醉后,用钻头在兔子的每一侧制造两个股骨髁缺损(φ=5mm,h=10mm),并植入各种peek支架。手术后前三天连续使用抗生素以防止细菌感染。peek支架组为对照组。
[0109]
1.19微ct
[0110]
使用micro-ct系统(skyscan 1176,bruker,germany)扫描骨骼。小鼠的扫描厚度为9μm,兔的扫描厚度为18μm。ct-vox软件用于重建3d图像以进行进一步分析。使用ctan软件分析bv/tv、tb.th、tb.n、tb.sp和bmd等参数。
[0111]
1.20生物力学测试
[0112]
通过配备2000n称重传感器的试验机(电子万能试验机,wdw-20,中国长春)使用三点弯曲研究断裂愈合质量的机械试验。使用直径为2mm的推杆以1mm/min的速度垂直向下加载样品。
[0113]
1.21组织学和免疫组化评估
[0114]
首先对小鼠的骨折样本进行脱钙并用h&e、马森三色、番红-o和固绿染色进行染色。阈值用于显示新骨和区分纤维组织,masson三色染色用于观察新形成的骨组织和胶原纤维,番红-o/fast green染色用于演示软骨内骨化。然后,用光学显微镜(nikon h600l,tokyo,japan)对染色的样品进行观察和拍照。此外,ocn的免疫组织化学染色用于评估新骨。正如我们之前的研究,对兔股骨髁标本使用van gieson染色来评估骨组织再生,红色表示新骨。
[0115]
1.22统计分析
[0116]
每个实验至少重复3次。将数据评估为平均值
±
标准偏差(sd)并使用graphpad instant software(graphpad prism software,inc.,usa)进行分析。使用单向方差分析(anova)、双向方差分析和t检验来评估方差的统计显着性。*p《0.05、**p《0.01和**p《0.001被认为具有统计学意义。
[0117]
结果与讨论
[0118]
2.1ti的表面理化性质和细胞形态
[0119]
通过碱和8m naoh热处理在钛板上形成纳米形态,所得结构表示为ti8。首先,使用扫描电子显微镜(sem)观察钛板的形貌。我们可以清楚地观察到ti8上的纳米形态类似于小梁骨形态(图2a)。然后,测试ti8样品的亲水性。结果表明,ti8样品具有比ti更好的亲水性,支持细胞粘附(图2b)。我们使用原子力显微镜(afm)进一步表征ti8形态(图2c);结果与sem图像一致。统计数据表明,ti8和ti之间的均方根(rq)和绝对(ra)粗糙度差异显着(图2d和e)。这表明碱热处理后钛板的粗糙度显着增加。还计算了最大和最小峰深;结果表明,ti8的最大峰深大于ti(p《0.05),ti8和ti的最小峰深没有差异(图2f和g)。
[0120]
干细胞在生物材料表面的初始粘附对于细胞增殖和分化很重要。在ti和ti8上培养24h后,我们使用sem观察细胞的形态。我们可以看到,在ti样品上培养后,细胞显示出细长的形状,并带有长突出的伪足,但在ti8样品中,细胞显示出广泛的扩散并具有相对多边形的形状(图2h)。培养24小时后细胞扩散形态的f-肌动蛋白荧光图像与sem图像一致(图2i)。细胞扩散区域的定量结果表明,在ti8上生长的细胞比在ti上生长的细胞具有更好的黏附(图2j)。细胞纵横比的定量结果表明,在ti8上生长的爬行面积广泛(图2k)。细胞活力测试结果表明,随着时间的增加,细胞逐渐增殖,ti8对细胞活力的影响与ti相同;这表明ti8纳米形貌不促进细胞增殖(图2l)。活/死染色进一步证明ti8和ti之间的细胞活性没有差异(图2m)。
[0121]
2.2通过纳米形貌和sev表征增强成骨
[0122]
细胞可以感知机械生物学线索,例如刚度和地形信号。特别是,纳米拓扑学线索已被纳入生物材料以调节细胞反应。接下来,我们研究了纳米形貌是否可以诱导hmsc成骨,并研究了在ti和ti8上培养的hmsc分泌的sev的特征(图3a)。在ti和ti8上分别培养hmscs7、14和21天后,碱性磷酸酶(alp)和茜素红s(ars)染色结果表明ti8上的纳米形貌可以在21d后显着促进hmsc分化(图3b和图s1a))。定量结果表明,与21d后的ti相比,ti8显着促进干细胞
分化,差异具有统计学意义(图3c和d)。如图s1b和c所示,14天后ti和ti8之间也存在统计学上的显着差异。为了进一步验证纳米形貌对ti8的成骨能力,包括runx2、opn、alp和ocn在内的成骨标记物通过qrt-pcr进行。如图s1d、e、f和g所示,21天后,ti8上的纳米形貌显着促进了hmsc的成骨。研究了纳米形态对hmsc分泌的sev特性的影响。具有较高和较低放大率的透射电子显微镜(tem)图像显示ti-21-sev和ti8-21-sev具有球形颗粒(图3e和图s2)。表面标记用于通过wb和nta确认sev的大小,这进一步证实了sev的存在(图3f、g)。sev的大小约为50-150nm,这与之前研究报告的结果一致。随后,我们研究了纳米形貌衍生的sev是否可以被hmsc内化。我们使用pkh26标记ti-21-sev和ti8-21-sev,并将它们与hmsc孵育24小时。我们可以看到大部分sev在24小时后被内化,并且通过细胞内化的sev数量没有差异(图3h)。
[0123]
2.3纳米拓扑学衍生的sev促进体外成骨
[0124]
我们收集了ti-21-sev和ti8-21-sev,并研究了纳米形貌训练的干细胞是否可以分泌具有促成骨潜力的sev(图4a)。alp和ars染色显示,与对照相比,ti-21-sev和ti8-21-sev具有优越的促分化能力,ti8-21-sev具有更好的促进成骨能力(图4b)。为了进一步验证ti8-21-sev的成骨能力,我们使用免疫荧光(if)进一步研究了ti8-21-sev的成骨能力。结果与alp和ars染色结果一致。包括runx2、ocn和alp在内的成骨相关标志物表明ti8-21-sev具有显着的诱导hmsc(骨髓间质干细胞)分化的能力(图4c)。选择了早期成骨相关标志物opn、转录因子runx2和成骨细胞标志物基因alp的成骨细胞分化的主要决定因素,以进一步验证ti8-21-sev通过qrt-pcr。与ti8-21-sev孵育7天后,opn、runx2和alp的表达显着高于对照组(图4d、e、f)。总之,我们的数据表明纳米拓扑结构可以诱导干细胞分泌具有促成骨潜力的sev。
[0125]
2.4纳米拓扑学衍生的sev促进体内成骨
[0126]
为了验证sev的成骨能力。我们使用小鼠骨折模型通过连续5天在骨折部位注射ti8-21-sev来验证它们的促骨作用(图5a)。使用成像系统探索留在损伤部位的ev,如图s3所示,连续注射5天后,我们可以看到许多did标记的sev在骨折部位积累,当我们在24小时后停止注射时(6d)和48小时(7d),did标记的sev开始减少。因此,我们发现连续五天的注射确保囊泡在骨折部位积聚良好,并在那里保持至少48小时。microct观察显示,14天后,与对照组相比,ti8-21-sev显着促进新骨形成。21天后,与对照组相比,新骨重塑明显,皮质骨逐渐形成(图5b)。检测骨折愈合质量的力学试验是通过三点弯曲生物力学试验进行的,结果表明,与对照组相比,注射ti8-21-sev在14或21天时明显改善了骨折愈合(图5c)。组织体积(tv)定量分析表明,骨折后14天,ti8-21-sev治疗后新骨痂形成逐渐减少,新骨形成。21天后,各组之间没有显着差异(图5d)。骨体积(bv)/tv结果表明ti8-21-sev在14天和21天后具有优越的促进新骨的能力(图5e)。小梁厚度(tb.th)和小梁分离(tb.sp)的结果表明,14天和21天后,三组之间没有显着差异(图5f,g),可能的解释是我们的骨折期研究了三周,这可能太短而无法显示tb的显着变化。th和tb。sp在成骨的早期阶段。使用的模型是骨折模型,可能需要更长的观察时间,因此,我们将来会继续尝试使用骨质疏松症ovx小鼠来验证这一点。为了进一步加强ti8-21-sev成骨能力的证据,我们通过microct使用相同的小鼠模型和相同的骨折部位在14天和21天后测量了骨折部位的再生。现有研究表明,采用两个微ct协议,用于提供活体小鼠随时间推移的骨量和结构变化的独特信息,证明活体小鼠的骨骼结构可以使用微ct监测超过4周,而当x暴露时没有明显的副作用-射线。图5b中的微ct随时间
推移杀死小鼠,证明活体小鼠的骨骼结构可以使用微ct监测超过4周,而当x暴露时没有明显的副作用-射线。与对照组相比,ti8-21-sev在21天后具有出色的促成骨能力(图s4)。同时,小鼠股骨的组织学染色结果也显示在ti8-21-sev治疗后14天和21天有明显的新骨形成(图5h)。
[0127]
2.5ti8-21-sev的成骨机制
[0128]
为了了解纳米形貌衍生的sev如何促进成骨,对与细胞培养基(a)、ti-21-sev(b)或ti8-21-sev(c)一起孵育的hmsc进行转录组rna分析,以a作为对照(图s5a)。基于pearson相关性的相关性分析表明,来自同一组的样本具有良好的一致性(图s5b)。维恩图显示了基因表达的差异,样本共有123个基因(图s5c)。热图分析和火山图数据显示,与细胞培养基培养的hmscs相比,ti-21-sev组有1566个基因上调,1328个基因下调,1635个基因上调,1517个基因上调。ti8-21-sev组中的基因下调。与ti-21-sev组相比,ti8-21-sev组中有111个基因上调,236个基因下调(图s5d和e)。这些结果证明了广泛的不同基因表达。接下来,fold变化的阈值》|2|p值《0.05用于显示差异表达基因,此类基因用于对生物过程、细胞成分和分子功能进行基因本体(go)分析。与对照相比,ti-21-sev组中的基因表现出更好的发育过程、解剖结构发育、细胞外区域、囊泡、碳水化合物衍生物结合和细胞骨架蛋白结合(图s6)。与对照组相比,ti8-21-sev组中差异表达的基因表现出更好的发育过程、解剖结构发育、细胞外区域、细胞骨架、碳水化合物衍生物结合和细胞骨架蛋白结合(图s7)。为了进一步证明hmsc的纳米拓扑调节,我们比较了用ti8-21-sev或ti-21-sev处理的细胞。与ti-21-sev组相比,ti8-21-sev处理可诱导不同基因参与解剖结构发育、细胞过程的正调控和细胞分化(图s8)。这些线索表明ti8-21-sev可能具有优越的促分化能力。为了进一步关注囊泡对细胞分化的影响,我们筛选了与细胞分化相关的go术语,并使用气泡图显示了与细胞分化相关的前10个go术语。结果表明,与对照相比,ti-21-sev处理可以调节成骨细胞分化、调节细胞分化、正调节成骨细胞分化、调节成骨细胞分化(图6a)。京都基因和基因组百科全书(kegg)通路分析进一步表明,多种通路与成骨相关,包括ras、pi3k-akt和p53信号通路、矿物质吸收、foxo信号通路、粘着斑、ecm-受体相互作用和细胞周期(图6b)。然后我们将ti8-21-sev处理的hmsc与对照进行了比较。结果表明成骨细胞分化、成骨细胞分化的正调节、细胞分化的正调节、干细胞分化的调节、细胞分化的调节可能在促进成骨中起主要作用(图6c)。kegg通路分析表明ti8-21-sev可能参与调控ras、pi3k-akt和p53信号通路、矿物质吸收、mapk信号通路、粘着斑、ecm-受体相互作用和细胞周期(图6d)。最后,我们将ti-21-sev与ti8-21-sev处理的hmsc进行了比较。go术语表明ti8-21-sev处理可诱导细胞分化和细胞分化的正调控(图s9a)。kegg分析表明细胞因子-细胞因子受体相互作用可能参与骨再生(图s9b)。还描述了sev的潜在分子信号通路,该通路由在ti表面纳米拓扑结构上培养的hmsc分泌,影响成骨分化(图6e)。
[0129]
rna-seq结果表明羟基磷灰石颗粒的层次结构可以刺激干细胞的成骨分化。此外,通过溶酶体增加的钙离子内吞作用激活了可能参与成骨分化的ras/camp/rap1/mapk信号通路。rna测序结果表明纳米拓扑结构通过ras信号通路、pi3k-akt信号通路、p53信号通路、mapk信号通路、矿物质吸收、foxo信号通路、粘着斑、ecm触发干细胞分泌sev以促进成骨-受体相互作用和细胞周期。
[0130]
2.6纳米形貌衍生sev的组织工程应用
[0131]
为了将sev用于骨组织工程,我们使用3d打印的peek支架加载ti8-21-sev,以使用经典的兔股骨髁缺损模型研究骨再生(图7a)。首先,通过sem观察不同peek支架的形态特征。我们可以看到支架具有多孔结构(图s10a)。然后,使用扫描电镜观察培养24h后不同peek支架上干细胞的形态。细胞在支架上显示出令人满意的生长,聚多巴胺(pda)涂层有利于干细胞的粘附和拉伸(图s10b)。接下来,我们使用圆形peek板观察加载的囊泡。pda包被后,我们可以观察到多巴胺聚集在颗粒中。我们进一步观察到sev与多巴胺颗粒不同,并分散在peek板上(图7b)。did标记的sev还通过共聚焦激光扫描显微镜的观察证实了sev均匀分布在peek板表面(图s10c)。接下来,我们研究了ti8-21-sev在体内的吸收。我们得出结论,ti8-21-sev在7天后缓慢释放和吸收(图s10d)。我们使用经典的兔股骨髁缺损模型继续研究在体内装饰在peek/pda支架上的ti8-21-sev的能力。在植入不同的peek支架6周和12周后,通过显微ct和组织学分析评估新骨再生情况。6周后,重建的显微ct图像显示peek/pda/ti8-21-sev组的新骨再生明显高于其他组(图s11a)。定量bv结果和bv/tv比表明,用ti8-21-sev修饰后,peek支架的成骨能力显着增强,并产生了更多的新骨组织(图s11b、c)。定量结果显示tb显着增加。th(图s11d)。6周后,各组之间的小梁骨数量和分离(tb.n和tb.sp)和骨矿物质密度(bmd)没有显着差异(图s10e、f、g)。vangieson(vg)和甲苯胺蓝染色进一步揭示了新骨组织再生,在支架植入后6周,peek/pda/ti8-21-sev组中观察到几个新骨(图s11h)。12周后,基于显微ct观察,peek/pda/ti8-21-sev组有明显的新骨形成(图7c)。bv和bv/tv的定量结果表明peek/pda/ti8-21-sev组具有显着的促成骨能力,并与对照组显示出统计学上的显着差异(图7d、e)。各组之间tb.th没有显着差异,这表明新骨重建在12周后完成(图7f)。小梁数(tb.n)和tb.sp的定量结果进一步表明,与对照组相比,ti8-21-sev可显着增加小梁骨数量,降低小梁骨分离程度(图7g,h)。bmd的定量结果显示,四组之间没有显着差异(图7i)。vg和甲苯胺蓝染色分析进一步表明,由于沿支架生长大量新骨,用ti8-21-sev装饰的peek支架可显着诱导新骨形成(图7j)。总体而言,上述发现表明ti8-21-sev可用于骨组织工程以诱导骨再生。
[0132]
总之,与传统的钛(ti)金属相比,由于适当的弹性模量、自然射线可透性和耐化学性,peek被认为是传统钛植入物的潜在替代品。然而,较差的生物活性阻碍了植入后的骨向内生长。在这项研究中,我们使用3d打印技术制造了具有多孔结构的peek支架。此外,聚多巴胺不仅可以作为sev固定化的中间体,而且还提供了增强细胞粘附的强大途径。
[0133]
结论
[0134]
在这项工作中,我们通过碱和热处理成功地在钛板上进行了纳米形貌,并通过复制纳米形貌的促成骨信息证明了ti8-21-sev具有记忆功能。基于该支架在兔股骨髁缺损模型中的应用,还表明负载ti8-21-sev的3d打印peek支架具有比其他支架更好的骨向内生长能力。
[0135]
本领域的技术人员可以明确,在不脱离本发明的总体精神以及构思的情形下,可以做出对于以上实施例的各种变型。其均落入本发明的保护范围之内。本发明的保护方案以本发明所附的权利要求书为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1