一种Pif1-like解旋酶及其应用的制作方法
一种pif1-like解旋酶及其应用
技术领域
1.本发明涉及基因测序、分子检测以及临床检测技术领域,具体涉及一种经修饰的pif1-like解旋酶、包含pif1-like解旋酶的构建体,以及其在表征目标多核苷酸或控制目标多核苷酸穿过孔的移动中的应用。
背景技术:
2.纳米孔测序技术指以单个核酸分子为测量单元,利用纳米孔对其序列信息进行即时连续读取的基因测序技术。
3.其利用了可以为离子电流提供通道的纳米孔。电泳驱动多核苷酸通过纳米孔,并且由于多核苷酸穿过纳米孔,因此可以降低通过纳米孔的电流。每个通过的核苷酸或一系列核苷酸获得了特征电流,并且对电流电平的记录对应于多核苷酸序列。在“链测序”方法(如使用解旋酶控制多核苷酸穿过孔的移动)中,单个多核苷酸链穿过所述孔并能实现对核苷酸的鉴定。这种测序技术的优势在于建库简单,无需扩增;读取速度快,对单个分子可以达到每小时上万碱基的读取速度;读长非常长,通常在上千碱基;有可能可以对rna和dna甲基化进行直接测量。这些都是现有的二代测序技术所无法达到的。
4.但是,纳米孔测序技术也有棘手的问题,需要解决,例如多核苷酸通过纳米孔的易位过快以至于单个核苷酸的电流电平过短而难以分辨。尤其是在面对核苷酸序列很长的情况下,例如500个或更多个,控制多核苷酸移动的分子马达可能会从多核苷酸上解脱。这允许多核苷酸在施加的场的方向上以不受控的方式被迅速拉动穿过所述孔。
5.现有技术中,也有对此问题的解决,例如,专利wo2013057495a3公开了一种新的表征目标多核苷酸的方法,所述的方法包括通过hel308解旋酶或分子马达控制目标多核苷酸穿过孔的移动。专利us20150065354a1公开了一种使用xpd解旋酶表征目标多核苷酸的方法,所述的方法包括通过xpd解旋酶控制目标多核苷酸穿过孔的移动。专利cn107109380a公开了一种经修饰的酶,该酶为可以控制目标多核苷酸穿过孔的移动的经修饰的dda解旋酶。上述方法均可以一定程度上控制目标多核苷酸穿过孔的移动。但是,仍然开发新的控制目标多核苷酸穿过孔的移动的解旋酶。
6.此外,解旋酶持续、均匀控制核酸运动的能力对准确识别核酸序列信息有重要作用。在解旋酶控制核酸穿过纳米孔的运动中,除了酶持续结合在核酸上这一必要特征之外,由于纳米孔测序技术是单分子测序技术,酶在不同核酸分子上运动的速率均一性,以及酶在同一个核酸分子不同碱基上的运动速率均一性,对于准确识别碱基信号也非常重要。具体来说,酶控制不同核酸分子的运动速率会因为不同酶分子的异质性导致不同酶控制核酸穿过纳米孔的速率不一样,或者因为某些酶活性较差,在控制核酸穿过纳米孔时出现停滞现象,从而不利于对碱基信号的分析和碱基序列的识别,或者不利于孔通道的高效利用,从而降低测序的准确率或通量;酶在同一个核酸分子上的移位会出现包括但不限于以下不利于测序性能的现象,比如个别或连续多个碱基因电场力作用脱离酶的控制而“滑脱”,或者酶因为步长不一致,出现每步长半个或多个碱基,或者酶相对核酸前向移位一个或多个步
长后又向后移位等。
7.因此,有效提升不同酶分子间的均一性,以及有效控制单一酶分子控制核酸穿过纳米孔的运动对于提升纳米孔链测序技术的性能非常重要。
技术实现要素:
8.为解决多核苷酸穿过纳米孔的易位过快的问题,本发明提供了一种新的经修饰的pif1-like解旋酶,经过修饰后的pif1-like解旋酶可以更长时间保持与多核苷酸的结合,并控制多核苷酸穿过孔的移动。本发明所述的pif1-like解旋酶是链测序过程中控制多核苷酸移动的有用工具,可以使多核苷酸以可控和逐步的方式顺着或逆着由所施加的电压引起的电场进行运动,从而控制多核苷酸通过纳米孔的速度,获得可识别的电流电平。尤其当多核苷酸链长度增加的情况下,例如500个或更多个核苷酸,需要具有提高进行性的分子马达时,本发明所述的pif1-like解旋酶依然不会从多核苷酸上解脱,即对于控制500、1000、5000、10000、20000、50000、100000或更多个多核苷酸的移动特别有效。基于本发明所述的pif1-like解旋酶在链测序领域控制多核苷酸平稳从孔移动,减少滑移或不规则移动的优势,可以促进核苷酸更精确、读长更长。基于本发明所述的pif1-like解旋酶在保持酶持续结合在核酸上的同时,有效提升酶分子控制核酸分子穿过纳米孔的运动,以提升核酸检测或测序的准确率和通量等性能。
9.本发明的第一方面,提供了一种pif1-like解旋酶,其特征在于,包括在pif1-like解旋酶的塔结构域、销结构域和/或1a结构域引入至少一个半胱氨酸残基和/或至少一个非天然氨基酸,还包括 (a)至少一个或多个天然氨基酸被取代或删除,其中所述被取代或删除的天然氨基酸包括对应于seq id no:6的c308和/或c419的氨基酸;和/或 (b)至少一个与单链dna或双链dna中一个或多个核苷酸相互作用的氨基酸被取代,其中所述被取代的氨基酸包括对应于seq id no:6的h87和/或v422和/或i282的氨基酸;其中所述pif1-like解旋酶保留其控制多核苷酸移动的能力。
10.具体地,提供一种seq id no:1-11的pif1-like解旋酶,包括在pif1-like解旋酶的塔结构域、销结构域和/或1a结构域(reca型马达)引入至少一个半胱氨酸残基和/或至少一个非天然氨基酸,还包括(a)至少一个或多个天然氨基酸被取代或删除,其中所述被取代或删除的天然氨基酸包括seq id no:6的c308和/或c419或与seq id no:6的c308和/或c419对应的seq id no:1到5和7到11中的氨基酸;和/或(b)至少一个与单链dna或双链dna中一个或多个核苷酸相互作用的氨基酸被取代,其中所述被取代的氨基酸包括seq id no:6的h87、v422和/或i282或与seq id no:6的h87、v422和/或i282对应的seq id no:1到5和7到11中的氨基酸;其中所述解旋酶保留其控制多核苷酸移动的能力。
11.优选的,包括在下列任一组中引入至少一个半胱氨酸残基和/或至少一个非天然氨基酸:(a)塔结构域;(b)销结构域;(c)1a结构域;(d)塔结构域和销结构域;(e)塔结构域和1a结构域;
(f)1a结构域和销结构域;(g)塔结构域、销结构域和1a结构域。
12.优选的,可以在塔结构域、销结构域和/或1a结构域引入1、2、3、4、5、6、7、8、9、10、11或更多个半胱氨酸残基,或者引入1、2、3、4、5、6、7、8、9、10、11或更多个非天然氨基酸,或者引入1、2、3、4、5、6、7、8、9、10、11或更多个半胱氨酸残基和非天然氨基酸。
13.优选的,引入半胱氨酸残基和/或至少一个非天然氨基酸后使得该pif1-like解旋酶与多核苷酸的结合更稳定,并增强了控制其移动的能力。
14.优选的,所述的pif1-like解旋酶选自pba-pm2、aph-acj61、aph-px29、avi
‑ꢀ
aeh1、sph-cbh8、eph-pei26、aph-am101、pphpspyzu05、eph-ecs1、eph-cronus2或mph-mp1。野生型的pif1-like解旋酶具体见表1。
15.表1 野生型的pif1-like解旋酶所述的pif1-like解旋酶的塔结构域、销结构域、钩结构域、1a结构域以及2a结构域的氨基酸残基位置见表2。
16.表2鉴定了构成每个pif1-like解旋酶中每个结构域的残基
在本发明的一个具体实施方式中,所述的pif1-like解旋酶选自mph-mp1、sph-cbh8、eph-pei26或pphpspyzu05。
17.优选的,所述的pif1-like解旋酶包括seq id no:11的变体,其中在塔结构域(残基e264-p278和n296-p389)和/或销结构域(残基k97-a113)和/或1a结构域(残基m1-l96和p114-k184)中引入了至少一个半胱氨酸残基和/或至少一个非天然氨基酸。
18.优选的,所述的pif1-like解旋酶包括seq id no:1的变体,其中在塔结构域(残基e264-p278和n296-a394)和/或销结构域(残基k89-e105)和/或1a结构域(残基m1-l88和m106-v181)中引入了至少一个半胱氨酸残基和/或至少一个非天然氨基酸;优选的,所述的pif1-like解旋酶包括seq id no:2的变体,其中在塔结构域(残基e265-p279和n297-a392)和/或销结构域(残基k89-d105)和/或1a结构域(残基m1-l88和i106-m180)中引入了至少一个半胱氨酸残基和/或至少一个非天然氨基酸;优选的,所述的pif1-like解旋酶包括seq id no:3的变体,其中在塔结构域(残基t266-p280和 n298-s403)和/或销结构域(残基k89-a109)和/或1a结构域(残基m1-l88和k110-v182)中引入了至少一个半胱氨酸残基和/或至少一个非天然氨基酸;优选的,所述的pif1-like解旋酶包括seq id no:4的变体,其中在塔结构域(残基t266-p280和n298-s404)和/或销结构域(残基k89-a109)和/或1a结构域(残基m1-l88和k110-v182)中引入了至少一个半胱氨酸残基和/或至少一个非天然氨基酸;优选的,所述的pif1-like解旋酶包括seq id no:5的变体,其中在塔结构域(残基e260-p274和n292-a391)和/或销结构域(残基k86-e102)和/或1a结构域(残基m1-l84和m103-k177)中引入了至少一个半胱氨酸残基和/或至少一个非天然氨基酸;优选的,所述的pif1-like解旋酶包括seq id no:6的变体,其中在塔结构域(残基e266-p280和n298-a396)和/或销结构域(残基k91-e107)和/或1a结构域(残基m1-l90和m108-m183)中引入了至少一个半胱氨酸残基和/或至少一个非天然氨基酸;优选的,所述的pif1-like解旋酶包括seq id no:7的变体,其中在塔结构域(残基t276-p290和n308-p402)和/或销结构域(残基k100-d116)和/或1a结构域(残基m1-l99和d117-m191)中引入了至少一个半胱氨酸残基和/或至少一个非天然氨基酸;优选的,所述的pif1-like解旋酶包括seq id no:8的变体,其中在塔结构域(残基
d274-p288和n306-a404)和/或销结构域(残基k95-e112)和/或1a结构域(残基m1-l95和i113-k187)中引入了至少一个半胱氨酸残基和/或至少一个非天然氨基酸;优选的,所述的pif1-like解旋酶包括seq id no:9的变体,其中在塔结构域(残基e260-p274和n292-a391)和/或销结构域(残基k86-e102)和/或1a结构域(残基m1-l85和m103-k177)中引入了至少一个半胱氨酸残基和/或至少一个非天然氨基酸;优选的,所述的pif1-like解旋酶包括seq id no:10的变体,其中在塔结构域(残基e265-p279和h297-a393)和/或销结构域(残基k88-e104)和/或1a结构域(残基m1-l87和i105-k180)中引入了至少一个半胱氨酸残基和/或至少一个非天然氨基酸。
19.优选的,所述的pif1-like解旋酶包括seq id no:11的变体,其包括(i)e105c和/或a362c;(ii)e104c和/或k360c;(iii)e104c和/或a362c;(iv)e104c和/或q363c;(v)e104c和/或k366c;(vi)e105c和/或m356c;(vii)e105c和/或k360c;(viii)e104c和/或m356c;(ix)e105c和/或q363c;(x)e105c和/或k366c;(xi)f108c 和/或m356c;(xii)f108c和/或k360c;(xiii)f108c和/或a362c;(xiv)f108c和/或q363c;(xv) f108c和/或k366c;(xvi)k134c和/或m356c;(xvii)k134c和/或k360c;(xviii)k134c和/或a362c;(xix)k134c和/或q363c;(xx)k134c和/或k366c;(xxi)(i)到(xx)任一个和g359c;(xxii)(i)到(xx)任一个和q111c;(xxiii) (i)到(xx)任一个和i138c;(xxiv)(i)到(xx)任一个和q111c和i138c;(xxv)e105c和/或f377c;(xxvi)y103l,e105y,n352n,a362c和y365n;(xxvii)e105y和a362c;(xxviii)a362c;(xxix)y103l,e105c,n352n,a362y和y365n;(xxx)y103l,e105c和a362y;(xxxi)e105c和/或a362c,和i280a;(xxxii)e105c和/或l358c;(xxxiii)e104c和/或g359c;(xxxiv)e104c和/或a362c;(xxxv)k106c和/或w378c;(xxxvi) t102c和/或n382c;(xxxvii)t102c和/或w378c;(xxxviii)e104c和/或y355c;(xxxix)e104c和/或n382c;(xl)e104c和/或k381c;(xli)e104c和/或k379c;(xlii)e104c和/或d376c;(xliii)e104c 和/或w378c;(xliv)e104c和/或w374c;(xlv)e105c和/或y355c;(xlvi)e105c和/或n382c;(xlvii)e105c和/或k381c;(xlviii)e105c和/或k379c;(xlix)e105c和/或d376c;(l)e105c和/或 w378c;(li)e105c和/或w374c;(lii)e105c和a362y;(liii)e105c,g359c和a362c;或(liv)i2c,e105c和a362c。
20.优选的,所述的pif1-like解旋酶包括seq id no:1-10中任一个的变体,其包括在seq id no:11中的(i)到(liv)的任一个所限定的位置对应的位置处包括一个半胱氨酸残基。
21.优选的,所述pif1-like解旋酶的氨基酸序列为seq id no:1到11所示氨基酸序列或与seq id no:1到11所示氨基酸序列具有至少30%、至少40%、至少50%、60%、至少70%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或至少99.9%的同源性并具有控制多核苷酸移动的能力。
22.在本发明的一个具体实施方式中,所述的与seq id no:11的第105位和/或第362位相应的氨基酸引入半胱氨酸残基,例如,seq id no:2的第97位和/或第363位,seq id no:3的第96位和/或第371位,seq id no:5的第94位和/或第361位,seq id no:6的第99位和/或第366位,seq id no:8的第104位和/或第375位等等。
23.为提高本发明所述的pif1-like解旋酶与多核苷酸结合的稳定性,降低从多核苷酸上解脱的能力,所述引入的半胱氨酸与半胱氨酸之间相互连接、非天然氨基酸与非天然
氨基酸之间相互连接之间、引入的半胱氨酸与非天然氨基酸之间相互连接、引入的半胱氨酸与解旋酶上的天然氨基酸之间相互连接、或者引入的非天然氨基酸与解旋酶上的天然氨基酸之间相互连接。
24.可以使任何数目和组合的两个以上引入的半胱氨酸和/或非天然氨基酸相互连接。例如,可以使3,4,5,6,7,8或更多个半胱氨酸和/或非天然氨基酸相互连接。一个或多个半胱氨酸可以与一个或多个半胱氨酸连接。一个或多个半胱氨酸可以与一个或多个非天然氨基酸诸如faz连接。一个或多个非天然氨基酸诸如faz可以与一个或多个非天然氨基酸诸如faz连接。一个或多个半胱氨酸可以与一个或多个解旋酶上的天然氨基酸连接。一个或多个非天然氨基酸诸如faz可以与一个或多个解旋酶上的天然氨基酸连接。
25.其中,所述的连接可以是任何方式,包括直接相连或者间接相连,优选的,所述的连接可以为短暂的接触,也可以为永久的连接。更进一步优选的,所述的连接可以为非共价连接或共价连接。
26.在本发明的一个具体实施方式中,所述的共价连接可以采用化学交联剂、线性分子或催化剂连接。所述的化学交联剂包括但不限于马来酰亚胺,活性酯,琥珀酰亚胺,叠氮化物,炔烃(诸如二苯并环辛炔醇(dibo或dbco),二氟环炔烃和线性炔烃)等;化学交联剂的长度可以从一个碳(碳酰氯型连接器)到多个埃变化。所述的线性分子包括但不限于聚乙二醇(pegs),多肽,多糖,脱氧核糖核酸(dna),肽核酸(pna),苏糖核酸(tna),甘油核酸(gna),饱和的和不饱和的烃,聚酰胺。所述的催化剂包括但不限于tmad等任何可以使得半胱氨酸残基之间、非天然氨基酸之间、半胱氨酸残基与非天然氨基酸之间、非天然氨基酸与天然氨基酸之间、或者半胱氨酸残基与天然氨基酸之间产生共价键的催化剂。
27.优选的,在(a)中,所述天然氨基酸被非极性氨基酸、极性氨基酸或带电荷的氨基酸取代;优选地,所述非极性氨基酸包括但不限于甘氨酸(g)、丙氨酸(a)或缬氨酸(v);所述极性氨基酸包括但不限于丝氨酸(s)、苏氨酸(t)、酪氨酸(y)、天冬酰胺(n)或谷氨酰胺(q);所述带电荷氨基酸包括但不限于天冬氨酸(d)、谷氨酸(e)或组氨酸(h)。
28.优选的,所述的pif1-like解旋酶进一步被修饰去除一个或多个半胱氨酸残基。
29.优选的,所述pif1-like解旋酶还包括至少一个或多个天然半胱氨酸被取代。进一步优选为丙氨酸(a)、甘氨酸、丝氨酸(s)、苏氨酸(t)、天冬氨酸(d)或缬氨酸(v)取代半胱氨酸。
30.优选的,所述的pif1-like解旋酶包括seq id no:6的变体,并且所述一个或多个被取代的天然半胱氨酸残基为(i)c308和/或c419与(ii)c114、c119、c141中的一个或多个的组合。
31.优选的,所述的pif1-like解旋酶包括seq id no:1、2、3、4、5、6、7、8、9、10和11中任一个的变体,并且所述一个或多个被取代的天然半胱氨酸残基见表3。表3 seq id no:1-11中的相应半胱氨酸残基位置
优选的,所述的pif1-like解旋酶进一步被修饰降低其表面的负电荷。
32.优选的,所述的pif1-like解旋酶还包括增加净正电荷的取代。进一步优选的,所述的增加净正电荷的取代包括对表面带负电的氨基酸、极性或非极性的氨基酸进行取代或修饰,或者在表面带负电的氨基酸、极性或非极性的氨基酸临近位置引入带正电的氨基酸。更进一步优选的,所述的增加净正电荷的取代包括带正电的氨基酸取代带负电的氨基酸、不带电的氨基酸、芳香族氨基酸、极性或非极性的氨基酸。更进一步优选的,所述的增加净正电荷的取代包括不带电的氨基酸取代带负电的氨基酸、芳香族氨基酸、极性或非极性的氨基酸。适合的带正电荷的氨基酸包括但不限于,组氨酸(h),赖氨酸(k)和/或精氨酸(r)。不带电荷的氨基酸没有净电荷。适合的不带电荷的氨基酸包括但不限于,半胱氨酸(c),丝氨酸(s),苏氨酸(t),蛋氨酸(m),天冬酰胺(n)或谷氨酰胺(q)。非极性氨基酸具有非极性侧链。非极性氨基酸包括但不限于,甘氨酸(g),丙氨酸(a),脯氨酸(p),异亮氨酸(i),亮氨酸(l)或缬氨酸(v)。芳香族氨基酸具有芳香族侧链。适合的芳香族氨基酸包括但不限于,组氨酸(h),苯丙氨酸(f),色氨酸(w)或酪氨酸(y)。
33.其中,所述的带正电的氨基酸、不带电荷的氨基酸、极性、非极性氨基酸或芳香族氨基酸可以是天然的或非天然的氨基酸,其可以是人工合成的或者经过修饰的天然氨基酸。
34.优选的取代包括但不限于,用精氨酸(r)取代谷氨酸(e),用赖氨酸(k)取代谷氨酸(e),用天冬酰胺(n)取代谷氨酸(e),用赖氨酸(k)取代天冬氨酸(d),以及用精氨酸(r)取代天冬氨酸(d)。
35.优选的,所述的pif1-like解旋酶包括seq id no:6的变体并且所述一个或多个带负电荷或不带电荷的氨基酸为s9,s173,d208或t218中的一个或多个。
36.优选的,所述的pif1-like解旋酶包括seq id no:7的变体并且所述一个或多个带负电荷或不带电荷的氨基酸为d8,e11,t26,s186,d216或s226中的一个或多个。可以中和任意数量的这些氨基酸,诸如这些氨基酸中的1,2,3,4,5,6,7或8个。
37.优选的,所述的pif1-like解旋酶包括seq id no:1到5和8到11中任一个的变体并且所述一个或多个带负电荷或不带电荷的氨基酸对应于seq id no:6中的s9,s173,d208或
t218中的一个或多个;或者seq id no:7中的d8,e11,t26,s186,d216或s226中的一个或多个。对应于seq id no:6中的s9,s173,d208或t218和对应于seq id no:7中的d8,e11,t26,s186,d216或s226的seq id no:1到5和8-11中的氨基酸可以使用图11a和图11b中的比对确定。
38.优选的,所述非天然氨基酸选自4-叠氮基-l-苯丙氨酸(faz),4-乙酰基-l-苯丙氨酸,3-乙酰基-l-苯丙氨酸,4-乙酰乙酰基-l苯丙氨酸,o-烯丙基-l-酪氨酸,3-(苯基硒烷基)-l-丙氨酸,o-2-丙炔-1-基-l-酪氨酸,4(二羟基硼基)-l-苯丙氨酸,4-[(乙基硫烷基)羰基]-l-苯丙氨酸,(2s)-2-氨基-3-{4-[(丙烷-2-基硫烷基)羰基]苯基}丙酸,(2s)-2-氨基-3-{4-[(2-氨基-3-硫烷基丙酰基)氨基]苯基}丙酸,o-甲基-l-酪氨酸,4-氨基-l-苯丙氨酸,4-氰基-l-苯丙氨酸,3-氰基-l-苯丙氨酸,4-氟-l-苯丙氨酸,4-碘-l-苯丙氨酸,4-溴-l-苯丙氨酸,o-(三氟甲基)酪氨酸,4-硝基l-苯丙氨酸,3-羟基-l-酪氨酸,3-氨基-l-酪氨酸,3-碘-l-酪氨酸,4-异丙基-l-苯丙氨酸,3-(2-萘基)-l-丙氨酸,4-苯基-l-苯丙氨酸,(2s)-2-氨基-3-(萘-2-基氨基)丙酸,6-(甲基硫烷基)正亮氨酸,6-氧-l-赖氨酸,d-酪氨酸,(2r)-2-羟基-3-(4-羟基苯基)丙酸,(2r)-2氨基辛酸酯3-(2,2
′‑
二吡啶-5-基)-d-丙氨酸,2-氨基-3-(8-羟基-3-喹啉基)丙酸,4-苯甲酰-l-苯丙氨酸,s-(2-硝基苄基)半胱氨酸,(2r)-2-氨基-3-[(2-硝基苄基)硫烷基]丙酸,(2s)-2-氨基-3-[(2-硝基苄基)氧基]丙酸,o-(4,5-二甲氧基-2-硝基苄基)-l-丝氨酸,(2s)-2-氨基-6-({[(2-硝基苄基)氧基]羰基}氨基)己酸,o-(2-硝基苄基)-l-酪氨酸,2-硝基苯丙氨酸,4-[(e)-苯基二氮烯基]-l-苯丙氨酸,4-[3-(三氟甲基)-3h-二吖丙啶基-3基]-d-苯丙氨酸,2-氨基-3-[[5-(二甲基氨基)-1-萘基]磺酰基氨基]丙酸,(2s)-2-氨基4-(7-羟基-2-氧-2h-色烯-4-基)丁酸,(2s)-3-[(6-乙酰基萘-2-基)氨基]-2-氨基丙酸,4(羧基甲基)苯丙氨酸,3-硝基-l-酪氨酸,o-硫基-l-酪氨酸,(2r)-6-乙酰氨基-2-氨基己酸酯,1-甲基组氨酸,2-氨基壬酸,2-氨基癸酸,l-同质半胱氨酸,5-硫烷基正缬氨酸,6-硫烷基-l-正亮氨酸,5-(甲基硫烷基)-l-正缬氨酸,n6-{[(2r,3r)-3-甲基-3,4-二氢-2h-吡咯2-基]羰基}-l-赖氨酸,n6-[(苄基氧基)羰基]赖氨酸,(2s)-2-氨基-6-[(环戊基羰基)氨基]己酸,n6-[(环戊基氧基)羰基]-l-赖氨酸,(2s)-2-氨基-6-{[(2r)-四氢呋喃-2-基羰基]氨基}己酸,(2s)-2-氨基-8-[(2r,3s)-3-乙炔基四氢呋喃-2-基]-8-氧基辛酸,n6-(叔丁氧基羰基)-l-赖氨酸,(2s)-2-羟基-6-({[(2-甲基-2-丙烷基)氧基]羰基}氨基)己酸,n6-[(烯丙氧基)羰基]赖氨酸,(2s)-2-氨基-6-({[(2-叠氮苄基)氧基]羰基}氨基)己酸,n6l-脯氨酰基-l-赖氨酸,(2s)-2-氨基-6-{[(丙-2-炔-1-基氧基)羰基]氨基}己酸或n6-[(2叠氮乙氧基)羰基]-l-赖氨酸。
[0039]
进一步优选的,在(b)中,用包含较大侧链(r基团)的氨基酸取代至少一个与单链或双链dna中一个或多个核苷酸的糖环和/或碱基相互作用的氨基酸。
[0040]
优选的,所述的pif1-like解旋酶包括,用包含较大侧链(r基团)的氨基酸取代至少一个与单链或双链dna一个或多个核苷酸的糖环和/或碱基相互作用的氨基酸。可以取代任何数量的氨基酸,例如,1个或更多个、2个或更多个、3个或更多个、4个或更多个、5个或更多个、或者6个或更多个氨基酸。每个氨基酸可以与碱基、糖环、或碱基和糖环相互作用。可以采用蛋白质建模来鉴定与单链或双链dna中一个或多个核苷酸的糖环和/或碱基相互作用的氨基酸。
[0041]
优选的,所述的pif1-like解旋酶包含(a)seq id no:11的变体,其中,所述至少一
个与单链或双链dna中一个或多个核苷酸的糖环和/或碱基相互作用的氨基酸是p73, h93, n99, f109, i280, a161, f130, d132, d162, d163, e277, k415, q291, h396, y244或 p100中的至少一个;或者(b) seq id no:6的变体,其中,所述至少一个与单链或双链dna中一个或多个核苷酸的糖环和/或碱基相互作用的氨基酸是(i)h87,v422和/或i282与(ii)p94,f103,v155,p67,m124,d126,e156,p157,e279, s293, n93,h403或f246中的至少一个的组合。这些数字对应seq id no:11和6中的相关位点,并且相比seq id no:11和6可能需要在一个或多个氨基酸已经在变体中插入或删除的情况下进行改变。如上所述,本领域技术人员可以确定变体中的相应位点。进一步优选包含seq id no:11的变体,其中,所述至少一个与单链或双链dna中一个或多个核苷酸的糖环和/或碱基相互作用的氨基酸是f109和一个或多个p73, h93, n99, f109, i280, a161, f130, d132, d162, d163, e277, k415, q291, h396, y244或p100。
[0042]
优选的,所述的pif1-like解旋酶为seq id no:1到5和7到10中任一的变体,其中,所述至少一个与单链或双链dna中一个或多个核苷酸的糖环和/或碱基相互作用的氨基酸是至少一个与seq id no:11中的p73, h93, n99, f109, i280, a161, f130, d132, d162, d163, e277, k415, q291, h396, y244或p100相对应的氨基酸或与seq id no:6中的p94,f103,i282,v155,p67,m124,d126,e156,p157,e279,v422,s293,h87,n93,h403或f246相对应的氨基酸。进一步优选包含seq id no:1到5和7到10中任一的变体,其中,所述至少一个与单链或双链dna中一个或多个核苷酸的糖环和/或碱基相互作用的氨基酸是与seq id no:11中f109对应的氨基酸和一个或多个与seq id no:11中p73, h93, n99, f109, i280, a161, f130, d132, d162, d163, e277, k415, q291, h396, y244或 p100相对应的氨基酸。
[0043]
表4示出了与seq id no:11中的p73, h93, n99, f109, i280, a161, f130, d132, d162, d163, e277, k415, q291, h396, y244和 p100对应的seq id no:1至10中的氨基酸。
[0044]
表4与seq id no:1至10对应的氨基酸位置
较大侧链(r基团)优选地(a)包含增加数量的碳原子(b)具有增加的长度(c)具有增加的分子体积和/或(d)具有增加的范德华体积。较大侧链(r基团)优选(a) ;(b) ;(c) ;(d);(a)和(b);(a)和(c);(a)和(d);(b)和(c);(b)和(d);(c)和(d);(a),(b)和(c);(a),(b)和(d);(a),(c)和(d);(b),(c)和(d);或(a),(b),(c)和(d)。可以采用本领域中的标准方法对(a)至(d)中的每一个进行测量。
[0045]
进一步优选的,所述较大侧链(r基团)增加了所述至少一个氨基酸与所述单链或双链dna中一个或多个核苷酸之间的(i)静电相互作用;(ii)氢键;(iii)阳离子-pi((阳离子-π))相互作用和/或(iv) π-π相互作用。例如,在(i)中,诸如精氨酸(r)、组氨酸(h)和赖氨酸(k)等带正电荷的氨基酸具有增加静电相互作用的r基团。例如,在(ii)中,诸如天冬酰胺(n)、丝氨酸(s)、谷氨酰胺(q)、苏氨酸(t)和组氨酸(h)等氨基酸具有增加氢键的r基团。例如,在(iii)中,诸如苯丙氨酸(f)、色氨酸(w)、酪氨酸(y)或组氨酸(h)等芳族氨基酸具有增加阳离子-pi(阳离子-π)相互作用的r基团。
[0046]
包含较大侧链(r)的氨基酸可以是非天然氨基酸。
[0047]
在本发明的一个具体实施方式中,所述较大侧链(r基团)的氨基酸不是丙氨酸(a)、半胱氨酸(c)、甘氨酸(g)、硒代半胱氨酸(u)、甲硫氨酸(m)、天冬氨酸(d)或谷氨酸(e)。
[0048]
在本发明的一个具体实施方式中,所述的pif1-like解旋酶包含以下取代中的一个或多个:a)组氨酸(h)优选被(i)精氨酸(r)或赖氨酸(k);(ii)谷氨酰胺(q)或天冬酰胺(n);(iii)苯丙氨酸(f)、酪氨酸(y)或色氨酸(w) ;(iv)酪氨酸(y)、精氨酸(r)或谷氨酰胺(q);或(v)精氨酸(r)、酪氨酸(y)、天冬酰胺(n)或谷氨酰胺(q)取代。组氨酸(h)更优选被(iv) y、r 或q或(v)r、y、n或q取代。
[0049]
b)天冬酰胺(n)优选被(i)精氨酸(r)或赖氨酸(k);(ii)谷氨酰胺(q)或组氨酸(h);(iii)苯丙氨酸(f)、酪氨酸(y)或色氨酸(w);或(iv)谷氨酰胺(q)、精氨酸(r)、组氨酸
d132h; d132y; d132k; a161i; a161l; a161n; a161w; a161h; d162h; d162y; d162k; d163w; d163f; d163y; d163h; d163i; d163l; d163v; y244w; y244h; e277g; i280h; i280k; i280w; q291k; q291r; q291w; q291f; h396n; h396q; h396w; k415w; k415r; k415; k415y; f109w/p73l; f109w/p73v; f109w/p73i; f109w/p73e; f109w/p73t; f109w/p73f; f109w/h93n; f109w/h93q; f109w/h93w; f109w/n99r; f109w/n99h; f109w/n99w; f109w/n99y; f109w/p100l; f109w/p100v; f109w/p100i; f109w/p100e; f109w/p100t; f109w/p100f; f109w/f130w; f109w/f130y; f109w/f130h; f109w/d132h; f109w/d132y; f109w/d132k; f109w/a161i; f109w/a161l; f109w/a161n; f109w/a161w; f109w/a161h; f109w/d162h; f109w/d162y; f109w/d162k; f109w/d163w; f109w/d163f; f109w/d163y; f109w/d163h; f109w/d163i; f109w/d163l; f109w/d163v; f109w/y244w; f109w/y244h; f109w/e277g; f109w/i280h; f109w/i280k; f109w/i280w; f109w/q291k; f109w/q291r; f109w/q291w; f109w/q291f; f109w/h396n; f109w/h396q; f109w/h396w; f109w/k415w; f109w/k415r; f109w/k415h;或者f109w/k415y。
[0065]
在本发明的一个具体实施方式中,所述的pif1-like解旋酶更优选包含seq id no:6的变体,其包含:p94w; p94f; f103w; i282f; v155l; v155i; d126h; d126n; d126q; p157w; p157f; p157l; v422y; v422r; v422h; v422w; s293r; s293n; s293q; h87r; h87y; h87n; h87q; n93q; n93r; n93k; n93h; h403y; h403r; h403q; f246r; f246y; 或者f246q。
[0066]
本发明的解旋酶优选是这样一种解旋酶,即,至少一个与ssdna或dsdna中一个或多个核苷酸的一个或多个磷酸基团相互作用的氨基酸被取代。可以取代任何数量的氨基酸,例如,1个或更多个、2个或更多个、3个或更多个、4个或更多个、5个或更多个或者6个或更多个氨基酸。ssdna中的核苷酸各自包含三个磷酸基团。被取代的每个氨基酸每次可以与任何数量的磷酸基团相互作用,例如,每次一个、两个或三个磷酸基团。与一个或多个磷酸基团相互作用的氨基酸可以采用蛋白质建模来进行鉴定。
[0067]
取代优选增加所述至少一个氨基酸和所述ssdna或dsdna中一个或多个磷酸基团之间的(i)静电相互作用;(ii)氢键和/或(iii)阳离子-pi(阳离子-π)相互作用。以下使用标记(i)、(ii)和(iii)对增加(i)、(ii)和(iii)的优选取代进行讨论。
[0068]
取代优选增加位点的净正电荷。可以采用本领域已知的方法来测量任何位点处的净电荷。例如,可采用等电点来限定氨基酸的净电荷。通常在约7.5处测量净电荷。取代优选是用带正电荷、不带电荷、非极性或芳族的氨基酸取代带负电荷的氨基酸。带负电荷的氨基酸是带有净负电荷的氨基酸。带负电荷的氨基酸包括但不限于天冬氨酸(d)和谷氨酸(e)。带正电荷的氨基酸是带有净正电荷的氨基酸。带正电荷的氨基酸可以是天然存在的或非天然存在的。带正电的氨基酸可以是合成的或修饰的。例如,带有净正电荷的修饰氨基酸可以专门设计用于本发明。对氨基酸进行的多种不同类型的修饰是本领域公知的。优选的天然存在的带正电荷的氨基酸包括但不限于组氨酸(h)、赖氨酸(k)和精氨酸(r)。
[0069]
不带电荷的氨基酸、非极性氨基酸或者芳族氨基酸可以是天然存在的或非天然存在的。其可以是合成的或修饰的。不带电荷的氨基酸没有净电荷。合适的不带电荷氨基酸包括但不限于半胱氨酸(c)、丝氨酸(s)、苏氨酸(t)、甲硫氨酸(m)、天冬酰胺(n)和谷氨酰胺
(q)。非极性氨基酸具有非极性侧链。合适的非极性氨基酸包括但不限于甘氨酸(g)、丙氨酸(a)、脯氨酸(p)、异亮氨酸(i)、亮氨酸(l)和缬氨酸(v)。芳族氨基酸具有芳族侧链。合适的芳族氨基酸包括但不限于组氨酸(h)、苯丙氨酸(f)、色氨酸(w)和酪氨酸(y)。
[0070]
pif1-like解旋酶优选包含seq id no:11的变体,其中,至少一个与ssdna或dsdna中一个或多个核苷酸的一个或多个磷酸基团相互作用的氨基酸是h75, t91, s94, k97, n246, n247, n284, k288, n297, t394或k397中的至少一个。pif1-like解旋酶优选包含seq id no:6的变体,其中,至少一个与ssdna或dsdna中一个或多个核苷酸的一个或多个磷酸基团相互作用的氨基酸是k91, t85, r88, h69, k404, t401, n299, n248或k249中的至少一个。这些数字对应seq id no:11或6中的相关位点,并且相比seq id no:11或6可能需要在一个或多个氨基酸已经在变体中插入或删除的情况下进行改变。本领域技术人员可以确定如上所述的变体中的相应位点。
[0071]
pif1-like解旋酶优选包含seq id no:1到5和7到10中任一的变体,其中,所述至少一个与ssdna或dsdna中一个或多个核苷酸的一个或多个磷酸基团相互作用的氨基酸是与seq id no:11中的h75, t91, s94, k97, n246, n247, n284, k288, n297, t394或k397相对应的至少一个氨基酸;或与seq id no:6中的k91, t85, r88, h69, k404, t401, n299, n248或k249相对应的至少一个氨基酸。
[0072]
表5示出了与seq id no:11中的h75, t91, s94, k97, n246, n247, n284, k288, n297, t394和k397对应的seq id no:1至10中的氨基酸。
[0073]
表5 与seq id no:11相应的seq id no:1至10中的氨基酸的位置优选的,所述的pif1-like解旋酶包含以下任一个或多个:a)组氨酸(h)被(i)精氨酸(r)或赖氨酸(k);(ii)天冬酰胺(n)、丝氨酸(s)、谷氨酰胺(q)或苏氨酸(t);(iii)苯丙氨酸(f)、色氨酸(w)或酪氨酸(y);或(iv)天冬酰胺(n)、谷氨酰胺(q)或精氨酸(r)取代;b)苏氨酸(t)被(i)精氨酸(r)、组氨酸(h)或赖氨酸(k);(ii)天冬酰胺(n)、丝氨酸(s)、谷氨酰胺(q)或组氨酸(h);(iii)苯丙氨酸(f)、色氨酸(w)、酪氨酸(y)或组氨酸(h);(iv)天冬酰胺(n)、谷氨酰胺(q)或精氨酸(r);或(v)天冬酰胺(n)、组氨酸(h)、赖氨酸(k)或精氨酸(r)取代;c)丝氨酸(s)被(i)精氨酸(r)、组氨酸(h)或赖氨酸(k);(ii)天冬酰胺(n)、谷氨酰
胺(q)、苏氨酸(t)或组氨酸(h);或(iii)苯丙氨酸(f)、色氨酸(w)、酪氨酸(y)或组氨酸(h)取代;d)天冬酰胺(n)被(i)精氨酸(r)、组氨酸(h)或赖氨酸(k);(ii)丝氨酸(s)、谷氨酰胺(q)、苏氨酸(t)或组氨酸(h);(iii)苯丙氨酸(f)、色氨酸(w)、酪氨酸(y)或组氨酸(h);或(iv)谷氨酰胺(q)、精氨酸(r)、组氨酸(h) 或赖氨酸(k)取代;和/或,e)赖氨酸(k)被(i)精氨酸(r)或组氨酸(h);(ii)天冬酰胺(n)、丝氨酸(s)、谷氨酰胺(q)、苏氨酸(t)或组氨酸(h);(iii)苯丙氨酸(f)、色氨酸(w)、酪氨酸(y)或组氨酸(h);或(iv)精氨酸(r)、谷氨酰胺(q)或天冬酰胺(n)取代;和/或,f)精氨酸(r)被(i)天冬酰胺(n) 、丝氨酸(s)或谷氨酰胺(q)取代。
[0074]
在本发明的一个具体实施方式中,所述pif1-like解旋酶是seq id no:11的变体,其包含(a)至(k)中的一个或多个,其中, (a)h75n ,h75q ,h75k或h75f;(b)t91k ,t91q或t91n;(c)s94h ,s94n ,s94k ,s94t ,s94r或s94q; (d) k97q, k97h或k97y; (e)n246h或n246q;(f)n247q或n247h;(g)n284h或n284q; (h) k288q或k288h; (i)n297q ,n297k或n297h;(j)t394k ,t394h或t394n;或(k)k397r,k397h或k397y。
[0075]
在本发明的一个具体实施方式中,所述pif1-like解旋酶是seq id no:6的变体,其包含(a)至(i)中的一个或多个,其中,(a)k91r;(b) t85n, t85q或t85r;(c) r88n或r88q;(d) h69n, h69q或h69r;(e) k404r;(f) t401n, t401h, t401k或t401r;(g) n299q, n299r, n299h或n299k;(h) n248q, n248r, n248h或n248k;或(i) k249r, k249q或k249n。
[0076]
进一步优选的,在(b)中,至少一个与双链dna中一个或多个核苷酸的双链相互作用的氨基酸被取代。
[0077]
优选的,所述pif1-like解旋酶包括:(a) seq id no:6的变体,其中,所述至少一个与ssdna或dsdna中一个或多个核苷酸的双链相互作用的氨基酸是m81, v59, q52, e286或k290中的至少一个;或者,(b)seq id no:1到5和7到11中任一的变体,其中,所述至少一个与ssdna或dsdna中一个或多个核苷酸的双链相互作用的氨基酸是与seqid no:6中的m81, v59, q52, e286或k290相对应的至少一个氨基酸。
[0078]
优选的,所述pif1-like解旋酶是seq id no:6的变体,其包含(a)至(e)中的一个或多个,其中,(a)m81k, m81r或m81h;(b)v59k, v59r或v59h;(c)q52k, q52r或q52h;(d)e286k, e286r或e286h;或 (e)k290r。
[0079]
优选的,所述pif1-like解旋酶是seq id no:6的变体,其包含如下氨基酸替代中的一个或多个:t85n, h87y、h87q, h87n, r88q、r88n、v155i、v155l、k91r, f103w, s239n, f246r, f246y, k249r, i282f, e286k或v422h。
[0080]
本发明的解旋酶还是这样一种解旋酶,其中,与跨膜孔相互作用的解旋酶的一部分包含一个或多个修饰,优选一个或多个取代,进一步优选所述解旋酶包括至少一个与跨膜孔相互作用的氨基酸被取代。所述与跨膜孔相互作用的解旋酶的一部分通常是当解旋酶用于控制多核苷酸穿过孔的移动时与跨膜孔相互作用的解旋酶的一部分,例如,以下进行更详细的讨论。当解旋酶用于控制多核苷酸穿过孔的移动时,所述一部分通常包含与孔相互作用或接触的氨基酸。在施加电势下,当解旋酶与正移动穿过孔的多核苷酸结合或连接时,所述一部分通常包含与孔相互作用或接触的氨基酸。
[0081]
与跨膜孔相互作用的一部分优选包含seq id no:11的变体,其中的位点包含e196,w202 ,n199或g201上的一个或多个氨基酸被取代,例如,2个、3个、4个或5个。
[0082]
与跨膜孔相互作用的一部分优选包含seq id no:1至10中任一的变体,其包含与seq id no:11在(a)e196;(b)w202;(c);n199;或(d)g201位点对应的至少一个或多个的取代。
[0083]
表6示出了与seq id no:11中的e196,w202,n199,g201对应的seq id no:1至10中的氨基酸。
[0084]
表6 与seq id no:11对应的seq id no:1至10中的氨基酸位置在本发明的一个具体实施方式中,所述的pif1-like解旋酶是seq id no.11的变体,其包含在以下位点上的取代:-f109/e196/h75 ,例如,f109w/e196l/h75n ,f109w/e196l/h75q ,f109w/e196l/h75k或者f109w/e196l/h75f;-f109/e196/t91 ,例如,f109w/e196l/t91k ,f109w/e196l/t91q或者f109w/e196l/t91n;-f109/s94/e196 ,例如,f109w/s94h/e196l ,f109w/s94t/e196l ,f109w/s94r/e196l ,f109w/s94q/e196l ,f109w/s94n/e196l ,或者f109w/s94k/e196l;f109/n99/e196,例如, ,f109w/n99r/e196l ,f109w/n99h/e196l , f109w/n99w/e196l或者f109w/n99y/e196l;-f109/s94/e196/i280 ,例如,f109w/s94h/e196l/i280k;-f109/p100/e196 ,例如,f109w/p100l/e196l ,f109w/p100v/e196l ,f109w/p100i/e196l或者f109w/p100t/e196l;-f109/d132/e196 ,例如,f109w/d132h/e196l ,f109w/d132y/e196l或者f109w/d132k/e196l;-f109/a161/e196 ,例如,f109w/a161i/e196l ,f109w/a161l/e196l ,f109w/a161n/e196l ,f109w/a161w/e196l或者f109w/a161h/e196l;-f109/d163/e196 ,例如,f109w/d163w/e196l ,f109w/d163f/e196l ,f109w/d163y/e196l ,f109w/d163h/e196l ,f109w/d163i/e196l ,f109w/d163l/e196l或者
f109w/d163v/e196l;-f109/y244/e196 ,例如,f109w/y244w/e196l ,f109w/y244y/e196l或者f109w/y244h/e196l;-f109/n246/e196 ,例如,f109w/n246h/e196l或者f109w/n246q/e196l;-f109/e196/i280 ,例如,f109w/e196l/i280k ,f109w/e196l/i280h ,f109w/e196l/i280w或者f109w/e196l/i280r;-f109/e196/q291 ,例如,f109w/e196l/q291k ,f109w/e196l/q291r ,f109w/e196l/q291w或者f109w/e196l/q291f;-f109/n297/e196 ,例如,f109w/n297q/e196l ,f109w/n297k/e196l或者f109w/n297h/e196l;-f109/t394/e196 ,例如,f109w/t394k/e196l ,f109w/t394h/e196l或者f109w/t394n/e196l;-f109/h396/e196 ,例如,f109w/h396y/e196l ,f109w/h396f/e196l ,f109w/h396q/e196l或者f109w/h396k/e196l;-f109/k397/e196 ,例如,f109w/k397r/e196l ,f109w/k397h/e196l或者f109w/k397y/e196l;或者,-f109/y416/e196 ,例如,f109w/y416w/e196l或者f109w/y416r/e196l。
[0085]
pif1-like解旋酶是具有下述氨基酸序列的酶:所述氨基酸序列从野生型解旋酶的氨基酸序列变化而来并保留多核苷酸结合活性。特别的,seq id no:1到11中任一个的变体是具有下述氨基酸序列的酶:所述氨基酸序列从seq id no:1到11中任一个的氨基酸序列变化而来并保留多核苷酸结合活性。多核苷酸结合活性可使用本领域已知方法确定。合适的方法包括,但不限于荧光各向异性法,色氨酸荧光法和电泳迁移位移试验法(emsa)。例如,变体结合单链多核苷酸的能力可以如实施例中所描述的进行确定。
[0086]
基于氨基酸同一性,对于seq id no:1到11中任一个氨基酸序列的整个长度,变体优选与该序列具有至少20%的同一性。更优选的是,基于氨基酸同一性,所述变体多肽与 seq id no:1到11中任一个氨基酸序列的整个序列,可以具有至少70%,至少75%,至少80%,至少85%,至少90%和更优选至少95%,97%或99%的同一性。在100或更多,例如150,200,300,400或 500或更多个连续氨基酸长度上,可以具有至少为70%,例如至少80%,至少85%,至少90%或至少95%的氨基酸同一性(严格同源性)。
[0087]
本发明的第二方面,提供了一种构建体,所述的构建体包含至少一个或多个本发明所述的pif1-like解旋酶。
[0088]
优选的,所述的构建体还包含多核苷酸结合部分。
[0089]
优选的,所述的构建体具有控制多核苷酸移动的能力。
[0090]
优选的,所述的多核苷酸结合部分可以与多核苷酸的碱基结合的部分,和/或与多核苷酸的糖环结合的部分,和/或与多核苷酸的磷酸结合的部分。
[0091]
优选的,组成所述构建体的pif1-like解旋酶与多核苷酸结合部分可以单独制备,后直接连接。与可以通过遗传融合的方式直接制备构建体,例如将编码pif1-like解旋酶与多核苷酸结合部分的核苷酸连接,后转入宿主细胞中表达、纯化获得。
[0092]
进一步优选的,所述的多核苷酸结合部分为能够与多核苷酸结合的多肽,包括但
不限于真核单链结合蛋白、细菌单链结合蛋白、古生菌单链结合蛋白、病毒单链结合蛋白或双链结合蛋白中的一种或两种以上的组合。
[0093]
在本发明的一个具体实施方式中,所述的多核苷酸结合部分包括但不限于表7所示的任一种:表7与多核苷酸结合的结合部分本发明的第三方面,提供了一种核酸,所述的核酸编码本发明所述的pif1-like解旋酶或所述的构建体。
[0094]
本发明的第四方面,提供了一种表达载体,所述的表达载体包含本发明所述的核酸。
[0095]
优选的,所述的核酸可操作的连接至表达载体中的调控元件,其中所述的调控元件优选为启动子。
[0096]
在本发明的一个具体实施方式中,所述的启动子选自t7、trc、lac、ara或λ
l
。
[0097]
优选的,所述的表达载体包括但不限于质粒、病毒或噬菌体。
[0098]
本发明的第五方面,提供了一种宿主细胞,所述的宿主细胞包含本发明所述的核酸或所述的表达载体。
[0099]
优选的,所述的宿主细胞包括但不限于大肠杆菌。
[0100]
在本发明的一个具体实施方式中,所述的宿主细胞选自bl21(de3)、jm109(de3)、b834(de3)、tuner、c41(de3)、rosetta2(de3)、origami、origami b等等。
[0101]
本发明的第六方面,提供了一种pif1-like解旋酶的制备方法,所述的方法包括提供野生型pif1-like解旋酶,然后对所述的野生型pif1-like解旋酶进行修饰,获得本发明所述的pif1-like解旋酶。
[0102]
本发明的第七方面,提供了一种pif1-like解旋酶的制备方法,所述的方法包括培养本发明所述的宿主细胞并进行诱导表达,纯化后获得pif1-like解旋酶。
[0103]
在本发明的一个具体实施方式中,所述的方法包括根据本发明所述pif1-like解旋酶的氨基酸序列,获得编码pif1-like解旋酶的核酸序列,酶切连接至表达载体后转化至大肠杆菌中,诱导表达和纯化,获得pif1-like解旋酶。
[0104]
本发明的第八方面,提供了一种控制多核苷酸移动的方法,所述的方法包括将本发明所述的pif1-like解旋酶或所述的构建体与多核苷酸接触。
[0105]
优选的,所述的控制多核苷酸移动为控制多核苷酸穿过孔的移动。所述的孔为纳米孔,所述的纳米孔为跨膜孔。该孔可以是天然的或人造的,包括但不限于蛋白孔、多核苷酸孔或固态孔。
[0106]
在本发明的一个具体实施方式中,所述的跨膜孔选自生物孔、固态孔或生物与固态杂交的孔。
[0107]
在本发明的一个具体实施方式中,所述的孔包括但不限于衍生自耻垢分枝杆菌孔蛋白a、耻垢分枝杆菌孔蛋白b、耻垢分枝杆菌孔蛋白c、耻垢分枝杆菌孔蛋白d、溶血素、胞溶素、白细胞介素、外膜孔蛋白f、外膜孔蛋白g、外膜磷脂酶a、wza或奈瑟氏菌自转运脂蛋白等等。
[0108]
优选的,所述的方法可以包含一个或多个的pif1-like解旋酶共同控制多核苷酸的移动。
[0109]
本发明的第九方面,提供了一种表征目标多核苷酸的方法,所述的方法包括:i)将本发明所述的pif1-like解旋酶或所述的构建体,与目标多核苷酸以及孔接触,使得pif1-like解旋酶或构建体控制目标多核苷酸穿过孔的移动;以及ii)获取目标多核苷酸中的核苷酸与所述孔相互作用时的一个或多个特征,以表征所述目标多核苷酸。
[0110]
优选的,所述的方法中可以使用任意数量的本发明所述的pif1-like解旋酶。优选可以为一个或多个,更优选为1、2、3、4、5、6、7、8、9个或更多个。其中,所述的两个以上本发明所述的pif1-like解旋酶可以相同或不同。也可以包含野生型pif1-like解旋酶或者其他类型的解旋酶。进一步的,两个以上个解旋酶之间可以连接或者只是通过分别结合在多核苷酸上而排列发挥控制多核苷酸移动的功能。
[0111]
优选的,当在孔施加一种力(如电压),目标多核苷酸通过孔的速率被pif1-like解旋酶或构建体所控制,从而获得一种可识别的稳定的电流水平,用于确定目标多核苷酸的特征。
[0112]
优选的,重复步骤i)和ii)一次或多次。
[0113]
优选的,所述的方法还包括横跨与所述解旋酶或构建体,和目标多核苷酸接触的孔施加势差的步骤。
[0114]
优选的,所述的孔是允许水合离子在施加的电势的驱动下从膜的一侧流向膜的另一层的结构。进一步优选的,所述的孔为纳米孔,所述的纳米孔为跨膜孔。所述跨膜孔为目标多核苷酸的移动提供了通道。
[0115]
所述的膜可以为任何现有技术中存在的膜,优选为两性分子层,即一种由具有至少一个亲水性部分和至少一个亲脂性或疏水性部分的两性分子诸如磷脂质形成的层,两性分子可以是合成的或天然存在的。进一步优选的,所述的膜为脂质双层膜。
[0116]
所述的目标多核苷酸可以使用任何已知的方法连接到膜上。如果膜是两性分子
层,如脂质双分子层,所述多核苷酸优选通过在所述膜中存在的多肽或通过在所述膜中存在的疏水锚被连接到该膜上。其中,疏水锚优选为脂质、脂肪酸、甾醇、碳纳米管或氨基酸。
[0117]
优选的,所述的孔选自生物孔、固态孔或生物与固态杂交的孔。
[0118]
在本发明的一个具体实施方式中,所述的孔包括但不限于衍生自耻垢分枝杆菌孔蛋白a、耻垢分枝杆菌孔蛋白b、耻垢分枝杆菌孔蛋白c、耻垢分枝杆菌孔蛋白d、溶血素、胞溶素、白细胞介素、外膜孔蛋白f、外膜孔蛋白g、外膜磷脂酶a、wza或奈瑟氏菌自转运脂蛋白等等。
[0119]
当提供了促进移动的所有必要组分时,pif1-like解旋酶沿着dna以5
’‑3’
的方向移动,但dna在孔中的定向(取决于dna的哪个末端被捕获)意味着酶可以用于逆着所施加的场的方向将dna移出孔,或顺着施加的场的方向将dna移进孔。
[0120]
优选的,所述的目标多核苷酸为单链、双链或至少一部分是双链的。
[0121]
进一步优选的,所述的目标多核苷酸可以通过标签、间隔物、甲基化、氧化或损伤的方式进行修饰。
[0122]
在本发明的一个具体实施方式中,所述的目标多核苷酸为至少一部分是双链的。其中所述的双链部分构成y衔体结构,所述的y衔体结构包含优先螺入所述孔的前导序列。
[0123]
进一步优选的,所述的目标多核苷酸的长度可以为10-100000个或更多个。
[0124]
在本发明的一个具体实施方式中,所述的目标多核苷酸的长度可以为至少10个、至少50个、至少100个、至少200个、至少300个、至少400个、至少500个、至少1000个、至少2000个、至少5000个、至少10000个、至少50000个或至少100000个等等。
[0125]
优选的,所述的解旋酶结合到单链多核苷酸的内部核苷酸中。
[0126]
优选的,所述的一个或多个特征选自目标多核苷酸的来源、长度、同一性、序列、二级结构或目标多核苷酸是否被修饰。
[0127]
优选的,所述的一个或多个特征通过电测量和/或光学测量进行。
[0128]
进一步优选的,通过电测量和/或光测量产生电信号和/或光信号,而每种核苷酸对应一种信号水平,继而将电信号和/或光信号转化为核苷酸的特征。
[0129]
在本发明的一个具体实施方式中,所述的电测量包括但不限于电流测量、阻抗测量、隧道测量、风洞测量或场效应晶体管(fet)测量等等。
[0130]
本发明所述的电信号选自电流、电压、隧穿、电阻、电位、电导率或横向电测量的测量值。
[0131]
在本发明的一个具体实施方式中,所述的电信号为穿过所述孔的电流。
[0132]
本发明的第十方面,提供了一种表征目标多核苷酸的产品,所述的产品包含本发明所述的pif1-like解旋酶、所述的构建体、所述的核酸、所述的表达载体或所述的宿主细胞,和孔。
[0133]
优选的,所述的产品中包含多个pif1-like解旋酶和/或多个构建体。
[0134]
优选的,所述的产品中包含多个孔。进一步优选的,所述的孔为纳米孔,所述的纳米孔为跨膜孔。
[0135]
在本发明的一个具体实施方式中,所述的跨膜孔选自生物孔、固态孔或生物与固态杂交的孔。
[0136]
在本发明的一个具体实施方式中,所述的孔包括但不限于衍生自耻垢分枝杆菌孔
蛋白a、耻垢分枝杆菌孔蛋白b、耻垢分枝杆菌孔蛋白c、耻垢分枝杆菌孔蛋白d、溶血素、胞溶素、白细胞介素、外膜孔蛋白f、外膜孔蛋白g、外膜磷脂酶a、wza或奈瑟氏菌自转运脂蛋白等等。
[0137]
在本发明的一个具体实施方式中,所述的产品包含多个pif1-like解旋酶或多个构建体,和多个孔。
[0138]
优选的,所述的产品选自试剂盒、装置或传感器。
[0139]
进一步优选的,所述的试剂盒中还包括包含脂质双层的芯片。所述的孔横跨脂质双层。
[0140]
本发明所述的试剂盒包含一个或多个脂质双层,每个脂质双层包含一个或多个所述的孔。
[0141]
本发明所述的试剂盒还包括实施表征目标多核苷酸的试剂或装置。优选的,所述的试剂包括缓冲剂、pcr扩增所需的工具。
[0142]
本发明的第十一方面,提供了本发明所述的pif1-like解旋酶、所述的构建体、所述的核酸、所述的表达载体、所述的宿主细胞或所述的产品在表征目标多核苷酸或控制目标多核苷酸穿过孔的移动中的应用。
[0143]
本发明的第十二方面,提供了一种表征目标多核苷酸的试剂盒,所述的试剂盒包含本发明所述的pif1-like解旋酶、所述的构建体或所述的核酸、所述的表达载体或所述的宿主细胞,和孔。
[0144]
本发明的第十三方面,提供了一种表征目标多核苷酸的装置,所述的装置包含本发明所述的pif1-like解旋酶、所述的构建体或所述的核酸、所述的表达载体或所述的宿主细胞,和孔。
[0145]
优选的,所述的装置包括支撑所述多个孔并可传输孔与多核苷酸相互作用的信号的传感器,和至少一个用于存储目标多核苷酸的存储器,和实施表征过程中所需的溶液。
[0146]
优选的,所述的装置包括多个pif1-like解旋酶和/或多个构建体,和多个孔。
[0147]
本发明的第十四方面,提供了一种表征目标多核苷酸的传感器,所述的传感器包含在所述孔和本发明所述pif1-like解旋酶或所述的构建体之间形成复合物。
[0148]
优选的,在所述目标多核苷酸存在下使所述孔和解旋酶或构建体接触,并跨所述孔施加电势。所述的电势选自电压电势或化学电势。
[0149]
本发明的第十五方面,提供了一种形成表征目标多核苷酸的传感器的方法,包括在所述孔和本发明所述pif1-like解旋酶或所述的构建体之间形成复合物,从而形成表征目标多核苷酸的传感器。
[0150]
本发明的第十六方面,提供了一种与多核苷酸连接的两个或多个解旋酶,其中,所述的两个或多个解旋酶中至少一个为本发明所述的pif1-like解旋酶。
[0151]
本发明的第十七方面,提供了一种pif1-like解旋酶寡聚体,所述的pif1-like解旋酶寡聚体包含一个或多个的本发明所述的pif1-like解旋酶。
[0152]
优选的,所述的pif1-like解旋酶寡聚体还可以包含野生型pif1-like解旋酶或其他类型的解旋酶。其中,所述的其他类型的解旋酶可以为hel308解旋酶、xpd解旋酶、dda解旋酶、trai解旋酶或者trwc解旋酶等等。
[0153]
优选的,所述的pif1-like解旋酶与野生型pif1-like解旋酶之间、pif1-like解旋
酶与pif1-like解旋酶之间、野生型pif1-like解旋酶与野生型pif1-like解旋酶、pif1-like解旋酶与其他类型解旋酶之间或者野生型pif1-like解旋酶与其他类型解旋酶之间,可以通过头对头、尾对尾或者头对尾的方式连接或排列。
[0154]
优选的,所述的pif1-like解旋酶寡聚体包含两个以上的本发明所述的pif1-like解旋酶,其中,所述的pif1-like解旋酶可以是不同的或者相同的。
[0155]
本发明所述的“pif1-like解旋酶”是经过修饰的,所述的修饰是相对于野生型或天然解旋酶是修饰的。
[0156]
本发明所述的“pif1-like解旋酶”、“构建体”或“孔”,均可以被修饰以助于鉴定或纯化,例如通过添加组氨酸残基(his标签),天冬氨酸残基(asp标签),链霉亲和素标签,flag标签,sumo标签,gst标签或mbp标签,或通过添加信号序列以促进它们从细胞中分泌,该细胞中的多肽不天然地含有该信号序列。引入遗传标签的替换方式是通过化学反应将标签连到pif1-like解旋酶、孔或构建体上的天然或人工位点。
[0157]
本发明所述的“核苷酸”包括但不局限于:腺苷单磷酸(amp)、鸟苷单磷酸(gmp)、胸苷单磷酸(tmp)、尿苷单磷酸(ump)、胞嘧啶核苷单磷酸(cmp)、环状腺苷单磷酸(camp)、环状鸟苷单磷酸(cgmp)脱氧腺苷单磷酸(damp)、脱氧鸟苷单磷酸(dgmp)、脱氧胸苷单磷酸(dtmp)、脱氧尿苷单磷酸(dump)和脱氧胞苷单磷酸(dcmp)。优选的,所述核苷酸选自amp、tmp、gmp、cmp、ump、damp、dtmp、dgmp或dcmp。
[0158]
本发明所述的“保守的氨基酸取代”包括但不限于:丙氨酸与丝氨酸、甘氨酸、苏氨酸、缬氨酸、脯氨酸或谷氨酸之间的替换;和/或,天冬氨酸与甘氨酸、天冬酰胺或谷氨酸之间的替换;和/或,丝氨酸与甘氨酸、天冬酰胺或苏氨酸之间的替换;和/或,亮氨酸与异亮氨酸或缬氨酸之间的替换;和/或,缬氨酸与亮氨酸、异亮氨酸之间的替换;和/或,酪氨酸与苯丙氨酸之间的替换;和/或,赖氨酸与精氨酸之间的替换。上述所述的取代基本不会改变本发明所述的氨基酸序列的活性。
[0159]
本发明所述的“两个以上”包括两个、三个、四个、五个、六个、七个、八个或更多个等等。
[0160]
本发明所述的“多个”包括但不限于两个以上、三个以上、四个以上、五个以上、六个以上、七个以上、八个以上或更多个等等。
[0161]
本发明所述的“至少一个”包括但不限于一个以上、两个以上、三个以上、四个以上、五个以上、六个以上、七个以上、八个以上或更多个等等。
[0162]
本发明所述的“和/或”包括择一列出的项目以及任何数量的项目组合。
[0163]
本发明所述的“包括”是开放式的描述,含有所描述的指定成分或步骤,以及不会实质上影响的其他指定成分或步骤。
[0164]
本发明所述的“非天然氨基酸”为不是天然存在于pif1-like解旋酶中的氨基酸。优选的,包括但不限于4-叠氮基-l-苯丙氨酸(faz),4-乙酰基-l-苯丙氨酸,3-乙酰基-l-苯丙氨酸,4-乙酰乙酰基-l苯丙氨酸,o-烯丙基-l-酪氨酸,3-(苯基硒烷基)-l-丙氨酸,o-2-丙炔-1-基-l-酪氨酸,4(二羟基硼基)-l-苯丙氨酸,4-[(乙基硫烷基)羰基]-l-苯丙氨酸,(2s)-2-氨基-3-{4-[(丙烷-2-基硫烷基)羰基]苯基}丙酸,(2s)-2-氨基-3-{4-[(2-氨基-3-硫烷基丙酰基)氨基]苯基}丙酸,o-甲基-l-酪氨酸,4-氨基-l-苯丙氨酸,4-氰基-l-苯丙氨酸,3-氰基-l-苯丙氨酸,4-氟-l-苯丙氨酸,4-碘-l-苯丙氨酸,4-溴-l-苯丙氨酸,o-(三
氟甲基)酪氨酸,4-硝基l-苯丙氨酸,3-羟基-l-酪氨酸,3-氨基-l-酪氨酸,3-碘-l-酪氨酸,4-异丙基-l-苯丙氨酸, 3-(2-萘基)-l-丙氨酸,4-苯基-l-苯丙氨酸,(2s)-2-氨基-3-(萘-2-基氨基)丙酸,6-(甲基硫烷基)正亮氨酸,6-氧-l-赖氨酸,d-酪氨酸,(2r)-2-羟基-3-(4-羟基苯基)丙酸,(2r)-2氨基辛酸酯3-(2,2
′‑
二吡啶-5-基)-d-丙氨酸,2-氨基-3-(8-羟基-3-喹啉基)丙酸,4-苯甲酰-l-苯丙氨酸,s-(2-硝基苄基)半胱氨酸,(2r)-2-氨基-3-[(2-硝基苄基)硫烷基]丙酸, (2s)-2-氨基-3-[(2-硝基苄基)氧基]丙酸,o-(4,5-二甲氧基-2-硝基苄基)-l-丝氨酸, (2s)-2-氨基-6-({[(2-硝基苄基)氧基]羰基}氨基)己酸,o-(2-硝基苄基)-l-酪氨酸,2-硝基苯丙氨酸,4-[(e)-苯基二氮烯基]-l-苯丙氨酸,4-[3-(三氟甲基)-3h-二吖丙啶基-3基]-d-苯丙氨酸,2-氨基-3-[[5-(二甲基氨基)-1-萘基]磺酰基氨基]丙酸,(2s)-2-氨基4-(7-羟基-2-氧-2h-色烯-4-基)丁酸,(2s)-3-[(6-乙酰基萘-2-基)氨基]-2-氨基丙酸,4(羧基甲基)苯丙氨酸,3-硝基-l-酪氨酸,o-硫基-l-酪氨酸,(2r)-6-乙酰氨基-2-氨基己酸酯,1-甲基组氨酸,2-氨基壬酸,2-氨基癸酸,l-同质半胱氨酸,5-硫烷基正缬氨酸,6-硫烷基-l-正亮氨酸,5-(甲基硫烷基)-l-正缬氨酸,n6-{[(2r,3r)-3-甲基-3,4-二氢-2h-吡咯2-基]羰基}-l-赖氨酸,n6-[(苄基氧基)羰基]赖氨酸,(2s)-2-氨基-6-[(环戊基羰基)氨基]己酸,n6-[(环戊基氧基)羰基]-l-赖氨酸,(2s)-2-氨基-6-{[(2r)-四氢呋喃-2-基羰基]氨基}己酸,(2s)-2-氨基-8-[(2r,3s)-3-乙炔基四氢呋喃-2-基]-8-氧基辛酸,n6-(叔丁氧基羰基)-l-赖氨酸,(2s)-2-羟基-6-({[(2-甲基-2-丙烷基)氧基]羰基}氨基)己酸,n6-[(烯丙氧基)羰基]赖氨酸,(2s)-2-氨基-6-({[(2-叠氮苄基)氧基]羰基}氨基)己酸,n6l-脯氨酰基-l-赖氨酸,(2s)-2-氨基-6-{[(丙-2-炔-1-基氧基)羰基]氨基}己酸或n6-[(2叠氮乙氧基)羰基]-l-赖氨酸。
附图说明
[0165]
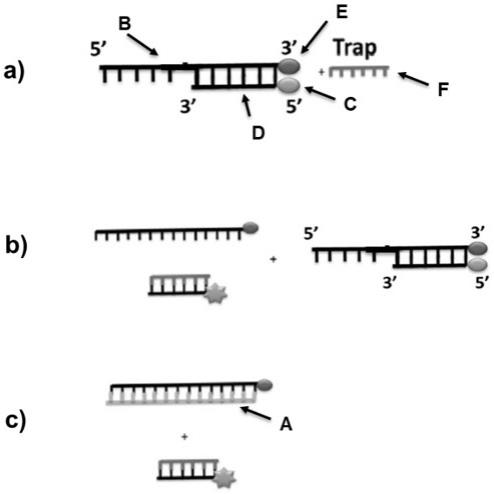
以下,结合附图来详细说明本发明的实施例,其中:图1:检测pif1-like解旋酶酶活性的荧光分析示意图。其中,荧光底物链具有5’端ssdna突出部分,以及50个碱基的杂交的dsdna部分。a)所示,包括主链上部(b)在3’端具有黑洞淬灭剂(bhq-1)碱基(e),并且所述杂交的互补链(d)在5’端具有羧基荧光素(c)。还包括,与荧光底物的较短链(d)互补的0.5μm的捕获链(f)。如b)所示,在atp(5mm)和mgcl2(5mm)存在下,添加到所述底物中的解旋酶(200nm)连接到所述荧光底物的5’端部分,沿着所述主链移动,并解开所述互补链后,过量的捕获链优先与互补链dna退火以防止初始底物与丢失荧光重新退火。如c)所示,加入过量与主链完全互补的捕获链(a)后,部分未被解旋的dsdna由于过量a的存在而产生链解旋效果,最终所有dsdna被解旋,荧光值达到最高。
[0166]
图2:荧光分析检测pif1-like解旋酶的解开杂交dsdna的能力,具体为含有400mm nacl的缓冲液中的时间依赖型dsdna被解旋比例的变化图。
[0167]
图3:显示了针对不同pif1-like解旋酶结合dna能力进行的凝胶测定结果。泳道1为预先构建的dsdna(seq id no:18与含5’fam修饰的seq id no:19杂交)。泳道2-6分别包含预先连接到dsdna的aph acj61、aph px29、sph cbh8、pphpspyzu05和mph mp1。泳道7-11分别包含预先连接到dsdna的aph acj61-d97c/a363c、aph px29-d96c/a371c、sph cbh8-a94c/a361c/c136a、pphpspyzu05-d104c/a375c/c146a和mph mp1-e105c/a362c。条带a对应于与seq id no:18杂交的seq id no:19。标记为1a、2a、3a、4a、5a的区域分别对应于1、2、3、
4、5个解旋酶结合与seq id no:18杂交的seq id no:19。
[0168]
图4:实施例中使用的dna构建体的图,其中seq id no:13(标记为b)其5’末端连接到20个ispc3间隔区(标记为a),其3’末端连接到4个ispc3间隔区(标记为c),该间隔区(标记为c)连接到seq id no:14(标记为d)的5’末端,该seq id no:14(标记为d)的3’末端连接到seq id no:17或seq id no:24(标记为e),该构建体的seq id no:15(标记为f)区域与seq id no:16(标记为g,其具有5’胆固醇系链)杂交。
[0169]
图5:当pif1-like解旋酶(mph mp1-e105c/a362c(具有突变e105c/a362c的seq id no:11))控制dna构建体a穿过纳米孔8mspa(seq id no:12)移位时的示例电流轨迹(y轴坐标=电流(pa,0到250),x轴坐标=采样频率(hz,0到3.5*105))。
[0170]
图6:图5电流轨迹图中所示的pif1-like解旋酶控制的dna移动的区域放大图(y轴坐标=电流(pa,30到100),x轴坐标=采样频率(hz,2.346到2.366*105))。
[0171]
图7:当pif1-like解旋酶(sph cbh8-a94c/a361c/c136a(具有a94c/a361c/c136a突变的seq id no:5)控制dna构建体b穿过mspa纳米孔移位时的示例电流轨迹(y轴坐标=电流(pa),x轴坐标=时间(s))。
[0172]
图8:当解旋酶(eph pei26-d99c/a366c/c141a (具有d99c/a366c/c141a突变的seq id no:6))控制dna构建体b穿过mspa纳米孔移位时的示例电流轨迹(y轴坐标=电流(pa),x轴坐标=时间(s))。
[0173]
图9:当解旋酶(pph pspyzu05-d104c/a375c/c146a(具有d104c/a375c和c146a突变的seq id no:8))控制dna构建体b穿过mspa纳米孔移位时的示例电流轨迹(y轴坐标=电流(pa),x轴坐标=时间(s))。
[0174]
图10:显示了经纯化后的mph mp1(seq id no:11)sds-page凝胶电泳图。其中,m是marker(kd),1道为mph mp1解旋酶的电泳结果图。
[0175]
图11a和图11b:显示了seq no:1至11的氨基酸序列对应关系。
[0176]
图12:显示了突变体eph-pei26-d99c/a366c/f103w/e286k(图a)和eph-pei26-d99c/ a366c/c114v/c119v/c141s/c308s/c419d/ f103w/e286k(图b)控制核酸文库穿过纳米孔的速率分布。
[0177]
图13:显示了eph-pei26-d99c/a366c/c114v/c119v/c141s/c308s/c419d(具有d99c/a366c/c114v/c119v/c141s/c308s/c419d突变的seq id no:6)和eph-pei26
‑ꢀ
d99c/a366c/c114v/c119v/c141s/c308s/c419d/f103w(具有d99c/a366c/c114v/ c119v/c141s/c308s/c419d/f103w突变的seq id no:6)控制核酸穿过纳米孔的移动。其中,图a是模拟的seq id no:24核酸序列逐个穿过纳米孔的移动所产生的电流信号特征;图b是突变体eph-pei26-d99c/a366c/c114v/c119v/c141s/c308s/c419d/f103w控制核酸序列seq id no:24穿过纳米孔的移动所产生的电流特征;图c是eph-pei26-d99c/a366c/ c114v/c119v/c141s/c308s/c419d控制核酸seq id no:24序列穿过纳米孔的移动所产生的的电流信号特征。
[0178]
图14:显示了对突变体eph-pei26-24和eph-pei26-25测序的大肠杆菌(e.coli)和人类基因组(human)随机打断文库序列的验证集准确率。
具体实施方式
[0179]
以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
[0180]
若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。各实施例中所用的设备和试剂均常规市售可得。测序所使用的测序仪为齐碳科技基因测序仪 qnome-9604,测序算法为ont(oxford nanopore technologies公司)开源的测序模型bonito-ctc,详细开源地址见:https://github.com/nanoporetech/bonito。这是一个开源的基于ctc的端到端的seq2seq模型,架构基于英伟达开源的语音识别网络quartznet。quartznet的论文是《quartznet: deep automatic speech recognition with 1d time-channel separable convolutions》。
[0181]
实施例1:pif1-like解旋酶的制备1、材料和方法将含有pif1-like解旋酶序列的重组质粒(氨基酸序列seq id no:1-11的变体,其对应核苷酸序列seq id no:25-35)通过热击转化到bl21(de3)感受态细胞,复苏菌液涂布氨苄抗性固体lb平板后在37℃过夜培养,挑取单克隆菌落,接种至100ml含有氨苄抗性的液体lb培养基中37℃培养。按1%的接种量转接至氨苄抗性的lb液体培养基中进行扩大培养,37℃、200rpm条件下培养,并连续不断的测量其od600值。当od600=0.6-0.8时,将lb培养基中的培养液冷却至18℃,并添加异丙基硫代半乳糖苷(isopropyl β-d-thiogalactoside,iptg)诱导表达,使得终浓度达到1mm。12-16h后,18℃收集细菌。高压破碎细菌,通过fplc方法进行纯化,收集样品。
[0182]
2、结果图10显示了经纯化后的mph mp1(seq id no:11的变体)sds-page凝胶电泳图。实施例2使用荧光分析检测酶活性来阐述pif1-like解旋酶的解开杂交dsdna的能力。
[0183]
1、材料和方法如图1中的a)所示,荧光底物链(终浓度100nm)具有5’端ssdna突出部分,以及50个碱基的杂交的dsdna部分。包括主链上部在3’端具有黑洞淬灭剂(bhq-1)碱基(seq id no:20
‑‑
bhq-3’),并且所述杂交的互补链在5’端具有羧基荧光素(5’fam-seq id no:21)。当杂交的来自荧光素的荧光被局部的bhq-1淬灭时,底物基本上是无荧光的。还包括与荧光底物的较短链互补的0.5μm的捕获链(seq id no:22)。如b)所示,在atp(5mm)和mgcl2(5mm)存在下,添加到底物中的pif1-like解旋酶(200nm)连接到所述荧光底物的5’端部分,沿着所述主链移动,并解开所述互补链后,过量的捕获链优先与互补链dna退火以防止初始底物与丢失荧光重新退火。同时,体系内仍存在一定量的杂交dsdna未被pif1-like解旋酶解旋。如c)所示,加入过量与主链完全互补的捕获链a(seq id no:23)后,部分未被解旋的dsdna由于过量a的存在而产生链解旋效果,最终所有dsdna被解旋,荧光值达到最高。
[0184]
2、结果图2显示了含有400mmnacl的缓冲液中的时间依赖型dsdna被解旋比例的变化图(10mm hepes ph8.0,5mm atp,5mm mgcl2,100nm荧光底物dna,0.5μm捕获dna)。
[0185]
实施例3示例性的采用凝胶测定来测量本发明经修饰的pif1-like解旋酶结合dna的能力。
[0186]
具体的,测量aph acj61-d97c/a363c(具有d97c/a363c突变的seq id no:2),aph px29-d96c/a371c(具有d96c/a371c突变的seq id no:3),sph cbh8-a94c/a361c/c136a(具有a94c/a361c和c136a突变的seq id no:5)和pph pspyzu05-d104c/a375c/c146a(具有d104c/a375c和c146a突变的seq id no:8)以及mph mp1-e105c/a362c(具有e105c/a362c突变的seq id no:11)结合dna的能力。
[0187]
1、材料和方法将退火的dna复合物(seq id no:18与含5’fam修饰的seq id no:19杂交)以(1:1,体积/体积)的比例分别与aph acj61,aph px29,sph cbh8,pph pspyzu05,mph mp1,aph acj61-d97c/a363c,aph px29-d96c/a371c,sph cbh8-a94c/a361c/c136a,pph pspyzu05-d104c/a375c/c146a,mph mp1-e105c/a362c在10mm hepe,ph值8.0,400mm氯化钾中混合,得到pif1-like解旋酶的最终浓度为(600nm)和dna为(30nm)。pif1-like解旋酶在室温下结合dna进行1小时。将tmad加入各样品中至终浓度5μm,在室温下培育1小时。将样品上样到4-20%tbe凝胶上,并在160v跑胶1.5小时。然后将该凝胶在蓝色荧光下观察dna条带。
[0188]
2、结果图3显示了pif1-like解旋酶在修饰前后对dna结合能力的影响。泳道2至6显示大量dna在电泳过程中未被pif1-like解旋酶结合而观察不到明显的结合条带。而泳道7-11显示了不同个数酶结合至dna的结合条带,其中泳道9和10显示了高达5个pif1-like解旋酶可以结合到seq id no:18的单链部分。这表明,pif1-like解旋酶在修饰后明显增强了与dna结合的牢固程度。
[0189]
实施例4本实施例以mph mp1-e105c/a362c(具有突变e105c/a362c的seq id no:11)为例,验证pif1-like解旋酶如何控制整个dna链移动穿过单个mspa纳米孔(seq id no:12)。
[0190]
1、材料和方法制备如图4所示的dna构建体a:seq id no:13(b区域)其5’末端连接到20个ispc3间隔区(a区域),其3’末端连接到4个ispc3间隔区(c区域),该间隔区连接到seq id no:14(d区域)的5’末端,该seq id no:14的3’末端连接到seq id no:17(e区域),该dna构建体的seq id no:15区域(f区域)与seq id no:16(g区域,其具有5’胆固醇系链)杂交。将制备的dna构建体和mph mp1-e105c/a362c在25℃的缓冲液(10mm hepes,ph 8.0,400mm nacl,5%甘油,2mm dtt)中一起预孵育30分钟。
[0191]
由嵌入1,2-二乙醇酰基-甘油-3-胆碱磷酸脂质双分子层的mspa纳米孔获得电测量。通过montal-mueller技术,在ptfe膜上的~25μm直径孔穴形成双分子层,隔开两个约100μl的缓冲溶液。所有实验在所述缓冲液中进行。使用装配有数字转换器的放大器测定单通道电流。将ag/agcl电极连接到所述缓冲液中使得顺式隔间连接到放大器的接地端,并且反式隔间连接到活性电极。
[0192]
在所述双分子层实现单孔之后,将dna多核苷酸和pif1-like解旋酶添加到电生理学室的顺式隔间的70μl缓冲液中以引发解旋酶-dna复合体在所述纳米孔的捕获。根据需要通过向所述顺式隔间添加二价金属(5mm mgcl2)和ntp(2.86μm atp)激活解旋酶atp酶活
性。实验在+180mv的恒定电势下实施。
[0193]
2、结果和讨论结果观察到了dna构建体被pif1-like解旋酶控制的dna移动,pif1-like解旋酶控制的dna移动的结果见图5。pif1-like解旋酶控制的dna移动为50秒长并对应于接近10kb的dna构建体穿过所述纳米孔的移位。其中,图6显示了pif1-like解旋酶控制的dna移动的部分区域的放大图。
[0194]
实施例5本实施例以sph cbh8-a94c/a361c/c136a(具有a94c/a361c/c136a突变的seq id no:5)和eph pei26-d99c/a366c/c141a(具有d99c/a366c/c141a突变的seq id no:6)以及pph pspyzu05-d104c/a375c/c146a(具有d104c/a375c和c146a突变的seq id no:8)为例,验证pif1-like解旋酶如何控制整个dna链移动穿过单个mspa纳米孔。
[0195]
1、材料和方法制备如图4所示的dna构建体b:seq id no:13其5’末端连接到20个ispc3间隔区,其3’末端连接到4个ispc3间隔区,该间隔区连接到 seq id no:14的5’末端,该seq id no:14的3’末端连接到seq id no:24,该dna构建体的seq id no:15区域与seq id no:16(其具有5’胆固醇系链)杂交。该dna构建体b与实施例4使用的构建体相似,不同在于标记为e的区域对应于seq id no:24。
[0196]
将在缓冲液(在50mm nacl中,10mm tris ph7.5)中的dna构建体b与在缓冲液(50mm kcl,10mmhepes,ph 8.0)中的sph cbh8-a94c/a361c/c136a,eph pei26-d99c/a366c/c141a或pph pspyzu05-d104c/a375c/c146a在室温下预孵育30分钟。然后向dna/酶预混合物中添加tmad并进一步孵育30分钟。最后,向所述预混合物中添加缓冲液(10mmhepes,600mm kcl,ph 8.0,3mm mgcl2)和atp。
[0197]
在室温下由嵌入到在缓冲液(10mm hepes,400mm kcl,ph 8.0)中的嵌段共聚物中的单个mspa纳米孔获得电测量值。在实现单个孔插入到嵌段共聚物中后,将pif1-like解旋酶(sph cbh8-a94c/a361c/c136a,eph pei26-d99c/a366c/c141a或pph pspyzu05-d104c/a375c/c146a(1nm终浓度)),dna(0.3nm终浓度),燃料(atp 3mm终浓度)的预混合物添加到单个纳米孔实验系统中。每个实验在保持电势180mv下进行2小时,并监控pif1-like解旋酶控制的dna移动。
[0198]
2、结果对dna构建体b,观察pif1-like解旋酶控制的dna移动,其sph cbh8-a94c/a361c/c136a,eph pei26-d99c/a366c/c141a或pph pspyzu05-d104c/ a375c/c146a控制的dna移动的结果分别参见图7-9。
[0199]
实施例6本实施例以eph-pei26-d99c/a366c/f103w/e286k(具有d99c/a366c/f103w/e286k突变的seq id no:6)和eph-pei26-d99c/a366c/c114v/c119v/c141s/ c308s/c419d/f103w/e286k(具有d99c/a366c/c114v/c119v/c141s/c308s/c419d/ f103w/e286k突变的seq id no:6)为例,说明通过替代或删除解旋酶的某些类型天然氨基酸,可以避免对解旋酶进行化学修饰或处理时在一个或多个该类型位点氨基酸的非特异性修饰,减少酶分子间的异质性,提升不同酶分子控制不同核酸分子穿过mspa纳米孔(seq id no:12)的速率均一
性。
[0200]
1、材料和方法制备如图4所示的dna构建体c:seq id no:13(b区域)其5’末端连接到20个ispc3间隔区(a区域),其3’末端连接到4个ispc3间隔区(c区域),该间隔区连接到seq id no:14(d区域)的5’末端,该dna构建体的seq id no:15(f区域)与seq id no:16(g区域,其5’端具有20个ispc3且末端修饰胆固醇)杂交。
[0201]
将浓度为10um 的a、b、c、d区段合成连接在一起的片段,与f片段、g片段按照1:1:1比例加入到退火缓冲液(10mm tris,ph7.0, 50mm nacl )中,按照98℃ 10min,-0.1℃/0.6s,300个循环,65℃ 5min,
ꢀ‑
0.1℃/0.6s,400个循环的流程进行退火处理(其中,a、b、c、d、f、g片段由生工生物工程(上海)股份有限公司提供)。
[0202]
将制备的dna构建体c与eph-pei26-d99c/a366c/f103w/e286k或eph-pei26-d99c/a366c/c114v/c119v/c141s/c308s/c419d/f103w/e286k在缓冲液(10mm hepes,50mm kcl, ph 7.0)中25℃下预孵育30分钟。然后添加终浓度1mm的tmad进行催化处理30分钟。最后,经过磁珠纯化,将纯化后的dna构建体/酶混合物与经过末端修复的10kb定长核酸文库seq id no: 17 (e区域)按照1.5:1的摩尔浓度比加入到t4 dna连接酶的快速连接反应体系中(如下表8所示,t4 快速连接(rapid ligation)试剂盒由enzymatics公司提供),室温快速ta连接10分钟。连接产物进行磁珠纯化后投入到后续的测序体系中。
[0203]
表8:t4 dna连接酶的快速连接反应体系由嵌入1,2-二乙醇酰基-甘油-3-胆碱磷酸脂质双分子层的mspa纳米孔获得电测量。通过montal-mueller技术,在ptfe膜上的~25μm直径孔穴形成双分子层,隔开两个约100μl的缓冲溶液。所有实验在所述缓冲液中进行。使用装配有数字转换器的放大器测定单通道电流。将ag/agcl电极连接到所述缓冲液中使得顺式隔间连接到放大器的接地端,并且反式隔间连接到活性电极。在所述双分子层实现嵌入单孔之后,将孵育完成的dna/酶混合物添加到电生理学室的顺式隔间的70到电缓冲液(10mm hepes,500mm kcl,50mm mgcl2, 50mm atp, ph 7.0)中,在35℃条件下施加180mv的恒定电势,引发dna构建体/酶复合体在所述mspa纳米孔(seq id no:12)的捕获,以及解旋酶控制核酸穿过纳米孔的运动,并监测和记录解旋酶控制的dna移动。
[0204]
2. 结果解旋酶序列上的某些类型天然氨基酸对解旋酶控制核酸穿过纳米孔的运动速率的均一性有影响,其中该类型天然氨基酸存在于或被引入解旋酶的核酸结合口袋处,进行
化学或生物修饰后缩小核酸结合口袋。为了鉴定和分析替换或删除解旋酶的该类型的天然氨基酸对解旋酶控制核酸穿过纳米孔运动速率均一性的改善作用,本实施例中,通过提取测序获得的每一条原始电流信号的时间,根据定长文库的碱基长度,计算每一条原始电流信号的速率。对eph-pei26-d99c/a366c/f103w/ e286k和eph-pei26-d99c/a366c/c114v/c119v/c141s/c308s/c419d/f103w/e286k控制核酸文库穿过纳米孔的电流信号的识别和处理,计算不同条核酸文库完整穿过纳米孔的速率并进行统计分析。
[0205]
如图12所示,图12a可以看出突变体eph-pei26-d99c/a366c/f103w/e286k控制核酸穿过纳米孔的速率呈多峰分布,而图12b中突变体eph-pei26-d99c/a366c/ c114v/c119v/c141s/c308s/c419d/f103w/e286k控制核酸的速率呈单峰分布。突变体eph-pei26-d99c/a366c/f103w/e286k和eph-pei26-d99c/a366c/c114v/c119v/c141s/ c308s/c419d/f103w/e286k中,突变位点d99c/a366c是在eph-pei26解旋酶的核酸结合口袋相关的1b结构域和2b结构域处分别引入的半胱氨酸突变,突变体eph-pei26-d99c/a366c/c114v/c119v/c141s/c308s/c419d/f103w/e286k将eph-pei26解旋酶1b结构域和2b结构域处引入的半胱氨酸(c)之外其余位点的半胱氨酸进行了c114v/c119v/c141s/c308s/c419d突变,c114v/c119v/c141s/c308s/c419d突变避免了tmad催化d99c/a366c之间二硫键的形成过程中在其他半胱氨酸位点如c114、c119、c141、c308或c419引入修饰,从而影响酶的功能,造成酶分子间的异质性,导致速率呈多峰分布。解旋酶控制核酸分子穿过纳米孔的运动速率的多峰分布会加大算法对信号进行识别的难度或不利于碱基的识别,通过取代解旋酶序列上的某些类型天然氨基酸,可有效改善解旋酶控制核酸穿过纳米孔的运动速率的均一性,从而提升有效测序数据的通量和准确率。
[0206]
实施例7本实施例通过对比分析eph-pei26-d99c/a366c/c114v/c119v/c141s/c308s/c419d(具有d99c/a366c/c114v/c119v/c141s/c308s/c419d突变的seq id no:6)和eph-pei26-d99c/a366c/c114v/c119v/c141s/c308s/c419d/f103w(具有d99c/a366c/c114v/c119v/c141s/c308s/c419d/f103w突变的seq id no:6)控制核酸穿过mspa纳米孔(seq id no:12)的移动所产生的电流信号,说明解旋酶与核酸的磷酸骨架或糖环或碱基相互作用的氨基酸侧链对电流信号的影响,进而影响测序的准确率。
[0207]
1、材料和方法制备如图4所示的dna构建体d:seq id no:13(b区域)其5’末端连接到20个ispc3间隔区(a区域),其3’末端连接到4个ispc3间隔区(c区域),该间隔区连接到seq id no:14(d区域)的5’末端,该dna构建体的seq id no:15(f区域)与seq id no:16 (g区域,其具有5’端有20个ispc3且末端修饰胆固醇)杂交。
[0208]
将浓度为10um 的a、b、c、d区段合成连接在一起的片段,与f片段、g片段按照1:1:1比例加入到退火缓冲液(10mm tris,ph7.0, 50mm nacl )中,按照98℃ 10min,-0.1℃/0.6s,300个循环,65℃ 5min,
ꢀ‑
0.1℃/0.6s,400个循环的流程进行退火处理(其中,a、b、c、d、f、g片段由生工生物工程(上海)股份有限公司提供)。
[0209]
将制备的dna构建体d与eph-pei26-d99c/a366c/c114v/c119v/c141s/ c308s/c419d或eph-pei26-d99c/a366c/c114v/c119v/c141s/c308s/c419d/f103w在25℃的缓冲液(10mm hepes,50mm kcl, ph 7.0)中预孵育30分钟,添加终浓度1mm的tmad进行催化处理30
分钟,经过磁珠纯化,将纯化后的dna构建体/酶混合物与seq id no:24及其互补序列退火形成的双链dna靶序列(e区域)按照1.5:1的摩尔浓度比加入到t4 dna连接酶的快速连接反应体系中(如下表9所示,t4 快速连接试剂盒由enzymatics公司提供),室温快速连接10分钟。连接产物进行磁珠纯化后投入到后续的测序体系中。
[0210]
表9:t4 dna连接酶的快速连接反应体系由嵌入1,2-二乙醇酰基-甘油-3-胆碱磷酸脂质双分子层的mspa纳米孔获得电测量。通过montal-mueller技术,在ptfe膜上的~25μm直径孔穴形成双分子层,隔开两个约100μl的缓冲溶液。所有实验在述缓冲液中进行。使用装配有数字转换器的放大器测定单通道电流。将ag/agcl电极连接到所述缓冲液中使得顺式隔间连接到放大器的接地端,并且反式隔间连接到活性电极。在所述双分子层实现嵌入单孔之后,将孵育完成的dna构建体和解旋酶添加到电生理学室的顺式隔间的70μl缓冲液(10mm hepes,600mm kcl,3mm mgcl2, 3mm atp, ph 7.0)中,在30℃条件下施加180mv的恒定电势,引发dna构建体/酶复合体在所述mspa纳米孔(seq id no:12)的捕获,以及解旋酶控制核酸穿过纳米孔的运动,并监测和记录经解旋酶控制的dna移动。
[0211]
2、结果结果观察到了dna构建体被eph-pei26解旋酶的突变体控制的dna移动。图13是eph-pei26解旋酶的突变体控制靶核酸序列seq id no:24穿过纳米孔的电流信号特征。a图是模拟的靶核酸序列seq id no:24逐个穿过纳米孔的移动所产生的电流信号特征;b是突变体eph-pei26-d99c/a366c/ c114v/c119v/c141s/c308s/c419d/f103w控制靶核酸序列seq id no:24穿过纳米孔的移动所产生的实际电流信号;c是eph-pei26-d99c/a366c/c114v/c119v/c141s/c308s/c419d控制靶核酸seq id no:24序列穿过纳米孔的移动所产生的实际电流信号。比较来看,突变体eph-pei26-d99c/a366c/c114v/c119v/c141s/c308s/c419d/f103w控制靶核酸seq id no:24穿过纳米孔时多出来了一些电流台阶信号(图b箭头标志),从而导致插入(insertion)类型错误的增加。结果提示,与核酸碱基序列相互作用的氨基酸侧链或特定结构域位点的与核酸碱基互作的氨基酸侧链影响测序的准确率。
[0212]
实施例8本实施例中,使用不同eph-pei26解旋酶突变体控制dna构建体穿过纳米孔的移动,测试的解旋酶具有至少一个与模板单链dna或互补单链dna的一个或多个核苷酸互作的氨基酸取代。通过对不同eph-pei26解旋酶突变体控制核酸穿过mspa纳米孔(seq id no:12)运动的不同参数进行分析,说明解旋酶与模板单链dna或互补单链dna的一个或多个核苷酸互作的氨基酸取代对核酸测序的速率和准确率的影响,并提供若干改善测序准确率和
或速率的突变体。
[0213]
1、材料和方法制备如图4所示的dna构建体e:seq id no:13(b区域)其5’末端连接到20个ispc3间隔区(a区域),其3’末端连接到4个ispc3间隔区(c区域),该间隔区连接到seq id no:14(d区域)的5’末端,该dna构建体的seq id no:15(f区域与seq id no:16(g区域,其具有5’端有20个ispc3且末端修饰胆固醇)杂交。
[0214]
将浓度为10um 的a、b、c、d区段合成连接在一起的片段,与f片段、g片段按照1:1:1比例加入到退火缓冲液(10mm tris,ph7.0, 50mm nacl )中,按照98℃ 10min,-0.1℃/0.6s,300个循环,65℃ 5min,
ꢀ‑
0.1℃/0.6s,400个循环的流程进行退火处理(其中,a、b、c、d、f、g片段由生工生物工程(上海)股份有限公司提供)。
[0215]
将制备的dna构建体和eph-pei26解旋酶的突变体在25℃的缓冲液(10mm hepes,50mm kcl, ph 7.0)中预孵育30分钟,不同的eph-pei26解旋酶突变体如下表所示。添加终浓度1mm的tmad进行催化处理30分钟,经过磁珠纯化,将纯化后的dna构建体/酶混合物与seq id no:17的靶核酸双链dna序列(e区域)按照1.5:1的摩尔浓度比加入到t4 dna连接酶的快速连接反应体系中(如下表所示,t4快速连接试剂盒由enzymatics公司提供),室温快速连接10分钟。连接产物进行磁珠纯化后投入到后续的测序体系中。
[0216]
表10:本实施例使用的不同的eph-pei26解旋酶突变体
表11:t4 dna连接酶的快速连接反应体系由嵌入1,2-二乙醇酰基-甘油-3-胆碱磷酸脂质双分子层的mspa纳米孔获得电测量。通过montal-mueller技术,在ptfe膜上的~25μm直径孔穴形成双分子层,隔开两个约100μl的缓冲溶液。所有实验在所述缓冲液中进行。使用装配有数字转换器的放大器测定单
通道电流。将ag/agcl电极连接到所述缓冲液中使得顺式隔间连接到放大器的接地端,并且反式隔间连接到活性电极。在所述双分子层实现嵌入单孔之后,将孵育完成的dna构建体和解旋酶添加到电生理学室的顺式隔间的70μl缓冲液(10mm hepes,500mm kcl,50 mm mgcl2, 50 mm atp, ph 7.0)中,在35℃条件下施加180mv的恒定电势,引发解旋酶-dna复合体在所述mspa纳米孔(seq id no:12)的捕获,以及解旋酶控制核酸穿过纳米孔的运动,并监测和记录经解旋酶控制的dna移动。
[0217]
2、结果通过分析不同eph-pei26解旋酶的突变体控制seq id no:17核酸序列穿过纳米孔时所产生的电流信号特征,包括速率中值(median speed)、台阶删除率(deletion ratio)、台阶插入率(insertion ratio)、非平整台阶占比( uneven ratio)、大电流扰动发生率(flick ratio)等,说明解旋酶与模板链或互补单链核酸相互作用的氨基酸取代对酶控制核酸移动能力的影响,进而筛选出有效控制核酸穿过纳米孔运动的解旋酶突变体,改善测序的准确率和通量指标。上述参数的定义及计算方法简要概述如下:首先将定长文库的测序原始电流信号通过常用的序列比对算法(如动态时间规划)与参考碱基序列做切分比对,获得切分后的电流信号和对应的碱基序列信息。根据切分比对的结果,分别统计各个参数。(1)速率中值(median speed)计算方法同实施例6中所描述;(2)台阶删除率(deletion ratio)表示原始电流信号中缺失的参考序列中对应的碱基,将缺失的碱基个数除以参考序列总的碱基数即为台阶删除率;(3)台阶插入率(insertion ratio)表示电流信号中存在插入台阶的比例,根据比对结果,如果出现两个或两个以上的台阶比对上一个碱基的话,认为是一个insertion;(4)非平整台阶占比( uneven ratio)表示不平整台阶比例。理想情况下,每一个碱基都会表达为原始电流信号上一段平整的连续信号。实际上,这段连续信号只是相对平整,信号块的电流值的标准差大于一定阈值时即认为是一个不平整台阶。不平整台阶的数量除以台阶总数量定义为非平整台阶占比;(5)大电流扰动发生率(flick ratio) 表示出现大的信号扰动的信号块比例。将信号做高通滤波,获得相对高频的成分。高通以后的信号块的标准差大于一定阈值的,认为这个信号块存在高干扰。高干扰块的数量除以总数量,即是大电流扰动发生率。其中,参数(2)-(5)的数值越低说明测序结果越好。
[0218]
不同突变体的各参数分析结果见表12。从参数分析结果来看,不同氨基酸位点对酶控制核酸的运动产生了不同的影响,包括运动速率,特别是台阶平整度、台阶删除率台阶插入率参数,这可能是氨基酸侧链对碱基移位的干扰或滑脱造成。上述参数值越小,我们认为酶控制核酸运动产生的电流信号质量越好,在评估不同突变体的时候综合各个参数的影响来考察突变的影响。我们选择上述参数间有较大差异的突变体进行后续的碱基识别模型训练,以验证氨基酸位点的改造对酶控制核酸运动参数的差异对测序准确率的影响。
[0219]
表12:不同突变体的电流信号特征参数
pei26-24和eph-pei26-25解旋酶突变体进行孵育和tmad催化处理,处理产物经过纯化后加入到测序仪芯片,进行测序收集信号。
[0221]
2、结果对突变体eph-pei26-24和eph-pei26-25测序的大肠杆菌(e.coli)和人类基因组(human)随机打断文库序列的验证集数据进行多轮次训练后的模型准确率结果见图14,分别针对突变体eph-pei26-24和eph-pei26-25训练的碱基识别模型对各自测试芯片数据的测试结果见表13。验证集准确率是指训练后获得的模型对验证集的芯片数据进行碱基识别后,单条文库信号中完全比对上参考序列的比例;相对应的,测试芯片的准确率是指用训练出的模型去识别测试芯片的数据,单条文库信号中完全比对上参考序列的比例,实施例中的准确率值为统计后的中值。可以看出,突变体eph-pei26-24分别在大肠杆菌和人类基因组的验证集数据上的准确率比eph-pei26-25要高,而且在测试芯片上也验证了这个差异,测试芯片间以及测试芯片和验证集之间准确率的差异与批次实验的重复性相关,特别是芯片间的差异。本实施例的结果表明,实施例8中关于不同突变体控制核酸运动的参数对于有效评估酶控制核酸运动的能力差异有效。
[0222]
表13:突变体eph-pei26-24和eph-pei26-25对各自测试芯片数据的测试结果以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
[0223]
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1