强化间充质干细胞促进血管生成的方法、组合物及应用
1.本发明涉及血管再生技术领域,特别涉及一种强化间充质干细胞促进血管生成的方法、组合物及应用。
背景技术:
2.间充质干细胞(mesenchymal stem cells, mscs)在免疫调节、血管再生和心肌再生等再生医学领域是一种潜在的临床材料。mscs在培养条件下可维持贴壁状态,在体外分化培养基中可分化成成骨细胞、脂肪细胞和成软骨细胞,可表达表面标志物cd105、cd73和cd90,缺乏cd14或cd11b、cd19、cd34、cd45和hla-dr的表达。mscs是一种混合细胞群,包含具有不同多潜能特性的干细胞、承诺祖细胞和分化细胞。mscs在适当的诱导条件下可分化为包括骨、软骨、脂肪、神经胶质和肝细胞样细胞在内的各种组织。mscs在皮肤创面愈合、阿尔茨海默病、抗炎治疗、狼疮性肾炎、颅面和骨科修复、肝脏缺血/再灌注损伤、心力衰竭等方面具有临床安全性和有效性,因此具有广阔的应用前景。
3.血管生成和血管重塑是骨再生、组织愈合和心血管修复中的重要事件。建立体外预血管化,并与mscs和huvec共培养。之前的报道显示,mscs促进了超高血管密度huvec的形成,并显著提高了血管生成基因的表达。mscs在体外和体内均表现出良好的血管生成能力。此外,vegf、缺氧、poly(乳酸-co-glycolic acid) (plga)静电纺丝纳米纤维、tgf-β抑制剂sb431542等治疗均可提高间充质干细胞促进血管分化的能力,涉及hif通路、nf-κb通路和tgf通路的激活。专利cn110295142a公布了一种促进干细胞血管生成的方法,发明人通过使用超顺磁性纳米颗粒或者所述超顺磁性纳米颗粒联合静磁场处理上述骨髓间充质干细胞进而得到强化的细胞产品。专利cn105358681a再干细胞中添加了促红细胞生成素以提高血管生成的能力。但是总体来说,促进干细胞血管再生的方法和产品是很少的,开发新的方法和产品很有必要。
4.二甲双胍是治疗2型糖尿病的一线药物。二甲双胍在认知恢复、衰老、年龄相关性炎症、糖尿病性心肌病、库欣综合征、儿童抗精神病药物相关的超重/肥胖、代谢紊乱和超重、动脉粥样硬化心血管疾病、非酒精性脂肪性肝病/非酒精性脂肪性肝炎。慢性局部给药二甲双胍可改善创面血管化,加速体内创面愈合,涉及ampk信号通路的激活。此外,二甲双胍可以促进小鼠海绵植入物的血管生成。此前有报道称,二甲双胍可通过激活ampk信号通路增强间充质干细胞的各种特性,如成骨分化和免疫调节功能。
技术实现要素:
5.本发明的目的是至少克服现有技术的不足之一,提供了一种强化间充质干细胞促进血管生成的方法、组合物及应用。
6.我们发现,二甲双胍能够增强干细胞在血管再生中的效用,由此衍生的方法和产品有助于强化干细胞的促血管再生的作用,还能增强成骨分化。本发明提出的增强间充质干细胞促进血管生成的方法、组合物和产品,操作简单,能高效地用于体外成血管和体内血
管生成,有助于提升间充质干细胞在血管生成在骨修复和血管生成组织工程中的应用,适合推广。
7.本发明中术语解释如下:mscs:间充质干细胞,英文mesenchymal stem cells;vegf:血管内皮生长因子,英文:vascular endothelial growth factor;egf:表皮细胞生长因子,英文epidermal growth factor;bfgf:碱性成纤维细胞生长因子,英文basic fibroblast growth factor;huvecs:人脐静脉内皮细胞,human umbilical vein endothelial cells;matrigel:基底膜基质,也称为基质胶。
8.本发明采用如下技术方案:一方面,本发明提供了一种强化间充质干细胞促进血管生成的组合物,包括二甲双胍,vegf,egf,bfgf ,n-乙酰半胱氨酸和半乳糖醛酸。
9.如上所述的任一可能的实现方式,进一步提供一种实现方式,所述组合物由二甲双胍,vegf,egf,bfgf ,n-乙酰半胱氨酸和半乳糖醛酸组成。
10.如上所述的任一可能的实现方式,进一步提供一种实现方式,所述组合物的组成成分为:浓度为50-200 μmol/l二甲双胍,5-20 nmol/l vegf,5-20 nmol/l egf,5-50 nmol/l bfgf,1-5wt.%n-乙酰半胱氨酸、1-10wt.%半乳糖醛酸。
11.如上所述的任一可能的实现方式,进一步提供一种实现方式,所述组合物的组成成分为:浓度为100 μmol/l二甲双胍,10 nmol/l vegf,10 nmol/l egf,10 nmol/l bfgf,2wt.%n-乙酰半胱氨酸、5wt.%半乳糖醛酸。
12.另一方面,本发明还提供了一种强化间充质干细胞促进血管生成的方法,包括:间充质干细胞mscs培养;在mscs中添加上述的组合物;体外构建共培养系统,和/或体内搭建血管基质环境。
13.如上所述的任一可能的实现方式,进一步提供一种实现方式,所述方法用于体外成血管,所述方法包括:s1、取生长良好的huvecs按照1
×
104细胞/ml接种在6孔板中;s2、取第3-5代生长良好的mscs按照1
×
105细胞/ml接种在6孔板的上层插件;s3、huvecs和mscs两种细胞均添加含10%fbs、1%青霉素或链霉素的dmem完全培养基,置于一定温度的含co2的培养箱中培养;s4、待两种细胞都贴壁后,转移生长有mscs的上层插件到接种了huvecs的6孔板上,构建成体外共培养系统;步骤s1、s2无先后顺序。
14.如上所述的任一可能的实现方式,进一步提供一种实现方式,所述方法用于体内成血管,所述方法具体为:向动物皮下组织注射含有间充质干细胞mscs、huvec和上述的组合物的matrigel基质胶。
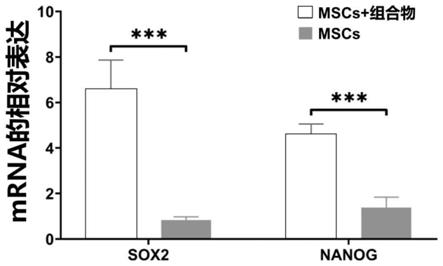
15.如上所述的任一可能的实现方式,进一步提供一种实现方式,所述的共培养系统中的mscs,事先经过上述的组合物的预处理培养,或在所述共培养系统的上层插件(上层插件为6孔板一部分,位于6孔板上层)上添加了如上述的组合物。
16.另一方面,本发明还提供了一种上述的强化间充质干细胞促进血管生成的方法在骨修复和血管生成组织工程中的应用。
17.本发明的有益效果为:本发明方法方便、快捷且高效。本发明提出的增强间充质干细胞促进血管生成的方法、组合物和产品,操作简单,能高效地用于体外成血管和体内血管生成,有助于提升间充质干细胞在血管生成在骨修复和血管生成组织工程中的应用,适合推广。
附图说明
18.图1所示为mscs的细胞形态。
19.图2所示为实施例中添加了组合物培养的mscs的形态。
20.图3所示为mscs的表面标志物检测。
21.图4所示为实施例中添加了组合物培养的mscs的表面标志物检测。
22.图5所示为实施例中添加了组合物培养的mscs的干性基因分析。
23.图6所示为添加了组合物培养的mscs的成骨成脂分化实验结果。
24.图7所示为成骨成脂相关基因的表达分析。
25.图8所示为实施例中添加了组合物培养的mscs的体外成血管分析。
26.图9所示为实施例中添加了组合物培养的mscs的体内血管生成。
具体实施方式
27.下文将结合具体附图详细描述本发明具体实施例。应当注意的是,下述实施例中描述的技术特征或者技术特征的组合不应当被认为是孤立的,它们可以被相互组合从而达到更好的技术效果。
28.本发明实施例一种强化间充质干细胞促进血管生成的组合物,包括二甲双胍,vegf,egf,n-乙酰半胱氨酸和半乳糖醛酸。
29.在一个优选实施例中,所述组合物由二甲双胍,vegf,egf,n-乙酰半胱氨酸和半乳糖醛酸组成。
30.在一个具体实施例中,所述组合物的组成成分为:浓度为50-200 μmol/l二甲双胍,5-20 nmol/l vegf,5-20 nmol/l egf,5-50 nmol/l bfgf,1-5wt.%n-乙酰半胱氨酸、1-10wt.%半乳糖醛酸。
31.在一个具体实施例中,所述组合物的组成成分为:浓度为100 μmol/l二甲双胍,10 nmol/l vegf,10 nmol/l egf,10 nmol/l bfgf,2wt.%n-乙酰半胱氨酸、5wt.%半乳糖醛酸。
32.本发明实施例一种强化间充质干细胞促进血管生成的方法,包括:间充质干细胞mscs培养;在mscs中添加如权利要求1-3任一项所述的组合物;体外构建共培养系统,和/或体内搭建血管基质环境。
33.在一个具体实施例中,所述方法用于体外成血管,所述方法包括:s1、取生长良好的huvecs按照1
×
104细胞/ml接种在6孔板中;s2、取第3-5代生长良好的mscs按照1
×
105细胞/ml接种在6孔板的上层插件;
s3、huvecs和mscs两种细胞均添加含10%fbs、1%青霉素或链霉素的dmem完全培养基,置于5%体积co2、37℃培养箱中培养;s4、待两种细胞都贴壁后,转移长有mscs的上层插件到接种了huvec的6孔板上,构建成体外共培养系统;步骤s1、s2无先后顺序。
34.在一个具体实施例中,所述方法用于体内成血管,所述方法具体为:向动物皮下组织注射含有间充质干细胞、huvec和如权利要求1-3任一项所述的组合物的matrigel基质胶。
35.实施例1 配置组合物二甲双胍溶解于缓冲液以配置成为10mmol/l的储液,vegf溶解于10mmol/l的储液,egf溶解于缓冲液以配置成为10mmol/l的储液,bfgf溶解于缓冲液以配置成为10mmol/l的储液,n-乙酰半胱氨酸溶解于缓冲液以配置成为20wt.%的储液、半乳糖醛酸溶解于缓冲液以配置成为50wt.%的储液。
36.实施例2构建体外共培养系统共培养系统用于检测体外血管生成分化。首先,将matrigel均匀涂抹在冰上6孔板的底部。matrigel(10mg/ml)用dmem培养基以1:1的比例稀释,并在6孔板中添加至500μl/孔。随后,将huvec接种于6孔板,并在37℃下预先覆盖有matrigel。mscs和huvec构建了一个共培养系统。将单独培养或处理过的组合物的mscs接种到插件中并转移到种植有huvec的6孔板中。6小时后观察管结构,并通过荧光倒置相差显微镜拍照。检查每个测试条件的五个场。总管长度由imagej软件计算,带有一个插件,血管生成分析,可以安装在网页上。实验重复3次。
37.实施例3 干细胞的培养及预处理间充质干细胞和huvec接种在补充有10%胎牛血清、1%10,000单位/ml青霉素、1%10mg/ml链霉素和100μmoll-抗坏血酸的dulbecco最低必需培养基中。将培养皿置于37℃恒温培养箱中,设置湿度为100%,co2浓度为5%。每2-3天更换一次新鲜培养基,细胞融合率为80-90%后传代。使用了第3-5代的干细胞。干细胞的培养及预处理是通过在培养基中补充添加物。
38.实施例4体内血管生成实验雄性balb/c裸鼠(6-8周,20-30g)购自北京大学医学部,动物实验程序获得北京大学动物研究伦理委员会的实验批准。通过注射混合有5
×
105个mscs细胞、100μm组合物和5
×
105个huvec细胞的matrigel进行体内血管生成试验。将血管塞移植到裸鼠背部皮下。7天后,通过免疫组织化学测试植入物。实验独立重复3次。
39.检测例1细胞活力测试以5
×
103个mscs细胞的浓度接种到96孔板中。然后,更设置浓度为50-200 μmol/l组合物,5-20 nmol/l vegf,5-20 nmol/l egf,5-50 nmol/l bfgf,1-5wt.%n-乙酰半胱氨酸、1-10wt.%半乳糖醛酸。培养24小时后,采用mtt法检测细胞数,酶标仪在od492处检测吸光度。
40.检测例2细胞周期分析共收获1
×
106个细胞,用pbs洗涤3次。根据说明书使用碘化丙啶标记进行细胞周
期分析。通过流式细胞术检测标记的细胞并通过flowjo软件进行分析。
41.检测例3流式细胞术将mscs制备成1
×
106个细胞的单细胞悬液,用4%多聚甲醛固定并用pbs洗涤。细胞用cd11b-pe、cd19-pe、cd34-pe、cd45-pe、hla-dr-pe、cd73-fitc、cd90-fitc、cd105-fitc。阴性对照和同种型对照用于校准细胞的荧光强度。通过流式细胞术检测标记细胞的强度。
42.检测例4成骨和成脂分化mscs接种在6孔板中。当汇合率为80%时,分别用新鲜的成骨分化培养基和成脂分化培养基替换mscs。诱导成骨分化的培养基每3天更换一次,重复7-10次。特别是成脂分化需要每3天在成脂分化培养基a液中诱导培养,然后更换b液1天,重复7-10次。培养3-4周后,用茜素红和油红o对钙结节和脂滴进行染色,并在显微镜下观察。
43.检测例5定量逆转录聚合酶链反应细胞在trizol中裂解。氯仿用于组分分离。随后,在异丙醇中沉淀rna。离心和沉淀后分离rna。逆转录反应由hifiscriptgdna removal rtmastermix和gdna eraser进行。在逆转录之前,通过在42
°
c下孵育2分钟,在逆转录时去除有效的gdna污染。随后,将不含gdna的cdna与5
×
hifiscript rtmastermix混合,并在37
°
c下孵育15分钟。85
°
c孵育5秒后终止反应。定量后,将1μgcdna添加到实时荧光定量系统中。qpcr系统和步骤根据ultrasybr mixture进行,由自动化机器支持以协助操作。归一化循环阈值值通过mrna表达强度进行评估并通过基因gapdh进行校正。mrna相对表达量用2(-δδct)计算。实验重复3次。
44.检测例6免疫组化麻醉小鼠后,迅速用生理盐水灌注,然后用4%多聚甲醛灌注。快速分离整个脑组织并置于冰上的4%多聚甲醛中12-24小时。然后,使用10%、20%和30%蔗糖进行组织脱水12-48小时。将组织包埋在oct中并储存在-80℃。组织片的厚度为40μm,它会自动溶解在pbs中。组织样本在10%山羊血清中封闭1小时,并在4℃下与cd31结合过夜。用pbs洗涤后,将组织样品与hrp标记的二抗结合1小时。样品用dab染色,依次用75%、85%、95%和100%乙醇脱水,并用甘油覆盖。将小鼠皮肤组织切片染色并在光学显微镜下观察。cd31阳性通过imagej在5个随机选择的区域上计算和计数区域。
45.如图1-2结果显示,干细胞呈现纤维状,且添加本发明组合物后并不改变细胞形态,表明适合于细胞培养和生长。如图3-4结果显示,mscs的标志物包括阴性对照、同型对照、cd11b、cd19、cd34、cd45、hla-dr、cd73、cd90、cd105的阳性率分别为0.18%、0.05%、33.49%、0.04%、16.59%、0.78%、0.02%、100.00%、99.85%和99.66%。而组合物处理mscs的阳性率分别为0.06%、0.07%、7.45%、0.02%、17.87%、0.32%、0.02%、100.00%、100.00%、100.00%。此外,mscs表面分子cd11b、cd19、cd73、cd90和cd105表达阳性,cd34、cd45和hla-dr表达阴性,说明组合物处理后mscs的免疫表型没有明显变化。
46.如图5-7结果显示,组合物可以增强mscs干性基因的表达,包括nanog和sox2。此外,mscs在培养基中诱导后呈现茜素红染色的钙结节。但油红o染色结果显示mscs成脂分化未形成明显的脂滴。采用rt-qpcr检测成骨和脂肪形成相关基因的mrna相对表达量。结果表明,组合物增强了alp、ocn、runx2等成骨分化相关基因的表达。而组合物抑制了成脂分化相关标志物pparγ和lpl的表达。
47.如图8-9结果显示,组合物刺激了一系列参与细胞迁移和运动生理过程的蛋白质
的丰度。迁移实验结果表明mscs可以促进huvec的迁移。此外,组合物增强了这一过程,并在 6 小时和 12 小时显示出显着差异。构建共培养体系后,结果表明mscs可以促进huvec在matrigel中的管总长度(μm)、管数和管数。与 mscs 组相比,用组合物处理的 mscs 显着增强了 huvec 的体外和体内血管生成能力。
48.本文虽然已经给出了本发明的几个实施例,但是本领域的技术人员应当理解,在不脱离本发明精神的情况下,可以对本文的实施例进行改变。上述实施例只是示例性的,不应以本文的实施例作为本发明权利范围的限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1