碘-恩杂鲁胺及其制备方法及其应用与流程
1.本发明涉及生物医药技术领域,具体涉及碘-恩杂鲁胺及其制备方法及其应用。
背景技术:
2.前列腺癌(prostate cancer,pca)是男性常见的实体恶性肿瘤之一,其在全球发病率位居第二,仅次于肺癌。据估计,2020年,前列腺癌在世界范围内年龄标化患病率为30.7/10万人。在欧美国家居男性恶性肿瘤发病率第一位,死亡率第二位。我国前列腺癌的发病率相对较低,但近年来已有明显上升的趋势。前列腺癌细胞的增殖和存活是由雄激素受体(ar)与雄激素类固醇激素结合后驱动的,控制雄激素受体信号轴是前列腺癌治疗的重点,雄激素剥夺疗法(adt) 和雄激素受体(arb)阻断治疗是当前公认的标准治疗方法。然而,在经过1.5至2 年的雄性激素阻断治疗有效期后,几乎所有的前列腺癌患者对adt和arb产生耐药性进展为去势不敏感前列腺癌阶段,即去势抵抗性前列腺癌(crpc)。而一旦进展为crpc,现有的治疗药物和方法往往难以取得有效的成果,最终导致死亡。因此迫切需要开发更有效的药物,尤其是针对晚期前列腺癌的新型抗肿瘤药物变得越加重要。
3.雄激素受体在前列腺癌的发展过程中发挥着重要的作用,雄激素受体基因的扩增与过表达是crpc最常见的耐药机制。临床证据表明绝大多数crpc发生机制与雄激素受体信号通路再激活、雄激素受体过度表达有关。因此新型雄激素受体拮抗剂研发已成为抗前列腺癌药物研究的热点。新一代雄激素受体抑制剂恩杂鲁胺(enzalutamide)于2012年被fda批准用于治疗转移性去势抵前列腺癌。恩杂鲁胺是一种新的雄激素受体抑制剂,能够竞争性的抑制雄激素与受体的结合,并且能够抑制雄激素受体的核转运以及该受体与dna的相互作用。
4.放射性治疗,尤其是多肽/配体介导的放射性核素治疗(prlt)是当今治疗前列腺癌的重要手段,放射性治疗因创伤相对较小,大部分老年患者都能耐受,安全性相对较高,且疗效可靠,一直以来都是老年前列腺癌患者首选的治疗方案。放射治疗是利用放射性核素或其标记物(放射性药物),在衰变过程中发射出来的核射线(主要是β射线)的辐射生物效应来抑制或破坏病变组织的一种治疗方法。放射性碘是目前已有放射性核素中较为经济的一种核素,放射性碘(123i、 124i、125i、131i)标记药物可用于多种疾病的诊断和及治疗,在核医学中有着重要的应用。因为131i在甲状腺癌显像和治疗效果显著,吸引着放射碘在其它实体瘤中越来越多的应用。
5.因此,开发靶向雄激素受体类的放射性碘标记小分子抑制剂具有重大的应用前景,可为前列腺癌临床的诊断及治疗提供更多的选择。目前没有将恩杂鲁胺采用放射性碘标记的报道。
技术实现要素:
6.本发明的目的在于提出碘-恩杂鲁胺及其制备方法及其应用,用于肿瘤诊断 (单光子发射计算机断层显像/spect、正电子发射计算机断层显像/pet)、治疗试剂碘(i*)-恩
杂鲁胺及其药物或药物组合物、制备方法及应用,特别是在制备用于治疗前列腺癌药物中的应用。
7.本发明的技术方案是这样实现的:
8.本发明提供一种碘-恩杂鲁胺,所述碘-恩杂鲁胺具有如下结构通式(1)的化合物:
[0009][0010]
其中,r1,r2,r3,r4,r5,r6各自独立的表示
123
i、
124
i、
125
i、
131
i、氢、氚、卤素、-oh、-nh2、-nhra、-nrarb、-cooh、-coora、-o(ch2)mnrarb、
ꢀ‑
onrarb或-nhco-ra、-sn(烷基)3、
99m
tc络合物、
11
c、
13
n、
15
o、
18
f、
22
na、
52
fe、
64
cu、
68
ga、
76
br、
82
rb、
18
f(c
1-5
)烷基、[
18
f(c
1-5
)烷基]氨基、[
18
f(c
1-5
)烷基] 烷基氨基,其中ra和rb各自独立的表示氢、-c1-6烷基或-(ch2)m-苯基。
[0011]
作为本发明的进一步改进,具有通式(2)-(7)的碘标记化合物,其中用作标记的碘*i为
123
i、
124
i、
125
i或
131
i:
[0012]
[0013][0014]
作为本发明的进一步改进,所述碘-恩杂鲁胺选自以下至少一种化合物:
[0015][0016]
优选地,所述碘-恩杂鲁胺为
[0017]
作为本发明的进一步改进,还包括其各种形式的盐。
[0018]
本发明进一步保护一种上述碘-恩杂鲁胺的制备方法,包括氯胺-t法、过氧化物氧化法或二氯二苯基甘脲(iodogen)法进行放射性碘标记。包括以下步骤:
[0019]
(1)将恩杂鲁胺溶解在二甲基亚砜(dmso)溶液中,加入到ph值为6.5-7.5 的放射性碘水溶液混合,直至混合后无恩杂鲁胺析出为满足要求;恩杂鲁胺与放射性碘水溶液的量按制备标记物所需的量加入;
[0020]
(2)在(1)混合液中加入氧化剂在室温下反应2-10分钟;氧化剂用量根据放射性碘确定并满足过量反应要求;
[0021]
(3)向(2)中加入过量还原剂以终止反应;取样进行标记率测定即可。
[0022]
作为本发明的进一步改进,步骤(1)所述放射性碘为碘-131或碘-123或碘
ꢀ‑
124或碘-125;步骤(2)所述氧化剂为氯胺-t或过氧化物或二氯二苯基甘脲;步骤(3)所述还原剂为硫代硫酸钠或偏重亚硫酸钠。
[0023]
作为本发明的进一步改进,所述氧化剂为二氯二苯基甘脲,加入的氧化剂二氯二苯基甘脲采用下述两种形式的任意一种,其中一种为新鲜配制的二氯二苯基甘脲的dmso溶液;另一种为将混合液加入制备好的二氯二苯基甘脲涂管中;这两种方式均应满足具有足够量的氧化剂二氯二苯基甘脲。
[0024]
作为本发明的进一步改进,所述放射性碘为碘-131时,二氯二苯基甘脲的用量为每毫居碘所用二氯二苯基甘脲量不少于20微克;所述放射性碘为碘-123时,二氯二苯基甘脲的用量为每毫居碘所用二氯二苯基甘脲量不少于1.3微克;所述放射性碘为碘-124时,二氯二苯基甘脲的用量为每毫居碘所用二氯二苯基甘脲量不少于10微克;所述放射性碘为碘-125时,二氯二苯基甘脲的用量为每毫居碘所用二氯二苯基甘脲量不少于140微克。
[0025]
本发明进一步保护一种上述碘-恩杂鲁胺在制备肿瘤的治疗、诊断和预防药物中的应用。
[0026]
进一步,本发明将已有抗肿瘤药活性成分恩杂鲁胺开发成放射性核素肿瘤诊治药物*i-恩杂鲁胺,有机地将雄性激素受体(ar)抑制剂与核素相结合,使之在小剂量时可适用于肿瘤及其转移灶的定位诊断,大剂量时可适用于肿瘤的治疗。
[0027]
作为本发明的进一步改进,所述碘-恩杂鲁胺用于制备前列腺癌的诊断的临床spect/ct(
123
i、
125
i、
131
i)和pet/ct(
124
i)的分子探针。
131
i标记的
131i‑ꢀ
恩杂鲁胺中的高能放射性碘对前列腺癌有放射治疗协同作用,可用作前列腺癌诊断和放射治疗药物。
[0028]
本发明具有如下有益效果:
[0029]
1、本发明放射性碘标记
*
i-恩杂鲁胺的制备方法简单,标记物稳定,标记率高,便于进一步的临床开发利用。
[0030]
2、本发明放射性碘标记
*
i-恩杂鲁胺有效提高了对前列腺癌细胞的抑制作用,达到较好的治疗效果。
[0031]
3、前列腺癌小鼠的体内分布实验结果表明,本发明放射性碘标记
*
i-恩杂鲁胺可与雄性激素受体相结合,在小鼠前列腺癌中均有一定的摄取和滞留,可被用于前列腺癌的诊断。
附图说明
[0032]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
[0033]
图1为放射性碘标记的
*
i-恩杂鲁胺的制备路线图;
[0034]
图2为制备得到的
125
i-恩杂鲁胺的hplc图;
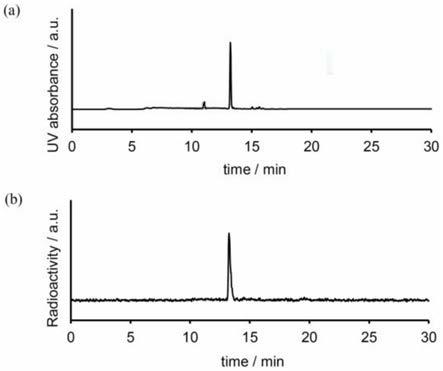
[0035]
图3为
125
i-恩杂鲁胺尾静脉注射后18小时在荷lncap细胞前列腺癌模型的 spect/ct 3d重建图;
[0036]
图4为
125
i-恩杂鲁胺尾静脉注射后18小时在荷lncap细胞前列腺癌模型的 spect/ct断层图。
具体实施方式
[0037]
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0038]
实施例1:
125
i-恩杂鲁胺的制备
[0039]
取50μl 1mg/l恩杂鲁胺dmso溶液,pbs 450μl ph 7.4,加入到已涂布有 50μg iodogen的ep管中,加入50μl na
125
i(500μci-2mci),涡旋30-60s混合均匀,于室温放置10分钟,取出反应液终止反应。加入2ml水,乙酸乙酯萃取 (5ml
×
3次),收集有机相,用light sep-pak c18 column分离纯化所述目标化合物,使目标化合物的放射性化学纯度大于99%。使用前sep-pak柱需用10ml 无水乙醇和10ml高纯水活化,并用3ml生理盐水洗脱出放射性杂质,然后再用0.5ml乙醇洗脱出目标化合物
125
i-恩杂鲁胺,95℃条件下n2吹干待用。
[0040]
实施例2:
131
i-恩杂鲁胺的制备
[0041]
取50μl 1mg/l恩杂鲁胺dmso溶液,pbs 450μl ph 7.4,加入到已涂布有 100μg iodogen的ep管中,加入100μl na
131
i(500μci-2mci),涡旋40-60s混合均匀,于室温放置10分钟,取出反应液终止反应。加入2ml水,乙酸乙酯萃取(5ml
×
3次),收集有机相,用light sep-pak c18 column分离纯化所述目标化合物,使目标化合物的放射性化学纯度大于99%。使用前sep-pak柱需用10ml 无水乙醇和10ml高纯水活化,并用3ml生理盐水洗脱出放射性杂质,然后再用0.5ml乙醇洗脱出目标化合物
131
i-恩杂鲁胺,95℃条件下n2吹干待用。
[0042]
测试例1:
125
i-恩杂鲁胺的鉴定
[0043]
采用薄层层析和高效液相法测定。
[0044]
a:薄层层析:以硅胶纸为支持物,展开剂为二氯甲烷/甲醇=9/1(v/v),待展开结束,在紫外下检测标记物在rf=0.6-0.8处呈淡黄色斑点;将层析纸剪成十段,γ计数仪测
定放射性计数率值,在rf=0.6-0.8处放射性浓聚,游离碘在rf=0-0.1处。
[0045]
b:高效液相色谱:biorad hplc,ymc-pack ods-a反相柱,乙腈/水=6/4,流速1ml/min,同时用紫外检测器(波长254nm)和放射性检测器检测,
125i‑ꢀ
恩杂鲁胺的保留时间约为13.240min。
[0046]
结果见图2。其中,a为紫外检测hplc谱图,b为radio-hplc谱图,测定放射化学纯度均大于99%。
[0047]
测试例2:
125
i-恩杂鲁胺的制备稳定性
[0048]
取实施例(1)项下制得的
125
i-恩杂鲁胺,加生理盐水溶解,置4℃冰箱。放置8天后,放化纯依然大于90%。说明标记物在4℃条件下稳定,可满足临床常规使用要求。
[0049]
测试例3:
125
i-恩杂鲁胺在正常小鼠体内的生物分布实验
[0050]
取12只正常的kunming雄小鼠,分别通过尾静脉注射0.2ml 125
i-恩杂鲁胺 (18.5mbq),分别于注射后5分钟、30分钟、60分钟和120分钟后断颈处死,取其心、肝、肺、肾、脾、胃、肌肉、骨、血、大肠、小肠等有关组织和器官,擦净后称重,并用γ-counter测其放射性计数,每个时相3只小鼠。计算各组织的每克百分注射剂量(%id/g),结果见表1。
[0051]
表1 125
i-恩杂鲁胺在正常小鼠体内的生物分布(id%/g,x
±
sd,n=3)
[0052][0053][0054]
结果表明,
125
i-恩杂鲁胺在血液中快速清除,迅速经肾脏通过尿路代谢出体内,在其他非靶器官如脑、肺、脾、肠等中的摄取较低且代谢快,具有良好的代谢性质。
[0055]
测试例4:
125
i-恩杂鲁胺在肿瘤小鼠体内的spect/ct显像实验
[0056]
取右上肢腋下荷lncap细胞的balb/c裸鼠,通过尾静脉注射0.15ml
125i‑ꢀ
恩杂鲁胺(约10.3mbq),于注射后20分钟,60分钟,120分钟,5小时,18小时,40小时进行spect/ct显像。显像前将裸鼠在summit as-1-000-7小动物麻醉系统中用混有3%(体积分数)异氟烷的氧气麻醉,显像过程中维持含1%(体积分数)异氟烷的氧气麻醉,显像时间为25分钟。结果见图4,从左到右分别是轴位,矢状位,冠状位,从上到下分别是ct图,核医学图,融合图,箭头指向肿瘤下沿。
[0057]
在不同的时间点,将麻醉的单独的裸鼠以俯卧位置放置在扫描仪台架上并用医用
胶带固定,同时将麻醉流速增加至0.8l/min。
[0058]
可见,在lncap模型鼠中,肿瘤部位有明显的放射性浓集,而且除肾脏和膀胱外,其他器官并没有明显的药物摄取。其在体内的代谢情况与在正常小鼠体内的生物分布结果一致。
[0059]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1